بیماریهای مغز و اعصاب
محور روده – مغز: میکروبیوتا در بیماری های تخریب کننده عصبی
راهنمای مطالعه نمایش
امتیازی که به این مقاله می دهید چند ستاره است؟
[کل: ۲ میانگین: ۳]
صدها میلیارد میکروارگانیسم مشترک در بدن انسان و روی بدن انسان زندگی می کنند که اکثر آنها اندکی پس از تولد در روده مستعمره می شوند و تا پایان عمر در آنجا می مانند. در مدل های حیوانی، ارتباطات دو طرفه بین سیستم عصبی مرکزی و میکروبیوتای روده (محور روده-مغز) به طور گسترده مورد مطالعه قرار گرفته است، و واضح است که تغییرات در ترکیب میکروبیوتا نقش حیاتی در پاتوژنز انواع اختلالات عصبی رشدی و عصبی، مانند اختلال طیف اوتیسم، بیماری آلزایمر (AD)، بیماری پارکینسون (PD)، مولتیپل اسکلروزیس، اسکلروز جانبی آمیوتروفیک، اضطراب، استرس و غیره.
کلید واژهها: میکروبیوم، محور روده و مغز، رژیم غذایی مبتنی بر عنصر بور، بیماری آلزایمر، بیماری پارکینسون، عنصر بور عامل محافظت کننده عصبی
۱. مقدمه
بدن انسان محل زندگی میلیاردها موجود زنده کوچک است که در مجموع به عنوان میکروبیوتای انسانی شناخته می شوند و ژنوم آنها به عنوان میکروبیوم شناخته می شود. میکروبیوتای روده ، که گاهی اوقات به عنوان «ارگان فراموش شده» شناخته می شود، با تقریباً ۳ میلیون ژن، که تا ۱۵۰ برابر ژنوم انسان است [۱]. میکروبها روی پوست انسان و همچنین در دستگاه تناسلی، دستگاه گوارش و تنفس انسان رشد میکنند و دستگاه گوارش بیشترین آلودگی را دارد. تصور می شود که کولون و رکتوم که در انتهای دستگاه گوارش (GI) قرار دارند، بیشترین تعداد باکتری را در بدن انسان در خود جای داده اند [۲]. با کمال تعجب، فقط یک سوم از میکروبیوتای روده انسان توسط اکثر افراد مشترک است، در حالی که دو سوم باقیمانده برای هر فرد منحصر به فرد است، مشابه کارت شناسایی شخصی [۳]. ساختار این جمعیت میکروبی در طول زمان تغییر میکند و در معرض تغییرات خارجی و درونزا قرار دارد [۴]. رژیم غذایی، متابولیسم، سن، مکان، استرس و درمان آنتی بیوتیکی همگی ممکن است تعادل بین عناصر مفید و میکروارگانیسم های بالقوه بیماری زا را مختل کنند، “دیس بیوز” [۵].کلمه ای برای این تعادل از هم پاشیده است. نشان داده شده است که میکروبیوتای روده نقش مهمی در حفظ عملکرد ایمنی و تعادل متابولیک، تولید ویتامین، محافظت از پاتوژن، تحریک رگزایی و حفظ سد روده ای دارد. درک این موضوع که میکروبیوتای روده در حفظ هموستاز و تنظیم عملاً هر سیستم اصلی بدن، از جمله سیستم عصبی مرکزی (CNS) نقش دارد، در طی دو دهه اخیر باعث شورش در زیست پزشکی شده است [۶]. “محور روده-مغز” (GBA) دلالت بر وجود یک مسیر ارتباطی دو طرفه بین میکروارگانیسمهای روده و CNS دارد که اکنون به طور گسترده پذیرفته شده است [۷] و بی نظمی این محور به طور فزاینده ای مشکوک به دخالت در پاتوفیزیولوژی اختلالات عصبی، مانند اختلال طیف اوتیسم، بیماری آلزایمر، مولتیپل اسکلروزیس، بیماری پارکینسون و غیره است [۶]. در حال حاضر، درمانهای مبتنی بر میکروبیوم، مانند پریبیوتیکها، پروبیوتیکها، و سینبیوتیکها، و همچنین پیوند مدفوع میکروبیوتا، با هدف ترویج یوبیوز برای بهبود سلامت متابولیک و روانی [۸] انجام میشود. علاوه بر این، بور (B)، نوعی عنصر بیولوژیکی فعال، به عنوان یک ماده مغذی ضروری پیشنهاد شده است که اثرات محافظت کننده عصبی را ایجاد می کند. مصرف بور با متابولیسم استخوان، مواد معدنی و چربی و عملکرد ایمنی مرتبط است. از آنجایی که شواهد نشان میدهد B برای سلامت انسان حیاتی است، بررسی ارتباط احتمالی بین دریافت مواد مغذی B و عملکرد مغز و روانشناختی بسیار مهم است [۹].
۲. بیماری آلزایمر
زوال عقل وضعیتی است که در آن حافظه، رفتار، استدلال، توانایی انجام فعالیت های روزانه، قضاوت و زبان بدتر می شود. ادعا شده است که بیماری آلزایمر و سایر اشکال زوال عقل پنجمین علت مرگ و میر در سراسر جهان است [۱۰] . مهم ترین عامل خطر سن است، به طوری که اکثریت قریب به اتفاق افراد مبتلا به زوال عقل آلزایمر ۶۵ سال یا بالاتر هستند [۱۱]. آمیلوئید خارج سلولی (A)، پلاکهای پیری (SP) و پیچخوردگیهای نوروفیبریلاری درون سلولی (NFT) ویژگیهای کلیدی بیماری آلزایمر هستند. افزایش تولید گونه های فعال اکسیژن (ROS) باعث التهاب عصبی و مرگ سلولی می شود. علاوه بر این، ناهنجاری های عروقی و آسیب میتوکندریایی در علت شناسی بیماری آلزایمر نقش دارند [۱۲] [۱۳].
۲.۱. دیسبیوز روده و بیماری آلزایمر
تولید پروتئینهای سیگنالدهنده که بر مسیرهای متابولیکی مرتبط با رشد AD تأثیر میگذارند، تحت تأثیر تغییرات در میکروبیوتای روده قرار میگیرند. فرآیند پیری باعث التهاب سیستماتیک موضعی میشود که نفوذپذیری دستگاه گوارش و عملکرد سد خونی مغزی را با اصلاح ترکیب GM، یعنی فراوانی بیشتر باکتریهای پیش التهابی نسبت به باکتریهای ضد التهابی، مختل میکند ( شکل ۱ ) [۱۴].
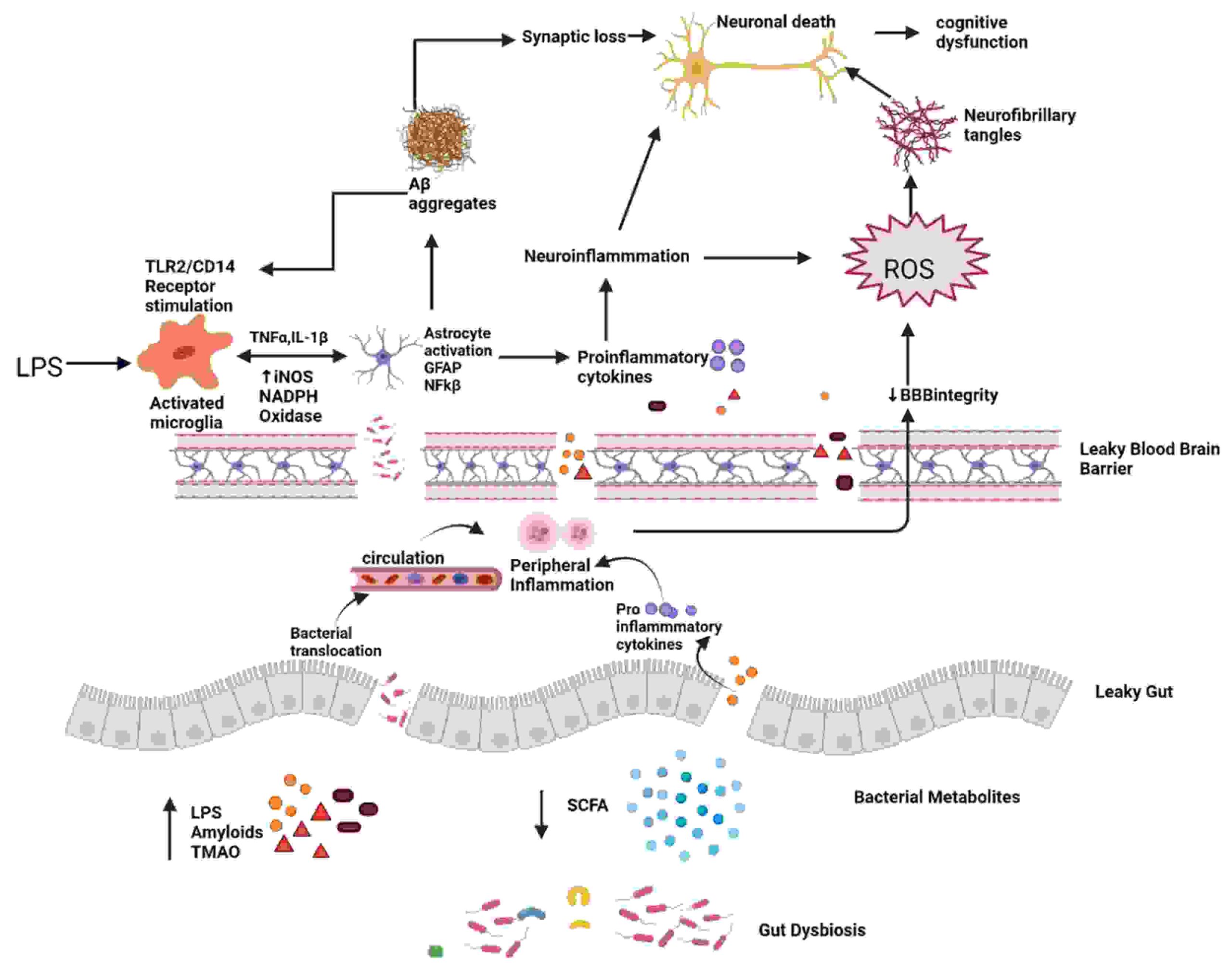 شکل ۱. دیسبیوز و بیماری آلزایمر. هنگامی که تعادل روده توسط میکروارگانیسم های پیش التهابی که آمیلوئیدهای باکتریایی، LPS، TMAO تولید می کنند و متابولیت های باکتریایی مفید مانند SCFA را کاهش می دهند، مختل می شود، نفوذپذیری روده آسیب می بیند. اختلال در روده و سد خونی مغزی منجر به افزایش تهاجم میکروب ها به محیطی و CNS و افزایش تولید سیتوکین های پیش التهابی و در نتیجه ایجاد التهاب محیطی و مرکزی می شود. این التهاب عصبی مستقیماً و از طریق ROS منجر به مرگ نورون ها می شود که منجر به تشکیل گره های عصبی فیبریلاری می شود. LPS همچنین بر روی گیرنده TLR2/TLR4 CD14 روی میکروگلیای فعال شده عمل می کند و TNF را افزایش می دهد.-α، IL-1β، iNOS، NADPH اکسیداز، و در نتیجه فعال سازی آستروسیت و فعالیت NF-kB که تجمع Aβ را بیشتر تقویت می کند. Aβ همچنین به عنوان آگونیست گیرنده TLR4 عمل می کند و بنابراین چرخه معیوب تجمع آمیلوئید و در نهایت مرگ نورونی در AD را ترویج می کند.
شکل ۱. دیسبیوز و بیماری آلزایمر. هنگامی که تعادل روده توسط میکروارگانیسم های پیش التهابی که آمیلوئیدهای باکتریایی، LPS، TMAO تولید می کنند و متابولیت های باکتریایی مفید مانند SCFA را کاهش می دهند، مختل می شود، نفوذپذیری روده آسیب می بیند. اختلال در روده و سد خونی مغزی منجر به افزایش تهاجم میکروب ها به محیطی و CNS و افزایش تولید سیتوکین های پیش التهابی و در نتیجه ایجاد التهاب محیطی و مرکزی می شود. این التهاب عصبی مستقیماً و از طریق ROS منجر به مرگ نورون ها می شود که منجر به تشکیل گره های عصبی فیبریلاری می شود. LPS همچنین بر روی گیرنده TLR2/TLR4 CD14 روی میکروگلیای فعال شده عمل می کند و TNF را افزایش می دهد.-α، IL-1β، iNOS، NADPH اکسیداز، و در نتیجه فعال سازی آستروسیت و فعالیت NF-kB که تجمع Aβ را بیشتر تقویت می کند. Aβ همچنین به عنوان آگونیست گیرنده TLR4 عمل می کند و بنابراین چرخه معیوب تجمع آمیلوئید و در نهایت مرگ نورونی در AD را ترویج می کند.۲.۲. متابولیتهای دخیل در بیماری آلزایمر
لیپوپلی ساکارید (LPS) – لیپوپلی ساکارید (LPS) یک ترکیب قندی لیپیدی است که جزء برجسته دیواره سلولی باکتری های گرم منفی است [۱۰] (۵۰ تا ۷۰ درصد در میکروبیوتای طبیعی روده). LPS یک ابزار ارزشمند برای بررسی التهاب عصبی در بیماری های عصبی است [۱۵]. اتصالات محکم بین اپیتلیال رودهسلول ها از ورود LPS به جریان خون در افراد سالم جلوگیری کردند. اگر اتصالات سفت ضعیف شوند LPS وارد جریان خون می شود و التهاب ایجاد می کند. در نتیجه، سطح LPS خون نه تنها نشان دهنده التهاب، بلکه نشت روده است. تعدادی از تحقیقات in vivo و in vitro نشان دادهاند که LPS بسیاری از مولکولهای درون سلولی را فعال میکند که بیان چند واسطهی التهابی را تغییر میدهند و از این رو به تخریب عصبی کمک میکنند یا آن را آغاز میکنند. LPS گیرندههای TLR4-CD14/TLR2 را روی لکوسیتها و میکروگلیاها فعال میکند، که منجر به افزایش سیتوکین با واسطه NF-kB میشود که سطح Aβ را افزایش میدهد، به الیگودندروسیتها آسیب میرساند و باعث آسیب میلین در مغز AD میشود. از آنجا که Aβ ۱-۴۲ همچنین یک آگونیست TLR4 است، ممکن است یک حلقه باطل را به حرکت درآورد که علت پیشرفت مداوم AD است [۱۶]. سد خونی مغزی نیز توسط LPS سرم مختل می شود، که همچنین می تواند وارد مغز شود و میکروگلیا، آستروسیت ها و مسیرهای آمیلوئیدوژنیک و التهابی متعددی را فعال کند. افزایش سطح سیتوکین های التهابی و NF-kB باعث افزایش پروتئین پیش ساز آمیلوئید (APP) و شکاف و تجمع پروتئین Aβ می شود که منجر به از دست دادن نورون و ایجاد بیماری آلزایمر می شود [۱۰]. ژائو و همکاران (۲۰۱۹) نشان داد که تجویز LPS باعث رفتار بیماری و اختلال شناختی و همچنین فعال شدن میکروگلیا و مرگ سلول های عصبی در هیپوکامپ در موش های C57BL/6J می شود. تیمار LPS سطوح IL-4 و IL-10 را کاهش داد در حالی که سطوح TNF، IL-1، PGE2 و اکسید نیتریک (NO) را افزایش داد. با توجه به تجزیه و تحلیل وسترن بلات، مسیر سیگنالینگ NF-kB در گروه های LPS فعال شد. علاوه بر این، VIPER، یک پپتید مهاری خاص TLR-4، التهاب عصبی و اختلال شناختی ناشی از LPS را کاهش داد [۱۷]. با توجه به Thingore و همکاران. (۲۰۲۰)، تزریق LPS التهاب عصبی را افزایش داد، باعث حفظ حافظه ضعیف و تشدید زوال شناختی شد و با کاهش SOD و افزایش پراکسیداسیون لیپیدی منجر به استرس اکسیداتیو شد[۱۸].
آمیلوئید – آمیلوئیدها پروتئین های خود تجمعی هستند که می توانند اختلال عملکرد سلولی را در بیماران مبتلا به اختلالات عصبی ایجاد کنند [۱۹]. Aβ محصول برش APP است، یک پروتئین غشایی که در رشد عصبی، سیگنال دهی و انتقال درون سلولی نقش دارد [۲۰]. در چندین مطالعه in vitro و in vivo آمیلوئیدهای تولید شده توسط GM نشان داده شده است که رسوب Aβ متقاطع را دارند [۲۱]. Curli توسط Escherichia coli ایجاد می شود، TasA توسط Bacillus subtilis، CsgA توسط Salmonella Typhimurium، FapCP توسط سودوموناس فلورسنس تولید می شود و غیره [۲۲]. آمیلوئیدهای باکتریایی ساختار پایه متفاوتی نسبت به آمیلوئیدهای مغزی دارند، اگرچه خواص متابولیکی و ساختاری مشابهی دارند [۲۳]. در فرآیندی به نام بذر، دانه های آمیلوئیدی از قبل موجود تولید شده از همان پروتئین می توانند پلیمریزاسیون پروتئین های آمیلوئیدوژن را به الیاف مرتب شده سرعت بخشند. این آمیلوئیدها باعث میشوند که فیبریلهای Aβ و الیگومرها بهطور نادرست تا شوند و به باکتریها اجازه میدهند به یکدیگر بچسبند و بیوفیلمهایی ایجاد کنند که ممکن است در برابر حملات ایمنی یا فیزیکی مقاومت کنند. پروتئینهای آمیلوئید باکتریایی در روده ممکن است سیستم ایمنی را تقویت کرده و پاسخهای ایمنی را به تشکیل آمیلوئید عصبی درونی در CNS افزایش دهند [۲۴]. شباهتها در ساختار پروتئین سوم ممکن است در ایجاد عوامل شبه پریون از طریق تقلید مولکولی نقش داشته باشد، که منجر به بذرکاری متقابل میشود که در آن یک پروتئین آمیلوئیدوژنیک باعث تولید پروتئین دیگری مانند یک پروتئین میزبان با ساختار متمایز میشود. برای اتخاذ ساختار ورق بیماری زا. به گفته Cattaneo و همکاران. (۲۰۱۷)، افراد دارای آمیلوئیدوز مثبت سطوح خونی بیشتری از IL-1β، IL-6، لیگاند کموکاین موتیف CXC و پروتئین گیرنده گره مانند ۳ و سطوح پایین تری از سیتوکین ضد التهابی IL-10 داشتند [ ۲۵] . هو و همکاران (۲۰۱۸) دریافتند که میکروبیوتای روده می تواند با ترویج تولید SCFA های خاصی که از ایجاد تجمعات مضر Aß محلول جلوگیری می کند، در برابر بیماری آلزایمر محافظت کند [۲۶]. در کارهای اخیر، جاوید و همکاران. (۲۰۲۰) دریافتند که FapCS دارای یک توانایی کاتالیزوری در کاشت آمیلوئیدوز پپتیدی، عملکرد شناختی ضعیف و آسیب شناسی رفتاری در شرایط آزمایشگاهی، در سیلیکو و در مدل AD گورخرماهی است [۲۷].
کالپروتکتین یک پروتئین کوچک متصل به کلسیم است که توسط نوتروفیل ها و مونوسیت ها، یک هترودایمر S100A8/A9 (یک لیگاند TLR4) تولید می شود. افزایش کالپروتکتین مدفوع ممکن است به عنوان نشانه ای از التهاب روده عمل کند. غلظت کالپروتکتین مدفوع در ۲۲ فرد مبتلا به بیماری آلزایمر با مقادیر سرمی اسیدهای آمینه معطر توسط Leblhuber و همکاران مقایسه شد. (۲۰۱۵). افزایش غلظت کالپروتکتین مدفوع با اختلال در عملکرد سد روده در بیماران آلزایمر مرتبط است [۲۸].
۲.۳. روده نشتی و مغز نشتی
لایه مخاطی، اپیتلیوم روده و لامینا پروپریا [۲۹] سد روده را تشکیل می دهند و از بدن در برابر میکروب های بیماری زا محافظت می کنند و از ورود ذرات سمی، مواد شیمیایی، باکتری ها و سایر ارگانیسم های تهدید کننده سلامت به جریان خون جلوگیری می کنند. ساختار میکروبیوتا بر نفوذپذیری لایه مخاطی تأثیر می گذارد [۳۰]. انبوهی از باکتری های تخریب کننده موسین Akkermansia muciniphila عملکرد سد روده و التهاب سیستمیک را بهبود می بخشد [۳۱]. تغییرات در اتصالات محکم توسط سویه های E. coli بیماری زا ، سالمونلا، شیگلا، هلیکوباکتر پیلوری ، ویبریو یا کلستریدیوم واسطه می شود [۳۲]. افزایش نفوذپذیری روده، که اغلب به نام روده نشتی شناخته می شود، به دلیل مشکلات مربوط به صلاحیت اتصالات محکم ایجاد می شود. با جدا کردن E-cadherin (یک مولکول چسبنده سلولی)، اگزوتوکسین Bacteroides fragilis اتصالات چسبندگی را مختل می کند [۳۳]. اختلال در هموستاز روده با کاهش مواد مفید مانند SCFAs و H2 و افزایش مواد مضر مانند LPS، آمیلوئیدها و TMAO بر نفوذپذیری روده تأثیر منفی میگذارد، سد مخاطی روده را نفوذپذیر میکند، پاسخهای ایمنی محیطی را فعال میکند و قسمت مرکزی را بالا میبرد. سطوح استرس اکسیداتیو [۳۴]. BBB (سد خونی مغزی)، که از سلولهای اندوتلیال مغز، آستروسیتها و پریسیتهای تخصصی تشکیل شده است، یک مرز نیمهتراوا بسیار انتخابی است [۳۵]. یکپارچگی BBB برای رشد و عملکرد مغز بسیار مهم است. طبق تحقیقات اخیر، انواع مواد شیمیایی می توانند BBB را به خطر بیندازند و به مولکول هایی مانند پروتئین، ویروس ها و حتی باکتری ها اجازه ورود به مغز را می دهند و سلامت مغز را به خطر می اندازند (ولینگ و همکاران، ۲۰۱۵) (جدول ۱). تجزیه ساختاری و عملکردی BBB ممکن است یک مرحله اولیه و حیاتی در علت شناسی بیماری آلزایمر باشد [ ۳۶ ]. حوادث پیش التهابی و سیتوتوکسیک ناشی از رسوب در عروق است که به افزایش نفوذپذیری BBB در مغز AD کمک می کند (روهر و همکاران، ۲۰۰۳، کارانو و همکاران، ۲۰۱۱، اریکسون و بنکس، ۲۰۱۳). TJ ها توسط الیگومرهای Aβ۱-۴۲ مختل می شوند که بیان ZO-1، claudin-5، و اکلودین را سرکوب می کنند و در عین حال تولید متالوپروتئازهای ماتریکس (MMP)-2 و MMP-9 را افزایش می دهند. همچنین به گیرنده RAGE متصل می شود و باعث تشکیل ROS می شود که TJ ها را مختل می کند و یکپارچگی BBB را به خطر می اندازد (Carrano و همکاران، ۲۰۱۲). طبق مطالعات آزمایشگاهی و مدلهای تائوپاتی موشهای تراریخته، تاو همچنین ممکن است باعث انحطاط BBB شود. بنابراین، هر دو تاو و Aβ ممکن است به تجزیه BBB، تشدید فرآیند تخریب عصبی و واکنشهای التهابی همراه با آن کمک کنند [۳۶].
جدول ۱
مطالعات مختلف تغییر در میکروبیوتای روده را در اختلالات نورودژنراتیو مختلف نشان می دهد.
| Neurodegenerative Disease | Study | Experimental Subject | Control | Method | Dysbiosis/Result | Ref |
|---|---|---|---|---|---|---|
| Alzhiemer’s Disease | Liang et al. (2016) | APP/PS1 transgenic mice | C57/Bl6 wild-type (WT) | ۱۶S rRNA sequencing | ↓Odoribacter, ↑Helicobacter | [۱۶] |
| Vogt et al. (2017) | Fecal samples from AD (n = ۲۵) | sex-matched Control participants (n = ۲۵) | ۱۶S rRNA sequencing | Firmicutes, Bifidobacterium↓, Bacteroidetes↑ | [۳۷] | |
| Zhang et al. (2017) | APP/PS1 transgenic male mice | Age and weight-matched littermate mice wild-type (WT) | ۱۶S rRNA sequencing | microbiota composition and diversity were perturbed and the level of SCFAs ↓in AD mice | [۳۸] | |
| Cattaneo et al. (2017) | Cognitively impaired patients with (n = 40, Amy+) and with no brain amyloidosis (n = 33, Amy−) | Without brain amyloidosis and cognitive impairment (n = 10) | Microbial DNA qPCR assay | Amy+—↑pro-inflammatory cytokines (IL-6, CXCL2, NLRP3, and IL-1β) ↓anti-inflammatory cytokine (IL-10) Amy+—↓E. rectale and ↑ Escherichia/Shigella | [۲۵] | |
| Zhuang et al. (2018) | Fecal samples- AD patients | age- and gender-matched cognitively normal controls | ۱۶S rRNA sequencing | At family level- ↑ Ruminococcaceae and ↓ Lachnospiraceae | [۳۹] | |
| Bauerl et al. (2018) | APP/PS1 transgenic mice | C57/B16 (WT) | ۱۶S rRNA sequencing | ↑ Proteobacteria and Erysipelotrichaceae | [۴۰] | |
| Honarpisheh et al. (2020) | Symptomatic Tg2576 mice | age-matched littermate WT | ۱۶S rRNA sequencing | ↑↑Firmicutes and Bacteroidetes ↑ Lactobacillus | [۴۱] | |
| Parkinson Disease | Cilia et al. (2020) | Fecal samples of PD pt. (n = 39) | ۱۶S rRNA sequencing | ↓Roseburia (Firmicutes phylum) -worse evolution of motor, non-motor and cognitive functions ↓Ruminococcaceae and Actinobacteria- rapid worsening of global cognitive functions | [۴۲] | |
| Tan et al. (2020) | Fecal samples of PD pt. (n = 104) | Control (n = 96) | ۱۶S rRNA gene sequencing | PD- ↓ SCFA (a/w poorer cognition and low BMI) and ↓ butyrate (a/w worse postural instability–gait disorder scores) | [۴۳] | |
| Nishiwaki et al. (2020) | Patients with PD (n = 223) | Control (n = 137) | ۱۶S rRNA gene sequencing | PD- ↑ Akkermansia and Catabacter (genera) and Akkermansiaceae (family). ↓ Roseburia, Faecalibacterium, and Lachnospiraceae ND3007 (genera) | [۴۴] | |
| Heinzel et al. 2020) | Stool sample PD pt. (n = 666) | Healthy Control | PD- ↓ Firmicutes and Faecalibacterium, ↑ Prevotella | [۴۵] | ||
| Shen et al. (2021) | Fifteen case–control studies | meta-analysis | PD- ↓ Prevotellaceae, Faecalibacterium, and Lachnospiraceae ↑ Bifidobacteriaceae, Ruminococcaceae, Verrucomicrobiaceae, and Christensenellaceae | [۴۶] | ||
| Vascellari et al. (2021) | PD patients (n = 56) (TD = Tremor Dominant-19; AR = Akinetic Rigid-23; D = Dyskinetic-14) | ۱۶S next-generation sequencing and gas chromatography-mass spectrometry | ↓ Lachnospiraceae, Blautia, Coprococcus, Lachnospira, and ↑ in Enterobacteriaceae, Escherichia and Serratia linked to non-TD subtypes | [۴۷] | ||
| Multiple Sclerosis | Saresella et al. (2020) | MS pt. (n = 38) | Healthy Controls (HC) | ↓BA producers, ↑mucin-degrading, pro-inflammatory components BA/CA ratio was significantly ↓in MS (ratio: 0.9) compared to HC (ratio: 5; p < 0.0001). BA = Butyric acid CA = Caproic acid | [۴۸] | |
| ALS | Mazzini et al. (2018) | ALS patients (n = 50) | Healthy controls (n = 50) | PCR | ↑E. coli and enterobacteria ↓total yeast in patients | [۴۹] |
| Gioia et al. (2020) | ALS (n = 50) | ۵۰ HC (n = 50) | PCR ۱۶S next-generation sequencing | An unbalance between potentially protective microbial groups, such as Bacteroidetes, and other with potential neurotoxic or pro-inflammatory activity, such as Cyanobacteria, has been shown | [۵۰] |
۳. بیماری پارکینسون
بیماری پارکینسون (PD) دومین بیماری نورودژنراتیو شایع در جهان است که با تجمع نابجای فیبرهای آلفا سینوکلئین معروف به اجسام لویی (LBs) در نورونهای دوپامینرژیک در جسم سیاه (SN) مشخص میشود [۵۱] . شیوع جهانی آن ۱۰ تا ۵۰ در هر ۱۰۰۰۰۰ نفر در سال و شیوع ۱۰۰-۳۰۰ در هر ۱۰۰۰۰۰ نفر است که پیش بینی می شود تعداد افراد مبتلا به PD تا سال ۲۰۳۰ به دلیل پیری جمعیت جهانی دو برابر شود [۵۲]. افزایش نفوذپذیری روده و قرار گرفتن در معرض سیستمیک اندوتوکسین های باکتریایی ناشی از تغییرات در میکروبیوتای روده است که باعث بیان بیش از حد α-syn می شود و از تا شدن نادرست آن برای تولید LBs پشتیبانی می کند. LB های روده ای از طریق عصب واگ وارد CNS می شوند و در نهایت به جسم سیاه می روند و آن را از بین می برند [۵۳] و در نتیجه علائم بالینی بیماری پارکینسون مانند لرزش، سفتی، مشکلات تعادلی و از دست دادن حرکت خود به خودی (آکینزی) ایجاد می شود. یبوست شایع ترین علامت پیش حرکتی در بیماری پارکینسون است که بیش از ۷۰ درصد افراد را درگیر می کند و بیش از ۱۰ سال قبل از ظاهر شدن علائم بالینی باعث پیشرفت پاتوژنز می شود. در نتیجه، علامت یبوست به عنوان یک بیومارکر بالینی برای شناسایی PD پرودرومال در نظر گرفته می شود (Berg et al., 2015) [۵۴]. در افراد مبتلا به PD، کاهش قابل توجهی در بسیاری از محصولات متابولیک میکروبیوتای روده وجود داشت که ممکن است منجر به یبوست شود. هنگامی که عفونت روده وجود داشت، آسیب پذیری بالاتری نسبت به PD گزارش شد که ممکن است باعث ایجاد علائم مشابه PD شود. در یک مدل موش، میکروبیوتای روده مشتق از PD ممکن است باعث تشدید اختلالات حرکتی با واسطه α-سینوکلئین و بیماری مغزی شود، در حالی که موش های بدون میکروب آسیب شناسی خفیف تری آلفا سینوکلئین را نشان دادند (Sampson et al., 2016) [۵۵]. تغییرات مربوط به میکروبیوم در PD در جدول ۱ مورد بحث قرار گرفته است.
۴. مولتیپل اسکلروزیس (MS)
ام اس یک بیماری خودایمنی مزمن است که در آن سلولهای ایمنی غلاف میلین را هدف قرار میدهند و باعث دمیلیناسیون و از دست دادن آکسون میشوند که منجر به فلج میشود، زیرا میلین به تکانههای الکتریکی اجازه میدهد از طریق نورونها جریان پیدا کنند [۵۶]. علیرغم متغیرهای خطر متعددی که در ایجاد بیماریهای خودایمنی نقش دارند، میکروبیوم روده مهمترین عامل خطر محیطی برای MS است [۵۷]. بیماران ام اس تعداد کمتری از فکالی باکتریوم ، یوباکتریوم رکتال، کورینه باکتریوم و فوزوباکتریا و نسبت بیشتری از اشریشیا، شیگلا، کلستریدیوم و فیرمیکوت در مقایسه با افراد سالم داشتند [۵۸] [۵۹]. گسترده ترین مدل حیوانی مورد استفاده که با ویژگی های ام اس در انسان مطابقت دارد، EAE (انسفالومیلیت خودایمنی تجربی) است. EAE در موش های GF القا نمی شود، که نشان می دهد میکروبیوتای روده برای القای EAE ضروری است. درمان خوراکی با آمپی سیلین، وانکومایسین، نئومایسین، سولفات و مترونیدازول پاسخ مشابهی با تاخیر در شروع و کاهش شدت بیماری و همچنین سطوح پایینتر سیتوکینهای پیش التهابی و سطوح بالاتر اینترلوکین IL- ایجاد کرد. ۱۰ و IL-13 [۶۰] . به گفته فرخی و همکاران، لیپید ۶۵۴ در خون بیماران ام اس در مقایسه با افراد سالم و مبتلا به آلزایمر به میزان قابل توجهی کاهش یافته است. (۲۰۱۳) [۶۱]. پروبیوتیک ها (IRT5 شامل لاکتوباسیلوس کازئی، لاکتوباسیلوس اسیدوفیلوس، لاکتوباسیلوس روتنی، بیفیدوباکتریوم بیفیدوم و استرپتوکوکوس ترموفیلوس) قبل از القای EAE داده شد که منجر به تاخیر در شروع و طول مدت خفیف بیماری شد [۶۲]. دیس بیوز در ام اس بیشتر در جدول ۱ توضیح داده شده است.
۵. اسکلروز جانبی آمیوتروفیک (ALS)
ALS یک بیماری عصبی مرگبار است که نورون های مغز و نخاع را تحت تاثیر قرار می دهد و منجر به مرگ زودرس نورون های حرکتی می شود [۶۳] . به دلیل فلج تنفسی، اکثر بیماران ALS در عرض ۳ تا ۵ سال می میرند [۶۴] . تعدادی از مطالعات نشانه هایی از ناهنجاری های موجود در میکروبیوتای روده را در افراد مبتلا به اسکلروز جانبی آمیوتروفیک کشف کرده اند . با استفاده از مدل حیوانی ALS، وو و همکاران. (۲۰۱۵) کشف کرد که ساختار اتصال محکم مختل شده و نفوذپذیری روده افزایش یافته است. دیس بیوز روده نیز در موش های ALS دیده شده است، با تعداد کمتری از باکتری های تولید کننده بوتیرات، مانند بوتیریویبریو فیبریسولون و E. coli [۶۵] . فانگ و همکاران (۲۰۱۶) کاهش نسبت Firmicutes/Bacteroidetes، کاهش زیادی در جنس های Anaerostipes ، Oscillibacter و Lachnospiraceae (باکتری های مفید) و افزایش قابل توجهی در متابولیسم گلوکز Dorea در بیماران ALS را کشف کردند [۶۶]. ژانگ و همکاران با استفاده از مدل موش ALS و رژیم غذایی حاوی ۲ درصد بوتیرات در آب آشامیدنی. دریافتند که تعادل میکروبی روده بازسازی شد، یکپارچگی روده افزایش یافت و طول عمر در مقایسه با موشهای کنترل افزایش یافت [۶۷]. مطالعات بیشتر مربوط به میکروبیوتا و ALS در جدول ۱ مورد بحث قرار گرفته است.
اطلاعات
منابع
- Parashar, A.; Udayabanu, M. Gut microbiota: Implications in Parkinson’s disease. Parkinsonism Relat. Disord. 2017, 38, 1–۷.
- Wu, W.; Kong, Q.; Tian, P.; Zhai, Q.; Wang, G.; Liu, X.; Zhao, J.; Zhang, H.; Lee, Y.K.; Chen, W. Targeting gut microbiota dysbiosis: Potential intervention strategies for neurological disorders. Engineering 2020, 6, 415–۴۲۳.
- Larroya-García, A.; Navas-Carrillo, D.; Orenes-Piñero, E. Impact of gut microbiota on neurological diseases: Diet composition and novel treatments. Crit. Rev. Food Sci. Nutr. 2019, 59, 3102–۳۱۱۶.
- Sekirov, I.; Russell, S.L.; Antunes, L.C.M.; Finlay, B.B. Gut microbiota in health and disease. Physiol. Rev. 2010, 90, 859–۹۰۴.
- Hughes, H.K.; Rose, D.; Ashwood, P. The gut microbiota and dysbiosis in autism spectrum disorders. Curr. Neurol. Neurosci. Rep. 2018, 18, 81.
- Cryan, J.F.; O’Riordan, K.J.; Sandhu, K.; Peterson, V.; Dinan, T.G. The gut microbiome in neurological disorders. Lancet Neurol. 2020, 19, 179–۱۹۴.
- Nandwana, V.; Debbarma, S. Fecal Microbiota Transplantation: A Microbiome Modulation Technique for Alzheimer’s Disease. Cureus 2021, 13, e16503.
- Moos, W.H.; Faller, D.V.; Harpp, D.N.; Kanara, I.; Pernokas, J.; Powers, W.R.; Steliou, K. Microbiota and neurological disorders: A gut feeling. BioResearch Open Access 2016, 5, 137–۱۴۵.
- Penland, J.G. The importance of boron nutrition for brain and psychological function. Biol. Trace Elem. Res. 1998, 66, 299–۳۱۷.
- Giacomeli, R.; Izoton, J.C.; Dos Santos, R.B.; Boeira, S.P.; Jesse, C.R.; Haas, S.E. Neuroprotective effects of curcumin lipid-core nanocapsules in a model Alzheimer’s disease induced by β-amyloid 1-42 peptide in aged female mice. Brain Res. 2019, 1721, 146325.
- Agrawal, I.; Jha, S. Mitochondrial dysfunction and Alzheimer’s disease: Role of microglia. Front. Aging Neurosci. 2020, 12, 252.
- Nandwana, V.; Kaur, J.; Singh, R.; Jaka, S.; Kaur, G.; Rawal, E.; Mathialagan, K.; Williams, O.C.A. Predictors of Hospitalization for Manic Episode in Alzheimer’s Dementia: Inputs From an Inpatient Case-Control Study. Cureus 2021, 13, e17333.
- Palop, J.J.; Mucke, L. Network abnormalities and interneuron dysfunction in Alzheimer disease. Nat. Rev. Neurosci. 2016, 17, 777–۷۹۲.
- Batista, C.R.A.; Gomes, G.F.; Candelario-Jalil, E.; Fiebich, B.L.; De Oliveira, A.C.P. Lipopolysaccharide-induced neuroinflammation as a bridge to understand neurodegeneration. Int. J. Mol. Sci. 2019, 20, 2293.
- Zhan, X.; Stamova, B.; Sharp, F.R. Lipopolysaccharide associates with amyloid plaques, neurons and oligodendrocytes in Alzheimer’s disease brain: A review. Front. Aging Neurosci. 2018, 10, 42.
- Zhao, J.; Bi, W.; Xiao, S.; Lan, X.; Cheng, X.; Zhang, J.; Lu, D.; Wei, W.; Wang, Y.; Li, H. Neuroinflammation induced by lipopolysaccharide causes cognitive impairment in mice. Sci. Rep. 2019, 9, 5790.
- Thingore, C.; Kshirsagar, V.; Juvekar, A. Amelioration of oxidative stress and neuroinflammation in lipopolysaccharide-induced memory impairment using Rosmarinic acid in mice. Metab. Brain Dis. 2021, 36, 299–۳۱۳.
- Sampson, T.R.; Challis, C.; Jain, N.; Moiseyenko, A.; Ladinsky, M.S.; Shastri, G.G.; Thron, T.; Needham, B.D.; Horvath, I.; Debelius, J.W. A gut bacterial amyloid promotes α-synuclein aggregation and motor impairment in mice. eLife 2020, 9, e53111.
- Chen, G.-f.; Xu, T.-h.; Yan, Y.; Zhou, Y.-r.; Jiang, Y.; Melcher, K.; Xu, H.E. Amyloid beta: Structure, biology and structure-based therapeutic development. Acta Pharmacol. Sin. 2017, 38, 1205–۱۲۳۵.
- Friedland, R.P.; McMillan, J.D.; Kurlawala, Z. What are the molecular mechanisms by which functional bacterial amyloids influence amyloid beta deposition and neuroinflammation in neurodegenerative disorders? Int. J. Mol. Sci. 2020, 21, 1652.
- Friedland, R.P.; Chapman, M.R. The role of microbial amyloid in neurodegeneration. PLoS Pathog. 2017, 13, e1006654.
- Zhao, Y.; Lukiw, W.J. Microbiome-generated amyloid and potential impact on amyloidogenesis in Alzheimer’s disease (AD). J. Nat. Sci. 2015, 1, e138.
- Zhou, Y.; Smith, D.; Leong, B.J.; Brännström, K.; Almqvist, F.; Chapman, M.R. Promiscuous cross-seeding between bacterial amyloids promotes interspecies biofilms. J. Biol. Chem. 2012, 287, 35092–۳۵۱۰۳.
- Cattaneo, A.; Cattane, N.; Galluzzi, S.; Provasi, S.; Lopizzo, N.; Festari, C.; Ferrari, C.; Guerra, U.P.; Paghera, B.; Muscio, C. Association of brain amyloidosis with pro-inflammatory gut bacterial taxa and peripheral inflammation markers in cognitively impaired elderly. Neurobiol. Aging 2017, 49, 60–۶۸.
- Ho, L.; Ono, K.; Tsuji, M.; Mazzola, P.; Singh, R.; Pasinetti, G.M. Protective roles of intestinal microbiota derived short chain fatty acids in Alzheimer’s disease-type beta-amyloid neuropathological mechanisms. Expert Rev. Neurother. 2018, 18, 83–۹۰.
- Javed, I.; Zhang, Z.; Adamcik, J.; Andrikopoulos, N.; Li, Y.; Otzen, D.E.; Lin, S.; Mezzenga, R.; Davis, T.P.; Ding, F. Accelerated amyloid beta pathogenesis by bacterial amyloid FapC. Adv. Sci. 2020, 7, 2001299.
- Leblhuber, F.; Geisler, S.; Steiner, K.; Fuchs, D.; Schütz, B. Elevated fecal calprotectin in patients with Alzheimer’s dementia indicates leaky gut. J. Neural Transm. 2015, 122, 1319–۱۳۲۲.
- Kowalski, K.; Mulak, A. Brain-gut-microbiota axis in Alzheimer’s disease. J. Neurogastroenterol. Motil. 2019, 25, 48.
- Jakobsson, H.E.; Rodríguez-Piñeiro, A.M.; Schütte, A.; Ermund, A.; Boysen, P.; Bemark, M.; Sommer, F.; Bäckhed, F.; Hansson, G.C.; Johansson, M.E. The composition of the gut microbiota shapes the colon mucus barrier. EMBO Rep. 2015, 16, 164–۱۷۷.
- Everard, A.; Belzer, C.; Geurts, L.; Ouwerkerk, J.P.; Druart, C.; Bindels, L.B.; Guiot, Y.; Derrien, M.; Muccioli, G.G.; Delzenne, N.M. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. Proc. Natl. Acad. Sci. USA 2013, 110, 9066–۹۰۷۱.
- König, J.; Wells, J.; Cani, P.D.; García-Ródenas, C.L.; MacDonald, T.; Mercenier, A.; Whyte, J.; Troost, F.; Brummer, R.-J. Human intestinal barrier function in health and disease. Clin. Transl. Gastroenterol. 2016, 7, e196.
- Choi, V.M.; Herrou, J.; Hecht, A.L.; Teoh, W.P.; Turner, J.R.; Crosson, S.; Wardenburg, J.B. Activation of Bacteroides fragilis toxin by a novel bacterial protease contributes to anaerobic sepsis in mice. Nat. Med. 2016, 22, 563–۵۶۷.
- Liu, S.; Gao, J.; Zhu, M.; Liu, K.; Zhang, H.-L. Gut microbiota and dysbiosis in Alzheimer’s disease: Implications for pathogenesis and treatment. Mol. Neurobiol. 2020, 57, 5026–۵۰۴۳.
- Ballabh, P.; Braun, A.; Nedergaard, M. The blood–brain barrier: An overview: Structure, regulation, and clinical implications. Neurobiol. Dis. 2004, 16, 1–۱۳.
- Zenaro, E.; Piacentino, G.; Constantin, G. The blood-brain barrier in Alzheimer’s disease. Neurobiol. Dis. 2017, 107, 41–۵۶.
- Vogt, N.M.; Kerby, R.L.; Dill-McFarland, K.A.; Harding, S.J.; Merluzzi, A.P.; Johnson, S.C.; Carlsson, C.M.; Asthana, S.; Zetterberg, H.; Blennow, K.; et al. Gut microbiome alterations in Alzheimer’s disease. Sci. Rep. 2017, 7, 13537.
- Zhang, L.; Wang, Y.; Xiayu, X.; Shi, C.; Chen, W.; Song, N.; Fu, X.; Zhou, R.; Xu, Y.-F.; Huang, L. Altered gut microbiota in a mouse model of Alzheimer’s disease. J. Alzheimer’s Dis. 2017, 60, 1241–۱۲۵۷.
- Zhuang, Z.-Q.; Shen, L.-L.; Li, W.-W.; Fu, X.; Zeng, F.; Gui, L.; Lü, Y.; Cai, M.; Zhu, C.; Tan, Y.-L. Gut microbiota is altered in patients with Alzheimer’s disease. J. Alzheimer’s Dis. 2018, 63, 1337–۱۳۴۶.
- Bäuerl, C.; Collado, M.C.; Diaz Cuevas, A.; Viña, J.; Pérez Martínez, G. Shifts in Gut Microbiota Composition in an APP/PSS 1 Transgenic Mouse Model of Alzheimer’s Disease during Lifespan; Wiley Online Library: New York, NY, USA, 2018.
- Honarpisheh, P.; Reynolds, C.R.; Blasco Conesa, M.P.; Moruno Manchon, J.F.; Putluri, N.; Bhattacharjee, M.B.; Urayama, A.; McCullough, L.D.; Ganesh, B.P. Dysregulated Gut Homeostasis Observed Prior to the Accumulation of the Brain Amyloid-β in Tg2576 Mice. Int. J. Mol. Sci. 2020, 21, 1711.
- Cilia, R.; Piatti, M.; Cereda, E.; Bolliri, C.; Caronni, S.; Ferri, V.; Cassani, E.; Bonvegna, S.; Ferrarese, C.; Zecchinelli, A.L. Does Gut Microbiota Influence the Course of Parkinson’s Disease? A 3-Year Prospective Exploratory Study in de novo Patients. J. Parkinson’s Dis. 2021, 11, 159–۱۷۰.
- Tan, A.H.; Chong, C.W.; Lim, S.Y.; Yap, I.K.S.; Teh, C.S.J.; Loke, M.F.; Song, S.L.; Tan, J.Y.; Ang, B.H.; Tan, Y.Q. Gut microbial ecosystem in Parkinson’s disease: New clinico-biological insights from multi-omics. Ann. Neurol. 2021, 89, 546–۵۵۹.
- Hiroshi, N.; Mikako, I.; Tomohiro, I.; Tomonari, H.; Tetsuya, M.; Kenichi, K.; Yoshio, T.; Jun, U.; Hiroshi, M.; Ken, K. Meta-Analysis of Gut Dysbiosis in Parkinson’s Disease. Mov. Disord. Off. J. Mov. Disord. Soc. 2020, 35, 1626–۱۶۳۵.
- Heinzel, S.; Aho, V.T.; Suenkel, U.; von Thaler, A.K.; Schulte, C.; Deuschle, C.; Paulin, L.; Hantunen, S.; Brockmann, K.; Eschweiler, G.W. Gut microbiome signatures of risk and prodromal markers of Parkinson disease. Ann. Neurol. 2020, 88, 320–۳۳۱.
- Shen, T.; Yue, Y.; He, T.; Huang, C.; Qu, B.; Lv, W.; Lai, H.-Y. The association between the gut microbiota and Parkinson’s disease, a meta-analysis. Front. Aging Neurosci. 2021, 13, 40.
- Vascellari, S.; Melis, M.; Palmas, V.; Pisanu, S.; Serra, A.; Perra, D.; Santoru, M.L.; Oppo, V.; Cusano, R.; Uva, P. Clinical Phenotypes of Parkinson’s Disease Associate with Distinct Gut Microbiota and Metabolome Enterotypes. Biomolecules 2021, 11, 144.
- Saresella, M.; Marventano, I.; Barone, M.; La Rosa, F.; Piancone, F.; Mendozzi, L.; d’Arma, A.; Rossi, V.; Pugnetti, L.; Roda, G.; et al. Alterations in Circulating Fatty Acid Are Associated With Gut Microbiota Dysbiosis and Inflammation in Multiple Sclerosis. Front. Immunol. 2020, 11, 1390.
- Mazzini, L.; Mogna, L.; De Marchi, F.; Amoruso, A.; Pane, M.; Aloisio, I.; Cionci, N.B.; Gaggìa, F.; Lucenti, A.; Bersano, E.; et al. Potential Role of Gut Microbiota in ALS Pathogenesis and Possible Novel Therapeutic Strategies. J. Clin. Gastroenterol. 2018, 52, S68–S70.
- Di Gioia, D.; Bozzi Cionci, N.; Baffoni, L.; Amoruso, A.; Pane, M.; Mogna, L.; Gaggìa, F.; Lucenti, M.A.; Bersano, E.; Cantello, R.; et al. A prospective longitudinal study on themicrobiota composition in amyotrophic lateral sclerosis. BMC Med. 2020, 18, 153.
- Romano, S.; Savva, G.M.; Bedarf, J.R.; Charles, I.G.; Hildebrand, F.; Narbad, A. Meta-analysis of the Parkinson’s disease gut microbiome suggests alterations linked to intestinal inflammation. NPJ Parkinson’s Dis. 2021, 7, 27.
- Liu, J.; Xu, F.; Nie, Z.; Shao, L. Gut Microbiota Approach—A New Strategy to Treat Parkinson’s Disease. Front. Cell. Infect. Microbiol. 2020, 10, 648.
- Berg, D.; Postuma, R.B.; Adler, C.H.; Bloem, B.R.; Chan, P.; Dubois, B.; Gasser, T.; Goetz, C.G.; Halliday, G.; Joseph, L. MDS research criteria for prodromal Parkinson’s disease. Mov. Disord. Off. J. Mov. Disord. Soc. 2015, 30, 1600–۱۶۱۱.
- Sampson, T.R.; Debelius, J.W.; Thron, T.; Janssen, S.; Shastri, G.G.; Ilhan, Z.E.; Challis, C.; Schretter, C.E.; Rocha, S.; Gradinaru, V. Gut microbiota regulate motor deficits and neuroinflammation in a model of Parkinson’s disease. Cell 2016, 167, 1469–۱۴۸۰.e12.
- Colpitts, S.L.; Kasper, E.J.; Keever, A.; Liljenberg, C.; Kirby, T.; Magori, K.; Kasper, L.H.; Ochoa-Repáraz, J. A bidirectional association between the gut microbiota and CNS disease in a biphasic murine model of multiple sclerosis. Gut Microbes 2017, 8, 561–۵۷۳.
- Brown, J.; Quattrochi, B.; Everett, C.; Hong, B.-Y.; Cervantes, J. Gut commensals, dysbiosis, and immune response imbalance in the pathogenesis of multiple sclerosis. Mult. Scler. J. 2021, 27, 807–۸۱۱.
- Cantarel, B.L.; Waubant, E.; Chehoud, C.; Kuczynski, J.; DeSantis, T.Z.; Warrington, J.; Venkatesan, A.; Fraser, C.M.; Mowry, E.M. Gut microbiota in multiple sclerosis: Possible influence of immunomodulators. J. Investig. Med. 2015, 63, 729–۷۳۴.
- Tremlett, H.; Fadrosh, D.W.; Faruqi, A.A.; Zhu, F.; Hart, J.; Roalstad, S.; Graves, J.; Lynch, S.; Waubant, E.; US Network of Pediatric MS Centers. Gut microbiota in early pediatric multiple sclerosis: A case−control study. Eur. J. Neurol. 2016, 23, 1308–۱۳۲۱.
- Ochoa-Repáraz, J.; Mielcarz, D.W.; Ditrio, L.E.; Burroughs, A.R.; Foureau, D.M.; Haque-Begum, S.; Kasper, L.H. Role of gut commensal microflora in the development of experimental autoimmune encephalomyelitis. J. Immunol. 2009, 183, 6041–۶۰۵۰.
- Farrokhi, V.; Nemati, R.; Nichols, F.C.; Yao, X.; Anstadt, E.; Fujiwara, M.; Grady, J.; Wakefield, D.; Castro, W.; Donaldson, J. Bacterial lipodipeptide, Lipid 654, is a microbiome-associated biomarker for multiple sclerosis. Clin. Transl. Immunol. 2013, 2, e8.
- Forbes, J.D.; Van Domselaar, G.; Bernstein, C.N. The gut microbiota in immune-mediated inflammatory diseases. Front. Microbiol. 2016, 7, 1081.
- Ojeda, J.; Ávila, A.; Vidal, P.M. Gut Microbiota Interaction with the Central Nervous System throughout Life. J. Clin. Med. 2021, 10, 1299.
- Alonso, A.; Logroscino, G.; Jick, S.S.; Hernán, M.A. Incidence and lifetime risk of motor neuron disease in the United Kingdom: A population-based study. Eur. J. Neurol. 2009, 16, 745–۷۵۱.
- Wu, S.; Yi, J.; Zhang, Y.G.; Zhou, J.; Sun, J. Leaky intestine and impaired microbiome in an amyotrophic lateral sclerosis mouse model. Physiol. Rep. 2015, 3, e12356.
- Fang, X.; Wang, X.; Yang, S.; Meng, F.; Wang, X.; Wei, H.; Chen, T. Evaluation of the microbial diversity in amyotrophic lateral sclerosis using high-throughput sequencing. Front. Microbiol. 2016, 7, 1479.
- Zhang, Y.-g.; Wu, S.; Yi, J.; Xia, Y.; Jin, D.; Zhou, J.; Sun, J. Target intestinal microbiota to alleviate disease progression in amyotrophic lateral sclerosis. Clin. Ther. 2017, 39, 322–۳۳۶.
- Balanzá-Martínez, V. Nutritional supplements in psychotic disorders. Actas Esp. De Psiquiatr. 2017, 45, 16–۲۵.
- Gibson, G.R.; Hutkins, R.; Sanders, M.E.; Prescott, S.L.; Reimer, R.A.; Salminen, S.J.; Scott, K.; Stanton, C.; Swanson, K.S.; Cani, P.D. Expert consensus document: The International Scientific Association for Probiotics and Prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 2017, 14, 491–۵۰۲.
آیا این مقاله برای شما مفید بود؟
بله
تقریبا
خیر

