فیزیولوژی پزشکی گانونگ؛ عملکردهای انتقالی و متابولیکی کبد

دعای مطالعه [ نمایش ]
بِسْمِ الله الرَّحْمنِ الرَّحیمِ
اَللّهُمَّ اَخْرِجْنى مِنْ ظُلُماتِ الْوَهْمِ
خدایا مرا بیرون آور از تاریکىهاى وهم،
وَ اَکْرِمْنى بِنُورِ الْفَهْمِ
و به نور فهم گرامى ام بدار،
اَللّهُمَّ افْتَحْ عَلَیْنا اَبْوابَ رَحْمَتِکَ
خدایا درهاى رحمتت را به روى ما بگشا،
وَانْشُرْ عَلَیْنا خَزائِنَ عُلُومِکَ بِرَحْمَتِکَ یا اَرْحَمَ الرّاحِمینَ
و خزانههاى علومت را بر ما باز کن به امید رحمتت اى مهربانترین مهربانان.
کتاب «فیزیولوژی پزشکی گانونگ» بهعنوان یکی از جامعترین و معتبرترین منابع در حوزه علوم پزشکی، همچنان مرجع کلیدی برای درک عملکرد پیچیده بدن انسان است. این اثر با تکیه بر تازهترین پژوهشها و توضیحات دقیق از سازوکارهای فیزیولوژیک، پلی میان علوم پایه پزشکی و کاربردهای بالینی ایجاد میکند و نقشی بیبدیل در آموزش، پژوهش و ارتقای دانش سلامت ایفا مینماید.
ترجمه دقیق و علمی این شاهکار توسط برند علمی آیندهنگاران مغز به مدیریت داریوش طاهری، دسترسی فارسیزبانان به مرزهای نوین دانش فیزیولوژی را ممکن ساخته و رسالتی علمی برای ارتقای آموزش پزشکی، فهم عمیقتر سازوکارهای بدن و توسعه روشهای نوین در حوزه سلامت فراهم آورده است.
» کتاب فیزیولوژی پزشکی گانونگ
» » فصل ۲۸: عملکردهای انتقالی و متابولیکی کبد
در حال ویرایش
» Ganong’s Review of Medical Physiology
»» CHAPTER 28: Transport & Metabolic Functions of the Liver
After studying this chapter you should be able to:
• Understand the functional anatomy of the liver and the relative arrangements of hepatocytes, cholangiocytes, endothelial cells, and Kupffer cells.
• Define the characteristics of the hepatic circulation and its role in subserving the liver’s functions.
• Describe the major functions of the liver with respect to metabolism, detoxification, and excretion of hydrophobic substances.
• Identify the plasma proteins that are synthesized by the liver.
• Outline the mechanisms by which the liver contributes to whole body ammonia homeostasis and the consequences of the failure of these mechanisms, particularly for brain function.
• Describe the constituents of bile, its formation, and its role in the excretion of cholesterol and bilirubin.
• Identify the mechanisms that permit normal functioning of the gallbladder and the basis of gallstone disease.
اهداف
پس از مطالعه این فصل، باید بتوانید:
• آناتومی عملکردی کبد و ترتیبات نسبی سلول های کبدی، کلانژیوسیت ها، سلول های اندوتلیال و سلول های کوپفر را درک کنید.
• ویژگی های گردش خون کبدی و نقش آن در انجام عملکردهای کبد را تعریف کنید.
• وظایف اصلی کبد را با توجه به متابولیسم، سم زدایی و دفع مواد آبگریز شرح دهید.
• پروتئین های پلاسما که توسط کبد سنتز می شوند را شناسایی کنید.
• مکانیسم هایی را که توسط آن کبد به هموستاز آمونیاک کل بدن کمک می کند و پیامدهای نارسایی این مکانیسم ها، به ویژه برای عملکرد مغز، مشخص کنید.
• اجزای تشکیل دهنده صفرا، تشکیل آن و نقش آن در دفع کلسترول و بیلی روبین را شرح دهید.
• مکانیسم هایی را که به عملکرد طبیعی کیسه صفرا و اساس بیماری سنگ کیسه صفرا اجازه می دهد، شناسایی کنید.

INTRODUCTION
The liver is the largest gland in the body. It is essential for life because it conducts a vast array of biochemical and metabolic functions, including ridding the body of substances that would otherwise be injurious if allowed to accumulate, and excreting drug metabolites. It is also the first port of call for most nutrients absorbed across the gut wall, supplies most of the plasma proteins, and synthesizes the bile that optimizes the absorption of fats as well as serving as an excretory fluid. The liver and associated biliary system have therefore evolved an array of structural and physiologic features that underpin this broad range of critical functions.
مقدمه
کبد بزرگترین غده بدن است. برای زندگی ضروری است، زیرا مجموعه وسیعی از عملکردهای بیوشیمیایی و متابولیک را انجام می دهد، از جمله خلاص شدن از بدن از موادی که در غیر این صورت اگر اجازه انباشته شدن آنها مضر باشد، و دفع متابولیت های دارو. همچنین اولین محل مورد نیاز برای اکثر مواد مغذی جذب شده در دیواره روده است، بیشتر پروتئین های پلاسما را تامین می کند و صفرا را سنتز می کند که جذب چربی ها را بهینه می کند و همچنین به عنوان مایع دفعی عمل می کند. بنابراین، کبد و سیستم صفراوی مرتبط مجموعهای از ویژگیهای ساختاری و فیزیولوژیکی را ایجاد کردهاند که زیربنای این طیف وسیعی از عملکردهای حیاتی است.
THE LIVER
FUNCTIONAL ANATOMY
An important function of the liver is to serve as a filter between the blood coming from the gastrointestinal tract and the blood in the rest of the body. Blood from the intestines and other viscera reach the liver via the portal vein. This blood percolates in sinusoids between plates of hepatic cells and eventually drains into the hepatic veins, which in turn empty into the inferior vena cava. Hepatic artery blood also enters the sinusoids. During its passage through the hepatic plates, the blood is extensively modified chemically. Bile is formed on the other side of each plate (Figure 28-1).
کبد
آناتومی عملکردی
عملکرد مهم کبد این است که به عنوان یک فیلتر بین خونی که از دستگاه گوارش می آید و خون در بقیه بدن عمل می کند. خون از روده ها و سایر احشاء از طریق سیاهرگ باب به کبد می رسد. این خون در سینوسیهای بین صفحات سلولهای کبدی نفوذ میکند و در نهایت به سیاهرگهای کبدی تخلیه میشود که به نوبه خود به داخل ورید اجوف تحتانی تخلیه میشود. خون شریان کبدی نیز وارد سینوسوئیدها می شود. خون در طی عبور از صفحات کبدی به طور گسترده ای از نظر شیمیایی اصلاح می شود. صفرا در طرف دیگر هر صفحه تشکیل می شود (شکل ۲۸-۱).

FIGURE 28-1 Schematic anatomy of the liver. Hepatocytes are arranged radially in plates surrounding a central vein. Blood is supplied to the liver by branches of the portal vein (PV) and hepatic artery (HA), which empty into sinusoids (S) surrounding the hepatocytes. The direction of blood flow is indicated with black arrows. The endothelial cells that line the sinusoids are fenestrated and thus provide little hindrance to the transfer of substances from the sinusoids to the space of Disse, which abuts the basolateral membrane of the hepatocytes. The apical membranes of adjacent hepatocytes form bile canaliculi, which transfer bile to the bile ducts lined by cholangiocytes. Bile flows in the opposite direction to blood (green arrows). The bile duct, portal vein, and hepatic artery comprise the “portal triad.” (Adapted with permission from Paulsen DF: Histology and Cell Biology: Examination and Board Review. 5th edition. New York, NY: McGraw-Hill; 2010.)
شکل ۲۸-۱ آناتومی شماتیک کبد. هپاتوسیت ها به صورت شعاعی در صفحات اطراف یک ورید مرکزی قرار گرفته اند. خون توسط شاخههای ورید باب (PV) و شریان کبدی (HA) به کبد میرسد، که به سینوسهای (S) اطراف سلولهای کبدی تخلیه میشود. جهت جریان خون با فلش های سیاه نشان داده می شود. سلولهای اندوتلیال که سینوسها را میپوشانند دارای فنس هستند و بنابراین مانع کمی برای انتقال مواد از سینوسها به فضای Disse میشوند که به غشای قاعدهای جانبی سلولهای کبدی نزدیک میشود. غشاهای آپیکال سلول های کبدی مجاور، کانال های صفراوی را تشکیل می دهند که صفرا را به مجاری صفراوی که توسط کلانژیوسیت ها پوشانده شده اند منتقل می کنند. صفرا در جهت مخالف خون جریان دارد (فلش های سبز). مجرای صفراوی، ورید باب و شریان کبدی “سه گانه پورتال” را تشکیل می دهند. (اقتباس شده با مجوز از Paulsen DF: Histology and Cell Biology: Examination and Board Review. نسخه پنجم. نیویورک، نیویورک: McGraw-Hill؛ ۲۰۱۰.)
In each hepatic lobule, the plates of hepatic cells are usually only one cell thick. Plasma is in intimate contact with these cells (Figure 28-2). The average transit time for blood across the liver lobule from the portal venule to the central hepatic vein is about 8.4 s. Additional details of the features of the hepatic microcirculation and macrocirculation, which are critical to organ function, are provided below. Numerous macrophages (Kupffer cells) are anchored to the endothelium of the sinusoids and project into the lumen. The functions of these phagocytic cells are discussed in Chapter 3.
در هر لوبول کبدی، صفحات سلول های کبدی معمولاً فقط یک سلول ضخامت دارند. پلاسما در تماس نزدیک با این سلول ها است (شکل ۲۸-۲). میانگین زمان انتقال خون از طریق لوبول کبد از ورید پورتال به ورید مرکزی کبد حدود ۸.۴ ثانیه است. جزئیات بیشتر از ویژگیهای میکروسیرکولاسیون و ماکروسیرکولاسیون کبدی که برای عملکرد اندام حیاتی هستند، در زیر ارائه شده است. ماکروفاژهای متعددی (سلول های کوپفر) به اندوتلیوم سینوس ها متصل می شوند و به داخل لومن می ریزند. عملکرد این سلول های فاگوسیتی در فصل ۳ مورد بحث قرار گرفته است.
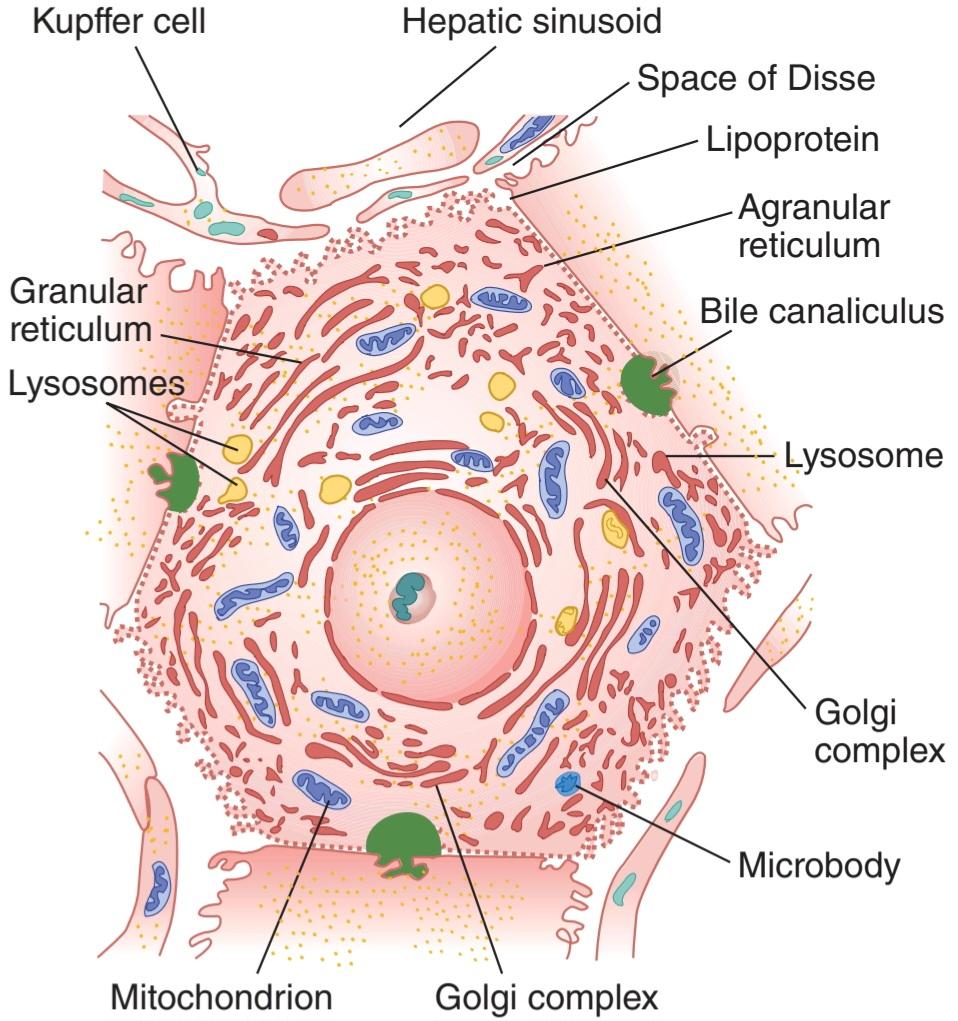
FIGURE 28-2 Hepatocyte. Note the relation of the cell to bile canaliculi and sinusoids. Note also the wide openings (fenestrations) between the endothelial cells next to the hepatocyte. (Used with permission of Sylvia Colard Keene.)
شکل ۲۸-۲ هپاتوسیت. به ارتباط سلول با کانال های صفراوی و سینوسی ها توجه کنید. همچنین به منافذ وسیع (فنستراسیون) بین سلول های اندوتلیال در کنار سلول کبدی توجه کنید. (با اجازه سیلویا کولارد کین استفاده شد.)
Each liver cell is opposed to several bile canaliculi (Figure 28-2). The canaliculi drain into intralobular bile ducts, and these coalesce via interlobular bile ducts to form the right and left hepatic ducts. These ducts join outside the liver to form the common hepatic duct. The cystic duct drains the gallbladder. The hepatic duct unites with the cystic duct to form the common bile duct (Figure 28-1). The common bile duct enters the duodenum at the duodenal papilla. Its orifice is surrounded by the sphincter of Oddi, and it usually unites with the main pancreatic duct just before entering the duodenum. The sphincter is usually closed, but when the gastric contents enter the duodenum, cholecystokinin (CCK) is released and the gastrointestinal hormone relaxes the sphincter and makes the gallbladder contract.
هر سلول کبدی با چندین کانال صفراوی مخالف است (شکل ۲۸-۲). کانال ها به داخل مجاری صفراوی داخل لوبولی تخلیه می شوند و این کانال ها از طریق مجاری صفراوی بین لوبولی به هم می پیوندند و مجاری کبدی راست و چپ را تشکیل می دهند. این مجاری به خارج از کبد می پیوندند و مجرای مشترک کبدی را تشکیل می دهند. مجرای کیستیک کیسه صفرا را تخلیه می کند. مجرای کبدی با مجرای کیستیک متحد می شود و مجرای صفراوی مشترک را تشکیل می دهد (شکل ۲۸-۱). مجرای صفراوی مشترک در پاپیلای دوازدهه وارد دوازدهه می شود. دهانه آن توسط اسفنکتر Oddi احاطه شده است و معمولاً درست قبل از ورود به دوازدهه با مجرای اصلی پانکراس متحد می شود. اسفنکتر معمولا بسته است، اما زمانی که محتویات معده وارد دوازدهه می شود، کوله سیستوکینین (CCK) آزاد می شود و هورمون گوارشی اسفنکتر را شل می کند و کیسه صفرا را منقبض می کند.
The walls of the extrahepatic biliary ducts and the gallbladder contain fibrous tissue and smooth muscle. They are lined by a layer of columnar cells known as cholangiocytes with scattered mucous glands. In the gallbladder, the surface is extensively folded; this increases its surface area and gives the interior of the gallbladder a honeycombed appearance. The cystic duct is also folded to form the so-called spiral valves. This arrangement is believed to increase the turbulence of bile as it flows out of the gallbladder, thereby reducing the risk that it will precipitate and form gallstones.
دیواره مجاری صفراوی خارج کبدی و کیسه صفرا حاوی بافت فیبری و ماهیچه صاف است. آنها توسط لایه ای از سلول های ستونی به نام کلانژیوسیت ها با غدد مخاطی پراکنده پوشیده شده اند. در کیسه صفرا، سطح به طور گسترده چین خورده است. این باعث افزایش سطح آن می شود و ظاهری لانه زنبوری به داخل کیسه صفرا می دهد. مجرای کیستیک نیز تا می شود تا به اصطلاح دریچه های مارپیچی را تشکیل دهد. اعتقاد بر این است که این ترتیب باعث افزایش تلاطم صفرا هنگام خروج آن از کیسه صفرا می شود و در نتیجه خطر رسوب و تشکیل سنگ صفرا را کاهش می دهد.
HEPATIC CIRCULATION
Large gaps occur between endothelial cells in the walls of hepatic sinusoids, and the sinusoids are highly permeable. The way the intrahepatic branches of the hepatic artery and portal vein converge on the sinusoids and drain into the central lobular veins of the liver is shown in Figure 28-1. The functional unit of the liver is the acinus. Each acinus is at the end of a vascular stalk containing terminal branches of portal veins, hepatic arteries, and bile ducts. Blood flows from the center of this functional unit to the terminal branches of the hepatic veins at the periphery (Figure 28-3). This is why the central portion of the acinus, sometimes called zone 1, is well oxygenated, the intermediate zone (zone 2) is moderately well oxygenated, and the peripheral zone (zone 3) is least well oxygenated and most susceptible to anoxic injury. The acini have been likened to grapes or berries, each on a vascular stem. The human liver contains about 100,000 acini.
گردش خون کبد
شکاف های بزرگی بین سلول های اندوتلیال در دیواره سینوسوئیدهای کبدی ایجاد می شود و سینوس ها نفوذپذیری بالایی دارند. نحوه تلاقی شاخه های داخل کبدی شریان کبدی و ورید پورتال روی سینوسوئیدها و تخلیه آن به وریدهای لوبولار مرکزی کبد در شکل ۲۸-۱ نشان داده شده است. واحد عملکردی کبد آسینوس است. هر آسینوس در انتهای یک ساقه عروقی است که شامل شاخه های انتهایی وریدهای باب، شریان های کبدی و مجاری صفراوی است. خون از مرکز این واحد عملکردی به شاخه های انتهایی وریدهای کبدی در حاشیه جریان دارد (شکل ۲۸-۳). به همین دلیل است که بخش مرکزی آسینوس، که گاهی به آن منطقه ۱ نیز میگویند، به خوبی اکسیژندار است، ناحیه میانی (منطقه ۲) نسبتاً خوب اکسیژن دارد، و ناحیه محیطی (ناحیه ۳) کمترین اکسیژن را دارد و بیشتر در معرض آسیبهای آنوکسیک است. آسین ها را به انگور یا توت تشبیه کرده اند که هر کدام روی یک ساقه آوندی قرار دارند. کبد انسان حدود ۱۰۰۰۰۰ آسین دارد.

FIGURE 28-3 Concept of the acinus as the functional unit of the liver. In each acinus, blood in the portal venule and hepatic arteriole enters the center of the acinus and flows outward to the hepatic venule. (Adapted with permission from Rappaport AM: The microcirculatory hepatic unit. Microvasc Res 1973 Sep; 6(2):212-228.)
شکل ۲۸-۳ مفهوم آسینوس به عنوان واحد عملکردی کبد. در هر آسینوس، خون در ورید پورتال و شریان کبدی وارد مرکز آسینوس شده و به سمت بیرون به سمت ورید کبدی جریان می یابد. (اقتباس شده با مجوز Rappaport AM: واحد کبدی میکروسیرکولاتوری. Microvasc Res 1973 Sep; 6(2):212-228.)
Portal venous pressure is normally about 10 mm Hg in humans, and hepatic venous pressure is approximately 5 mm Hg. The mean pressure in the hepatic artery branches that converge on the sinusoids is about 90 mm Hg, but the pressure in the sinusoids is lower than the portal venous pressure, so a marked pressure drop occurs along the hepatic arterioles. This pressure drop is adjusted so that there is an inverse relationship between hepatic arterial and portal venous blood flow. This inverse relationship may be maintained in part by the rate at which adenosine is removed from the region around the arterioles. According to this hypothesis, adenosine is produced by metabolism at a constant rate. When portal flow is reduced, it is washed away more slowly, and the local accumulation of adenosine dilates the terminal arterioles. In the period between meals, moreover, many of the sinusoids are collapsed. Following a meal, on the other hand, when portal flow to the liver from the intestine increases considerably, these “reserve” sinusoids are recruited. This arrangement means that portal pressures do not increase linearly with portal flow until all sinusoids have been recruited. This may be important to prevent fluid loss from the highly permeable liver under normal conditions. Indeed, if hepatic pressures are increased in disease states (such as the hardening of the liver that is seen in cirrhosis), many liters of fluid can accumulate in the peritoneal cavity as ascites.
فشار ورید پورتال به طور معمول در انسان حدود ۱۰ میلی متر جیوه و فشار ورید کبدی تقریباً ۵ میلی متر جیوه است. فشار متوسط در شاخههای شریان کبدی که روی سینوسها همگرا میشوند حدود ۹۰ میلیمتر جیوه است، اما فشار در سینوسها کمتر از فشار ورید باب است، بنابراین یک افت فشار مشخص در امتداد شریانهای کبدی رخ میدهد. این افت فشار طوری تنظیم می شود که یک رابطه معکوس بین جریان خون شریانی کبدی و ورید پورتال وجود دارد. این رابطه معکوس ممکن است تا حدی با سرعت حذف آدنوزین از ناحیه اطراف شریان ها حفظ شود. بر اساس این فرضیه، آدنوزین توسط متابولیسم با سرعت ثابت تولید می شود. هنگامی که جریان پورتال کاهش می یابد، آهسته تر شسته می شود و تجمع موضعی آدنوزین باعث گشاد شدن شریان های انتهایی می شود. علاوه بر این، در فاصله بین وعده های غذایی، بسیاری از سینوس ها فرو می ریزند. از طرف دیگر، پس از غذا، هنگامی که جریان پورتال از روده به کبد به طور قابل توجهی افزایش می یابد، این سینوسوئیدهای “ذخیره” به کار گرفته می شوند. این ترتیب به این معنی است که فشارهای پورتال به صورت خطی با جریان پورتال افزایش نمی یابد تا زمانی که تمام سینوسی ها به کار گرفته شوند. این ممکن است برای جلوگیری از از دست دادن مایعات از کبد بسیار نفوذپذیر در شرایط عادی مهم باشد. در واقع، اگر فشار کبد در حالت های بیماری (مانند سخت شدن کبد که در سیروز دیده می شود) افزایش یابد، بسیاری از لیتر مایع می تواند به عنوان آسیت در حفره صفاق جمع شود.
The intrahepatic portal vein radicles have smooth muscle in their walls that is innervated by noradrenergic vasoconstrictor nerve fibers reaching the liver via the 3rd to 11th thoracic ventral roots and the splanchnic nerves. The vasoconstrictor innervation of the hepatic artery comes from the hepatic sympathetic plexus. When systemic venous pressure rises, the portal vein radicles are dilated passively and the amount of blood in the liver increases. In heart failure, this hepatic venous congestion may be extreme. Conversely, when diffuse noradrenergic discharge occurs in response to a drop in systemic blood pressure, the intrahepatic portal radicles constrict, portal pressure rises, and blood flow through the liver is brisk, bypassing most of the organ. Most of the blood in the liver enters the systemic circulation. Constriction of the hepatic arterioles diverts blood from the liver, and constriction of the mesenteric arterioles reduces portal inflow. In severe shock, hepatic blood flow may be reduced to such a degree that patchy necrosis of the liver takes place.
ریشههای ورید پورتال داخل کبدی دارای عضله صاف در دیوارههای خود هستند که توسط رشتههای عصبی تنگکننده عروق نورآدرنرژیک عصببندی میشوند که از طریق ریشههای شکمی سینهای ۳ تا ۱۱ و اعصاب اسپلانکنیک به کبد میرسند. عصب منقبض کننده عروق شریان کبدی از شبکه سمپاتیک کبدی ناشی می شود. هنگامی که فشار ورید سیستمیک افزایش می یابد، ریشه های سیاهرگ باب به طور غیر فعال گشاد می شوند و مقدار خون در کبد افزایش می یابد. در نارسایی قلبی، این احتقان وریدی کبدی ممکن است شدید باشد. برعکس، وقتی ترشحات نورآدرنرژیک منتشر در پاسخ به افت فشار خون سیستمیک اتفاق میافتد، ریشههای پورتال داخل کبدی منقبض میشوند، فشار پورتال افزایش مییابد و جریان خون در کبد سریع است و بیشتر اندام را دور میزند. بیشتر خون در کبد وارد گردش خون سیستمیک می شود. انقباض شریان های کبدی خون را از کبد منحرف می کند و انقباض شریان های مزانتریک جریان ورودی پورتال را کاهش می دهد. در شوک شدید، جریان خون کبدی ممکن است به حدی کاهش یابد که نکروز تکهای کبد رخ دهد.
FUNCTIONS OF THE LIVER
The liver has many complex functions that are summarized in Table 28-1. Several will be touched upon briefly here.
عملکردهای کبد
کبد وظایف پیچیده زیادی دارد که در جدول ۲۸-۱ خلاصه شده است. در اینجا به طور خلاصه به چند مورد اشاره خواهد شد.
TABLE 28-1 Principal functions of the liver.
جدول ۲۸-۱ عملکردهای اصلی کبد.

METABOLISM & DETOXIFICATION
It is beyond the scope of this volume to touch upon all of the metabolic functions of the liver. Instead, this chapter will focus on those aspects most closely aligned to gastrointestinal physiology. First, the liver plays key roles in carbohydrate metabolism, including glycogen storage, conversion of galactose and fructose to glucose, and gluconeogenesis, as well as many of the reactions covered in Chapter 1. The substrates for these reactions derive from the products of carbohydrate digestion and absorption that are transported from the intestine to the liver in the portal blood. The liver also plays a major role in maintaining the stability of blood glucose levels in the postprandial period, removing excess glucose from the blood and returning it as needed the so-called glucose buffer function of the liver. In liver failure, hypoglycemia is commonly seen. Similarly, the liver contributes to fat metabolism. It supports a high rate of fatty acid oxidation for energy supply to the liver itself and other organs. Amino acids and two carbon fragments derived from carbohydrates are also converted in the liver to fats for storage. The liver also synthesizes most of the lipoproteins required by the body and preserves cholesterol homeostasis by synthesizing this molecule and also converting excess cholesterol to bile acids.
متابولیسم و سم زدایی
پرداختن به تمام عملکردهای متابولیکی کبد از حوصله این جلد خارج است. درعوض، این فصل بر روی جنبه هایی تمرکز خواهد کرد که نزدیک به فیزیولوژی دستگاه گوارش هستند. اول، کبد نقش کلیدی در متابولیسم کربوهیدرات، از جمله ذخیره گلیکوژن، تبدیل گالاکتوز و فروکتوز به گلوکز، و گلوکونئوژنز، و همچنین بسیاری از واکنش های پوشش داده شده در فصل ۱ ایفا می کند. بسترهای این واکنش ها از محصولات هضم کربوهیدرات و جذب از خون در آزمایش منتقل می شوند. کبد همچنین نقش عمده ای در حفظ ثبات سطح گلوکز خون در دوره پس از غذا دارد، گلوکز اضافی را از خون خارج می کند و در صورت نیاز آن را به اصطلاح عملکرد بافر گلوکز کبد برمی گرداند. در نارسایی کبد، هیپوگلیسمی معمولا دیده می شود. به طور مشابه، کبد به متابولیسم چربی کمک می کند. از سرعت بالایی از اکسیداسیون اسیدهای چرب برای تامین انرژی خود کبد و سایر اندام ها پشتیبانی می کند. اسیدهای آمینه و دو قطعه کربن حاصل از کربوهیدرات ها نیز در کبد به چربی برای ذخیره سازی تبدیل می شوند. کبد همچنین اکثر لیپوپروتئین های مورد نیاز بدن را سنتز می کند و با سنتز این مولکول و همچنین تبدیل کلسترول اضافی به اسیدهای صفراوی، هموستاز کلسترول را حفظ می کند.
The liver also detoxifies the blood of substances originating from the gut or elsewhere in the body. Part of this function is physical in nature-bacteria and other particulates are trapped in and broken down by the strategically located Kupffer cells. The remaining reactions are biochemical, and mediated in their first stages by the large number of cytochrome P450 enzymes expressed in hepatocytes. These convert xenobiotics and other toxins to inactive, less lipophilic metabolites. Detoxification reactions are divided into phase I (oxidation, hydroxylation, and other reactions mediated by cytochrome P450s) and phase II (esterification). Ultimately, metabolites are secreted into the bile for elimination via the gastrointestinal tract. In this regard, in addition to disposing of drugs, the liver is responsible for metabolism of essentially all steroid hormones. Liver disease can therefore result in the apparent overactivity of the relevant hormone systems.
کبد همچنین خون موادی را که از روده یا سایر نقاط بدن منشا می گیرند سم زدایی می کند. بخشی از این عملکرد در طبیعت فیزیکی است – باکتری ها و ذرات دیگر در سلول های کوپفر واقع در استراتژیک به دام افتاده و تجزیه می شوند. واکنشهای باقیمانده بیوشیمیایی هستند و در اولین مراحل خود توسط تعداد زیادی آنزیم سیتوکروم P450 بیان شده در سلولهای کبدی انجام میشوند. اینها بیگانهبیوتیکها و سایر سموم را به متابولیتهای غیرفعال و کمتر چربی دوست تبدیل میکنند. واکنشهای سمزدایی به فاز I (اکسیداسیون، هیدروکسیلاسیون و سایر واکنشهایی که با واسطه سیتوکروم P450s انجام میشوند) و فاز II (استریسازی) تقسیم میشوند. در نهایت، متابولیت ها برای دفع از طریق دستگاه گوارش به صفرا ترشح می شوند. در این راستا، کبد علاوه بر دفع داروها، مسئول متابولیسم اساساً تمام هورمونهای استروئیدی است. بنابراین بیماری کبد می تواند منجر به فعالیت بیش از حد ظاهری سیستم های هورمونی مربوطه شود.
SYNTHESIS OF PLASMA PROTEINS
The principal proteins synthesized by the liver are listed in Table 28–۱. Albumin is quantitatively the most significant, and accounts for the majority of plasma oncotic pressure. Many of the products are acute-phase proteins, proteins synthesized and secreted into the plasma on exposure to stressful stimuli (see Chapter 3). Others are proteins that transport steroids and other hormones in the plasma, and still others are clotting factors. Following blood loss, the liver replaces the plasma proteins in days to weeks. The only major class of plasma proteins not synthesized by the liver is the immunoglobulins.
سنتز پروتئین های پلاسما
پروتئین های اصلی سنتز شده توسط کبد در جدول ۲۸-۱ فهرست شده است. آلبومین از نظر کمی مهم ترین است و بیشترین فشار انکوتیک پلاسما را تشکیل می دهد. بسیاری از فرآورده ها پروتئین های فاز حاد هستند، پروتئین هایی که در اثر قرار گرفتن در معرض محرک های استرس زا سنتز شده و در پلاسما ترشح می شوند (به فصل ۳ مراجعه کنید). برخی دیگر پروتئین هایی هستند که استروئیدها و سایر هورمون ها را در پلاسما منتقل می کنند و برخی دیگر از عوامل لخته شدن خون هستند. به دنبال از دست دادن خون، کبد طی چند روز تا چند هفته جایگزین پروتئین های پلاسما می شود. تنها کلاس اصلی پروتئین های پلاسما که توسط کبد سنتز نمی شوند، ایمونوگلوبولین ها هستند.
AMMONIA METABOLISM & EXCRETION
The liver is critical for ammonia handling in the body (Clinical Box 28-1). Ammonia levels must be carefully controlled because it is toxic to the central nervous system (CNS), and freely permeable across the blood-brain barrier. The liver is the only organ in which the complete urea cycle (also known as the Krebs-Henseleit cycle) is expressed (Figure 1-20). This converts circulating ammonia to urea, which can then be excreted in the urine (Figure 28-4).
متابولیسم و دفع آمونیاک
کبد برای انتقال آمونیاک در بدن حیاتی است (کادر بالینی ۲۸-۱). سطح آمونیاک باید به دقت کنترل شود زیرا برای سیستم عصبی مرکزی (CNS) سمی است و آزادانه در سد خونی مغزی نفوذ می کند. کبد تنها عضوی است که چرخه کامل اوره (همچنین به عنوان چرخه کربس-هنسلیت شناخته می شود) در آن بیان می شود (شکل ۱-۲۰). این امر آمونیاک در گردش را به اوره تبدیل می کند که سپس می تواند از طریق ادرار دفع شود (شکل ۲۸-۴).

FIGURE 28-4 Whole body ammonia homeostasis in health. The majority of ammonia produced by the body is excreted by the kidneys in the form of urea.
شکل ۲۸-۴ هموستاز آمونیاک کل بدن در سلامت. اکثر آمونیاک تولید شده توسط بدن توسط کلیه ها به شکل اوره دفع می شود.
Ammonia in the circulation comes primarily from the colon and kidneys with lesser amounts deriving from the breakdown of red blood cells and from metabolism in the muscles. As it passes through the liver, almost all of the ammonia in the circulation is cleared into the hepatocytes. There, it is converted in the mitochondria to carbamoyl phosphate, which in turn reacts with ornithine to generate citrulline. A series of subsequent cytoplasmic reactions eventually produce arginine, and this can be dehydrated to urea and ornithine. The latter returns to the mitochondria to begin another cycle, and urea, as a small molecule, diffuses readily back out into the sinusoidal blood. It is then filtered in the kidneys and lost from the body in the urine.
آمونیاک موجود در گردش خون عمدتاً از روده بزرگ و کلیه ها با مقادیر کمتری از تجزیه گلبول های قرمز خون و متابولیسم در ماهیچه ها ناشی می شود. همانطور که از کبد عبور می کند، تقریباً تمام آمونیاک موجود در گردش خون به سلول های کبدی پاک می شود. در آنجا، در میتوکندری به کاربامویل فسفات تبدیل می شود که به نوبه خود با اورنیتین واکنش می دهد و سیترولین تولید می کند. مجموعهای از واکنشهای سیتوپلاسمی بعدی در نهایت آرژنین تولید میکند و این میتواند به اوره و اورنیتین تبدیل شود. دومی برای شروع چرخه دیگری به میتوکندری باز می گردد و اوره به عنوان یک مولکول کوچک به راحتی به داخل خون سینوسی منتشر می شود. سپس در کلیه ها فیلتر شده و در ادرار از بدن دفع می شود.
CLINICAL BOX 28- 1
Hepatic Encephalopathy
The clinical importance of hepatic ammonia metabolism is seen in liver failure, when increased levels of circulating ammonia cause the condition of hepatic encephalopathy. Initially, patients may seem merely confused, but if untreated, the condition can progress to coma and irreversible changes in cognition. The disease results not only from the loss of functional hepatocytes, but also shunting of portal blood around the hardened liver, meaning that less ammonia is removed from the blood by the remaining hepatic mass. Additional substances that are normally detoxified by the liver likely also contribute to the mental status changes.
جعبه بالینی ۲۸- ۱
انسفالوپاتی کبدی
اهمیت بالینی متابولیسم آمونیاک کبدی در نارسایی کبدی دیده می شود، زمانی که افزایش سطح آمونیاک در گردش باعث بیماری آنسفالوپاتی کبدی می شود. در ابتدا، بیماران ممکن است صرفاً گیج به نظر برسند، اما در صورت عدم درمان، این بیماری می تواند به کما و تغییرات غیرقابل برگشت در شناخت پیشرفت کند. این بیماری نه تنها در نتیجه از دست دادن سلولهای کبدی عملکردی، بلکه در نتیجه شنت خون پورتال در اطراف کبد سخت شده است، به این معنی که آمونیاک کمتری توسط توده کبدی باقیمانده از خون خارج میشود. مواد اضافی که به طور معمول توسط کبد سم زدایی می شوند، احتمالاً به تغییرات وضعیت روانی نیز کمک می کنند.
THERAPEUTIQ HIGHLIGHTS
The cognitive symptoms of advanced liver disease can be minimized by reducing the load of ammonia coming to the liver from the colon (eg, by feeding the nonabsorbable carbohydrate, lactulose, which is converted into short-chain fatty acids in the colonic lumen and thereby traps luminal ammonia in its ionized form). However, in severe disease, the only truly effective treatment is to perform a liver transplant, although the paucity of available organs means that there is great interest in artificial liver assist devices that could clean the blood.
نکات برجسته درمانی
علائم شناختی بیماری پیشرفته کبد را می توان با کاهش بار آمونیاکی که از روده بزرگ به کبد وارد می شود (به عنوان مثال، با تغذیه کربوهیدرات غیرقابل جذب، لاکتولوز، که در مجرای روده بزرگ به اسیدهای چرب با زنجیره کوتاه تبدیل می شود و در نتیجه آمونیاک مجرا را به شکل یونیزه شده آن به دام می اندازد) به حداقل رساند. با این حال، در بیماری شدید، تنها درمان واقعاً مؤثر، انجام پیوند کبد است، اگرچه کمبود اندامهای موجود به این معنی است که علاقه زیادی به دستگاههای کمکی کبد مصنوعی وجود دارد که میتوانند خون را تمیز کنند.
BILE
Bile is made up of the bile acids, bile pigments, and other substances dissolved in an alkaline electrolyte solution that resembles pancreatic juice (Table 28–۲). About 500 mL is secreted per day. Some of the components of the bile are reabsorbed in the intestine and then excreted again by the liver (enterohepatic circulation). In addition to its role in digestion and absorption of fats (Chapter 26), bile (and subsequently the feces) is the major excretory route for lipid-soluble waste products.
صفرا
صفرا از اسیدهای صفراوی، رنگدانه های صفراوی و سایر مواد حل شده در محلول الکترولیت قلیایی که شبیه آب پانکراس است تشکیل شده است (جدول ۲۸-۲). حدود ۵۰۰ میلی لیتر در روز ترشح می شود. برخی از اجزای صفرا در روده بازجذب می شوند و سپس دوباره توسط کبد دفع می شوند (گردش کبدی). صفرا (و متعاقباً مدفوع) علاوه بر نقشی که در هضم و جذب چربی ها دارد (فصل ۲۶) راه اصلی دفع مواد زائد محلول در چربی است.
The glucuronides of the bile pigments, bilirubin and biliverdin, are responsible for the golden yellow color of bile. The formation of these breakdown products of hemoglobin is discussed in detail in Chapter 31, and their excretion is discussed in the following text.
گلوکورونیدهای رنگدانه های صفراوی، بیلی روبین و بیلی وردین، مسئول رنگ زرد طلایی صفرا هستند. تشکیل این محصولات تجزیه هموگلوبین به تفصیل در فصل ۳۱ مورد بحث قرار گرفته و دفع آنها در متن زیر مورد بحث قرار گرفته است.
TABLE 28-2 Composition of human hepatic duct bile.
جدول ۲۸-۲ ترکیب صفرا مجرای کبدی انسان.

BILIRUBIN METABOLISM & EXCRETION
Most of the bilirubin in the body is formed in the tissues by the breakdown of hemoglobin (see Chapter 31 and Figure 28-5). The bilirubin is bound to albumin in the circulation. Most of it is tightly bound, but some of it can dissociate in the liver, and free bilirubin enters liver cells via a member of the organic anion transporting polypeptide (OATP) family, and then becomes bound to cytoplasmic proteins (Figure 28–۶). It is next conjugated to glucuronic acid in a reaction catalyzed by the enzyme glucuronyl transferase (UDP- glucuronosyltransferase). This enzyme is located primarily in the smooth endoplasmic reticulum. Each bilirubin molecule reacts with two uridine diphosphoglucuronic acid (UDPGA) molecules to form bilirubin diglucuronide. This glucuronide, which is more water-soluble than the free bilirubin, is then transported against a concentration gradient most likely by an active transporter known as multidrug resistance protein-2 (MRP-2) into the bile canaliculi. A small amount of the bilirubin glucuronide escapes into the blood, where it is bound less tightly to albumin than is free bilirubin, and is excreted in the urine. Thus, the total plasma bilirubin normally includes free bilirubin plus a small amount of conjugated bilirubin. Most of the bilirubin glucuronide passes via the bile ducts to the intestine.
متابولیسم و دفع بیلی روبین
بیشتر بیلی روبین در بدن در بافت ها با تجزیه هموگلوبین تشکیل می شود (به فصل ۳۱ و شکل ۲۸-۵ مراجعه کنید). بیلی روبین در گردش خون به آلبومین متصل می شود. بیشتر آن به شدت متصل است، اما مقداری از آن می تواند در کبد جدا شود و بیلی روبین آزاد از طریق یکی از اعضای خانواده پلی پپتیدهای انتقال دهنده آنیون آلی (OATP) وارد سلول های کبدی شده و سپس به پروتئین های سیتوپلاسمی متصل می شود (شکل ۲۸-۶). سپس در واکنشی که توسط آنزیم گلوکورونیل ترانسفراز (UDP- glucuronosyltransferase) کاتالیز می شود، به اسید گلوکورونیک کونژوگه می شود. این آنزیم عمدتاً در شبکه آندوپلاسمی صاف قرار دارد. هر مولکول بیلی روبین با دو مولکول یوریدین دی فسفوگلوکورونیک اسید (UDPGA) واکنش می دهد تا بیلی روبین دی گلوکورونید را تشکیل دهد. این گلوکورونید که بیشتر از بیلی روبین آزاد در آب محلول است، سپس در برابر یک گرادیان غلظت به احتمال زیاد توسط یک انتقال دهنده فعال به نام پروتئین مقاومت چند دارویی-۲ (MRP-2) به داخل کانال های صفراوی منتقل می شود. مقدار کمی از بیلی روبین گلوکورونید به خون میرود، جایی که نسبت به بیلیروبین آزاد محکمتر به آلبومین متصل میشود و از طریق ادرار دفع میشود. بنابراین، بیلی روبین کل پلاسما معمولاً شامل بیلی روبین آزاد به اضافه مقدار کمی بیلی روبین کونژوگه است. بیشتر بیلی روبین گلوکورونید از طریق مجاری صفراوی به روده می رود.

FIGURE 28-5 Conversion of heme to bilirubin is a two-step reaction catalyzed by heme oxygenase and biliverdin reductase. M, methyl; P, propionate; V, vinyl.
شکل ۲۸-۵ تبدیل هم به بیلی روبین یک واکنش دو مرحله ای است که توسط هم اکسیژناز و بیلی وردین ردوکتاز کاتالیز می شود. M، متیل؛ P، پروپیونات؛ V، وینیل.

FIGURE 28-6 Handling of bilirubin by hepatocytes. Albumin (Alb)-bound bilirubin (B) enters the space of Disse adjacent to the basolateral membrane of hepatocytes, and bilirubin is selectively transported into the hepatocyte. Here, it is conjugated with glucuronic acid (G). The conjugates are secreted into bile via the multidrug resistance protein 2 (MRP-2). Some unconjugated and conjugated bilirubin also refluxes into the plasma. The purple circles linking the two adjacent cells represent the tight junctions. BG, bilirubin monoglucuronide; BG2, bilirubin diglucuronide; OATP, organic anion transporting polypeptide.
شکل ۲۸-۶ مدیریت بیلی روبین توسط سلول های کبدی. بیلی روبین متصل به آلبومین (Alb) (B) وارد فضای Disse مجاور غشای قاعده جانبی سلولهای کبدی می شود و بیلی روبین به طور انتخابی به داخل سلول کبدی منتقل می شود. در اینجا با اسید گلوکورونیک (G) کونژوگه می شود. مزدوج ها از طریق پروتئین مقاومت چند دارویی ۲ (MRP-2) به صفرا ترشح می شوند. مقداری بیلی روبین غیر کونژوگه و کونژوگه نیز به پلاسما برگشت می کند. دایره های بنفش که دو سلول مجاور را به هم متصل می کنند، نشان دهنده اتصالات محکم هستند. BG، بیلی روبین مونوگلوکورونید؛ BG2، بیلی روبین دی گلوکورونید؛ OATP، پلی پپتید انتقال دهنده آنیون آلی.
The intestinal mucosa is relatively impermeable to conjugated bilirubin but is permeable to unconjugated bilirubin and to urobilinogens, a series of colorless derivatives of bilirubin formed by the action of bacteria in the intestine. Consequently, some of the bile pigments and urobilinogens are reabsorbed in the portal circulation. Some of the reabsorbed substances are again excreted by the liver (enterohepatic circulation), but small amounts of urobilinogens enter the general circulation and are excreted in the urine.
مخاط روده نسبت به بیلی روبین کونژوگه نفوذناپذیر است، اما نسبت به بیلی روبین کونژوگه و اوروبیلینوژن ها، مجموعه ای از مشتقات بی رنگ بیلی روبین که در اثر فعالیت باکتری ها در روده ایجاد می شوند، نفوذپذیر است. در نتیجه، برخی از رنگدانه های صفراوی و اوروبیلینوژن ها در گردش خون پورتال دوباره جذب می شوند. برخی از مواد بازجذب مجدداً توسط کبد دفع می شوند (گردش کبدی) اما مقدار کمی از اوروبیلینوژن وارد گردش خون عمومی شده و از طریق ادرار دفع می شود.
JAUNDICE
When free or conjugated bilirubin accumulates in the blood, the skin, scleras, and mucous membranes turn yellow. This yellowness is known as jaundice (icterus) and is usually detectable when the total plasma bilirubin is greater than 2 mg/dL (34 μmol/L). Hyperbilirubinemia may be due to (1) excess production of bilirubin (hemolytic anemia, etc; see Chapter 31), (2) decreased uptake of bilirubin into hepatic cells, (3) disturbed intracellular protein binding or conjugation, (4) disturbed secretion of conjugated bilirubin into the bile canaliculi, or (5) intrahepatic or extrahepatic bile duct obstruction. When it is due to one of the first three processes, the free bilirubin rises. When it is due to disturbed secretion of conjugated bilirubin or bile duct obstruction, bilirubin glucuronide regurgitates into the blood, and it is predominantly the conjugated bilirubin in the plasma that is elevated.
یرقان
هنگامی که بیلی روبین آزاد یا کونژوگه در خون انباشته می شود، پوست، صلبیه و غشاهای مخاطی زرد می شوند. این زردی به نام یرقان (icterus) شناخته می شود و معمولاً زمانی قابل تشخیص است که بیلی روبین کل پلاسما بیش از ۲ میلی گرم در دسی لیتر (۳۴ میکرومول در لیتر) باشد. هیپربیلی روبینمی ممکن است به دلیل (۱) تولید بیش از حد بیلی روبین (کم خونی همولیتیک و غیره؛ به فصل ۳۱ مراجعه کنید)، (۲) کاهش جذب بیلی روبین به سلول های کبدی، (۳) اختلال در اتصال یا کونژوگاسیون پروتئین داخل سلولی، (۴) ترشح مختل شده بیلی روبین مزدوج، یا بیلی روب مزدوج (۵) انسداد مجرای صفراوی خارج کبدی هنگامی که به دلیل یکی از سه فرآیند اول باشد، بیلی روبین آزاد افزایش می یابد. هنگامی که به دلیل ترشح مختل بیلی روبین کونژوگه یا انسداد مجرای صفراوی باشد، گلوکورونید بیلی روبین به خون برگشت می کند و عمدتاً بیلی روبین کونژوگه در پلاسما است که افزایش می یابد.
OTHER SUBSTANCES CONJUGATED BY GLUCURONYL TRANSFERASE
The glucuronyl transferase system in the smooth endoplasmic reticulum catalyzes the formation of the glucuronides of a variety of substances in addition to bilirubin. As discussed above, the list includes steroids (see Chapter 20) and various drugs. These other compounds can compete with bilirubin for the enzyme system when they are present in appreciable amounts. In addition, several barbiturates, antihistamines, anticonvulsants, and other compounds cause marked proliferation of the smooth endoplasmic reticulum in the hepatic cells, with a concurrent increase in hepatic glucuronyl transferase activity. Phenobarbital has been used successfully for the treatment of a congenital disease in which there is a relative deficiency of glucuronyl transferase (type 2 UDP-glucuronosyltransferase deficiency).
سایر مواد کونژوگه شده توسط گلوکورونیل ترانسفراز
سیستم گلوکورونیل ترانسفراز در شبکه آندوپلاسمی صاف تشکیل گلوکورونیدهای مواد مختلف علاوه بر بیلی روبین را کاتالیز می کند. همانطور که در بالا توضیح داده شد، این لیست شامل استروئیدها (به فصل ۲۰ مراجعه کنید) و داروهای مختلف است. این ترکیبات دیگر زمانی که در مقادیر قابل توجهی وجود داشته باشند می توانند برای سیستم آنزیمی با بیلی روبین رقابت کنند. علاوه بر این، چندین باربیتورات، آنتی هیستامین، ضد تشنج و سایر ترکیبات باعث تکثیر مشخص شبکه آندوپلاسمی صاف در سلولهای کبدی میشوند، همراه با افزایش همزمان فعالیت گلوکورونیل ترانسفراز کبدی. فنوباربیتال با موفقیت برای درمان یک بیماری مادرزادی که در آن کمبود نسبی گلوکورونیل ترانسفراز وجود دارد (کمبود UDP-گلوکورونوزیل ترانسفراز نوع ۲) استفاده شده است.
OTHER SUBSTANCES EXCRETED IN THE BILE
Cholesterol and alkaline phosphatase are excreted in the bile. In patients with jaundice due to intrahepatic or extrahepatic obstruction of the bile duct, the blood levels of these two substances usually rise. A much smaller rise is generally seen when the jaundice is due to nonobstructive hepatocellular disease. Adrenocortical and other steroid hormones and a number of drugs are excreted in the bile and subsequently reabsorbed (enterohepatic circulation).
سایر موادی که در صفرا دفع می شوند
کلسترول و آلکالین فسفاتاز در صفرا دفع می شوند. در بیماران مبتلا به زردی ناشی از انسداد داخل یا خارج کبدی مجرای صفراوی، معمولاً سطح خونی این دو ماده افزایش می یابد. زمانی که زردی به دلیل بیماری سلول های کبدی غیر انسدادی باشد، معمولاً افزایش بسیار کمتری مشاهده می شود. قشر آدرنال و سایر هورمون های استروئیدی و تعدادی از داروها در صفرا دفع می شوند و متعاقباً دوباره جذب می شوند (گردش کبدی).
THE BILIARY SYSTEM
BILE FORMATION
Each of its major constituents derived from the hepatocytes enters the bile by means of a specific canalicular transporter. It is the active secretion of bile acids, however, that is believed to be the primary driving force for the initial formation of canalicular bile. Because they are osmotically active, the canalicular bile is transiently hypertonic. However, the tight junctions that join adjacent hepatocytes are relatively permeable and thus a number of additional substances passively enter the bile from the plasma by diffusion. These substances include water, glucose, calcium, glutathione, amino acids, and urea.
سیستم صفراوی
تشکیل صفرا
هر یک از اجزای اصلی آن که از سلولهای کبدی مشتق شدهاند، از طریق یک ناقل کانالی خاص وارد صفرا میشوند. با این حال، اعتقاد بر این است که این ترشح فعال اسیدهای صفراوی است که نیروی محرکه اولیه برای تشکیل اولیه صفرا کانالیکولار است. از آنجا که آنها از نظر اسمزی فعال هستند، صفرا کانالی گذرا هیپرتونیک است. با این حال، اتصالات محکمی که به سلولهای کبدی مجاور میپیوندند، نسبتاً نفوذپذیر هستند و بنابراین تعدادی از مواد اضافی به طور غیرفعال از طریق انتشار از پلاسما وارد صفرا میشوند. این مواد شامل آب، گلوکز، کلسیم، گلوتاتیون، اسیدهای آمینه و اوره است.
Phosphatidylcholine that enters the bile forms mixed micelles with the bile acids and cholesterol. The ratio of bile acids:phosphatidylcholine:cholesterol in canalicular bile is approximately 10:3:1. Deviations from this ratio may cause cholesterol to precipitate, leading to one type of gallstones (Figure 28-7).
فسفاتیدیل کولینی که وارد صفرا می شود، میسل های مخلوط با اسیدهای صفراوی و کلسترول را تشکیل می دهد. نسبت اسیدهای صفراوی: فسفاتیدیل کولین: کلسترول در صفرای کانالی تقریباً ۱۰:۳:۱ است. انحراف از این نسبت ممکن است باعث رسوب کلسترول شود که منجر به یک نوع سنگ کیسه صفرا می شود (شکل ۲۸-۷).

FIGURE 28-7 Cholesterol solubility in bile as a function of the proportions of lecithin (phosphatidylcholine), bile salts (bile acids), and cholesterol. In bile that has a composition described by any point below line ABC (eg, point P), cholesterol is solely in micellar solution; points above line ABC describe bile in which there are cholesterol crystals as well. (Reproduced with permission from Small DM: Gallstones. N Engl J Med 1968; Sep 12; 279(11):588–۵۹۳.)
شکل ۲۸-۷ حلالیت کلسترول در صفرا به عنوان تابعی از نسبت های لسیتین (فسفاتیدیل کولین)، نمک های صفراوی (اسیدهای صفراوی) و کلسترول. در صفراوی که دارای ترکیبی است که با هر نقطه زیر خط ABC (مثلاً نقطه P) توصیف شده است، کلسترول فقط در محلول میسلی است. نقاط بالای خط ABC صفرا را توصیف می کند که در آن کریستال های کلسترول نیز وجود دارد. (تکثیر شده با اجازه Small DM: Gallstones. N Engl J Med 1968؛ ۱۲ سپتامبر؛ ۲۷۹(۱۱):۵۸۸-۵۹۳.)
The bile is transferred to progressively larger bile ductules and ducts, where it undergoes modification of its composition. The bile ductules are lined by cholangiocytes, specialized columnar epithelial cells. Their tight junctions are less permeable than those of the hepatocytes, although they remain freely permeable to water and thus bile remains isotonic. The ductules scavenge plasma constituents, such as glucose and amino acids, and return them to the circulation by active transport. Glutathione is also hydrolyzed to its constituent amino acids by an enzyme, gamma glutamyltranspeptidase (GGT), expressed on the apical membrane of the cholangiocytes. Removal of glucose and amino acids is likely important to prevent bacterial overgrowth in the bile, particularly during gallbladder storage (see below). The ductules also secrete bicarbonate in response to secretin in the postprandial period, as well as IgA and mucus for protection.
صفرا به مجراها و مجاری صفراوی به تدریج بزرگتر منتقل می شود و در آنجا تغییراتی در ترکیب خود ایجاد می شود. مجراهای صفراوی توسط کلانژیوسیت ها، سلول های اپیتلیال ستونی تخصصی پوشیده شده اند. اتصالات محکم آنها نسبت به سلولهای کبدی نفوذپذیری کمتری دارند، اگرچه آزادانه در برابر آب نفوذپذیر میمانند و بنابراین صفرا ایزوتونیک باقی میماند. مجراها مواد تشکیل دهنده پلاسما مانند گلوکز و اسیدهای آمینه را از بین می برند و با انتقال فعال به گردش خون باز می گردند. گلوتاتیون همچنین توسط آنزیمی به نام گاما گلوتامیل ترانس پپتیداز (GGT) که بر روی غشای آپیکال کلانژیوسیت ها بیان می شود، به اسیدهای آمینه تشکیل دهنده خود هیدرولیز می شود. حذف گلوکز و اسیدهای آمینه احتمالاً برای جلوگیری از رشد بیش از حد باکتری ها در صفرا، به ویژه در طول ذخیره سازی کیسه صفرا مهم است (به زیر مراجعه کنید). مجراها همچنین در پاسخ به سکرتین در دوره پس از غذا بی کربنات و همچنین IgA و مخاط را برای محافظت ترشح می کنند.
FUNCTIONS OF THE GALLBLADDER
In normal individuals, bile flows into the gallbladder when the sphincter of Oddi is closed (ie, the period in between meals). In the gallbladder, the bile is concentrated by absorption of water. The degree of this concentration is shown by the increase in the concentration of solids (Table 28-3); hepatic bile is 97% water, whereas the average water content of gallbladder bile is 89%. However, because the bile acids are a micellar solution, the micelles simply become larger, and since osmolarity is a colligative property, bile remains isotonic. However, bile becomes less alkaline as sodium ions are exchanged for protons (although the overall concentration of sodium ions rises with a concomitant loss of chloride and bicarbonate as the bile is concentrated).
عملکردهای کیسه صفرا
در افراد عادی، صفرا هنگامی که اسفنکتر اودی بسته می شود (یعنی دوره بین وعده های غذایی) به کیسه صفرا می ریزد. در کیسه صفرا، صفرا با جذب آب متمرکز می شود. درجه این غلظت با افزایش غلظت مواد جامد نشان داده شده است (جدول ۲۸-۳). صفرای کبدی ۹۷ درصد آب است، در حالی که میزان متوسط آب صفرای کیسه صفرا ۸۹ درصد است. با این حال، از آنجایی که اسیدهای صفراوی یک محلول میسلی هستند، میسل ها به سادگی بزرگتر می شوند و از آنجایی که اسمولاریته یک خاصیت جمعی است، صفرا ایزوتونیک باقی می ماند. با این حال، با مبادله یون های سدیم با پروتون ها، صفرا کمتر قلیایی می شود (اگرچه غلظت کلی یون های سدیم با از دست دادن همزمان کلرید و بی کربنات با غلیظ شدن صفرا افزایش می یابد).
TABLE 28-3 Comparison of human hepatic duct bile and gallbladder bile.
جدول ۲۸-۳ مقایسه صفرا مجرای کبد انسان و صفرا کیسه صفرا.

REGULATION OF BILIARY SECRETION
When food enters the mouth, the resistance of the sphincter of Oddi decreases under both neural and hormonal influences (Figure 28-8). Fatty acids and amino acids in the duodenum release CCK, which causes gallbladder contraction.
تنظیم ترشح صفرا
هنگامی که غذا وارد دهان می شود، مقاومت اسفنکتر اودی تحت تأثیرات عصبی و هورمونی کاهش می یابد (شکل ۲۸-۸). اسیدهای چرب و اسیدهای آمینه موجود در دوازدهه CCK را آزاد می کنند که باعث انقباض کیسه صفرا می شود.
The production of bile is increased by stimulation of the vagus nerves and by the hormone secretin, which increases the water and HCO3 content of bile. Substances that increase the secretion of bile are known as choleretics. Bile acids themselves are among the most important physiologic choleretics.
تولید صفرا با تحریک اعصاب واگ و توسط هورمون سکرتین افزایش می یابد که باعث افزایش محتوای آب و HCO۳ صفرا می شود. موادی که ترشح صفرا را افزایش می دهند به عنوان کولرتیک شناخته می شوند. اسیدهای صفراوی خود از مهم ترین کلرتیک های فیزیولوژیک هستند.

FIGURE 28-8 Neurohumoral control of gallbladder contraction and biliary secretion. Endocrine release of cholecystokinin (CCK) in response to nutrients causes gallbladder contraction. CCK also activates vagal afferents to trigger a vagovagal reflex that reinforces gallbladder contraction (via acetylcholine [ACH]) and relaxation of the sphincter of Oddi to permit bile outflow (via NO and vasoactive intestinal polypeptide [VIP]).
شکل ۲۸-۸ کنترل نوروهومورال انقباض کیسه صفرا و ترشح صفراوی. آزادسازی غدد درون ریز کوله سیستوکینین (CCK) در پاسخ به مواد مغذی باعث انقباض کیسه صفرا می شود. CCK همچنین آوران های واگ را فعال می کند تا یک رفلکس واگوگال را تحریک کند که انقباض کیسه صفرا (از طریق استیل کولین [ACH]) و شل شدن اسفنکتر Oddi را برای اجازه خروج صفرا (از طریق NO و پلی پپتید وازواکتیو روده [VIP]) تقویت می کند.
EFFECTS OF CHOLECYSTECTOMY
The periodic discharge of bile from the gallbladder aids digestion but is not essential for it. Cholecystectomized patients maintain good health and nutrition with a constant slow discharge of bile into the duodenum, although eventually the bile duct becomes somewhat dilated, and more bile tends to enter the duodenum after meals than at other times.
اثرات کوله سیستکتومی
تخلیه دوره ای صفرا از کیسه صفرا به هضم کمک می کند اما برای آن ضروری نیست. بیماران کوله سیستکتومی شده با تخلیه آرام صفرا به اثنی عشر، سلامت و تغذیه خوبی را حفظ می کنند، اگرچه در نهایت مجرای صفراوی تا حدودی گشاد می شود و صفرای بیشتری بعد از غذا نسبت به زمان های دیگر وارد دوازدهه می شود.
VISUALIZING THE GALLBLADDER
Exploration of the right upper quadrant with an ultrasonic beam (ultrasonography) and computed tomography (CT) have become the most widely used methods for visualizing the gallbladder and detecting gallstones. A third method of diagnosing gallbladder disease is nuclear cholescintigraphy. When administered intravenously, technetium-99m-labeled derivatives of iminodiacetic acid are excreted in the bile and provide excellent gamma camera images of the gallbladder and bile ducts. The response of the gallbladder to CCK can then be observed following intravenous administration of the hormone. The biliary tree can also be visualized by injecting contrast media from an endoscope channel maneuvered into the sphincter of Oddi, in a procedure known as endoscopic retrograde cholangiopancreatography (ERCP). It is even possible to insert small instruments with which to remove gallstone fragments that may be obstructing the flow of bile, the flow of pancreatic juice, or both (Clinical Box 28-2).
تجسم کیسه صفرا
اکتشاف ربع فوقانی راست با پرتو اولتراسونیک (سونوگرافی) و توموگرافی کامپیوتری (CT) به پرکاربردترین روشها برای تجسم کیسه صفرا و تشخیص سنگهای صفراوی تبدیل شدهاند. روش سوم برای تشخیص بیماری کیسه صفرا کولسینتی گرافی هسته ای است. هنگامی که به صورت داخل وریدی تجویز می شود، مشتقات برچسب شده با تکنسیوم 99m از اسید ایمینودی استیک در صفرا دفع می شوند و تصاویر دوربین گاما عالی از کیسه صفرا و مجاری صفراوی را ارائه می دهند. پاسخ کیسه صفرا به CCK پس از تجویز داخل وریدی این هورمون قابل مشاهده است. درخت صفراوی را نیز می توان با تزریق مواد حاجب از کانال آندوسکوپی که به اسفنکتر Oddi مانور می دهد، در روشی به نام کلانژیوپانکراتوگرافی رتروگراد آندوسکوپی (ERCP) مشاهده کرد. حتی می توان ابزارهای کوچکی را وارد کرد که با آن قطعات سنگ کیسه صفرا را که ممکن است مانع از جریان صفرا، جریان شیره پانکراس یا هر دو شوند، خارج کرد (کادر بالینی ۲۸-۲).
CLINICAL BOX 28-2
Gallstones
Cholelithiasis, that is, the presence of gallstones, is a common condition. Its incidence increases with age, so that in the United States, for example, 20% of the women and 5% of the men between the ages of 50 and 65 have gallstones. The stones are of two types: calcium bilirubinate stones and cholesterol stones. In the United States and Europe, 85% of the stones are cholesterol stones. Three factors appear to be involved in the formation of cholesterol stones. One is bile stasis; stones form in the bile that is sequestrated in the gallbladder rather than the bile that is flowing in the bile ducts. A second is supersaturation of the bile with cholesterol. Cholesterol is very insoluble in bile, and it is maintained in solution in micelles only at certain concentrations of bile salts and lecithin. At concentrations above line ABC in Figure 28-7, the bile is supersaturated and contains small crystals of cholesterol in addition to micelles. However, many healthy individuals in whom gallstones do not develop also have supersaturated bile. The third factor is a mix of nucleation factors that favors formation of stones from the supersaturated bile. Outside the body, bile from patients with cholelithiasis forms stones in 2-3 days, whereas it takes more than 2 weeks for stones to form in bile from normal individuals. The exact nature of the nucleation factors is unsettled, although glycoproteins in gallbladder mucus have been implicated. In addition, it is unsettled whether stones form as a result of excess production of components that favor nucleation or decreased production of antinucleation components that prevent stones from forming in normal individuals.
جعبه بالینی ۲۸-۲
سنگ کیسه صفرا
کللیتیازیس، یعنی وجود سنگ کیسه صفرا، یک بیماری شایع است. بروز آن با افزایش سن افزایش می یابد، به طوری که برای مثال در ایالات متحده، ۲۰ درصد از زنان و ۵ درصد از مردان بین ۵۰ تا ۶۵ سال به سنگ کیسه صفرا مبتلا هستند. سنگ ها دو نوع هستند: سنگ های بیلی روبینات کلسیمی و سنگ های کلسترولی. در ایالات متحده و اروپا ۸۵ درصد از سنگ ها را سنگ های کلسترولی تشکیل می دهند. به نظر می رسد سه عامل در تشکیل سنگ های کلسترولی دخیل هستند. یکی استاز صفرا است. سنگها در صفراوی که در کیسه صفرا انباشته شدهاند، به جای صفراوی که در مجاری صفراوی جریان دارد، تشکیل میشوند. دوم اشباع صفرا با کلسترول است. کلسترول در صفرا بسیار نامحلول است و تنها در غلظت های معینی از نمک های صفراوی و لسیتین به صورت محلول در میسل ها نگهداری می شود. در غلظت های بالاتر از خط ABC در شکل ۲۸-۷، صفرا فوق اشباع است و علاوه بر میسل، حاوی کریستال های کوچکی از کلسترول است. با این حال، بسیاری از افراد سالم که سنگ کیسه صفرا در آنها ایجاد نمی شود، صفرای فوق اشباع نیز دارند. عامل سوم ترکیبی از فاکتورهای هسته است که به تشکیل سنگ از صفرای فوق اشباع کمک می کند. در خارج از بدن، صفرا از بیماران مبتلا به سنگ کلیه در ۲-۳ روز تشکیل سنگ می دهد، در حالی که بیش از ۲ هفته طول می کشد تا سنگ در صفرا افراد عادی تشکیل شود. ماهیت دقیق فاکتورهای هسته سازی نامشخص است، اگرچه گلیکوپروتئین ها در مخاط کیسه صفرا دخیل هستند. علاوه بر این، مشخص نیست که آیا سنگ ها در نتیجه تولید بیش از حد اجزایی که به نفع هسته سازی هستند یا کاهش تولید اجزای ضد هسته ای که از تشکیل سنگ در افراد عادی جلوگیری می کنند، تشکیل می شوند.
Gallstones that obstruct bile outflow from the liver can result in obstructive jaundice. If the flow of bile out of the liver is completely blocked, substances normally excreted in the bile, such as cholesterol, accumulate in the bloodstream. The interruption of the enterohepatic circulation of bile acids also induces the liver to synthesize bile acids at a greater rate. Some of these bile acids can be excreted by the kidney, and thus represent a mechanism for indirect excretion of at least a portion of cholesterol. However, retained biliary constituents may also cause liver toxicity.
سنگ های صفراوی که مانع خروج صفرا از کبد می شوند، می توانند منجر به زردی انسدادی شوند. اگر جریان صفرا به خارج از کبد به طور کامل مسدود شود، موادی که معمولاً در صفرا دفع می شوند، مانند کلسترول، در جریان خون تجمع می یابند. وقفه در گردش خون کبدی اسیدهای صفراوی همچنین کبد را وادار می کند تا اسیدهای صفراوی را با سرعت بیشتری سنتز کند. برخی از این اسیدهای صفراوی می توانند توسط کلیه دفع شوند و بنابراین مکانیسمی برای دفع غیرمستقیم حداقل بخشی از کلسترول نشان می دهند. با این حال، ترکیبات صفراوی باقی مانده نیز ممکن است باعث مسمومیت کبدی شوند.
THERAPEUTIC HIGHLIGHTS
The treatment of gallstones depends on their nature and the severity of any symptoms. Many, particularly if small and retained in the gallbladder, may be asymptomatic. Larger stones that cause obstruction may need to be removed surgically, or via ERCP. Oral dissolution agents may dissolve small stones composed of cholesterol, but the effect is slow and stones often return once therapy is stopped. A definitive cure for patients who suffer from recurrent attacks of symptomatic cholelithiasis is to have the gallbladder removed, which is usually now performed laparoscopically.
نکات برجسته درمانی
درمان سنگ کیسه صفرا به ماهیت آنها و شدت علائم بستگی دارد. بسیاری از آنها، به خصوص اگر کوچک باشند و در کیسه صفرا باقی بمانند، ممکن است بدون علامت باشند. سنگ های بزرگتر که باعث انسداد می شوند ممکن است نیاز به برداشتن با جراحی یا از طریق ERCP داشته باشند. عوامل انحلال خوراکی ممکن است سنگ های کوچکی که از کلسترول تشکیل شده اند را حل کنند، اما اثر آهسته است و سنگ ها اغلب پس از قطع درمان برمی گردند. یک درمان قطعی برای بیمارانی که از حملات مکرر کللیتیازیس علامت دار رنج می برند، برداشتن کیسه صفرا است که معمولاً اکنون به روش لاپاراسکوپی انجام می شود.
CHAPTER SUMMARY
خلاصه فصل
• The liver conducts a huge number of metabolic reactions and serves to detoxify and dispose of many exogenous substances, as well as metabolites endogenous to the body that would be harmful if allowed to accumulate.
• کبد تعداد زیادی واکنش های متابولیکی را انجام می دهد و برای سم زدایی و دفع بسیاری از مواد برون زا و همچنین متابولیت های درون زا برای بدن که اگر اجازه انباشته شدن آن ها مضر باشد، خدمت می کند.
• The structure of the liver is such that it can filter large volumes of blood and remove even hydrophobic substances that are protein-bound. This function is provided for by a fenestrated endothelium. The liver also receives essentially all venous blood from the intestine prior to its delivery to the remainder of the body.
• ساختار کبد به گونه ای است که می تواند حجم زیادی از خون را فیلتر کرده و حتی مواد آبگریز را که به پروتئین متصل هستند را حذف کند. این عملکرد توسط یک اندوتلیوم فنس دار تامین می شود. کبد همچنین اساساً تمام خون وریدی را از روده قبل از تحویل آن به بقیه بدن دریافت می کند.
• The liver serves to buffer blood glucose, synthesize the majority of plasma proteins, contribute to lipid metabolism, and preserve cholesterol homeostasis.
• کبد برای بافر گلوکز خون، سنتز اکثر پروتئین های پلاسما، کمک به متابولیسم لیپیدها و حفظ هموستاز کلسترول عمل می کند.
• Bilirubin is an end product of heme metabolism that is glucuronidated by the hepatocyte to permit its excretion in bile. Bilirubin and its metabolites impart color to the bile and stools.
• بیلی روبین محصول نهایی متابولیسم هِم است که توسط سلولهای کبدی گلوکورونید می شود تا امکان دفع آن در صفرا فراهم شود. بیلی روبین و متابولیت های آن به صفرا و مدفوع رنگ می دهند.
• The liver removes ammonia from the blood and converts it to urea for excretion by the kidneys. An accumulation of ammonia as well as other toxins cause hepatic encephalopathy in the setting of liver failure.
• کبد آمونیاک را از خون خارج کرده و برای دفع توسط کلیه ها به اوره تبدیل می کند. تجمع آمونیاک و همچنین سایر سموم باعث انسفالوپاتی کبدی در زمینه نارسایی کبد می شود.
• Bile contains substances actively secreted across the canalicular membrane by hepatocytes, and notably bile acids, phosphatidylcholine, and cholesterol. The composition of bile is modified as it passes through the bile ducts and is stored in the gallbladder. Gallbladder contraction is regulated to coordinate bile availability with the timing of meals.
• صفرا حاوی موادی است که به طور فعال در سراسر غشای کانالی توسط سلول های کبدی ترشح می شود، و به ویژه اسیدهای صفراوی، فسفاتیدیل کولین و کلسترول. ترکیب صفرا با عبور از مجاری صفراوی تغییر می کند و در کیسه صفرا ذخیره می شود. انقباض کیسه صفرا برای هماهنگی در دسترس بودن صفرا با زمان وعده های غذایی تنظیم می شود.
MULTIPLE-CHOICE QUESTIONS
For all questions, select the single best answer unless otherwise directed.
سوالات چند گزینه ای
برای همه سؤالات، بهترین پاسخ را انتخاب کنید، مگر اینکه دستور دیگری داده شود.
۱. Which of the following cell types protects against sepsis secondary to translocation of intestinal bacteria?
A. Hepatic stellate cell
B. Cholangiocyte
C. Kupffer cell
D. Hepatocyte
E. Gallbladder epithelial cell
۱. کدام یک از انواع سلول های زیر در برابر سپسیس ثانویه به جابجایی باکتری های روده محافظت می کند؟
الف. سلول های ستاره ای کبدی
ب. کلانژیوسیت
ج. سلول کوپفر
د. هپاتوسیت
ی. سلول اپیتلیال کیسه صفرا
۲. A 60-year-old man comes to his physician complaining of a progressive increase in his girth despite attempts to diet. He is also jaundiced and complains of nausea and malaise. When a large needle is inserted into his abdomen, several liters of tan fluid drain out. An increase in which of the following is not involved in this fluid accumulation?
A. Portal pressure
B. Hepatic collagen
C. Plasma albumin
D. Stellate cell activity
E. Plasma transudation
۲. مردی ۶۰ ساله با شکایت از افزایش تدریجی دور کمرش علیرغم تلاش برای گرفتن رژیم، نزد پزشکش می آید. او همچنین زردی دارد و از حالت تهوع و بی حالی شکایت دارد. هنگامی که یک سوزن بزرگ به شکم او وارد می شود، چندین لیتر مایع برنزه از آن خارج می شود. افزایش در کدام یک از موارد زیر در این تجمع مایع دخیل نیست؟
الف. فشار پورتال
ب. کلاژن کبدی
ج. آلبومین پلاسما
د. فعالیت سلول های ستاره ای
ی. ترانسودااسیون پلاسما
۳. P450s (CYPs) are highly expressed in hepatocytes. In which of the following do they not play an important role?
A. Bile acid formation
B. Carcinogenesis
C. Steroid hormone formation
D. Detoxification of drugs
E. Glycogen synthesis
۳. P450s (CYPs) در سلولهای کبدی به شدت بیان میشوند. در کدام یک از موارد زیر نقش مهمی ندارند؟
الف. تشکیل اسید صفراوی
ب. سرطان زایی
ج. تشکیل هورمون استروئیدی
د. سم زدایی از داروها
ی. سنتز گلیکوژن
۴. A surgeon is studying new methods of liver transplantation. She performs a complete hepatectomy in an experimental animal. Before the donor liver is grafted, a rise in the blood level of which of the following would be expected?
A. Glucose
B. Fibrinogen
C. 25-Hydroxycholecalciferol
D. Conjugated bilirubin
E. Estrogens
۴. یک جراح در حال مطالعه روش های جدید پیوند کبد است. او یک هپاتکتومی کامل را در یک حیوان آزمایشی انجام می دهد. قبل از پیوند کبد اهداکننده، افزایش سطح خون کدام یک از موارد زیر قابل انتظار است؟
الف. گلوکز
ب. فیبرینوژن
ج. 25-هیدروکسی کوله کلسیفرول
د. بیلی روبین کونژوگه
ی. استروژن ها
۵. A scientist studying the function of the different cell types in the liver creates a mouse in which the activity of one specific cell type is transiently ablated. The mice exhibit behavioral defects consistent with encephalopathy. The function of which of the following cell types was most likely targeted?
A. Hepatic stellate cell
B. Cholangiocyte
C. Kupffer cell
D. Hepatocyte
E. Gallbladder epithelial cell
۵. دانشمندی که در حال مطالعه عملکرد انواع سلول های مختلف در کبد است، موشی ایجاد می کند که در آن فعالیت یک نوع سلول خاص به طور موقت از بین می رود. موش ها نقایص رفتاری مطابق با انسفالوپاتی را نشان می دهند. عملکرد کدام یک از انواع سلول های زیر به احتمال زیاد مورد هدف قرار گرفته است؟
الف. سلول های ستاره ای کبدی
ب. کلانژیوسیت
ج. سلول کوپفر
د. هپاتوسیت
ی. سلول اپیتلیال کیسه صفرا
۶. A patient suffering from severe ulcerative colitis undergoes a total colectomy with formation of a stoma. After a full recovery from surgery, and compared to his condition prior to surgery, which of the following would be expected to be decreased?
A. Ability to absorb lipids
B. Ability to absorb lipids
C. Circulating levels of conjugated bile acids
D. Urinary urea
E. Urinary urobilinogen
۶. بیمار مبتلا به کولیت اولسراتیو شدید تحت کولکتومی کامل با تشکیل استوما قرار می گیرد. پس از بهبودی کامل پس از جراحی و در مقایسه با وضعیت قبل از عمل جراحی، انتظار میرود کدامیک از موارد زیر کاهش یابد؟
الف. توانایی جذب لیپیدها
ب. توانایی جذب لیپیدها
ج. سطوح در گردش اسیدهای صفراوی مزدوج
د. اوره ادرار
ی. اوروبیلینوژن ادراری
۷. Compared to hepatic bile, gallbladder bile contains a reduced concentration of which of the following?
A. Bile acids
B. Chloride ions
C. Protons
D. Glucose
E. Calcium ions
۷. صفرای کیسه صفرا در مقایسه با صفرای کبدی دارای غلظت کمتری از کدام یک از موارد زیر است؟
الف. اسیدهای صفراوی
ب. یونهای کلرید
ج. پروتون ها
د. گلوکز
ی. یون های کلسیم
۸. A newborn delivered vaginally is noted to be mildly jaundiced, but no bilirubin is found in the urine. The child’s symptoms are most likely attributable to a developmental delay in the expression or establishment of which of the following:
A. Colonic bacterial colonization
B. MDR2
C. UDP glucuronyl transferase
D. Heme oxygenase
E. Biliverdin reductase
۸. نوزادی که از طریق واژینال به دنیا آمده است، زردی خفیف دارد، اما بیلی روبین در ادرار یافت نمی شود. علائم کودک به احتمال زیاد به تاخیر رشد در بیان یا ایجاد کدام یک از موارد زیر مربوط می شود:
الف. کلونیزاسیون باکتریایی کولون
ب. MDR2
ج. UDP گلوکورونیل ترانسفراز
د. هم اکسیژناز
ی. بیلیوردین ردوکتاز
۹. A 40-year-old woman comes to her primary care clinician complaining of severe, episodic abdominal pain that is particularly intense after she ingests a fatty meal. An imaging procedure reveals that her gallbladder is acutely dilated, and a diagnosis of cholelithiasis is made. A gallstone lodged in which location will also increase her risk of pancreatitis?
A. Left hepatic duct
B. Right hepatic duct
C. Cystic duct
D. Common bile duct
E. Sphincter of Oddi
۹. یک زن ۴۰ ساله با شکایت از درد شدید شکمی که به ویژه پس از خوردن یک وعده غذایی چرب شدید است، به پزشک مراقبت های اولیه مراجعه می کند. یک روش تصویربرداری نشان میدهد که کیسه صفرا او به شدت گشاد شده است و تشخیص کللیتیازیس داده میشود. سنگ کیسه صفرا در کدام محل نیز خطر پانکراتیت را افزایش می دهد؟
الف. مجرای کبدی چپ
ب. مجرای راست کبدی
ج. مجرای کیستیک
د. مجرای صفراوی مشترک
ی. اسفنکتر اودی
۱۰. A 45-year-old woman is brought to the emergency room with a 3-day history of colicky epigastric pain that suddenly increased in severity after a large meal. A gallstone is found to be occluding her spincter of Oddi. Which of the following substances would be found at reduced levels in her circulation?
A. Unconjugated bile acids
B. Conjugated bile acids
C. Cholesterol
D. Phosphatidylcholine
E. Amylase
۱۰. زنی ۴۵ ساله با سابقه ۳ روزه درد اپیگاستر کولیکی که ناگهان پس از یک وعده غذایی زیاد شدت یافته بود به اورژانس آورده شد. یک سنگ کیسه صفرا پیدا شده است که اسپنکتر اودی او را مسدود کرده است. کدام یک از مواد زیر در سطوح کاهش یافته در گردش خون او یافت می شود؟
الف. اسیدهای صفراوی غیر کونژوگه
ب. اسیدهای صفراوی مزدوج
ج. کلسترول
د. فسفاتیدیل کولین
ی. آمیلاز
کلیک کنید «منابع»
🚀 با ما همراه شوید!
تازهترین مطالب و آموزشهای مغز و اعصاب را از دست ندهید. با فالو کردن کانال تلگرام آیندهنگاران مغز، از ما حمایت کنید!
