فیزیولوژی پزشکی گانونگ؛، منشأ ضربان قلب و فعالیت الکتریکی قلب

دعای مطالعه [ نمایش ]
بِسْمِ الله الرَّحْمنِ الرَّحیمِ
اَللّهُمَّ اَخْرِجْنى مِنْ ظُلُماتِ الْوَهْمِ
خدایا مرا بیرون آور از تاریکىهاى وهم،
وَ اَکْرِمْنى بِنُورِ الْفَهْمِ
و به نور فهم گرامى ام بدار،
اَللّهُمَّ افْتَحْ عَلَیْنا اَبْوابَ رَحْمَتِکَ
خدایا درهاى رحمتت را به روى ما بگشا،
وَانْشُرْ عَلَیْنا خَزائِنَ عُلُومِکَ بِرَحْمَتِکَ یا اَرْحَمَ الرّاحِمینَ
و خزانههاى علومت را بر ما باز کن به امید رحمتت اى مهربانترین مهربانان.
کتاب «فیزیولوژی پزشکی گانونگ» بهعنوان یکی از جامعترین و معتبرترین منابع در حوزه علوم پزشکی، همچنان مرجع کلیدی برای درک عملکرد پیچیده بدن انسان است. این اثر با تکیه بر تازهترین پژوهشها و توضیحات دقیق از سازوکارهای فیزیولوژیک، پلی میان علوم پایه پزشکی و کاربردهای بالینی ایجاد میکند و نقشی بیبدیل در آموزش، پژوهش و ارتقای دانش سلامت ایفا مینماید.
ترجمه دقیق و علمی این شاهکار توسط برند علمی آیندهنگاران مغز به مدیریت داریوش طاهری، دسترسی فارسیزبانان به مرزهای نوین دانش فیزیولوژی را ممکن ساخته و رسالتی علمی برای ارتقای آموزش پزشکی، فهم عمیقتر سازوکارهای بدن و توسعه روشهای نوین در حوزه سلامت فراهم آورده است.
» کتاب فیزیولوژی پزشکی گانونگ
» » فصل ۲۹: منشأ ضربان قلب و فعالیت الکتریکی قلب
در حال ویرایش
» Ganong’s Review of Medical Physiology
»» CHAPTER 29: Origin of the Heartbeat & the Electrical Activity of the Heart
SECTION V
Cardiovascular Physiology
بخش پنجم
فیزیولوژی قلب و عروق

Cells exist within a body fluid compartment known as the interstitial fluid, and the cardiovascular system has evolved to ensure that the composition of the interstitial fluid is maintained within a narrow range. Homeostasis is accomplished by pumping a separate fluid compartment—plasma-around the body, where it can be “conditioned” as it passes through specific organs that add nutrients, oxygen, hormones and needed metabolites, and/or remove waste products. The plasma then delivers needed substances to other organs and tissues. Efficient transfer of substances between the cells and the plasma is accomplished by dense networks of capillaries, which offer little resistance to the transfer of substances across their walls, and provide for short diffusion distances between the capillaries and the sites at which products will be utilized. The pumping function in this system is provided by the heart, a four-chambered organ that drives blood around two circuits in series, one that perfuses the lungs and one that serves the remainder of the body.
سلول ها در یک محفظه مایع بدن به نام مایع بینابینی وجود دارند و سیستم قلبی عروقی تکامل یافته است تا اطمینان حاصل شود که ترکیب مایع بینابینی در محدوده باریکی حفظ می شود. هموستاز با پمپاژ یک محفظه مایع جداگانه – پلاسما – در اطراف بدن انجام می شود، جایی که می توان آن را “تنظیم” کرد، زیرا از اندام های خاصی عبور می کند که مواد مغذی، اکسیژن، هورمون ها و متابولیت های مورد نیاز را اضافه می کند و/یا مواد زائد را حذف می کند. پلاسما سپس مواد مورد نیاز را به سایر اندام ها و بافت ها می رساند. انتقال موثر مواد بین سلولها و پلاسما توسط شبکههای متراکم مویرگها انجام میشود که مقاومت کمی در برابر انتقال مواد از طریق دیوارههای آنها ایجاد میکند و فواصل انتشار کوتاهی را بین مویرگها و مکانهایی که محصولات در آنها مورد استفاده قرار میگیرند فراهم میکند. عملکرد پمپاژ در این سیستم توسط قلب ارائه می شود، یک اندام چهار حفره ای که خون را به دور دو مدار متوالی می چرخاند، یکی که ریه ها را پرفیوژن می کند و دیگری که به بقیه بدن خدمت می کند.
In principle, this sounds like a simple system. However, in practice, exquisite minute-to-minute regulation is needed to ensure that organs receive the substances that they need when they need them, particularly in the face of ever- changing demands. For example, when an individual begins to exercise, there is a prompt demand for additional oxygen and glucose in the contracting muscles to sustain muscle activity. In the brain, there is no capacity to store glucose and blood flow must be maintained to ensure consciousness, even in the face of hydrostatic challenges (eg, moving from a recumbent to a standing position). The cardiovascular system must therefore be able to adjust the rate at which the plasma is circulated around the body as a whole and to redirect plasma flow to the places where it is most needed. Further, the body is an “open” system, meaning that some bodily constituents (eg, water) are constantly being lost to the environment. The circulation, and the organs that condition it, must respond promptly to these threats to homeostasis to ensure the proper functioning of vital body systems, which typically operate within a narrow range of osmolarity, pH, oxygen saturation, etc.
در اصل، این مانند یک سیستم ساده به نظر می رسد. با این حال، در عمل، تنظیم دقیق دقیقه به دقیقه مورد نیاز است تا اطمینان حاصل شود که اندام ها مواد مورد نیاز خود را در زمان نیاز دریافت می کنند، به ویژه در مواجهه با تقاضاهای در حال تغییر. به عنوان مثال، زمانی که فردی شروع به ورزش می کند، نیاز فوری به اکسیژن و گلوکز اضافی در عضلات منقبض برای حفظ فعالیت عضلانی وجود دارد. در مغز، هیچ ظرفیتی برای ذخیره گلوکز وجود ندارد و جریان خون باید برای اطمینان از هوشیاری حفظ شود، حتی در مواجهه با چالشهای هیدرواستاتیک (مثلاً حرکت از حالت خوابیده به حالت ایستاده). بنابراین سیستم قلبی عروقی باید بتواند سرعت گردش پلاسما را در کل بدن تنظیم کند و جریان پلاسما را به مکان هایی که بیشتر مورد نیاز است هدایت کند. علاوه بر این، بدن یک سیستم “باز” است، به این معنی که برخی از اجزای بدن (به عنوان مثال، آب) به طور مداوم در محیط از بین می روند. گردش خون، و اندام هایی که آن را تنظیم می کنند، باید به سرعت به این تهدیدات برای هموستاز پاسخ دهند تا از عملکرد صحیح سیستم های حیاتی بدن، که معمولاً در محدوده باریکی از اسمولاریته، pH، اشباع اکسیژن و غیره عمل می کنند، اطمینان حاصل کنند.
In this section, the components of the cardiovascular system that permit it to serve the body’s needs for substance transfer will be considered. First, the electrical activity that allows the chambers of the heart to contract in an ordered fashion, to move the circulation unidirectionally, will be discussed. Then, the properties of blood and its components that suit them to transport dissolved solutes to and from the interstitial fluid will be considered. The properties of the circulatory “plumbing,” or blood vessels, will be addressed, along with the mechanisms that regulate them. Finally, the specialized properties of the circulation in areas of the body with unique needs will be discussed.
در این بخش، اجزای سیستم قلبی عروقی که به آن اجازه می دهد تا نیازهای بدن را برای انتقال مواد تامین کند، در نظر گرفته می شود. ابتدا، فعالیت الکتریکی که به حفرههای قلب اجازه میدهد به صورت منظم منقبض شوند و گردش خون را به صورت یک طرفه حرکت دهند، مورد بحث قرار خواهد گرفت. سپس خواص خون و اجزای آن که برای انتقال املاح محلول به مایع بینابینی مناسب است مورد توجه قرار می گیرد. خواص “لوله کشی” یا رگ های خونی گردش خون، همراه با مکانیسم هایی که آنها را تنظیم می کند، مورد توجه قرار خواهد گرفت. در نهایت، خواص تخصصی گردش خون در مناطقی از بدن با نیازهای منحصر به فرد مورد بحث قرار خواهد گرفت.
Obviously, a functional cardiovascular system is vital for life, and irreversible damage quickly ensues in a number of organs if the heart stops beating. Less drastic disorders of the cardiovascular system also represent a considerable burden of disease. In fact, cardiovascular diseases, collectively, are the leading cause of death and responsible for significant disability worldwide. In the United States, heart disease and stroke are the first and third most common causes of death, and an estimated one in three American adults has some form of cardiovascular disorder. Cardiovascular diseases are also leading causes of hospitalization, and account for the highest economic burden of any disease category. Finally, while there have been impressive gains in treatment and prevention of some cardiovascular diseases, the growing epidemic of obesity, and the rise in the proportion of the population with at least one cardiovascular risk factor, has been cause for considerable alarm among public health officials. All of these facts underscore the relevance of a thorough understanding of cardiovascular physiology for the aspiring health professional.
بدیهی است که یک سیستم قلبی عروقی عملکردی برای زندگی حیاتی است و در صورت توقف ضربان قلب، آسیب های غیرقابل برگشتی به سرعت در تعدادی از اندام ها ایجاد می شود. اختلالات کمتر شدید سیستم قلبی عروقی نیز نشان دهنده بار قابل توجهی از بیماری است. در واقع، بیماری های قلبی عروقی، مجموعاً، عامل اصلی مرگ و میر و مسئول ناتوانی قابل توجه در سراسر جهان هستند. در ایالات متحده، بیماری قلبی و سکته مغزی اولین و سومین علت شایع مرگ و میر هستند و تخمین زده می شود که از هر سه بزرگسال آمریکایی، یک نفر به نوعی اختلال قلبی عروقی مبتلا است. بیماری های قلبی عروقی نیز از علل اصلی بستری شدن در بیمارستان هستند و بیشترین بار اقتصادی را در بین هر گروه بیماری به خود اختصاص می دهند. در نهایت، در حالی که دستاوردهای چشمگیری در درمان و پیشگیری از برخی بیماریهای قلبی عروقی به دست آمده است، همهگیری رو به رشد چاقی و افزایش نسبت جمعیتی با حداقل یک عامل خطر قلبی عروقی، باعث نگرانی قابل توجهی در بین مقامات بهداشت عمومی شده است. همه این حقایق بر ارتباط یک درک کامل از فیزیولوژی قلب و عروق برای متخصصان مشتاق سلامت تأکید می کند.
OBJECTIVES
After studying this chapter you should be able to:
• Describe the structure and function of the conduction system of the heart and compare the action potentials in each part.
• Describe the way the electrocardiogram (ECG) is recorded, the waves of the ECG, and the relationship of the ECG to the electrical axis of the heart.
• Name the common cardiac arrhythmias and describe the processes that produce them.
• List the principal early and late ECG manifestations of myocardial infarction and explain the early changes in terms of the underlying ionic events that produce them.
• Describe the ECG changes and the changes in cardiac function produced by alterations in the ionic composition of the body fluids.
اهداف
پس از مطالعه فصل، باید بتوانید:
• ساختار و عملکرد سیستم هدایت قلب را شرح دهید و پتانسیل های عمل را در هر قسمت با هم مقایسه کنید.
• نحوه ثبت الکتروکاردیوگرام (ECG)، امواج ECG و رابطه ECG با محور الکتریکی قلب را شرح دهید.
• آریتمی های رایج قلبی را نام برده و فرآیندهایی را که باعث ایجاد آنها می شوند، توضیح دهید.
• تظاهرات اصلی اولیه و دیررس ECG میوکارد را فهرست کنید انفارکتوس و تغییرات اولیه را از نظر رویدادهای یونی زمینه ای که آنها را ایجاد می کند توضیح دهید.
• تغییرات ECG و تغییرات در عملکرد قلب ناشی از تغییرات در ترکیب یونی مایعات بدن را شرح دهید.

INTRODUCTION
The parts of the heart normally beat in orderly sequence: Contraction of the atria (atrial systole) is followed by contraction of the ventricles (ventricular systole), and during diastole all four chambers are relaxed (also see Chapter 30). The cardiac electric activity that triggers heartbeat originates in a specialized cardiac conduction system and spreads via this system to all parts of the myocardium. The structures that make up the conduction system are the sinoatrial node (SA node), the internodal atrial pathways, the atrioventricular node (AV node), the bundle of His and its branches, and the Purkinje system. The various parts of the conduction system and, under abnormal conditions, parts of the myocardium, are capable of spontaneous discharge. However, the SA node normally discharges most rapidly, with depolarization spreading from it to the other regions before they discharge spontaneously. The SA node is therefore the normal cardiac pacemaker, with its rate of discharge determining the rate at which the heart beats. Impulses generated in the SA node pass through the atrial pathways to the AV node, through this node to the bundle of His, and through the branches of the bundle of His via the Purkinje system to the ventricular muscle. Each of the cell types in the heart contains a unique electrical discharge pattern; the sum of these electrical discharges can be recorded as the electrocardiogram (ECG or EKG).
مقدمه
قسمتهای قلب معمولاً به ترتیب منظم میزنند: انقباض دهلیزها (سیستول دهلیزی) با انقباض بطنها (سیستول بطنی) دنبال میشود و در طول دیاستول، هر چهار حفره شل میشوند (همچنین به فصل ۳۰ مراجعه کنید). فعالیت الکتریکی قلبی که باعث تحریک ضربان قلب می شود از یک سیستم هدایت قلبی تخصصی سرچشمه می گیرد و از طریق این سیستم به تمام قسمت های میوکارد گسترش می یابد. ساختارهایی که سیستم هدایت را تشکیل می دهند عبارتند از: گره سینوسی دهلیزی (گره SA)، مسیرهای دهلیزی بین گرهی، گره دهلیزی بطنی (گره AV)، دسته هیس و شاخه های آن و سیستم پورکنژ. بخشهای مختلف سیستم هدایت و در شرایط غیرطبیعی، بخشهایی از میوکارد قادر به تخلیه خود به خودی هستند. با این حال، گره SA معمولاً سریعتر تخلیه میشود و دپلاریزاسیون از آن به نواحی دیگر قبل از تخلیه خود به خود گسترش مییابد. بنابراین گره SA یک ضربان ساز طبیعی قلب است که میزان ترشح آن تعیین کننده سرعت ضربان قلب است. ایمپالس های تولید شده در گره SA از مسیرهای دهلیزی به گره AV، از طریق این گره به بسته نرم افزاری His، و از طریق شاخه های بسته نرم افزاری His از طریق سیستم پورکنژ به عضله بطنی عبور می کنند. هر یک از انواع سلول های قلب دارای یک الگوی تخلیه الکتریکی منحصر به فرد است. مجموع این تخلیه های الکتریکی را می توان به عنوان نوار قلب (ECG یا EKG) ثبت کرد.
ORIGIN & SPREAD OF CARDIAC EXCITATION
ANATOMIC CONSIDERATIONS
In the human heart, the SA node is located at the junction of the superior vena cava with the right atrium. The AV node is located in the right posterior portion of the interatrial septum (Figure 29-1). There are three bundles of atrial fibers that contain Purkinje-type fibers and connect the SA node to the AV node: the anterior, middle (tract of Wenckebach), and posterior (tract of Thorel) tracts. Bachmann bundle is sometimes used to identify a branch of the anterior intermodal tract that connects the right and left atria. Conduction also occurs through atrial myocytes, but it is more rapid in these bundles. The AV node is continuous with the bundle of His, which gives off a left bundle branch at the top of the interventricular septum and continues as the right bundle branch. The left bundle branch divides into an anterior fascicle and a posterior fascicle. The branches and fascicles run subendocardially down either side of the septum and come into contact with the Purkinje system, whose fibers spread to all parts of the ventricular myocardium.
منشاء و گسترش تحریک قلبی
ملاحظات آناتومیک
در قلب انسان، گره SA در محل اتصال ورید اجوف فوقانی به دهلیز راست قرار دارد. گره AV در قسمت خلفی راست سپتوم بین دهلیزی قرار دارد (شکل ۲۹-۱). سه دسته از فیبرهای دهلیزی وجود دارد که حاوی فیبرهای نوع پورکنژ هستند و گره SA را به گره AV متصل می کنند: مجاری قدامی، میانی (دستگاه Wenckebach) و خلفی (دستگاه تورل). باندل باخمن گاهی اوقات برای شناسایی شاخه ای از دستگاه بین وجهی قدامی که دهلیز راست و چپ را به هم متصل می کند استفاده می شود. هدایت از طریق میوسیت های دهلیزی نیز انجام می شود، اما در این دسته ها سریعتر است. گره AV با دسته His پیوسته است که یک شاخه چپ در بالای سپتوم بین بطنی ایجاد می کند و به عنوان شاخه باندل سمت راست ادامه می یابد. شاخه سمت چپ به یک فاسیکل قدامی و یک فاسیکل خلفی تقسیم می شود. شاخه ها و فاسیکل ها به صورت ساب اندوکاردیال در دو طرف سپتوم قرار می گیرند و با سیستم پورکنژ در تماس هستند که رشته های آن به تمام قسمت های میوکارد بطنی گسترش می یابد.

FIGURE 29-1 Conducting system of the heart. Left: Anatomic depiction of the human heart with additional focus on areas of the conduction system. Right: Typical transmembrane action potentials for the SA and AV nodes, other parts of the conduction system, and the atrial and ventricular muscles are shown along with the correlation to the extracellularly recorded electrical activity, that is, the electrocardiogram (ECG). The action potentials and ECG are plotted on the same time axis but with different zero points on the vertical scale for comparison. AV, atrioventricular; LAF, left anterior fascicle; SA, sinoatrial. (Data from Donahue JG, Choo PW, Manson JE, et al. The incidence of herpes zoster. Arch Intern Med 1995;155:1605-1609; Choo PW, Galil K, Donahue JG, et al. Risk factors for postherpetic neuralgia. Arch Intern Med 1997;157:1217- 1224.)
شکل ۲۹-۱ سیستم هدایت قلب. سمت چپ: تصویر آناتومیک قلب انسان با تمرکز بیشتر بر مناطقی از سیستم هدایت. راست: پتانسیل عمل غشایی معمولی برای گره های SA و AV، سایر بخش های سیستم هدایت، و عضلات دهلیزی و بطنی همراه با همبستگی با فعالیت الکتریکی ثبت شده خارج سلولی، یعنی الکتروکاردیوگرام (ECG) نشان داده شده است. پتانسیل عمل و ECG در یک محور زمانی اما با نقاط صفر متفاوت در مقیاس عمودی برای مقایسه ترسیم می شود. AV، دهلیزی. LAF، فاسیکل قدامی چپ؛ SA، سینوسی دهلیزی. (داده های Donahue JG، Choo PW، Manson JE، و همکاران. بروز هرپس زوستر. Arch Intern Med 1995; 155:1605-1609؛ Choo PW، Galil K، Donahue JG، و همکاران. عوامل خطر برای نورالژی پس از تبخال. Arch 1719; 1224.)
The histology of a typical cardiac muscle cell (eg, a ventricular myocyte) is described in Chapter 5. For the most part, the conduction system is composed of modified cardiac muscle that has fewer striations and indistinct boundaries. Individual cells within regions of the heart have unique histologic features. Purkinje fibers, specialized conducting cells, are large with fewer mitochondria and striations and distinctly different from a myocyte specialized for contraction. Compared with Purkinje fibers, cells within the SA node and, to a lesser extent, the AV nodes are smaller and sparsely striated and are less conductive due to their higher internal resistance. The atrial muscle fibers are separated from those of the ventricles by a fibrous tissue ring, and normally the only conducting tissue between the atria and ventricles is the bundle of His.
بافت شناسی یک سلول عضله قلب معمولی (به عنوان مثال، یک میوسیت بطنی) در فصل ۵ توضیح داده شده است. در بیشتر موارد، سیستم هدایت از عضله قلبی اصلاح شده تشکیل شده است که دارای خطوط کمتر و مرزهای نامشخص است. سلول های منفرد در نواحی قلب دارای ویژگی های بافت شناسی منحصر به فردی هستند. فیبرهای پورکنژ، سلولهای رسانای تخصصی، بزرگ با میتوکندریها و رگههای کمتر هستند و بهطور مشخص با میوسیتهای تخصصی انقباض متفاوت هستند. در مقایسه با فیبرهای پورکنژ، سلولهای درون گره SA و تا حدی کمتر، گرههای AV کوچکتر و مخططتر هستند و به دلیل مقاومت داخلی بالاتر، رسانایی کمتری دارند. فیبرهای عضلانی دهلیزی توسط یک حلقه بافتی فیبری از بطن ها جدا می شوند و به طور معمول تنها بافت رسانا بین دهلیزها و بطن ها دسته His است.
The SA node develops from structures on the right side of the embryo and the AV node from structures on the left. This is why in the adult the right vagus is distributed mainly to the SA node and the left vagus mainly to the AV node. Similarly, the sympathetic innervation on the right side is distributed primarily to the SA node and the sympathetic innervation on the left side primarily to the AV node. On each side, most sympathetic fibers come from the stellate ganglion. Noradrenergic fibers are epicardial, whereas the vagal fibers are endocardial. However, connections exist for reciprocal inhibitory effects of the sympathetic and parasympathetic innervation of the heart on each other. Thus, acetylcholine acts presynaptically to reduce norepinephrine release from the sympathetic nerves, and conversely, neuropeptide Y released from noradrenergic endings may inhibit the release of acetylcholine.
گره SA از ساختارهای سمت راست جنین و گره AV از ساختارهای سمت چپ ایجاد می شود. به همین دلیل است که در بزرگسالان واگ راست عمدتاً به گره SA و واگ چپ عمدتاً به گره AV توزیع می شود. به طور مشابه، عصب سمپاتیک در سمت راست عمدتاً به گره SA و عصب سمپاتیک در سمت چپ عمدتاً به گره AV توزیع می شود. در هر طرف، بیشتر رشته های سمپاتیک از گانگلیون ستاره ای می آیند. فیبرهای نورآدرنرژیک اپی کاردی هستند، در حالی که فیبرهای واگ آندوکاردیال هستند. با این حال، ارتباطات برای اثرات بازدارنده متقابل عصب سمپاتیک و پاراسمپاتیک قلب بر روی یکدیگر وجود دارد. بنابراین، استیل کولین به صورت پیش سیناپسی برای کاهش ترشح نوراپی نفرین از اعصاب سمپاتیک عمل می کند و برعکس، نوروپپتید Y آزاد شده از انتهای نورآدرنرژیک ممکن است آزادسازی استیل کولین را مهار کند.
PROPERTIES OF CARDIAC MUSCLE
The electrical responses of cardiac muscle and nodal tissue and the ionic fluxes that underlie them are discussed in detail in Chapter 5 and are briefly reviewed here for comparison with the pacemaker cells below. Myocardial fibers have a resting membrane potential of approximately -90 mV (Figure 29-2A). The individual fibers are separated by membranes, but membrane depolarization spreads radially through them as if they were a syncytium because of the presence of gap junctions. The transmembrane action potential of single cardiac muscle cells is characterized by rapid depolarization (phase 0), an initial rapid repolarization (phase 1), a plateau (phase 2), and a slow repolarization process (phase 3) that allows return to the resting membrane potential (phase 4). The initial depolarization is due to Na+ influx through rapidly opening voltage-gated Na+ channels (the Na* current, INa). The inactivation of voltage-gated Na* channels contributes to the rapid repolarization phase. Ca2+ influx through more slowly opening voltage-gated Ca2+ channels (the Ca2+ current, Ica) produces the plateau phase, and repolarization is due to net K* efflux through multiple types of K+ channels. Recorded extracellularly, the summed electrical activity of all the cardiac muscle fibers is the ECG (discussed below). The timing of the discharge of the individual units relative to the ECG is shown in Figure 29-1 (right panel). Note that the ECG is a combined electrical record and thus the overall shape reflects electrical activity from cells from different regions of the heart.
خواص عضله قلب
پاسخ های الکتریکی عضله قلب و بافت گرهی و شارهای یونی که زیربنای آنها هستند به تفصیل در فصل ۵ مورد بحث قرار گرفته و در اینجا به طور خلاصه برای مقایسه با سلول های ضربان ساز در زیر بررسی شده است. فیبرهای میوکارد دارای پتانسیل غشای استراحت تقریباً ۹۰- میلی ولت هستند (شکل ۲۹-2A). فیبرهای منفرد توسط غشاها از هم جدا می شوند، اما دپلاریزاسیون غشاء به دلیل وجود اتصالات شکافی به طور شعاعی از طریق آنها پخش می شود که گویی یک سینسیتیوم هستند. پتانسیل عمل غشایی تک سلولی عضله قلب با دپلاریزاسیون سریع (فاز ۰)، یک رپلاریزاسیون سریع اولیه (فاز ۱)، یک پلاتو (فاز ۲)، و یک فرآیند رپلاریزاسیون آهسته (فاز ۳) مشخص می شود که امکان بازگشت به پتانسیل غشای در حال استراحت (فاز ۴) را فراهم می کند. دپلاریزاسیون اولیه به دلیل هجوم +Na از طریق کانالهای +Na با ولتاژ باز میشود (جریان Na+، INa). غیرفعال شدن کانال های +Na دارای ولتاژ به فاز رپلاریزاسیون سریع کمک می کند. هجوم +Ca۲ از طریق کانالهای +Ca۲ دارای ولتاژ آهستهتر (جریان Ca۲+، Ica) فاز فلات را تولید میکند و رپلاریزاسیون به دلیل جریان خالص +K از طریق چندین نوع کانال +K است. مجموع فعالیت الکتریکی تمام فیبرهای عضلانی قلب که به صورت خارج سلولی ثبت می شود، ECG است (که در زیر بحث می شود). زمان تخلیه واحدهای جداگانه نسبت به ECG در شکل ۲۹-۱ (پانل سمت راست) نشان داده شده است. توجه داشته باشید که ECG یک رکورد الکتریکی ترکیبی است و بنابراین شکل کلی فعالیت الکتریکی سلولهای مناطق مختلف قلب را منعکس میکند.

FIGURE 29-2 Comparison of action potentials in ventricular muscle and diagram of the membrane potential of pacemaker tissue. A) Phases of action potential in ventricular myocyte (0-4, see text for details) are superimposed with principal changes in current that contribute to changes in membrane potential. B) The principal current responsible for each part of the potential of pacemaker tissue is shown under or beside the component. L, long-lasting; T, transient. Other ion channels contribute to the electrical response. Note that the resting membrane potential of pacemaker tissue is somewhat lower than that of atrial and ventricular muscle.
شکل ۲۹-۲ مقایسه پتانسیل عمل در عضله بطنی و نمودار پتانسیل غشایی بافت ضربان ساز. الف) مراحل پتانسیل عمل در میوسیت بطنی (۰-۴، برای جزئیات بیشتر به متن مراجعه کنید) با تغییرات اصلی در جریان که به تغییرات پتانسیل غشاء کمک می کند، روی هم قرار می گیرند. ب) جریان اصلی مسئول هر قسمت از پتانسیل بافت ضربان ساز در زیر یا کنار قطعه نشان داده می شود. L، طولانی مدت؛ T، گذرا سایر کانال های یونی به پاسخ الکتریکی کمک می کنند. توجه داشته باشید که پتانسیل غشای استراحت بافت ضربان ساز تا حدودی کمتر از عضله دهلیزی و بطنی است.
PACEMAKER POTENTIALS
Rhythmically discharging cells have a membrane potential that, after each impulse, declines to the firing level. Thus, this prepotential or pacemaker potential (Figure 29-2B) triggers the next impulse. At the peak of each impulse, Ik begins and brings about repolarization. Ik then declines, and a channel permeable to both Na* and K* is activated. Because this channel is activated following hyperpolarization, it is referred to as an “h” channel and the current through the h channels is called “h” current (I); however, because of its unusual (funny) activation it has also been dubbed an “f” channel and the current produced as “funny current.” As I increases, the membrane begins to depolarize, forming the first part of the prepotential. When prepotential reaches the activation threshold of voltage-gated Ca2+ channels, Ca2+ channels then open. There are two types of these voltage-gated Ca2+ channels in the heart, the T (for transient) channels and the L (for long-lasting) channels. The Ca2+ current (Ica) due to opening of T channels completes the prepotential, and Ica due to opening of L channels produces the impulse. Other ion channels are also involved, and there is evidence that local Ca2+ release from the sarcoplasmic reticulum (Ca2+ sparks) occurs during the prepotential.
پتانسیل های ضربان ساز
سلول های ریتمیک تخلیه دارای پتانسیل غشایی هستند که پس از هر ضربه به سطح شلیک کاهش می یابد. بنابراین، این پتانسیل پیش پتانسیل یا ضربان ساز (شکل ۲۹-2B) تکانه بعدی را تحریک می کند. در اوج هر تکانه، Ik شروع می شود و دوباره قطبی شدن را ایجاد می کند. سپس Ik کاهش می یابد و کانالی که به +Na و +K نفوذ می کند فعال می شود. از آنجایی که این کانال به دنبال هایپرپلاریزاسیون فعال می شود، به آن کانال “h” می گویند و جریان عبوری از کانال های h را جریان “h” (I) می نامند. با این حال، به دلیل فعالسازی غیرمعمول (خندهدار) آن، کانال «f» نیز نامیده میشود و جریان به عنوان «جریان خندهدار» تولید میشود. با افزایش من، غشاء شروع به دپلاریزه شدن می کند و اولین قسمت پیش پتانسیل را تشکیل می دهد. وقتی پیش پتانسیل به آستانه فعال سازی کانال های +Ca۲ دارای ولتاژ رسید، کانال های +Ca۲ باز می شوند. دو نوع از این کانال های +Ca۲ دارای ولتاژ در قلب وجود دارد، کانال T (برای گذرا) و کانال L (برای طولانی مدت). جریان Ca۲+ (Ica) به دلیل باز شدن کانال های T، پیش پتانسیل را تکمیل می کند و Ica به دلیل باز شدن کانال های L، ضربه را تولید می کند. کانالهای یونی دیگر نیز درگیر هستند و شواهدی وجود دارد که نشان میدهد انتشار موضعی +Ca۲ از شبکه سارکوپلاسمی (جرقههای +Ca۲) در طول پیشپتانسیل رخ میدهد.
The action potentials in the SA and AV nodes are largely due to Ca2+ invlus, with no contribution by Na+ influx. Consequently, there is no sharp, rapid depolarizing spike before the plateau, as there is in other parts of the conduction system and in the atrial and ventricular fibers. In addition, prepotentials are normally prominent only in the SA and AV nodes. However, “latent pacemakers” are present in other portions of the conduction system that can take over when the SA and AV nodes are depressed or conduction from them is blocked. Atrial and ventricular muscle fibers do not have prepotentials, and they discharge spontaneously only when injured or abnormal.
پتانسیلهای عمل در گرههای SA و AV عمدتاً به دلیل Ca۲+ invlus است، بدون کمک هجوم +Na. در نتیجه، هیچ سنبله دپلاریزاسیون تیز و سریعی قبل از فلات وجود ندارد، همانطور که در سایر قسمت های سیستم هدایت و فیبرهای دهلیزی و بطنی وجود دارد. علاوه بر این، پیش پتانسیل ها معمولاً فقط در گره های SA و AV برجسته هستند. با این حال، «پیس میکرهای نهفته» در بخشهای دیگر سیستم هدایت وجود دارند که میتوانند زمانی که گرههای SA و AV تحت فشار قرار میگیرند یا هدایت آنها مسدود میشود، کنترل شوند. فیبرهای عضلانی دهلیزی و بطنی دارای پیشپتانسیل نیستند و تنها در صورت آسیب یا غیرطبیعی ترشح میشوند.
When the cholinergic vagal fibers to nodal tissue are stimulated, the membrane becomes hyperpolarized and the slope of the prepotentials is decreased (Figure 29-3) because the acetylcholine released at the nerve endings increases the K+ conductance of nodal tissue. This action is mediated by M2 muscarinic receptors, which, via the ẞy subunit of a G protein, open a special set of K+ channels. The resulting K+ currents (IKAch) through these G protein-gated K+ channels slows the depolarizing effect of I. In addition, activation of the M2 receptors decreases cyclic adenosine 3′,5′-monophosphate (cAMP) in the cells, and this slows the opening of Ca2+ channels. The result is a decrease in firing rate. Strong vagal stimulation may abolish spontaneous discharge for some time.
هنگامی که الیاف واگ کولینرژیک به بافت گره تحریک می شوند، غشاء هیپرپلاریزه می شود و شیب پیش پتانسیل ها کاهش می یابد (شکل ۲۹-۳) زیرا استیل کولین آزاد شده در انتهای عصب باعث افزایش هدایت +K بافت گره می شود. این عمل توسط گیرنده های موسکارینی M2 انجام می شود که از طریق زیرواحد ẞy یک پروتئین G، مجموعه خاصی از کانال های +K را باز می کند. جریانهای K+ (IKAch) از طریق این کانالهای +K دردار با پروتئین G، اثر دپلاریزاسیون I را کاهش میدهد. علاوه بر این، فعال شدن گیرندههای M2 آدنوزین ۳’،۵′-مونوفسفات حلقوی (cAMP) را در سلولها کاهش میدهد و این امر باز شدن کانالهای +Ca۲ را کند میکند. نتیجه کاهش سرعت شلیک است. تحریک شدید واگ ممکن است ترشحات خود به خود را برای مدتی از بین ببرد.

FIGURE 29-3 Effect of sympathetic (noradrenergic) and vagal (cholinergic) stimulation on the membrane potential of the SA node. Note the reduced slope of the prepotential after vagal stimulation and the increased spontaneous discharge after sympathetic stimulation. SA, sinoatrial.
شکل ۲۹-۳ اثر تحریک سمپاتیک (نورآدرنرژیک) و واگ (کولینرژیک) بر پتانسیل غشایی گره SA. به کاهش شیب پیش پتانسیل پس از تحریک واگ و افزایش ترشحات خودبخودی پس از تحریک سمپاتیک توجه کنید. SA، سینوسی دهلیزی.
Conversely, stimulation of the sympathetic cardiac nerves speeds the depolarizing effect of I, and the rate of spontaneous discharge increases (Figure 29-3). Norepinephrine secreted by the sympathetic endings binds to ẞ۱ receptors, and the resulting increase in intracellular CAMP facilitates the opening of L channels, increasing Ica and the rapidity of the depolarization phase of the impulse.
برعکس، تحریک اعصاب قلبی سمپاتیک، اثر دپلاریزاسیون I را سرعت می بخشد و سرعت ترشحات خود به خودی افزایش می یابد (شکل ۲۹-۳). نوراپی نفرین ترشح شده توسط انتهای سمپاتیک به گیرنده های ẞ۱ متصل می شود و افزایش CAMP درون سلولی باعث تسهیل باز شدن کانال های L، افزایش Ica و سرعت فاز دپلاریزاسیون تکانه می شود.
The rate of discharge of the SA node and other nodal tissue is influenced by temperature and by drugs. The discharge frequency is increased when the temperature rises, and this may contribute to the tachycardia associated with fever. Digitalis depresses nodal tissue and exerts an effect like that of vagal stimulation, particularly on the AV node (Clinical Box 29-1; also see Clinical Box 5-6).
سرعت تخلیه گره SA و سایر بافت های گرهی تحت تأثیر دما و داروها است. دفعات تخلیه با افزایش دما افزایش می یابد و این ممکن است به تاکی کاردی مرتبط با تب کمک کند. دیجیتالیس بافت گره را کاهش می دهد و اثری مانند تحریک واگ اعمال می کند، به ویژه بر روی گره AV (کادر بالینی ۲۹-۱؛ همچنین به جعبه بالینی ۵-۶ مراجعه کنید).
CLINICAL BOX 29-1
Use of Digitalis
Digitalis, or its clinically useful preparations (digoxin and digitoxin), has been described in medical literature for over 200 years. It was originally derived from the foxglove plant. (Digitalis purpurea is the name of the common foxglove.) Correct administration can strengthen cardiac contractions through digitalis inhibitory effects on the Na, K ATPase, resulting in greater amounts of Ca2+ release and subsequent changes in contraction forces. Digitalis can also have an electrical effect in decreasing AV nodal conduction velocity and thus altering AV transmission to the ventricles.
جعبه بالینی ۲۹-۱
استفاده از Digitalis
Digitalis یا داروهای مفید بالینی آن (دیگوکسین و دیژیتوکسین)، بیش از ۲۰۰ سال است که در ادبیات پزشکی توصیف شده است. در اصل از گیاه دستکش روباهی گرفته شده است. (Digitalis purpurea نام دستکش روباه معمولی است.) تجویز صحیح می تواند انقباضات قلبی را از طریق اثرات بازدارنده دیژیتالیس بر روی Na, K ATPase تقویت کند و در نتیجه مقادیر بیشتری از +Ca۲ آزاد شود و متعاقباً در نیروهای انقباضی تغییر کند. دیجیتالیس همچنین می تواند یک اثر الکتریکی در کاهش سرعت رسانش گره AV و در نتیجه تغییر انتقال AV به بطن ها داشته باشد.
THERAPEUTIQ HIGHLIGHTS
Digitalis has been used for treatment of systolic heart failure. It augments contractility, thereby improving cardiac output, improving left ventricle emptying, and decreasing ventricular filling pressures. Digitalis has also been used to treat atrial fibrillation and atrial flutter. In this scenario, digitalis reduces the number of impulses transmitted through the AV node and thus, provides effective rate control.
نکات برجسته درمانی
دیجیتالیس برای درمان نارسایی سیستولیک قلب استفاده می شود. انقباض را افزایش می دهد و در نتیجه برون ده قلبی را بهبود می بخشد، تخلیه بطن چپ را بهبود می بخشد و فشار پر شدن بطن را کاهش می دهد. دیجیتالیس همچنین برای درمان فیبریلاسیون دهلیزی و فلوتر دهلیزی استفاده شده است. در این سناریو، دیژیتال تعداد تکانه های ارسال شده از طریق گره AV را کاهش می دهد و بنابراین، کنترل نرخ موثری را فراهم می کند.
In both these instances alternative treatments developed over the past 20 years and the need to tightly regulate dose due to significant potential for side effects have reduced the use of digitalis. However, with better understanding of mechanism and toxicity, digitalis and its clinically prepared derivatives remain important drugs in modern medicine.
در هر دو این موارد، درمانهای جایگزین ایجاد شده در ۲۰ سال گذشته و نیاز به تنظیم دقیق دوز به دلیل پتانسیل قابل توجه عوارض جانبی، استفاده از دیژیتال را کاهش داده است. با این حال، با درک بهتر مکانیسم و سمیت، دیژیتال و مشتقات بالینی آماده شده آن همچنان داروهای مهمی در پزشکی مدرن هستند.
SPREAD OF CARDIAC EXCITATION
Depolarization initiated in the SA node spreads radially through the atria, then converges on the AV node. Atrial depolarization is complete in about 0.1 s. Because conduction in the AV node is slow (Table 29-1), a delay of about 0.1 s (AV nodal delay) occurs before excitation spreads to the ventricles. It is interesting to note here that when there is a lack of contribution of Ina in the depolarization (phase 0) of the action potential, a marked loss of conduction is observed. This delay is shortened by stimulation of the sympathetic nerves to the heart and lengthened by stimulation of the vagi. From the top of the septum, the wave of depolarization spreads in the rapidly conducting Purkinje fibers to all parts of the ventricles in 0.08-0.1 s. In humans, depolarization of the ventricular muscle starts at the left side of the interventricular septum and moves first to the right across the mid portion of the septum. The wave of depolarization then spreads down the septum to the apex of the heart. It returns along the ventricular walls to the AV groove, proceeding from the endocardial to the epicardial surface (Figure 29-4). The last parts of the heart to be depolarized are the posterobasal portion of the left ventricle, the pulmonary conus, and the uppermost portion of the septum.
گسترش برانگیختگی قلبی
دپلاریزاسیون آغاز شده در گره SA به صورت شعاعی در دهلیزها گسترش می یابد، سپس بر روی گره AV همگرا می شود. دپلاریزاسیون دهلیزی در حدود ۰.۱ ثانیه کامل می شود. از آنجایی که رسانش در گره AV کند است (جدول ۲۹-۱)، تاخیری در حدود ۰.۱ ثانیه (تاخیر گره AV) قبل از گسترش تحریک به بطن ها رخ می دهد. جالب است که در اینجا بدانیم که وقتی عدم مشارکت Ina در دپلاریزاسیون (فاز ۰) پتانسیل عمل وجود دارد، از دست دادن قابل توجهی از هدایت مشاهده می شود. این تاخیر با تحریک اعصاب سمپاتیک به قلب کوتاه شده و با تحریک واگی طولانی تر می شود. از بالای سپتوم، موج دپلاریزاسیون در فیبرهای پورکنژ که به سرعت رسانا هستند به تمام قسمت های بطن در ۰.۰۸-۰.۱ ثانیه گسترش می یابد. در انسان، دپلاریزاسیون عضله بطنی از سمت چپ سپتوم بین بطنی شروع می شود و ابتدا به سمت راست در قسمت میانی سپتوم حرکت می کند. سپس موج دپلاریزاسیون از سپتوم به سمت راس قلب گسترش می یابد. در امتداد دیواره های بطن به شیار AV باز می گردد و از اندوکارد به سطح اپی کاردیال پیش می رود (شکل ۲۹-۴). آخرین قسمتهای قلب که دپلاریزه میشوند، قسمت خلفی بازال بطن چپ، مخروط ریوی و بالاترین قسمت سپتوم هستند.
TABLE 29-1 Conduction speeds in cardiac tissue.
جدول ۲۹-۱ سرعت های هدایت در بافت قلب.


FIGURE 29-4 Normal spread of electrical activity in the heart. A) Conducting system of the heart. B) Sequence of cardiac excitation. Top: Anatomic position of electrical activity. Bottom: Corresponding electrocardiogram. The yellow color denotes areas that are depolarized. AV, atrioventricular; SA, sinoatrial. (Reproduced with permission from Goldman MJ: Principles of Clinical Electrocardiography, 12th ed. Originally published by Appleton & Lange. Copyright © ۱۹۸۶ by McGraw-Hill.)
شکل ۲۹-۴ انتشار طبیعی فعالیت الکتریکی در قلب. الف) سیستم هدایت قلب. ب) توالی تحریک قلبی. بالا: موقعیت آناتومیک فعالیت الکتریکی. پایین: متناظر نوار قلب رنگ زرد نشان دهنده نواحی دپولاریزه است. AV، دهلیزی. SA، سینوسی دهلیزی. (تکثیر شده با اجازه گلدمن ام جی: اصول الکتروکاردیوگرافی بالینی، ویرایش دوازدهم. در اصل توسط اپلتون و لانگ منتشر شده است. حق نشر © ۱۹۸۶ توسط McGraw-Hill.)
THE ELECTROCARDIOGRAM
Because the body fluids are good conductors (ie, because the body is a volume conductor), fluctuations in potential, representing the algebraic sum of the action potentials of myocardial fibers, can be recorded extracellularly. The record of these fluctuations in potential during the cardiac cycle is the ECG or EKG.
الکتروکاردیوگرام
از آنجایی که مایعات بدن رسانای خوبی هستند (یعنی چون بدن یک رسانای حجمی است)، نوسانات پتانسیل، که مجموع جبری پتانسیل های عمل فیبرهای میوکارد را نشان می دهد، می تواند به صورت خارج سلولی ثبت شود. رکورد این نوسانات پتانسیل در طول چرخه قلبی ECG یا EKG است.
The ECG may be recorded by using an active or exploring electrode connected to an indifferent electrode at zero potential (unipolar recording) or by using two active electrodes (bipolar recording). In a volume conductor, the sum of the potentials at the points of an equilateral triangle with a current source in the center is zero at all times. A triangle with the heart at its center (Einthoven triangle, see below) can be approximated by placing electrodes on both arms and on the left leg. These are the three standard limb leads used in electrocardiography. If these electrodes are connected to a common terminal, an indifferent electrode that stays near zero potential is obtained. Depolarization moving toward an active electrode in a volume conductor produces a positive deflection, whereas depolarization moving in the opposite direction produces a negative deflection.
ECG ممکن است با استفاده از یک الکترود فعال یا کاوشگر متصل به یک الکترود بی تفاوت با پتانسیل صفر (ضبط تک قطبی) یا با استفاده از دو الکترود فعال (ضبط دوقطبی) ثبت شود. در یک هادی حجمی، مجموع پتانسیل ها در نقاط یک مثلث متساوی الاضلاع با منبع جریان در مرکز در تمام زمان ها صفر است. مثلثی که قلب در مرکز آن قرار دارد (مثلث Einthoven، در زیر ببینید) را می توان با قرار دادن الکترودها روی هر دو دست و روی پای چپ تقریب زد. اینها سه لید استاندارد اندام مورد استفاده در الکتروکاردیوگرافی هستند. اگر این الکترودها به یک ترمینال مشترک متصل شوند، یک الکترود بی تفاوت که نزدیک به پتانسیل صفر باقی می ماند به دست می آید. دپلاریزاسیون حرکت به سمت الکترود فعال در یک رسانای حجمی باعث ایجاد انحراف مثبت می شود، در حالی که دپلاریزاسیون حرکت در جهت مخالف باعث ایجاد انحراف منفی می شود.
The names of the various waves and segments of the ECG in humans are shown in Figure 29-5. By convention, an upward deflection is written when the active electrode becomes positive relative to the indifferent electrode, and a downward deflection is written when the active electrode becomes negative. As can be seen in Figure 29-1, the P wave is primarily produced by atrial depolarization, the QRS complex is dominated by ventricular depolarization, and the T wave by ventricular repolarization. The U wave is an inconstant finding that may be due to ventricular myocytes with long action potentials. However, the contributions to this segment are still undetermined. The intervals between the various waves of the ECG and the events in the heart that occur during these intervals are shown in Table 29-2.
نام امواج و بخش های مختلف ECG در انسان در شکل ۲۹-۵ نشان داده شده است. طبق قرارداد، زمانی که الکترود فعال نسبت به الکترود بی تفاوت مثبت می شود، انحراف رو به بالا نوشته می شود و زمانی که الکترود فعال منفی می شود، انحراف رو به پایین نوشته می شود. همانطور که در شکل ۲۹-۱ مشاهده می شود، موج P در درجه اول توسط دپلاریزاسیون دهلیزی تولید می شود، کمپلکس QRS توسط دپلاریزاسیون بطنی و موج T توسط رپلاریزاسیون بطنی غالب می شود. موج U یک یافته غیر ثابت است که ممکن است ناشی از میوسیت های بطنی با پتانسیل عمل طولانی باشد. با این حال، سهم به این بخش هنوز مشخص نیست. فواصل بین امواج مختلف ECG و رویدادهای قلب که در این فواصل رخ می دهد در جدول ۲۹-۲ نشان داده شده است.

FIGURE 29-5 Waves of the ECG. Standard names for individual waves and segments that make up the ECG are shown. Electrical activity that contributes the observed deflections are discussed in the text and in Table 29-2. ECG, electrocardiogram.
شکل ۲۹-۵ امواج ECG. نام های استاندارد برای امواج و بخش هایی که ECG را تشکیل می دهند نشان داده شده است. فعالیت الکتریکی که به انحرافات مشاهده شده کمک می کند در متن و جدول ۲۹-۲ بحث شده است. نوار قلب، نوار قلب.
TABLE 29-2 ECG intervals.
جدول ۲۹-۲ فواصل ECG.

aMeasured from the beginning of the P wave to the beginning of the QRS complex. Shortens as heart rate increases from average of 0.18 s at a rate of 70 beats/min to 0.14 s at a rate of 130 beats/min. “Can be lower (0.35 s) depending on the heart rate.
aاز ابتدای موج P تا ابتدای کمپلکس QRS اندازه گیری می شود. با افزایش ضربان قلب از میانگین ۰.۱۸ ثانیه با سرعت ۷۰ ضربه در دقیقه به ۰.۱۴ ثانیه با نرخ ۱۳۰ ضربه در دقیقه کاهش می یابد. بسته به ضربان قلب می تواند کمتر (۰.۳۵ ثانیه) باشد.
BIPOLAR LEADS
Bipolar leads were used before unipolar leads were developed. The standard limb leads each record the differences in potential between two limbs. Because current flows only in the body fluids, the records obtained are those that would be obtained if the electrodes were at the points of attachment of the limbs, no matter where on the limbs the electrodes are placed. In lead I, the electrodes are connected so that an upward deflection is inscribed when the left arm becomes positive relative to the right (left arm positive). In lead II, the electrodes are on the right arm and left leg, with the leg positive; and in lead III, the electrodes are on the left arm and left leg, with the leg positive.
سرنخ های دوقطبی
سرنخ های دوقطبی قبل از ایجاد لیدهای تک قطبی استفاده می شدند. لیدهای استاندارد هر کدام تفاوت پتانسیل بین دو اندام را ثبت می کنند. از آنجایی که جریان فقط در مایعات بدن جریان دارد، رکوردهای به دست آمده آنهایی هستند که اگر الکترودها در نقاط اتصال اندام ها قرار داشته باشند، مهم نیست که الکترودها در کجای اندام قرار می گیرند، به دست می آیند. در سرب I، الکترودها طوری به هم وصل شده اند که وقتی بازوی چپ نسبت به راست مثبت می شود (بازوی چپ مثبت) یک انحراف به سمت بالا نوشته می شود. در لید II، الکترودها روی بازوی راست و پای چپ قرار دارند و پا مثبت است. و در سرب III، الکترودها روی بازوی چپ و پای چپ قرار دارند و پا مثبت است.
UNIPOLAR (V) LEADS
An additional nine unipolar leads, that is, leads that record the potential difference between an exploring electrode and an indifferent electrode, are commonly used in clinical electrocardiography. There are six unipolar chest leads (precordial leads) designated V1-V6 (Figure 29-6) and three unipolar limb leads: VR (right arm), VL (left arm), and VF (left foot). The indifferent electrode is constructed by connecting electrodes placed on the two arms and the left leg to a central terminal. This “V” lead effectively records a “zero” potential because they are situated such that the electrical activity should be cancelled out. Augmented limb leads, designated by the letter a (aVR, aVL, aVF), are generally used. The augmented limb leads do not use the “V” electrode as the zero, rather, they are recordings between the one, augmented limb and the other two limbs. This increases the size of the potentials by 50% without any change in configuration from the nonaugmented record.
یک قطبی (V) منجر می شود
نه لید تک قطبی اضافی، یعنی لیدهایی که اختلاف پتانسیل بین یک الکترود کاوشگر و یک الکترود بی تفاوت را ثبت می کنند، معمولاً در الکتروکاردیوگرافی بالینی استفاده می شوند. شش لید قفسه سینه تک قطبی (سرنخ پیش کوردیال) با نام V1-V6 (شکل ۲۹-۶) و سه لید تک قطبی اندام وجود دارد: VR (بازوی راست)، VL (بازوی چپ)، و VF (پای چپ). الکترود بی تفاوت با اتصال الکترودهایی که روی دو بازو و پای چپ قرار می گیرند به یک ترمینال مرکزی ساخته می شود. این لید “V” به طور موثر پتانسیل “صفر” را ثبت می کند زیرا آنها به گونه ای قرار دارند که فعالیت الکتریکی باید لغو شود. لیدهای اندام تقویت شده، که با حرف a (aVR، aVL، aVF) مشخص می شوند، به طور کلی استفاده می شوند. لیدهای اندام تقویت شده از الکترود “V” به عنوان صفر استفاده نمی کنند، بلکه آنها ضبط بین یک اندام تقویت شده و دو اندام دیگر هستند. این اندازه پتانسیلها را تا ۵۰% افزایش میدهد بدون اینکه هیچ تغییری در پیکربندی نسبت به رکورد غیرافزوده ایجاد شود.

FIGURE 29-6 Unipolar electrocardiographic leads. Positional for standard unipolar leads are shown. The augmented extremity leads (aVR, aVL, and aVF) are shown on the right arm, left arm, and left leg, respectively. The six chest leads (V1-V6) are shown in their proper placement.
شکل ۲۹-۶ لیدهای الکتروکاردیوگرافی تک قطبی. موقعیت برای لیدهای تک قطبی استاندارد نشان داده شده است. لیدهای تقویت شده اندام (aVR، aVL و aVF) به ترتیب روی بازوی راست، بازوی چپ و پای چپ نشان داده می شوند. شش لید قفسه سینه (V1-V6) در محل مناسب خود نشان داده شده است.
Unipolar leads can also be placed at the tips of catheters and inserted into the esophagus or heart. Although sensitivity can be increased, this is obviously more invasive and thus, not a first step in obtaining electrical readings.
لیدهای تک قطبی را نیز می توان در نوک کاتترها قرار داد و در مری یا قلب قرار داد. اگرچه حساسیت را می توان افزایش داد، اما این بدیهی است که تهاجمی تر است و بنابراین اولین گام برای به دست آوردن قرائت های الکتریکی نیست.
NORMAL ECG
The ECG tracings of a normal individual are shown in Figure 29-4b and Figure 29-7. The sequence in which the parts of the heart are depolarized (Figure 29–۴) and the position of the heart relative to the electrodes (Figure 29-7) are the important considerations in interpreting the configurations of the waves in each lead. The atria are located posteriorly in the chest. The ventricles form the base and anterior surface of the heart, and the right ventricle is anterolateral to the left. Thus, aVR “looks at” the cavities of the ventricles. Atrial depolarization, ventricular depolarization, and ventricular repolarization move away from the exploring electrode, and the P wave, QRS complex, and T wave are therefore all negative (downward) deflections; aVL and aVF look at the ventricles, and the deflections are therefore predominantly positive or biphasic. There is no Q wave in V1 and V2, and the initial portion of the QRS complex is a small upward deflection because ventricular depolarization first moves across the midportion of the septum from left to right toward the exploring electrode. The wave of excitation then moves down the septum and into the left ventricle away from the electrode, producing a large S wave. Finally, it moves back along the ventricular wall toward the electrode, producing the return to the isoelectric line. Conversely, in the left ventricular leads (V4-V6) there may be an initial small Q wave (left to right septal depolarization), and there is a large R wave (septal and left ventricular depolarization) followed in V4 and V5 by a moderate S wave (late depolarization of the ventricular walls moving back toward the AV junction). It should be noted that there is considerable variation in the position of the normal heart, and the position affects the configuration of the electrocardiographic complexes in the various leads.
نوار قلب نرمال
ردیابی ECG یک فرد طبیعی در شکل ۲۹-4b و شکل ۲۹-۷ نشان داده شده است. دنباله ای که در آن قسمت های قلب دپلاریزه می شوند (شکل ۲۹-۴) و موقعیت قلب نسبت به الکترودها (شکل ۲۹-۷) ملاحظات مهم در تفسیر پیکربندی امواج در هر لید هستند. دهلیزها در قسمت خلفی قفسه سینه قرار دارند. بطن ها پایه و سطح قدامی قلب را تشکیل می دهند و بطن راست به سمت چپ قدامی است. بنابراین، aVR به حفرههای بطنها نگاه میکند. دپلاریزاسیون دهلیزی، دپلاریزاسیون بطنی و رپلاریزاسیون بطنی از الکترود کاوشگر دور می شوند و بنابراین موج P، کمپلکس QRS و موج T همگی انحرافات منفی (به سمت پایین) هستند. aVL و aVF به بطن ها نگاه می کنند و بنابراین انحرافات عمدتاً مثبت یا دوفازی هستند. هیچ موج Q در V1 و V2 وجود ندارد و قسمت اولیه کمپلکس QRS یک انحراف کوچک به سمت بالا است زیرا دپلاریزاسیون بطنی ابتدا در قسمت میانی سپتوم از چپ به راست به سمت الکترود کاوشگر حرکت می کند. سپس موج تحریک از سپتوم به سمت پایین حرکت می کند و به بطن چپ از الکترود دور می شود و موج S بزرگ تولید می کند. در نهایت، در امتداد دیواره بطن به سمت الکترود حرکت می کند و بازگشت به خط ایزوالکتریک را ایجاد می کند. برعکس، در لیدهای بطن چپ (V4-V6) ممکن است یک موج Q اولیه کوچک (دپلاریزاسیون سپتوم چپ به راست) و یک موج R بزرگ (دپلاریزاسیون سپتوم و بطن چپ) وجود داشته باشد که در V4 و V5 با یک موج S متوسط (دپلاریزاسیون دیرهنگام دیوارههای بطن به سمت عقب حرکت میکند). لازم به ذکر است که تغییرات قابل توجهی در موقعیت قلب طبیعی وجود دارد و این موقعیت بر پیکربندی مجتمع های الکتروکاردیوگرافی در لیدهای مختلف تأثیر می گذارد.
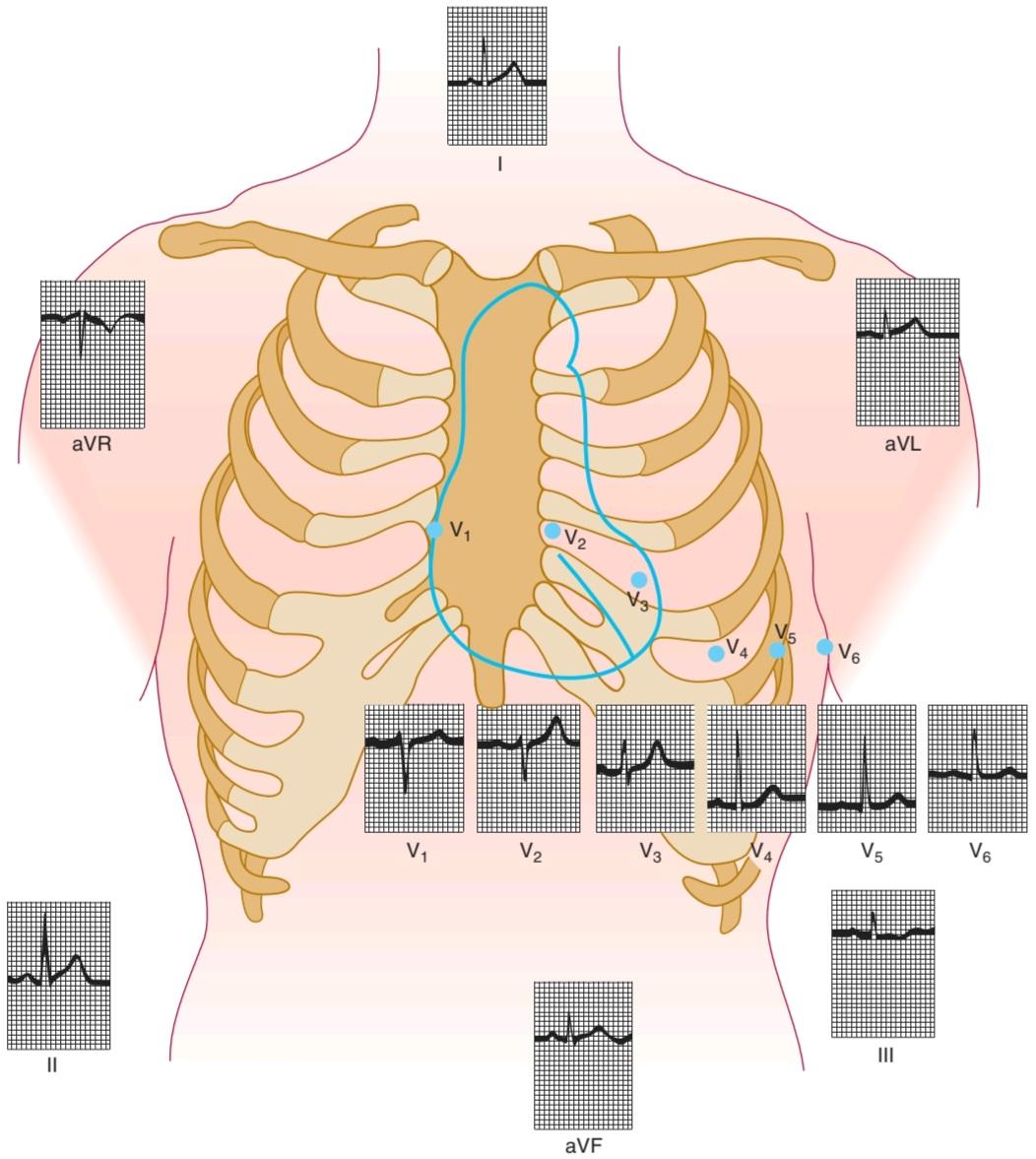
FIGURE 29-7 Normal ECG. Tracings from individual electrodes (positions marked in figure) are shown for a normal ECG. See text for additional details. ECG, electrocardiogram. (Reproduced with permission from Goldman MJ: Principles of Clinical Electrocardiography, 12th ed. Originally published by Appleton & Lange. Copyright © ۱۹۸۶ by McGraw-Hill.)
شکل ۲۹-۷ ECG طبیعی. ردیابی از تک تک الکترودها (موقعیت های مشخص شده در شکل) برای ECG طبیعی نشان داده شده است. برای جزئیات بیشتر به متن مراجعه کنید. نوار قلب، نوار قلب. (تکثیر شده با اجازه گلدمن ام جی: اصول الکتروکاردیوگرافی بالینی، ویرایش دوازدهم. در اصل توسط اپلتون و لانگ منتشر شده است. حق نشر © ۱۹۸۶ توسط McGraw-Hill.)
BIPOLAR LIMB LEADS & THE CARDIAC VECTOR
Because the standard limb leads are records of the potential differences between two points, the deflection in each lead at any instant indicates the magnitude and direction of the electromotive force generated in the heart in the axis of the lead (cardiac vector or axis). The vector at any given moment in the two dimensions of the frontal plane can be calculated from any two standard limb leads (Figure 29-8) if it is assumed that the three electrode locations form the points of an equilateral triangle (Einthoven triangle) and that the heart lies in the center of the triangle. These assumptions are not completely warranted, but calculated vectors are useful approximations. An approximate mean QRS vector (“electrical axis of the heart”) is often plotted by using the average QRS deflection in each lead, as shown in Figure 29-8. This is a mean vector as opposed to an instantaneous vector, and the average QRS deflections should be measured by integrating the QRS complexes. However, they can be approximated by measuring the net differences between the positive and negative peaks of the QRS. The normal direction of the mean QRS vector is generally said to be from -30 to +110° on the coordinate system shown in Figure 29-8. Left or right axis deviation is said to be present if the calculated axis falls to the left of -30° or to the right of +110°, respectively. Right axis deviation suggests right ventricular hypertrophy. Left axis deviation may be due to left ventricular hypertrophy, but there are better and more reliable electrocardiographic criteria for this condition.
سرنخ های دوقطبی اندام و ناقل قلب
از آنجایی که لیدهای اندام استاندارد رکوردهایی از اختلاف پتانسیل بین دو نقطه هستند، انحراف در هر لید در هر لحظه نشان دهنده بزرگی و جهت نیروی حرکتی الکتریکی ایجاد شده در قلب در محور لید (بردار یا محور قلبی) است. اگر فرض شود که سه محل الکترود نقاط یک مثلث متساوی الاضلاع (مثلث Einthoven) را تشکیل می دهند و قلب در مرکز مثلث قرار دارد، بردار در هر لحظه در دو بعد صفحه فرونتال را می توان از هر دو لید استاندارد اندام محاسبه کرد (شکل ۲۹-۸). این مفروضات کاملاً تأیید نشده اند، اما بردارهای محاسبه شده تقریب های مفیدی هستند. یک میانگین تقریبی بردار QRS (“محور الکتریکی قلب”) اغلب با استفاده از میانگین انحراف QRS در هر لید ترسیم می شود، همانطور که در شکل ۲۹-۸ نشان داده شده است. این یک بردار متوسط در مقابل یک بردار آنی است و میانگین انحرافات QRS باید با ادغام کمپلکس های QRS اندازه گیری شود. با این حال، آنها را می توان با اندازه گیری تفاوت خالص بین قله های مثبت و منفی QRS تقریب زد. جهت نرمال میانگین بردار QRS به طور کلی از ۳۰- تا ۱۱۰+ در سیستم مختصات نشان داده شده در شکل ۲۹-۸ گفته می شود. انحراف محور چپ یا راست در صورتی وجود دارد که محور محاسبه شده به ترتیب به سمت چپ ۳۰- درجه یا به راست ۱۱۰+ درجه باشد. انحراف محور راست نشان دهنده هایپرتروفی بطن راست است. انحراف محور چپ ممکن است به دلیل هیپرتروفی بطن چپ باشد، اما معیارهای الکتروکاردیوگرافی بهتر و قابل اعتمادتری برای این وضعیت وجود دارد.
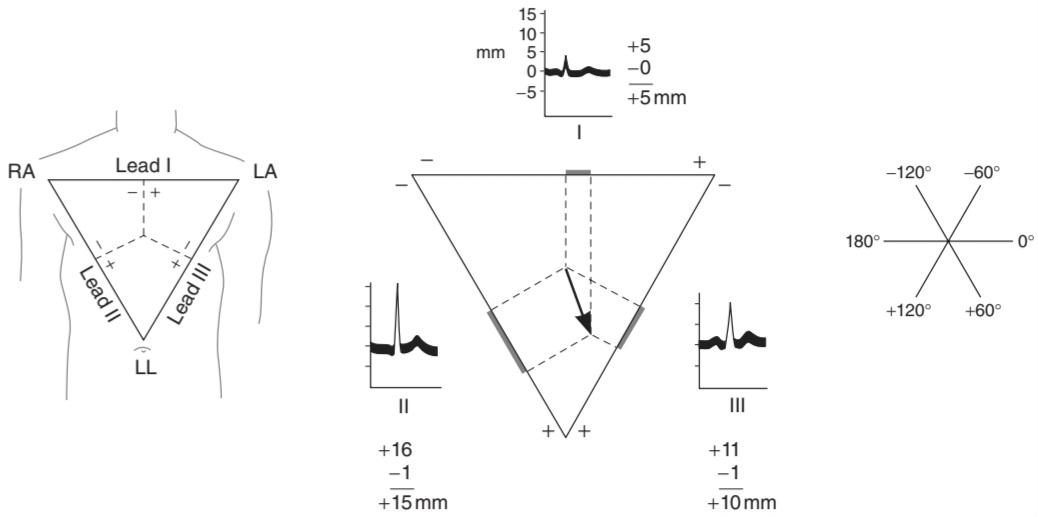
FIGURE 29-8 Cardiac vector. Left: Einthoven triangle. Perpendiculars dropped from the midpoints of the sides of the equilateral triangle intersect at the center of electrical activity. RA, right arm; LA, left arm; LL, left leg. Center: Calculation of mean QRS vector. In each lead, distances equal to the height of the R wave minus the height of the largest negative deflection in the QRS complex are measured off from the midpoint of the side of the triangle representing that lead. An arrow drawn from the center of electrical activity to the point of intersection of perpendiculars extended from the distances measured off on the sides represents the magnitude and direction of the mean QRS vector. Right: Reference axes for determining the direction of the vector.
شکل ۲۹-۸ ناقل قلبی. سمت چپ: مثلث Einthoven. عمودهای رها شده از وسط اضلاع مثلث متساوی الاضلاع در مرکز فعالیت الکتریکی همدیگر را قطع می کنند. RA، بازوی راست؛ LA، بازوی چپ؛ LL، پای چپ. مرکز: محاسبه میانگین بردار QRS. در هر لید، فواصل برابر با ارتفاع موج R منهای ارتفاع بزرگترین انحراف منفی در مجموعه QRS از نقطه وسط ضلع مثلثی که آن لید را نشان می دهد اندازه گیری می شود. فلشی که از مرکز فعالیت الکتریکی تا نقطه تقاطع عمودها کشیده شده از فواصل اندازه گیری شده در طرفین، نشان دهنده بزرگی و جهت بردار QRS است. راست: محورهای مرجع برای تعیین جهت بردار.
HIS BUNDLE ELECTROGRAM
In patients with heart block, the electrical events in the AV node, bundle of His, and Purkinje system are frequently studied with a catheter containing an electrode at its tip that is passed through a vein to the right side of the heart and manipulated into a position close to the tricuspid valve. Three or more standard electrocardiographic leads are recorded simultaneously. The record of the electrical activity obtained with the catheter (Figure 29-9) is the His bundle electrogram (HBE). It normally shows an A deflection when the AV node is activated, an H spike during transmission through the His bundle, and a V deflection during ventricular depolarization. With the HBE and the standard electrocardiographic leads, it is possible to time three intervals accurately: (1) the PA interval, the time from the first appearance of atrial depolarization to the A wave in the HBE, which represents conduction time from the SA node to the AV node; (2) the AH interval, from the A wave to the start of the H spike, which represents the AV nodal conduction time; and (3) the HV interval, the time from the start of the H spike to the start of the QRS deflection in the ECG, which represents conduction in the bundle of His and the bundle branches. The approximate normal values for these intervals in adults are PA, 27 ms; AH, 92 ms; and HV, 43 ms. These values illustrate the relative slowness of conduction in the AV node.
الکتروگرام بسته ای او
در بیماران مبتلا به بلوک قلبی، رویدادهای الکتریکی در گره AV، دسته هیس و سیستم پورکنژ اغلب با یک کاتتر حاوی الکترود در نوک آن که از طریق ورید به سمت راست قلب عبور میکند و در موقعیتی نزدیک به دریچه تریکوسپید دستکاری میشود، مطالعه میشود. سه یا چند لید استاندارد الکتروکاردیوگرافی به طور همزمان ثبت می شود. رکورد فعالیت الکتریکی به دست آمده با کاتتر (شکل ۲۹-۹) الکتروگرام باندل His (HBE) است. به طور معمول یک انحراف A را هنگامی که گره AV فعال می شود، یک سنبله H در حین انتقال از طریق بسته His، و یک انحراف V در هنگام دپلاریزاسیون بطنی نشان می دهد. با HBE و لیدهای الکتروکاردیوگرافی استاندارد، می توان سه بازه را به طور دقیق زمان بندی کرد: (۱) فاصله PA، زمان از اولین ظهور دپلاریزاسیون دهلیزی تا موج A در HBE، که نشان دهنده زمان انتقال از گره SA به گره AV است. (۲) فاصله AH، از موج A تا شروع سنبله H، که نشان دهنده زمان هدایت گرهی AV است. و (۳) فاصله HV، زمان از شروع سنبله H تا شروع انحراف QRS در ECG، که نشان دهنده رسانایی در بسته His و شاخه های بسته نرم افزاری است. مقادیر طبیعی تقریبی برای این فواصل در بزرگسالان PA، ۲۷ میلی ثانیه است. ق، ۹۲ میلی ثانیه; و HV، ۴۳ میلیثانیه. این مقادیر کندی نسبی هدایت در گره AV را نشان می دهد.

FIGURE 29-9 Normal His bundle electrogram (HBE) with simultaneously recorded ECG. An HBE recorded with an invasive electrode is superimposed on a standard ECG reading. Timing of depolarizations of the HBE are described in the text. ECG, electrocardiogram.
شکل ۲۹-۹ نرمال الکتروگرام باندل او (HBE) با ECG ثبت شده همزمان. یک HBE ثبت شده با یک الکترود تهاجمی روی یک قرائت استاندارد ECG قرار می گیرد. زمان دپلاریزاسیون HBE در متن توضیح داده شده است. نوار قلب، نوار قلب.
MONITORING
The ECG has long been used in patient care. In the past, it was often recorded continuously in hospital coronary care units, with alarms arranged to sound at the onset of life-threatening arrhythmias. Using a small portable tape recorder (Holter monitor), it is also possible to record the ECG in ambulatory individuals as they go about their normal activities. The recording is later played back at high speed and analyzed. Recordings obtained with monitors have proved valuable in the diagnosis of arrhythmias and in planning the treatment of patients recovering from myocardial infarctions. Currently, modern systems can be hooked up to individuals and obtain and store heart rhythm data over days to better evaluate long-term electrical activity.
مانیتورینگ
ECG برای مدت طولانی در مراقبت از بیمار استفاده می شود. در گذشته، اغلب به طور مداوم در بخشهای مراقبتهای کرونری بیمارستان، با آلارمهایی که در هنگام شروع آریتمیهای تهدیدکننده زندگی به صدا در میآیند، ضبط میشد. با استفاده از یک ضبط صوت کوچک قابل حمل (هولتر مانیتور)، همچنین می توان ECG را در افراد سرپایی در حین انجام فعالیت های عادی خود ضبط کرد. ضبط بعداً با سرعت بالا پخش و تجزیه و تحلیل می شود. ضبطهای بهدستآمده با مانیتورها در تشخیص آریتمیها و برنامهریزی درمان بیمارانی که پس از سکته قلبی بهبود مییابند، ارزشمند بودهاند. در حال حاضر، سیستمهای مدرن را میتوان به افراد متصل کرد و دادههای ریتم قلب را در طول روز به دست آورد و ذخیره کرد تا فعالیت الکتریکی طولانیمدت را بهتر ارزیابی کند.
CLINICAL APPLICATIONS: CARDIAC ARRHYTHMIAS
NORMAL CARDIAC RATE
In the normal human heart, each beat originates in the SA node (normal sinus rhythm, NSR). The heart beats about 70 times a minute at rest. The rate is slowed (bradycardia) during sleep and accelerated (tachycardia) by emotion, exercise, fever, and many other stimuli. In healthy young individuals breathing at a normal rate, the heart rate varies with the phases of respiration: It accelerates during inspiration and decelerates during expiration, especially if the depth of breathing is increased. This sinus arrhythmia (Figure 29-10) is a normal phenomenon and is primarily due to fluctuations in parasympathetic output to the heart. During inspiration, impulses in the vagi from the stretch receptors in the lungs inhibit the cardio-inhibitory area in the medulla oblongata. The tonic vagal discharge that keeps the heart rate slow decreases, and the heart rate rises. Disease processes affecting the sinus node lead to marked bradycardia accompanied by dizziness and syncope (Clinical Box 29-2).
کاربردهای بالینی: آریتمی های قلبی
ضربان قلب طبیعی
در قلب طبیعی انسان، هر ضربان از گره SA (ریتم سینوسی طبیعی، NSR) منشا می گیرد. قلب در حالت استراحت حدود ۷۰ بار در دقیقه می تپد. این سرعت در طول خواب کاهش می یابد (برادی کاردی) و توسط احساسات، ورزش، تب و بسیاری از محرک های دیگر تسریع می شود (تاکی کاردی). در افراد جوان سالم که با سرعت طبیعی نفس می کشند، ضربان قلب با مراحل تنفس تغییر می کند: در طول دم تسریع می شود و در هنگام بازدم کند می شود، به خصوص اگر عمق تنفس افزایش یابد. این آریتمی سینوسی (شکل ۲۹-۱۰) یک پدیده طبیعی است و در درجه اول به دلیل نوسانات خروجی پاراسمپاتیک به قلب است. در طول دم، تکانههای گیرندههای کششی در واگی در ریهها، ناحیه مهارکننده قلبی در بصل النخاع را مهار میکنند. ترشحات مقوی واگ که ضربان قلب را آهسته نگه می دارد کاهش می یابد و ضربان قلب افزایش می یابد. فرآیندهای بیماری موثر بر گره سینوسی منجر به برادی کاردی مشخص همراه با سرگیجه و سنکوپ می شود (کادر بالینی ۲۹-۲).

FIGURE 29-10 Sinus arrhythmia in a young man and an old man. Each subject breathed five times per minute. With each inspiration the RR interval (the interval between R waves) declined, indicating an increase in heart rate. Note the marked reduction in the magnitude of the arrhythmia in the older man. These records were obtained after ẞ-adrenergic blockade but would have been generally similar in its absence. (Reproduced with permission from Pfeifer MA, Weinberg CR, Cook D, Best JD, Reenan A, Halter JB: Differential changes of autonomic nervous system function with age in man. Am J Med 1983;75:249.)
شکل ۲۹-۱۰ آریتمی سینوسی در یک مرد جوان و یک مرد مسن. هر آزمودنی پنج بار در دقیقه نفس می کشید. با هر دم، فاصله RR (فاصله بین امواج R) کاهش می یابد، که نشان دهنده افزایش ضربان قلب است. به کاهش قابل توجه بزرگی آریتمی در مرد مسن توجه کنید. این رکوردها پس از محاصره آدرنرژیک به دست آمد، اما در غیاب آن به طور کلی مشابه بود. (با اجازه Pfeifer MA، Weinberg CR، Cook D، Best JD، Reenan A، Halter JB: تغییرات متفاوت عملکرد سیستم عصبی خودمختار با افزایش سن در انسان. Am J Med 1983؛ ۷۵:۲۴۹.)
CLINICAL BOX 29-2
Sick Sinus Syndrome
Sick sinus syndrome (bradycardia-tachycardia syndrome; sinus node dysfunction) is a collection of heart rhythm disorders that include sinus bradycardia (slow heart rates from the natural pacemaker of the heart), tachycardias (fast heart rates), and bradycardia-tachycardia (alternating slow and fast heart rhythms). Sick sinus syndrome is relatively uncommon and is usually found in people older than 50, in whom the cause is often a nonspecific, scar-like degeneration of the heart’s conduction system. When found in younger people, especially in children, a common cause of sick sinus syndrome is heart surgery, especially on the upper chambers. Holter monitoring is an effective tool for diagnosing sick sinus syndrome because of the episodic nature of the disorder. Extremely slow heart rate and prolonged pauses may be seen during Holter monitoring, along with episodes of atrial tachycardias.
جعبه بالینی ۲۹-۲
سندرم سینوس بیمار
سندرم سینوسی بیمار (سندرم برادی کاردی-تاکی کاردی؛ اختلال عملکرد گره سینوسی) مجموعه ای از اختلالات ریتم قلب است که شامل برادی کاردی سینوسی (آهسته شدن ضربان قلب از ضربان ساز طبیعی قلب)، تاکی کاردی (ضربان قلب سریع) و برادی کاردی-تاکی کاردی (آهسته و سریع ضربان قلب) است. سندرم سینوس بیمار نسبتاً نادر است و معمولاً در افراد بالای ۵۰ سال دیده میشود که در آنها علت اغلب انحطاط غیراختصاصی و اسکار مانند سیستم هدایت قلب است. هنگامی که در افراد جوان تر، به ویژه در کودکان یافت می شود، یکی از علل شایع سندرم سینوس بیمار، جراحی قلب است، به ویژه در اتاق های فوقانی. مانیتورینگ هولتر به دلیل ماهیت اپیزودیک این اختلال، ابزاری موثر برای تشخیص سندرم سینوس بیمار است. ضربان قلب بسیار آهسته و مکث های طولانی مدت ممکن است در طول مانیتورینگ هولتر همراه با دوره های تاکی کاردی دهلیزی دیده شود.
THERAPEUTIC HIGHLIGHTS
Treatment depends on the severity and type of disease. Tachycardias are frequently treated with medication. When there is marked bradycardia in patients with sick sinus syndrome or third-degree heart block, an electronic pacemaker is frequently implanted. These devices, which have become sophisticated and reliable, are useful in patients with sinus node dysfunction, AV block, and bifascicular or trifascicular block. They are useful also in patients with severe neurogenic syncope, in whom carotid sinus stimulation produces pauses of more than 3 s between heartbeats.
نکات برجسته درمانی
درمان بستگی به شدت و نوع بیماری دارد. تاکی کاردی اغلب با دارو درمان می شود. هنگامی که برادی کاردی مشخص در بیماران مبتلا به سندرم سینوس بیمار یا بلوک قلبی درجه سوم وجود دارد، ضربان ساز الکترونیکی اغلب کاشته می شود. این دستگاه ها که پیچیده و قابل اعتماد شده اند، در بیماران مبتلا به اختلال عملکرد غدد سینوسی، بلوک AV و بلوک دو فاسیکولار یا سه فاسیکولار مفید هستند. آنها همچنین در بیماران مبتلا به سنکوپ عصبی شدید، که در آنها تحریک سینوس کاروتید باعث ایجاد مکث بیش از ۳ ثانیه بین ضربان قلب می شود، مفید هستند.
ABNORMAL PACEMAKERS
The AV node and other portions of the conduction system can, in abnormal situations, become the cardiac pacemaker. In addition, diseased atrial and ventricular muscle fibers can have their membrane potentials reduced and discharge repetitively.
ضربان سازهای غیر طبیعی
گره AV و سایر بخشهای سیستم هدایت میتوانند در موقعیتهای غیرطبیعی به ضربانساز قلب تبدیل شوند. علاوه بر این، فیبرهای عضلانی دهلیزی و بطنی بیمار می توانند پتانسیل غشایی آنها کاهش یافته و به طور مکرر تخلیه شوند.
As noted above, the discharge rate of the SA node is more rapid than that of the other parts of the conduction system, and this is why the SA node normally controls the heart rate. When conduction from the atria to the ventricles is completely interrupted, complete (third-degree) heart block results, and the ventricles beat at a low rate (idioventricular rhythm) independently of the atria (Figure 29-11). The block may be due to disease in the AV node (AV nodal block) or in the conducting system below the node (infranodal block). In patients with AV nodal block, the remaining nodal tissue becomes the pacemaker and the rate of the idioventricular rhythm is approximately 45 beats/min. In patients with infranodal block due to disease in the bundle of His, the ventricular pacemaker is located more peripherally in the conduction system and the ventricular rate is lower; it averages 35 beats/min, but in individual cases it can be as low as 15 beats/min. In such individuals, there may also be periods of asystole lasting a minute or more. The resultant cerebral ischemia causes dizziness and fainting (Stokes-Adams syndrome). Causes of third-degree heart block include septal myocardial infarction and damage to the bundle of His during surgical correction of congenital interventricular septal defects.
همانطور که در بالا ذکر شد، سرعت تخلیه گره SA سریعتر از سایر قسمت های سیستم هدایت است و به همین دلیل است که گره SA معمولاً ضربان قلب را کنترل می کند. هنگامی که انتقال از دهلیزها به بطن ها به طور کامل قطع شود، بلوک کامل (درجه سوم) قلب ایجاد می شود و بطن ها مستقل از دهلیزها با سرعت کم (ریتم idio-ventricular) می تپند (شکل ۲۹-۱۱). بلوک ممکن است به دلیل بیماری در گره AV (بلوک گرهی AV) یا در سیستم رسانای زیر گره (بلوک زیر گرهی) باشد. در بیماران مبتلا به بلوک گره AV، بافت گره باقی مانده به ضربان ساز تبدیل می شود و سرعت ریتم داخل بطنی تقریباً ۴۵ ضربه در دقیقه است. در بیماران مبتلا به بلوک اینفراندال به دلیل بیماری در بسته هیس، ضربان ساز بطنی بیشتر در قسمت محیطی در سیستم هدایت قرار دارد و سرعت بطنی کمتر است. به طور متوسط ۳۵ ضربه در دقیقه است، اما در موارد فردی می تواند به ۱۵ ضربه در دقیقه نیز برسد. در چنین افرادی، ممکن است دوره هایی از آسیستول به مدت یک دقیقه یا بیشتر نیز وجود داشته باشد. ایسکمی مغزی ناشی از آن باعث سرگیجه و غش می شود (سندرم استوکس-آدامز). علل بلوک قلبی درجه سوم عبارتند از انفارکتوس میوکارد سپتوم و آسیب به باندل هیس در طی اصلاح جراحی نقایص مادرزادی سپتوم بین بطنی.
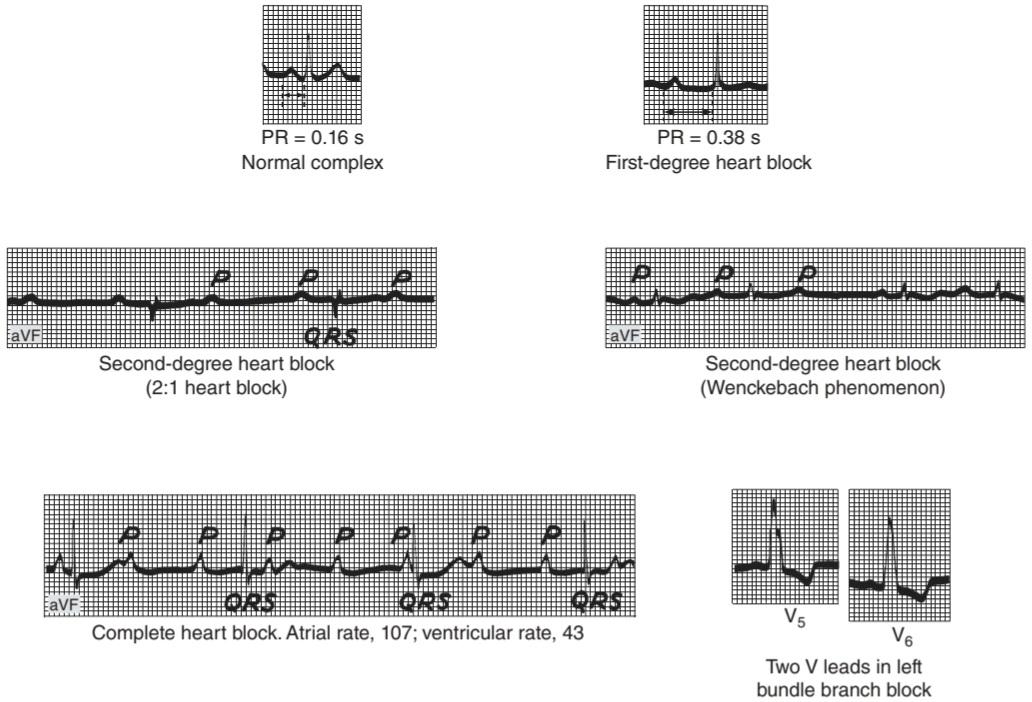
FIGURE 29-11 ECG with heart block. Individual traces that depict various forms of heart block are shown. When appropriate, unipolar leads are noted. See text for further details. ECG, electrocardiogram.
شکل ۲۹-۱۱ ECG با بلوک قلبی. ردپای فردی که اشکال مختلف بلوک قلبی را نشان می دهد نشان داده شده است. در صورت لزوم، لیدهای تک قطبی ذکر می شوند. برای جزئیات بیشتر به متن مراجعه کنید. نوار قلب، نوار قلب.
When conduction between the atria and ventricles is slowed but not completely interrupted, incomplete heart block is present. In the form called first-degree heart block, all the atrial impulses reach the ventricles but the PR interval is abnormally long. In the form called second-degree heart block, not all atrial impulses are conducted to the ventricles. For example, a ventricular beat may follow every second or every third atrial beat (2:1 block, 3:1 block, etc). In another form of incomplete heart block, there are repeated sequences of beats in which the PR interval lengthens progressively until a ventricular beat is dropped (Wenckebach phenomenon). The PR interval of the cardiac cycle that follows each dropped beat is usually normal or only slightly prolonged (Figure 29-11).
هنگامی که هدایت بین دهلیزها و بطن ها کند می شود اما به طور کامل قطع نمی شود، بلوک قلبی ناقص وجود دارد. در شکلی که بلوک قلبی درجه یک نامیده می شود، تمام تکانه های دهلیزی به بطن ها می رسد اما فاصله PR به طور غیر طبیعی طولانی است. در شکلی که بلوک قلبی درجه دوم نامیده می شود، همه تکانه های دهلیزی به بطن ها هدایت نمی شوند. برای مثال، ضربان بطنی ممکن است به دنبال هر ضربان دوم یا سوم دهلیزی باشد (بلوک ۲:۱، بلوک ۳:۱ و غیره). در شکل دیگری از بلوک ناقص قلب، توالی های مکرری از ضربان وجود دارد که در آن فاصله PR به تدریج طولانی می شود تا زمانی که ضربان بطنی کاهش یابد (پدیده Wenckebach). فاصله PR از چرخه قلبی که به دنبال هر ضربان کاهش می یابد، معمولاً طبیعی است یا فقط کمی طولانی است (شکل ۲۹-۱۱).
Sometimes one branch of the bundle of His is interrupted, causing right or left bundle branch block. In bundle branch block, excitation passes normally down the bundle on the intact side and then sweeps back through the muscle to activate the ventricle on the blocked side. The ventricular rate is therefore normal, but the QRS complexes are prolonged and deformed (Figure 29-11). Block can also occur in the anterior or posterior fascicle of the left bundle branch, producing the condition called hemiblock or fascicular block. Left anterior hemiblock produces abnormal left axis deviation in the ECG, whereas left posterior hemiblock produces abnormal right axis deviation. It is not uncommon to find combinations of fascicular and branch blocks (bifascicular or trifascicular block). The HBE permits detailed analysis of the site of block when there is a defect in the conduction system.
گاهی اوقات یک شاخه از باندل هیس قطع می شود و باعث بلوک شاخه سمت راست یا چپ می شود. در بلوک شاخه ای، تحریک به طور معمول از سمت دست نخورده به سمت پایین بسته می شود و سپس از طریق عضله به عقب می رود تا بطن در سمت مسدود شده را فعال کند. بنابراین ضربان بطنی طبیعی است، اما کمپلکس های QRS طولانی شده و تغییر شکل می دهند (شکل ۲۹-۱۱). بلوک همچنین میتواند در فاسیکل قدامی یا خلفی شاخه چپ رخ دهد و شرایطی را ایجاد کند که همیبلوک یا بلوک فاسیکولار نامیده میشود. نیم بلوک قدامی چپ باعث انحراف غیرطبیعی محور چپ در ECG می شود، در حالی که نیم بلوک خلفی چپ باعث انحراف غیر طبیعی محور راست می شود. یافتن ترکیبی از بلوک های فاسیکولار و شاخه ای (بلوک دو فاسیکولار یا سه فاسیکولار) غیر معمول نیست. HBE اجازه تجزیه و تحلیل دقیق محل بلوک را در صورت وجود نقص در سیستم هدایت می دهد.
ECTOPIC FOCI OF EXCITATION
Normally, myocardial cells do not discharge spontaneously, and the possibility of spontaneous discharge of the His bundle and Purkinje system is low because the normal pacemaker discharge of the SA node is more rapid than their rate of spontaneous discharge. However, in abnormal conditions, the His-Purkinje fibers or the myocardial fibers may discharge spontaneously. In these conditions, increased automaticity of the heart is said to be present. If an irritable ectopic focus discharges once, the result is a beat that occurs before the expected next normal beat and transiently interrupts the cardiac rhythm (atrial, nodal, or ventricular extrasystole or premature beat). If the focus discharges repetitively at a rate higher than that of the SA node, it produces rapid, regular tachycardia (atrial, ventricular, or nodal paroxysmal tachycardia or atrial flutter).
کانون تحریک خارج از رحم
به طور معمول، سلولهای میوکارد خود به خود تخلیه نمیشوند و احتمال ترشحات خودبخودی هیس باندل و سیستم پورکنژ کم است، زیرا تخلیه ضربانساز طبیعی گره SA سریعتر از میزان ترشحات خود به خودی آنها است. با این حال، در شرایط غیر طبیعی، فیبرهای His-Purkinje یا فیبرهای میوکارد ممکن است خود به خود ترشح شوند. گفته می شود در این شرایط، افزایش خودکاری قلب وجود دارد. اگر فوکوس نابجای تحریکپذیر یک بار تخلیه شود، نتیجه ضربانی است که قبل از ضربان طبیعی مورد انتظار بعدی اتفاق میافتد و به طور گذرا ریتم قلب را قطع میکند (بطنی، اکستراسیستول دهلیزی، گرهی یا بطنی یا ضربان زودرس). اگر فوکوس به طور مکرر با سرعتی بیشتر از گره SA تخلیه شود، تاکی کاردی سریع و منظم ایجاد می کند (تاکی کاردی حمله ای دهلیزی، بطنی یا گرهی یا فلوتر دهلیزی).
REENTRY
A more common cause of paroxysmal arrhythmias is a defect in conduction that permits a wave of excitation to propagate continuously within a closed circuit (circus movement). For example, if a transient block is present on one side of a portion of the conducting system, the impulse can go down the other side. If the block then wears off, the impulse may conduct in a retrograde direction in the previously blocked side back to the origin and then descend again, establishing a circus movement. An example of this in a ring of tissue is shown in Figure 29- 12. If the reentry is in the AV node, the reentrant activity depolarizes the atrium, and the resulting atrial beat is called an echo beat. In addition, the reentrant activity in the node propagates back down to the ventricle, producing paroxysmal nodal tachycardia. Circus movements can also become established in the atrial or ventricular muscle fibers. In individuals with an abnormal extra bundle of conducting tissue connecting the atria to the ventricles (bundle of Kent), the circus activity can pass in one direction through the AV node and in the other direction through the bundle, thus involving both the atria and the ventricles.
ورود مجدد
یکی از علل شایعتر آریتمیهای حملهای، نقص در هدایت است که به موجی از تحریک اجازه میدهد به طور مداوم در یک مدار بسته منتشر شود (حرکت سیرک). به عنوان مثال، اگر یک بلوک گذرا در یک طرف بخشی از سیستم رسانا وجود داشته باشد، ضربه می تواند از طرف دیگر پایین بیاید. اگر بلوک از بین برود، ضربه ممکن است در جهت رتروگراد در سمت مسدود شده قبلی به مبدأ هدایت شود و سپس دوباره پایین بیاید و یک حرکت سیرک ایجاد شود. نمونه ای از این مورد در یک حلقه از بافت در شکل ۲۹-۱۲ نشان داده شده است. اگر ورود مجدد در گره AV باشد، فعالیت باز ورود دهلیز را دپولاریزه می کند و ضربان دهلیزی حاصل ضربان اکو نامیده می شود. علاوه بر این، فعالیت مجدد در گره به سمت بطن منتشر می شود و تاکی کاردی گرهی حمله ای ایجاد می کند. حرکات سیرک همچنین می تواند در فیبرهای عضلانی دهلیزی یا بطنی ایجاد شود. در افرادی که دارای یک بسته اضافی غیر طبیعی از بافت رسانا هستند که دهلیزها را به بطن ها متصل می کند (بسته کنت)، فعالیت سیرک می تواند در یک جهت از طریق گره AV و در جهت دیگر از طریق بسته عبور کند، بنابراین دهلیزها و بطن ها را درگیر می کند.

FIGURE 29-12 Depolarization of a ring of cardiac tissue. Normally, the impulse spreads in both directions in the ring (left) and the tissue immediately behind each branch of the impulse is refractory. When a transient block occurs on one side (center), the impulse on the other side goes around the ring, and if the transient block has now worn off (right), the impulse passes this area and continues to circle indefinitely (circus movement).
شکل ۲۹-۱۲ دپلاریزاسیون حلقه ای از بافت قلب. به طور معمول، تکانه در هر دو جهت در حلقه (چپ) پخش می شود و بافت بلافاصله پشت هر شاخه از تکانه نسوز است. هنگامی که یک بلوک گذرا در یک طرف (مرکز) رخ می دهد، ضربه در طرف دیگر به دور حلقه می رود، و اگر بلوک گذرا اکنون فرسوده شده باشد (راست)، ضربه از این ناحیه عبور می کند و به طور نامحدود به چرخش ادامه می دهد (حرکت سیرک).
ATRIAL ARRHYTHMIAS
Excitation spreading from an independently discharging focus in the atria stimulates the AV node prematurely and is conducted to the ventricles. The P waves of atrial extrasystoles are abnormal, but the QRST configurations are usually normal (Figure 29-13). The excitation may depolarize the SA node, which must repolarize and then depolarize to the firing level before it can initiate the next normal beat. Consequently, a pause occurs between the extrasystole and the next normal beat that is usually equal in length to the interval between the normal beats preceding the extrasystole, and the rhythm is “reset” (see below).
آریتمی های دهلیزی
تحریک منتشر شده از یک کانون تخلیه مستقل در دهلیزها، گره AV را پیش از موعد تحریک می کند و به بطن ها هدایت می شود. امواج P اکستراسیستول دهلیزی غیرطبیعی است، اما پیکربندی QRST معمولاً طبیعی است (شکل ۲۹-۱۳). تحریک ممکن است گره SA را دپولاریزه کند، که باید قبل از شروع ضربان طبیعی بعدی، دوباره قطبی شود و سپس تا سطح شلیک دپلاریزه شود. در نتیجه، مکثی بین اکستراسیستول و ضربان طبیعی بعدی رخ میدهد که طول آن معمولاً برابر با فاصله بین ضربانهای طبیعی قبل از اکستراسیستول است، و ریتم “بازنشانی” میشود (به زیر مراجعه کنید).

FIGURE 29-13 Atrial arrhythmias. The illustration shows an atrial premature beat with its P wave superimposed on the T wave of the preceding beat (arrow); atrial tachycardia; atrial flutter with 4:1 AV block; and atrial fibrillation with a totally irregular ventricular rate. Leads used to capture electrical activity are marked in each trace. AV, atrioventricular. (Tracings reproduced with permission from Goldschlager N, Goldman MJ: Principles of Clinical Electrocardiography, 13th ed. Originally published by Appleton & Lange. Copyright © ۱۹۸۹ by McGraw-Hill.)
شکل ۲۹-۱۳ آریتمی های دهلیزی. تصویر یک ضربان زودرس دهلیزی را نشان می دهد که موج P آن روی موج T ضربان قبلی قرار دارد (فلش). تاکی کاردی دهلیزی؛ فلوتر دهلیزی با بلوک AV 4:1. و فیبریلاسیون دهلیزی با سرعت بطنی کاملا نامنظم. سرنخ های مورد استفاده برای ثبت فعالیت الکتریکی در هر ردیابی مشخص شده اند. AV، دهلیزی بطنی. (ردیابی با اجازه Goldschlager N، Goldman MJ: Principles of Clinical Electrocardiography، ویرایش سیزدهم تکثیر شد. در ابتدا توسط Appleton & Lange منتشر شد. حق چاپ © ۱۹۸۹ توسط McGraw-Hill.)
Atrial tachycardia occurs when an atrial focus discharges regularly or there is reentrant activity producing atrial rates up to 220/min. Sometimes, especially in digitalized patients, some degree of atrioventricular block is associated with the tachycardia (paroxysmal atrial tachycardia with block).
تاکی کاردی دهلیزی زمانی اتفاق میافتد که کانون دهلیزی به طور منظم تخلیه میشود یا فعالیت مجددی وجود دارد که نرخ دهلیزی را تا ۲۲۰ در دقیقه ایجاد میکند. گاهی اوقات، به خصوص در بیماران دیجیتالی شده، درجاتی از بلوک دهلیزی با تاکی کاردی همراه است (تاکی کاردی دهلیزی پراکسیسمال همراه با بلوک).
In atrial flutter, the atrial rate is 200-350/min (Figure 29-13). In the most common form of this arrhythmia, there is large counterclockwise circus movement in the right atrium. This produces a characteristic sawtooth pattern of flutter waves due to atrial contractions. It is almost always associated with 2:1 or greater AV block, because in adults the AV node cannot conduct more than about 230 impulses per minute.
در فلوتر دهلیزی، سرعت دهلیزی ۲۰۰-۳۵۰ در دقیقه است (شکل ۲۹-۱۳). در شایع ترین شکل این آریتمی، حرکت سیرک بزرگ در جهت خلاف جهت عقربه های ساعت در دهلیز راست وجود دارد. این یک الگوی مشخصه دندان اره ای از امواج فلاتر به دلیل انقباضات دهلیزی ایجاد می کند. تقریباً همیشه با بلوک AV 2: 1 یا بیشتر همراه است، زیرا در بزرگسالان گره AV نمی تواند بیش از ۲۳۰ ایمپالس در دقیقه انجام دهد.
In atrial fibrillation, the atria beat very rapidly (300-500/min) in a completely irregular and disorganized fashion. Because the AV node discharges at irregular intervals, the ventricles also beat at a completely irregular rate, usually 80-160/min (Figure 29-13). The condition can be paroxysmal or chronic, and in some cases there appears to be a genetic predisposition. The cause of atrial fibrillation is still a matter of debate, but in most cases it appears to be due to multiple concurrently circulating reentrant excitation waves in both atria. However, some cases of paroxysmal atrial fibrillation seem to be produced by discharge of one or more ectopic foci. Many of these foci appear to be located in the pulmonary veins as much as 4 cm from the heart. Atrial muscle fibers extend along the pulmonary veins and are the origin of these discharges.
در فیبریلاسیون دهلیزی، دهلیزها بسیار سریع (۳۰۰-۵۰۰ در دقیقه) به صورت کاملاً نامنظم و نامنظم می زند. از آنجا که گره AV در فواصل نامنظم تخلیه می شود، بطن ها نیز با سرعتی کاملا نامنظم، معمولاً ۸۰-۱۶۰ در دقیقه (شکل ۲۹-۱۳) می تپند. این بیماری می تواند حمله ای یا مزمن باشد و در برخی موارد به نظر می رسد که یک استعداد ژنتیکی وجود دارد. علت فیبریلاسیون دهلیزی هنوز محل بحث است، اما در بیشتر موارد به نظر می رسد که به دلیل چندین موج تحریک مجدد همزمان در هر دو دهلیز باشد. با این حال، برخی از موارد فیبریلاسیون دهلیزی حمله ای به نظر می رسد با تخلیه یک یا چند کانون نابجا ایجاد می شود. به نظر می رسد بسیاری از این کانون ها در وریدهای ریوی تا ۴ سانتی متری قلب قرار دارند. فیبرهای عضلانی دهلیزی در امتداد وریدهای ریوی گسترش یافته و منشا این ترشحات هستند.
CONSEQUENCES OF ATRIAL ARRHYTHMIAS
Occasional atrial extrasystoles occur from time to time in most normal humans and have no pathological significance. In paroxysmal atrial tachycardia and flutter, the ventricular rate may be so high that diastole is too short for adequate filling of the ventricles with blood between contractions. Consequently, cardiac output is reduced and symptoms of heart failure appear. Heart failure may also complicate atrial fibrillation when the ventricular rate is high. Acetylcholine liberated at vagal endings depresses conduction in the atrial musculature and AV node. This is why stimulating reflex vagal discharge by pressing on the eyeball (oculocardiac reflex) or massaging the carotid sinus often converts tachycardia and sometimes converts atrial flutter to normal sinus rhythm. Alternatively, vagal stimulation increases the degree of AV block, abruptly lowering the ventricular rate. Digitalis also depresses AV conduction and is used to lower a rapid ventricular rate in atrial fibrillation.
پیامدهای آریتمی دهلیزی
اکستراسیستول های دهلیزی گاه به گاه در اکثر انسان های طبیعی رخ می دهد و هیچ اهمیت پاتولوژیکی ندارد. در تاکی کاردی و فلوتر دهلیزی حملهای، سرعت بطنی ممکن است آنقدر زیاد باشد که دیاستول برای پر شدن کافی بطنها با خون بین انقباضات بسیار کوتاه باشد. در نتیجه، برون ده قلبی کاهش می یابد و علائم نارسایی قلبی ظاهر می شود. نارسایی قلبی همچنین ممکن است فیبریلاسیون دهلیزی را در زمانی که ضربان بطنی بالا است، پیچیده کند. استیل کولین آزاد شده در انتهای واگ هدایت را در عضله دهلیزی و گره AV کاهش می دهد. به همین دلیل است که تحریک ترشحات واگ رفلکس با فشار دادن روی کره چشم (رفلکس چشمی) یا ماساژ سینوس کاروتید اغلب تاکی کاردی را تبدیل می کند و گاهی اوقات فلوتر دهلیزی را به ریتم سینوسی طبیعی تبدیل می کند. از طرف دیگر، تحریک واگ درجه بلوک AV را افزایش می دهد و به طور ناگهانی سرعت بطنی را کاهش می دهد. Digitalis همچنین هدایت AV را کاهش می دهد و برای کاهش سرعت بطنی سریع در فیبریلاسیون دهلیزی استفاده می شود.
VENTRICULAR ARRHYTHMIAS
Premature beats that originate in an ectopic ventricular focus usually have bizarrely shaped prolonged QRS complexes (Figure 29-14) because of the slow spread of the impulse from the focus through the ventricular muscle to the rest of the ventricle. They are usually incapable of exciting the bundle of His, and retrograde conduction to the atria therefore does not occur. In the meantime, the next succeeding normal SA nodal impulse depolarizes the atria. The P wave is usually buried in the QRS of the extrasystole. If the normal impulse reaches the ventricles, they are still in the refractory period following depolarization from the ectopic focus.
آریتمی های بطنی
ضربانهای زودرس که از کانون بطن نابجا منشأ میگیرند معمولاً دارای کمپلکسهای طولانی QRS با شکل عجیب و غریب هستند (شکل ۲۹-۱۴) به دلیل انتشار آهسته تکانه از کانون از طریق عضله بطنی به بقیه بطن. آنها معمولاً قادر به برانگیختن دسته هیس نیستند و بنابراین هدایت رتروگراد به دهلیزها رخ نمی دهد. در این بین، ضربه گرهی SA نرمال بعدی بعدی دهلیزها را دپلاریزه می کند. موج P معمولاً در QRS اکستراسیستول مدفون می شود. اگر تکانه طبیعی به بطن ها برسد، آنها هنوز در دوره نسوز به دنبال دپلاریزاسیون از کانون خارج رحمی هستند.

FIGURE 29-14 Top: Ventricular premature beats (VPB). The lines under the tracing illustrate the compensatory pause and show that the duration of the premature beat plus the preceding normal beat is equal to the duration of two normal beats. Bottom: Ventricular tachycardia.
شکل ۲۹-۱۴ بالا: ضربان زودرس بطنی (VPB). خطوط زیر ردیابی مکث جبرانی را نشان می دهد و نشان می دهد که مدت ضربان زودرس به اضافه ضربان عادی قبلی برابر است با مدت زمان دو ضربان عادی. پایین: تاکی کاردی بطنی.
However, the second succeeding impulse from the SA node produces a normal beat. Thus, ventricular premature beats are followed by a compensatory pause that is often longer than the pause after an atrial extrasystole.
با این حال، دومین ضربه متوالی از گره SA یک ضربان عادی تولید می کند. بنابراین، ضربانهای زودرس بطنی با یک مکث جبرانی که اغلب طولانیتر از مکث پس از اکستراسیستول دهلیزی است، دنبال میشود.
Furthermore, ventricular premature beats do not interrupt the regular discharge of the SA node, whereas atrial premature beats often interrupt and “reset” the normal rhythm.
علاوه بر این، ضربانهای زودرس بطنی ترشح منظم گره SA را قطع نمیکنند، در حالی که ضربانهای زودرس دهلیزی اغلب ریتم طبیعی را قطع کرده و “بازنشانی” میکنند.
Atrial and ventricular premature beats are not strong enough to produce a pulse at the wrist if they occur early in diastole, when the ventricles have not had time to fill with blood and the ventricular musculature is still in its relatively refractory period. They may not even open the aortic and pulmonary valves, in which case there is, in addition, no second heart sound.
ضربانهای زودرس دهلیزی و بطنی در صورتی که در اوایل دیاستول رخ دهند، زمانی که بطنها زمان پر شدن از خون را ندارند و ماهیچههای بطنی هنوز در دوره نسبتاً مقاوم خود هستند، آنقدر قوی نیستند که نبض را در مچ ایجاد کنند. آنها حتی ممکن است دریچه های آئورت و ریوی را باز نکنند، در این صورت، علاوه بر این، صدای قلب دوم وجود ندارد.
Paroxysmal ventricular tachycardia (Figure 29-14) is in effect a series of rapid, regular ventricular depolarizations usually due to a circus movement involving the ventricles. Torsades de pointes is a form of ventricular tachycardia in which the QRS morphology varies (Figure 29-15). Tachycardias originating above the ventricles (supraventricular tachycardias such as paroxysmal nodal tachycardia) can be distinguished from paroxysmal ventricular tachycardia by use of the HBE; in supraventricular tachycardias, a His bundle H deflection is present, whereas in ventricular tachycardias, there is none. Ventricular premature beats are not uncommon and, in the absence of ischemic heart disease, usually benign. Ventricular tachycardia is more serious because cardiac output is decreased, and ventricular fibrillation is an occasional complication of ventricular tachycardia.
تاکی کاردی بطنی حمله ای (شکل ۲۹-۱۴) در واقع یک سری دپلاریزاسیون های سریع و منظم بطنی است که معمولاً به دلیل یک حرکت سیرک درگیر بطن ها است. Torsades de pointes شکلی از تاکی کاردی بطنی است که در آن مورفولوژی QRS متفاوت است (شکل ۲۹-۱۵). تاکی کاردی هایی که از بالای بطن ها منشا می گیرند (تاکی کاردی های فوق بطنی مانند تاکی کاردی گرهی حمله ای) را می توان با استفاده از HBE از تاکی کاردی بطنی حمله ای متمایز کرد. در تاکی کاردی های فوق بطنی، انحراف H باندل هیس وجود دارد، در حالی که در تاکی کاردی های بطنی، هیچ وجود ندارد. ضربان زودرس بطنی غیر معمول نیست و در غیاب بیماری ایسکمیک قلب، معمولاً خوش خیم است. تاکی کاردی بطنی جدی تر است زیرا برون ده قلبی کاهش می یابد و فیبریلاسیون بطنی یکی از عوارض گاه به گاه تاکی کاردی بطنی است.

FIGURE 29-15 Record obtained from an implanted cardioverter- defibrillator in a 12-year-old boy with congenital long QT syndrome who collapsed while answering a question in school. Top: Normal sinus rhythm with long QT interval. Middle: Torsades de pointes. Bottom: Ventricular fibrillation with discharge of defibrillator, as programmed 7.5 s after the start of ventricular tachycardia, converting the heart to normal sinus rhythm. The boy recovered consciousness in 2 min and had no neurologic sequelae. (Reproduced with permission from Moss AJ, Daubert JP: Images in clinical medicine. Internal ventricular fibrillation. N Engl J Med 2000;342:398.)
شکل ۲۹-۱۵ رکورد به دست آمده از یک دفیبریلاتور کاردیوورتر کاشته شده در یک پسر ۱۲ ساله با سندرم مادرزادی QT طولانی که هنگام پاسخ دادن به یک سوال در مدرسه سقوط کرد. بالا: ریتم سینوسی طبیعی با فاصله QT طولانی. میانه: Torsades de pointes. پایین: فیبریلاسیون بطنی با تخلیه دفیبریلاتور، همانطور که ۷.۵ ثانیه پس از شروع تاکی کاردی بطنی برنامه ریزی شده است، قلب را به ریتم سینوسی طبیعی تبدیل می کند. پسر در ۲ دقیقه به هوش آمد و هیچ عارضه عصبی نداشت. (تکثیر شده با اجازه Moss AJ، Daubert JP: تصاویر در پزشکی بالینی. فیبریلاسیون بطنی داخلی. N Engl J Med 2000; 342:398.)
In ventricular fibrillation (Figure 29-15), the ventricular muscle fibers contract in a totally irregular and ineffective way because of the very rapid discharge of multiple ventricular ectopic foci or a circus movement. The fibrillating ventricles, like the fibrillating atria, look like a quivering “bag of worms.” Ventricular fibrillation can be produced by an electric shock or an extrasystole during a critical interval, the vulnerable period. The vulnerable period coincides in time with the midportion of the T wave; that is, it occurs at a time when some of the ventricular myocardium is depolarized, some is incompletely repolarized, and some is completely repolarized. These are excellent conditions in which to establish reentry and a circus movement. The fibrillating ventricles cannot pump blood effectively, and circulation of the blood stops. Therefore, in the absence of emergency treatment, ventricular fibrillation that lasts more than a few minutes is fatal. The most frequent cause of sudden death in patients with myocardial infarcts is ventricular fibrillation.
در فیبریلاسیون بطنی (شکل ۲۹-۱۵)، فیبرهای عضلانی بطنی به روشی کاملاً نامنظم و بی اثر منقبض می شوند، زیرا به دلیل تخلیه بسیار سریع کانون های نابجای متعدد بطنی یا حرکت سیرک می باشد. بطن های فیبریلاسیون مانند دهلیزهای فیبریلاسیون مانند یک “کیسه کرم” لرزان به نظر می رسند. فیبریلاسیون بطنی می تواند توسط شوک الکتریکی یا اکستراسیستول در یک بازه زمانی بحرانی، یعنی دوره آسیب پذیر، ایجاد شود. دوره آسیب پذیر از نظر زمانی با قسمت میانی موج T همزمان است. یعنی زمانی رخ می دهد که بخشی از میوکارد بطنی دپلاریزه شده، برخی به طور ناقص رپلاریزه شده و برخی کاملاً رپلاریزه شده است. اینها شرایط عالی برای برقراری ورود مجدد و یک جنبش سیرک هستند. بطن های فیبریلاسیون نمی توانند خون را به طور موثر پمپاژ کنند و گردش خون متوقف می شود. بنابراین، در صورت عدم درمان اورژانسی، فیبریلاسیون بطنی که بیش از چند دقیقه طول بکشد، کشنده است. شایع ترین علت مرگ ناگهانی در بیماران مبتلا به انفارکتوس میوکارد فیبریلاسیون بطنی است.
LONG QT SYNDROME
An indication of vulnerability of the heart during repolarization is the fact that in patients in whom the QT interval is prolonged, cardiac repolarization is irregular and the incidence of ventricular arrhythmias and sudden death increases. The syndrome can be caused by a number of different drugs, by electrolyte abnormalities, and by myocardial ischemia. It can also be congenital. Mutations of eight different genes have been reported to cause the syndrome. Six cause reduced function of various K+ channels by alterations in their structure; one inhibits a K+ channel by reducing the amount of the ankyrin isoform that links it to the cytoskeleton; and one increases the function of the cardiac Na+ channel. Long QT syndrome is discussed in Clinical Box 5-5.
سندرم QT طولانی
نشانه آسیب پذیری قلب در حین رپلاریزاسیون این واقعیت است که در بیمارانی که فاصله QT طولانی شده است، رپلاریزاسیون قلبی نامنظم است و بروز آریتمی های بطنی و مرگ ناگهانی افزایش می یابد. این سندرم می تواند توسط تعدادی از داروهای مختلف، ناهنجاری های الکترولیتی و ایسکمی میوکارد ایجاد شود. همچنین می تواند مادرزادی باشد. جهش هشت ژن مختلف باعث ایجاد این سندرم گزارش شده است. شش مورد باعث کاهش عملکرد کانال های مختلف +K با تغییر در ساختار آنها می شود. یک کانال +K را با کاهش مقدار ایزوفرم ankyrin که آن را به اسکلت سلولی متصل می کند، مهار می کند. و یکی عملکرد کانال +Na قلب را افزایش می دهد. سندرم QT طولانی در جعبه بالینی ۵-۵ مورد بحث قرار گرفته است.
ACCELERATED AV CONDUCTION
An interesting condition seen in some otherwise normal individuals who are prone to attacks of paroxysmal atrial arrhythmias is accelerated AV conduction (Wolff-Parkinson-White syndrome). Normally, the only conducting pathway between the atria and the ventricles is the AV node. Individuals with Wolff- Parkinson-White syndrome have an additional aberrant muscular or nodal tissue connection (bundle of Kent) between the atria and ventricles. This conducts more rapidly than the slowly conducting AV node, and one ventricle is excited early. The manifestations of its activation merge with the normal QRS pattern, producing a short PR interval and a prolonged QRS deflection slurred on the upstroke (Figure 29-16), with a normal interval between the start of the P wave and the end of the QRS complex (“PJ interval”). The paroxysmal atrial tachycardias seen in this syndrome often follow an atrial premature beat. This beat conducts normally down the AV node but spreads to the ventricular end of the aberrant bundle, and the impulse is transmitted retrograde to the atrium. A circus movement is thus established. Less commonly, an atrial premature beat finds the AV node refractory but reaches the ventricles via the bundle of Kent, setting up a circus movement in which the impulse passes from the ventricles to the atria via the AV node.
هدایت AV تسریع شده
یک وضعیت جالب که در برخی از افراد عادی که مستعد حملات آریتمی های دهلیزی حمله ای هستند مشاهده می شود، انتقال سریع AV (سندرم ولف پارکینسون وایت) است. به طور معمول، تنها مسیر هدایت بین دهلیز و بطن، گره AV است. افراد مبتلا به سندرم ولف پارکینسون وایت دارای یک اتصال عضلانی یا گرهی نابجای اضافی (بسته ای از کنت) بین دهلیزها و بطن ها هستند. این گره سریعتر از گره AV با کندی هدایت می شود و یک بطن زود تحریک می شود. تظاهرات فعالسازی آن با الگوی QRS معمولی ادغام میشود، و یک فاصله PR کوتاه و یک انحراف طولانیمدت QRS ایجاد میکند که در بالارفتن فاصله ایجاد میکند (شکل ۲۹-۱۶)، با یک فاصله طبیعی بین شروع موج P و انتهای کمپلکس QRS (“فاصله PJ”). تاکی کاردی دهلیزی حمله ای که در این سندرم مشاهده می شود، اغلب به دنبال ضربان زودرس دهلیزی است. این ضربان به طور معمول به سمت پایین گره AV هدایت می شود، اما به انتهای بطنی بسته ناهنجار گسترش می یابد و ضربه به صورت رتروگراد به دهلیز منتقل می شود. بنابراین یک جنبش سیرک ایجاد می شود. معمولاً، ضربان زودرس دهلیزی، گره AV را مقاوم میبیند، اما از طریق بسته کنت به بطنها میرسد و یک حرکت سیرک ایجاد میکند که در آن ضربه از طریق گره AV از بطنها به دهلیزها میرسد.

FIGURE 29-16 Accelerated AV conduction. Top: Normal sinus beat. Middle: Short PR interval; wide, slurred QRS complex; normal PJ interval (Wolff- Parkinson-White syndrome). Bottom: Short PR interval, normal QRS complex (Lown-Ganong-Levine syndrome). (Reproduced with permission from Goldschlager N, Goldman MJ: Principles of Clinical Electrocardiography, 13th ed. Originally published by Appleton & Lange. Copyright © ۱۹۸۹ by McGraw- Hill.)
شکل ۲۹-۱۶ هدایت AV تسریع شده. بالا: ضربان سینوس طبیعی. وسط: فاصله روابط عمومی کوتاه. کمپلکس QRS گسترده و نامفهوم؛ فاصله PJ طبیعی (سندرم ولف پارکینسون وایت). پایین: فاصله کوتاه PR، کمپلکس QRS طبیعی (سندرم Lown-Ganong-Levine). (تکثیر شده با اجازه Goldschlager N، Goldman MJ: Principles of Clinical Electrocardiography، ed 13th. در اصل توسط Appleton & Lange منتشر شده است. حق چاپ © ۱۹۸۹ توسط McGraw-Hill.)
In some instances, the Wolff-Parkinson-White syndrome is familial. In two such families, there is a mutation in a gene that codes for an AMP-activated protein kinase. Presumably, this kinase is normally involved in suppressing abnormal atrioventricular pathways during fetal development.
در برخی موارد، سندرم ولف پارکینسون وایت خانوادگی است. در دو خانواده از این قبیل، یک جهش در ژنی وجود دارد که یک پروتئین کیناز فعال شده با AMP را کد می کند. احتمالاً این کیناز معمولاً در سرکوب مسیرهای دهلیزی غیر طبیعی در طول رشد جنین نقش دارد.
Attacks of paroxysmal supraventricular tachycardia, usually nodal tachycardia, are seen in individuals with short PR intervals and normal QRS complexes (Lown-Ganong-Levine syndrome). In this condition, depolarization presumably passes from the atria to the ventricles via an aberrant bundle that bypasses the AV node but enters the intraventricular conducting system distal to the node.
حملات تاکی کاردی فوق بطنی حمله ای، معمولا تاکی کاردی گرهی، در افراد با فواصل PR کوتاه و کمپلکس های QRS طبیعی (سندرم لوون-گانونگ-لوین) دیده می شود. در این شرایط، دپلاریزاسیون احتمالاً از دهلیزها به بطن ها از طریق یک بسته نابجا می گذرد که گره AV را دور می زند اما وارد سیستم رسانای داخل بطنی دیستال گره می شود.
TREATMENTS FOR ARRHYTHMIAS
Many different drugs used in the treatment of arrhythmias slow conduction in the conduction system and the myocardium. This depresses ectopic activity and reduces the discrepancy between normal and reentrant paths so that reentry does not occur. Drugs that target Na+ channels (eg, quinidine) can slow INa and prolong refractoriness (eg, quinidine, disopy-ramide), decrease Ina with minimal prolongation of refractoriness (eg, flecainide, propafenone) or shorten refractoriness in depolarized cells (eg, lidocaine, mexiletine). Drugs that target K+ channels can prolong refractoriness (eg, amiodarone, sotalol, dofetilide). Drugs that block L-type voltage-gated Ca2+ channels can slow SA pacemaker and AV conduction (eg, nifedipine, verapamil, diltiazem). Finally, drugs that block ß-adrenergic receptors thus reduce the activation of Ical (eg, propanolol, metoprolol). Interestingly, it has become clear that in some patients any of these drugs can be proarrhythmic rather than antiarrhythmic-that is, they can also cause various arrhythmias. Therefore, careful monitoring and alternative procedures are extremely important when using antiarrhythmic drugs.
درمان های آریتمی
بسیاری از داروهای مختلف در درمان آریتمی استفاده می شود که هدایت کند در سیستم هدایت و میوکارد. این امر فعالیت نابجا را کاهش می دهد و اختلاف بین مسیرهای طبیعی و ورودی مجدد را کاهش می دهد به طوری که ورود مجدد رخ نمی دهد. داروهایی که کانالهای +Na را هدف قرار میدهند (مثلا کینیدین) میتوانند INa را کاهش داده و نسوز را طولانیتر کنند (مانند کینیدین، دیسوپی رامید)، اینا را با حداقل طولانیتر شدن نسوز (مانند فلکائینید، پروپافنون) کاهش دهند یا مقاومت سلولهای دپلاریزه را کوتاه کنند (مثلا لیدوکائین، مکسیلت). داروهایی که کانالهای +K را هدف قرار میدهند میتوانند مقاومسازی را طولانیتر کنند (مانند آمیودارون، سوتالول، دوفتیلید). داروهایی که کانالهای +Ca۲ دارای ولتاژ نوع L را مسدود میکنند، میتوانند سرعت ساز SA و هدایت AV را کاهش دهند (مانند نیفدیپین، وراپامیل، دیلتیازم). در نهایت، داروهایی که گیرنده های β-آدرنرژیک را مسدود می کنند، بنابراین فعال شدن Ical را کاهش می دهند (مثلاً پروپانولول، متوپرولول). جالب اینجاست که مشخص شده است که در برخی از بیماران هر یک از این داروها می تواند به جای ضد آریتمی، پرو آریتمی باشد، یعنی می تواند باعث ایجاد آریتمی های مختلف نیز شود. بنابراین، هنگام استفاده از داروهای ضد آریتمی، نظارت دقیق و روش های جایگزین بسیار مهم است.
An alternative treatment is radiofrequency catheter ablation of reentrant pathways. Catheters with electrodes at the tip can be inserted into the chambers of the heart and its environs and used to map the exact location of an ectopic focus or accessory bundle responsible for the production of reentry and supraventricular tachycardia. The pathway can then be ablated by passing radiofrequency current with the catheter tip placed close to the bundle or focus. In skilled hands, this form of treatment can be very effective and is associated with few complications. It is particularly useful in conditions that cause supraventricular tachycardias, including Wolff-Parkinson-White syndrome and atrial flutter. It has also been used with success to ablate foci in the pulmonary veins causing paroxysmal atrial fibrillation.
یک درمان جایگزین، فرسایش کاتتر با فرکانس رادیویی مسیرهای ورودی مجدد است. کاتترهایی با الکترود در نوک آن را میتوان در حفرههای قلب و اطراف آن قرار داد و برای نقشهبرداری از محل دقیق فوکوس نابجا یا بسته جانبی که مسئول تولید تاکی کاردی مجدد و فوق بطنی است، استفاده کرد. سپس مسیر را می توان با عبور جریان فرکانس رادیویی با نوک کاتتر نزدیک به بسته یا فوکوس قطع کرد. در دستان ماهر، این شکل از درمان می تواند بسیار موثر باشد و با عوارض کمی همراه است. به ویژه در شرایطی که باعث تاکی کاردی فوق بطنی می شود، از جمله سندرم ولف پارکینسون وایت و فلاتر دهلیزی مفید است. همچنین با موفقیت برای از بین بردن کانونهایی در وریدهای ریوی که باعث فیبریلاسیون دهلیزی حملهای میشوند، استفاده شده است.
ELECTROCARDIOGRAPHIC FINDINGS IN OTHER CARDIAC & SYSTEMIC DISEASES
MYOCARDIAL INFARCTION
When the blood supply to part of the myocardium is interrupted, profound changes take place in the myocardium that lead to irreversible changes and death of muscle cells. The ECG is very useful for diagnosing ischemia and locating areas of infarction. The underlying electrical events and the resulting electrocardiographic changes are complex, and only a brief review can be presented here.
یافته های الکتروکاردیوگرافی در سایر بیماری های قلبی و سیستمی
انفارکتوس میوکارد
هنگامی که خون رسانی به بخشی از میوکارد قطع می شود، تغییرات عمیقی در میوکارد ایجاد می شود که منجر به تغییرات برگشت ناپذیر و مرگ سلول های عضلانی می شود. ECG برای تشخیص ایسکمی و مکان یابی مناطق انفارکتوس بسیار مفید است. رویدادهای الکتریکی زمینه ای و تغییرات الکتروکاردیوگرافی ناشی از آن پیچیده هستند و فقط می توان یک بررسی کوتاه در اینجا ارائه کرد.
The three major abnormalities that cause electrocardiographic changes in acute myocardial infarction are summarized in Table 29-3. The first change— abnormally rapid repolarization after discharge of the infarcted muscle fibers as a result of accelerated opening of K+ channels-develops seconds after occlusion of a coronary artery in experimental animals. It lasts only a few minutes, but before it is over the resting membrane potential of the infarcted fibers declines because of the loss of intracellular K. Starting about 30 min later, the infarcted fibers also begin to depolarize more slowly than the surrounding normal fibers.
سه ناهنجاری عمده که باعث تغییرات الکتروکاردیوگرافی در انفارکتوس حاد میوکارد می شوند در جدول ۲۹-۳ خلاصه شده است. اولین تغییر – رپلاریزاسیون سریع غیرعادی پس از تخلیه فیبرهای عضلانی انفارکتوس شده در نتیجه باز شدن سریع کانال های +K – چند ثانیه پس از انسداد شریان کرونر در حیوانات آزمایشگاهی ایجاد می شود. این تنها چند دقیقه طول می کشد، اما قبل از پایان آن، پتانسیل غشای استراحت الیاف انفارکتوس به دلیل از دست دادن K داخل سلولی کاهش می یابد. با شروع حدود ۳۰ دقیقه بعد، الیاف انفارکتوس نیز شروع به دپلاریزاسیون کندتر از الیاف طبیعی اطراف می کنند.
TABLE 29-3 Summary of the three major abnormalities of membrane polarization associated with acute myocardial infarction.
جدول ۲۹-۳ خلاصه ای از سه ناهنجاری اصلی پلاریزاسیون غشاء مرتبط با انفارکتوس حاد میوکارد.

All three of these changes cause current flow that produces elevation of the ST segment in electrocardiographic leads recorded with electrodes over the infarcted area (Figure 29-17). Because of the rapid repolarization in the infarct, the membrane potential of the area is greater than it is in the normal area during the latter part of repolarization, making the normal region negative relative to the infarct. Extracellularly, current therefore flows out of the infarct into the normal area (since, by convention, current flow is from positive to negative). This current flows toward electrodes over the injured area, causing increased positivity between the S and T waves of the ECG. Similarly, the delayed depolarization of the infarcted cells causes the infarcted area to be positive relative to the healthy tissue (Table 29-3) during the early part of repolarization, and the result is also ST segment elevation. The remaining change the decline in resting membrane potential during diastole causes a current flow into the infarct during ventricular diastole. The result of this current flow is a depression of the TQ segment of the ECG. However, the electronic arrangement in electrocardiographic recorders is such that a TQ segment depression is recorded as an ST segment elevation. Thus, the hallmark of acute myocardial infarction is elevation of the ST segments in the leads overlying the area of infarction (Figure 29-17). Leads on the opposite side of the heart show ST segment depression.
هر سه این تغییرات باعث ایجاد جریان جریان می شود که باعث افزایش قطعه ST در لیدهای الکتروکاردیوگرافی ثبت شده با الکترودها در ناحیه انفارکتوس شده می شود (شکل ۲۹-۱۷). به دلیل رپلاریزاسیون سریع در انفارکتوس، پتانسیل غشایی ناحیه در طول آخرین مرحله رپلاریزاسیون بیشتر از ناحیه طبیعی است و ناحیه نرمال را نسبت به انفارکتوس منفی می کند. بنابراین، جریان خارج سلولی از انفارکتوس به ناحیه نرمال می ریزد (زیرا طبق قرارداد، جریان جریان از مثبت به منفی است). این جریان به سمت الکترودها در ناحیه آسیب دیده جریان می یابد و باعث افزایش مثبت بین امواج S و T ECG می شود. به طور مشابه، دپلاریزاسیون تاخیری سلول های انفارکتوس باعث می شود که ناحیه انفارکتوس نسبت به بافت سالم مثبت شود (جدول ۲۹-۳) در اوایل رپلاریزاسیون، و نتیجه نیز بالا رفتن قطعه ST است. تغییر باقیمانده کاهش پتانسیل غشای در حال استراحت در طول دیاستول باعث جریانی به داخل انفارکتوس در طول دیاستول بطنی می شود. نتیجه این جریان، فرورفتگی بخش TQ ECG است. با این حال، آرایش الکترونیکی در ضبط کننده های الکتروکاردیوگرافی به گونه ای است که فرورفتگی قطعه TQ به عنوان ارتفاع قطعه ST ثبت می شود. بنابراین، مشخصه انفارکتوس حاد میوکارد، بالا رفتن قطعات ST در لیدهای پوشاننده ناحیه انفارکتوس است (شکل ۲۹-۱۷). سرنخ های طرف مقابل قلب، افسردگی بخش ST را نشان می دهد.

FIGURE 29-17 Diagrammatic illustration of serial electrocardiographic patterns in anterior infarction. A) Normal tracing. B) Very early pattern (hours after infarction): ST segment elevation in I, aVL, and V3-6; reciprocal ST depression in II, III, and aVF. C) Later pattern (many hours to a few days): Q waves have appeared in I, aVL, and V5-6. QS complexes are present in V3-4. This indicates that the major transmural infarction is underlying the area recorded by V3-4; ST segment changes persist but are of lesser degree, and the T waves are beginning to invert in the leads in which the ST segments are elevated. D) Late established pattern (many days to weeks): The Q waves and QS complexes persist, the ST segments are isoelectric, and the T waves are symmetric and deeply inverted in leads that had ST elevation and tall in leads that had ST depression. This pattern may persist for the remainder of the patient’s life. E) Very late pattern: This may occur many months to years after the infarction. The abnormal Q waves and QS complexes persist. The T waves have gradually returned to normal. (Reproduced with permission from Goldschlager N, Goldman MJ: Principles of Clinical Electrocardiography, 13th ed. Originally published by Appleton & Lange. Copyright © ۱۹۸۹ by McGraw- Hill.)
شکل ۲۹-۱۷ تصویر نموداری از الگوهای الکتروکاردیوگرافی سریال در انفارکتوس قدامی. الف) ردیابی عادی. ب) الگوی بسیار زودرس (ساعتها پس از انفارکتوس): ارتفاع قطعه ST در I، aVL و V3-6. افسردگی متقابل ST در II، III و aVF. ج) الگوی بعدی (از چند ساعت تا چند روز): امواج Q در I، aVL و V5-6 ظاهر شده اند. کمپلکس های QS در V3-4 وجود دارند. این نشان می دهد که انفارکتوس بزرگ ترانس مورال در زیر ناحیه ثبت شده توسط V3-4 است. تغییرات بخش ST همچنان ادامه دارد اما درجه کمتری دارد و امواج T در لیدهایی که در آن بخش های ST بالا می روند معکوس می شوند. د) الگوی ایجاد شده دیرهنگام (از چند روز تا چند هفته): امواج Q و کمپلکس های QS باقی می مانند، بخش های ST ایزوالکتریک هستند و امواج T در لیدهایی که دارای ارتفاع ST و بلند هستند در لیدهایی که دارای فرورفتگی ST هستند متقارن و عمیقا معکوس هستند. این الگو ممکن است تا پایان عمر بیمار باقی بماند. ه) الگوی بسیار دیرهنگام: این ممکن است چندین ماه تا سال بعد از انفارکتوس رخ دهد. امواج Q غیرطبیعی و کمپلکس های QS باقی می مانند. امواج T به تدریج به حالت عادی بازگشته است. (تکثیر شده با اجازه Goldschlager N، Goldman MJ: Principles of Clinical Electrocardiography، ed 13th. در اصل توسط Appleton & Lange منتشر شده است. حق چاپ © ۱۹۸۹ توسط McGraw-Hill.)
After some days or weeks, the ST segment abnormalities subside. The dead muscle and scar tissue become electrically silent. The infarcted area is therefore negative relative to the normal myocardium during systole, and it fails to contribute its share of positivity to the electrocardiographic complexes. The manifestations of this negativity are multiple and subtle. Common changes include the appearance of a Q wave in some of the leads in which it was not previously present and an increase in the size of the normal Q wave in some of the other leads, although so-called non-Q-wave infarcts are also seen. These latter infarcts tend to be less severe, but there is a high incidence of subsequent reinfarction. Another finding in infarction of the anterior left ventricle is “failure of progression of the R wave;” that is, the R wave fails to become successively larger in the precordial leads as the electrode is moved from right to left over the left ventricle. If the septum is infarcted, the conduction system may be damaged, causing bundle branch block or other forms of heart block.
پس از چند روز یا چند هفته، ناهنجاری های قطعه ST فروکش می کند. ماهیچه مرده و بافت اسکار از نظر الکتریکی ساکت می شوند. بنابراین، ناحیه انفارکتوس نسبت به میوکارد طبیعی در طول سیستول منفی است و نمی تواند سهم مثبت خود را در مجتمع های الکتروکاردیوگرافی کمک کند. جلوه های این منفی گرایی متعدد و ظریف است. تغییرات رایج عبارتند از ظهور موج Q در برخی از لیدها که قبلاً در آنها وجود نداشت و افزایش اندازه موج Q معمولی در برخی از لیدهای دیگر، اگرچه به اصطلاح انفارکت های غیر موج Q نیز دیده می شود. این انفارکتات دوم معمولاً شدت کمتری دارند، اما بروز انفارکتوس مجدد بعدی زیاد است. یافته دیگر در انفارکتوس قدامی بطن چپ “شکست پیشرفت موج R” است. به این معنا که موج R نمی تواند به طور متوالی در لیدهای پیش کوردیال بزرگتر شود زیرا الکترود از راست به چپ بر روی بطن چپ حرکت می کند. اگر سپتوم دچار انفارکتوس شده باشد، سیستم هدایت ممکن است آسیب ببیند و باعث بلوک شاخه ای یا سایر اشکال بلوک قلبی شود.
Myocardial infarctions are often complicated by serious ventricular arrhythmias, with the threat of ventricular fibrillation and death. In experimental animals, and presumably in humans, ventricular arrhythmias occur during three periods. During the first 30 min of an infarction, arrhythmias due to reentry are common. There follows a period relatively free from arrhythmias but, starting 12 h after infarction, arrhythmias occur as a result of increased automaticity. Arrhythmias occurring 3 days to several weeks after infarction are once again usually due to reentry. It is worth noting in this regard that infarcts that damage the epicardial portions of the myocardium interrupt sympathetic nerve fibers, producing denervation super-sensitivity to catecholamines in the area beyond the infarct. Alternatively, endocardial lesions can selectively interrupt vagal fibers, leaving the actions of sympathetic fibers unopposed.
انفارکتوس میوکارد اغلب با آریتمی های شدید بطنی همراه با تهدید فیبریلاسیون بطنی و مرگ پیچیده می شود. در حیوانات آزمایشگاهی و احتمالاً در انسان، آریتمی بطنی در طول سه دوره رخ می دهد. در طول ۳۰ دقیقه اول انفارکتوس، آریتمی های ناشی از ورود مجدد شایع است. پس از یک دوره نسبتاً عاری از آریتمی وجود دارد، اما با شروع ۱۲ ساعت پس از انفارکتوس، آریتمی در نتیجه افزایش خودکاری رخ می دهد. آریتمی هایی که ۳ روز تا چند هفته پس از انفارکتوس رخ می دهد، یک بار دیگر معمولاً به دلیل ورود مجدد است. در این رابطه شایان ذکر است که انفارکت هایی که به بخش های اپیکارد میوکارد آسیب می رسانند، رشته های عصبی سمپاتیک را قطع می کنند و باعث ایجاد حساسیت فوق العاده عصب به کاتکول آمین ها در ناحیه ماورای انفارکتوس می شوند. از طرف دیگر، ضایعات اندوکاردیال می توانند به طور انتخابی فیبرهای واگ را قطع کنند و فعالیت فیبرهای سمپاتیک را بدون مخالفت باقی بگذارند.
EFFECTS OF CHANGES IN THE IONIC COMPOSITION OF THE BLOOD
Changes in the Na* and K+ concentrations of the extracellular fluids would be expected to affect the potentials of the myocardial fibers because the electrical activity of the heart depends on the distribution of these ions across the muscle cell membranes. Clinically, a fall in the plasma level of Na+ may be associated with low-voltage electrocardiographic complexes, but changes in the plasma K+ level produce severe cardiac abnormalities. Hyperkalemia is a very dangerous and potentially lethal condition because of its effects on the heart. As the plasma K* level rises, the first change in the ECG is the appearance of tall peaked T waves, a manifestation of altered repolarization (Figure 29-18). At higher K+ levels, paralysis of the atria and prolongation of the QRS complexes occur. Ventricular arrhythmias may develop. The resting membrane potential of the muscle fibers decreases as the extracellular K+ concentration increases. The fibers eventually become unexcitable, and the heart stops in diastole. Conversely, a decrease in the plasma K+ level causes prolongation of the PR interval, prominent U waves, and, occasionally, late T wave inversion in the precardial leads. If the T and U waves merge, the apparent QT interval is often prolonged; if the T and U waves are separated, the true QT interval is seen to be of normal duration. Hypokalemia is a serious condition, but it is not as rapidly fatal as hyperkalemia.
اثرات تغییرات در ترکیب یونی خون
انتظار می رود تغییرات در غلظت +Na و +K مایعات خارج سلولی بر پتانسیل های فیبرهای میوکارد تأثیر بگذارد زیرا فعالیت الکتریکی قلب به توزیع این یون ها در غشای سلول های عضلانی بستگی دارد. از نظر بالینی، کاهش سطح پلاسمایی +Na ممکن است با کمپلکس های الکتروکاردیوگرافی ولتاژ پایین همراه باشد، اما تغییرات در سطح +K پلاسما باعث ناهنجاری های شدید قلبی می شود. هیپرکالمی یک بیماری بسیار خطرناک و بالقوه کشنده به دلیل اثرات آن بر قلب است. با افزایش سطح +K پلاسما، اولین تغییر در ECG، ظهور امواج T با اوج بلندی است، که تظاهری از تغییر رپلاریزاسیون است (شکل ۲۹-۱۸). در سطوح بالاتر +K، فلج دهلیزها و طولانی شدن کمپلکس های QRS رخ می دهد. ممکن است آریتمی بطنی ایجاد شود. پتانسیل غشای استراحت فیبرهای عضلانی با افزایش غلظت +K خارج سلولی کاهش می یابد. فیبرها در نهایت تحریک ناپذیر می شوند و قلب در دیاستول متوقف می شود. برعکس، کاهش سطح +K پلاسما باعث طولانی شدن فاصله PR، امواج U برجسته و گاهی وارونگی دیررس موج T در لیدهای پرکاردیال می شود. اگر امواج T و U ادغام شوند، فاصله QT ظاهری اغلب طولانی می شود. اگر امواج T و U از هم جدا شوند، فاصله QT واقعی مدت زمان طبیعی است. هیپوکالمی یک بیماری جدی است، اما به سرعت هیپرکالمی کشنده نیست.

FIGURE 29-18 Correlation of plasma K* level and the ECG, assuming that the plasma Ca2+ level is normal. The diagrammed complexes are left ventricular epicardial leads. ECG, electrocardiogram. (Reproduced with permission from Goldman MJ: Principles of Clinical Electrocardiography, 12th ed. Originally published by Appleton & Lange. Copyright © ۱۹۸۶ by McGraw- Hill.)
شکل ۲۹-۱۸ همبستگی سطح +K پلاسما و ECG، با فرض نرمال بودن سطح +Ca۲ پلاسما. کمپلکس های نمودار شده لیدهای اپی کاردیال بطن چپ هستند. نوار قلب، نوار قلب. (تکثیر شده با مجوز گلدمن ام جی: اصول الکتروکاردیوگرافی بالینی، ویرایش دوازدهم. در اصل توسط اپلتون و لانگ منتشر شده است. حق نشر © ۱۹۸۶ توسط مک گراو-هیل.)
Increases in extracellular Ca2+ concentration enhance myocardial contractility. When large amounts of Ca2+ are infused into experimental animals, the heart relaxes less during diastole and eventually stops in systole (calcium rigor). However, in clinical conditions associated with hypercalcemia, the plasma calcium level is rarely if ever high enough to affect the heart. Hypocalcemia causes prolongation of the ST segment and consequently of the QT interval, a change that is also produced by phenothiazines and tricyclic antidepressant drugs and by various diseases of the central nervous system.
افزایش غلظت +Ca۲ خارج سلولی باعث افزایش انقباض میوکارد می شود. هنگامی که مقادیر زیادی +Ca۲ به حیوانات آزمایشگاهی تزریق می شود، قلب در طول دیاستول کمتر شل می شود و در نهایت در سیستول (سخت کلسیم) متوقف می شود. با این حال، در شرایط بالینی مرتبط با هیپرکلسمی، سطح کلسیم پلاسما به ندرت به اندازه ای بالاست که بر قلب تأثیر بگذارد. هیپوکلسمی باعث طولانی شدن قطعه ST و در نتیجه فاصله QT می شود، تغییری که توسط فنوتیازین ها و داروهای ضد افسردگی سه حلقه ای و بیماری های مختلف سیستم عصبی مرکزی نیز ایجاد می شود.
CHAPTER SUMMARY
خلاصه فصل
• Contractions in the heart are controlled via a well-regulated electrical signaling cascade that originates in pacemaker cells in the sinoatrial (SA) node and is passed via internodal atrial pathways to the atrioventricular (AV) node, the bundle of His, the Purkinje system, and to all parts of the ventricle.
• انقباضات در قلب از طریق یک آبشار سیگنال الکتریکی تنظیم شده کنترل می شود که از سلول های ضربان ساز در گره سینوسی دهلیزی (SA) سرچشمه می گیرد و از طریق مسیرهای دهلیزی بین گره ای به گره دهلیزی (AV)، بسته His، سیستم پورکنژ و به تمام قسمت های بطن منتقل می شود.
• Most cardiac cells have an action potential that includes a rapid depolarization, an initial rapid repolarization, a plateau, and a slow repolarization process to return to resting potential. These changes are defined by sequential activation, inactivation and deactivation of Na*, Ca2+, and K+ channels.
• بیشتر سلول های قلبی دارای پتانسیل عمل هستند که شامل دپلاریزاسیون سریع، رپلاریزاسیون سریع اولیه، پلاتو و فرآیند رپلاریزاسیون آهسته برای بازگشت به پتانسیل استراحت است. این تغییرات با فعال سازی متوالی، غیرفعال و غیرفعال سازی کانال های +Na+، Ca۲ و +K تعریف می شوند.
• Compared to typical myocytes, pacemaker cells have a slightly different sequence of events. After repolarization to the resting potential, there is a slow depolarization that occurs due to a channel that can pass both Na* and K*. As this “funny” current continues to depolarize the cell the activation threshold of the voltage-gated Ca2+ channels, Ca2+ channels are activated to rapidly depolarize the cell. The hyperpolarization phase is again dominated by K+ current.
• در مقایسه با میوسیتهای معمولی، سلولهای ضربان ساز توالی رویدادها کمی متفاوت هستند. پس از رپلاریزاسیون به پتانسیل استراحت، دپلاریزاسیون آهسته ای رخ می دهد که به دلیل کانالی که می تواند هم +Na و هم +K را عبور دهد، رخ می دهد. از آنجایی که این جریان «خندهدار» به دپلاریز کردن سلول، آستانه فعالسازی کانالهای +Ca۲ دارای ولتاژ ادامه میدهد، کانالهای +Ca۲ فعال میشوند تا به سرعت سلول را دپولاریزه کنند. فاز hyperpolarization دوباره توسط +K جریان تحت سلطه است.
• Spread of the electrical signal from cell to cell is via gap junctions. The rate of spread is dependent on anatomic features, but also can be altered (to a certain extent) via neural input.
• انتشار سیگنال الکتریکی از سلولی به سلول دیگر از طریق اتصالات شکاف است. سرعت انتشار به ویژگی های آناتومیک بستگی دارد، اما همچنین می تواند (تا حد معینی) از طریق ورودی عصبی تغییر یابد.
• The electrocardiogram (ECG or EKG) is an algebraic sum of the electrical activity in the heart. The normal ECG includes well-defined waves and segments, including the P wave (atrial depolarization), the QRS complex (ventricular depolarization), and the T wave (ventricular repolarization). Various arrhythmias can be detected in irregular ECG recordings.
• الکتروکاردیوگرام (ECG یا EKG) یک مجموع جبری از فعالیت الکتریکی در قلب است. ECG نرمال شامل امواج و بخشهای کاملاً مشخص است، از جمله موج P (دپلاریزاسیون دهلیزی)، کمپلکس QRS (دپلاریزاسیون بطنی)، و موج T (بازپلاریزاسیون بطنی). آریتمی های مختلفی را می توان در ضبط نامنظم ECG تشخیص داد.
• Because of the contribution of ionic movement to cardiac muscle contraction, heart tissue is sensitive to ionic composition of the blood. Most serious are increases in [K*] that can produce severe cardiac abnormalities, including paralysis of the atria and ventricular arrhythmias.
• به دلیل سهم حرکت یونی در انقباض عضله قلب، بافت قلب به ترکیب یونی خون حساس است. جدی ترین افزایش در [+K] است که می تواند ناهنجاری های شدید قلبی، از جمله فلج دهلیزها و آریتمی های بطنی ایجاد کند.
MULTIPLE-CHOICE QUESTIONS
For all questions, select the single best answer unless otherwise directed.
سوالات چند گزینه ای
برای همه سؤالات، بهترین پاسخ را انتخاب کنید، مگر اینکه دستور دیگری داده شود.
۱. Which part of the ECG (eg, Figure 29-5) corresponds to ventricular repolarization?
A. The P wave
B. The QRS duration
C. The T wave
D. The U wave
E. The PR interval
۱. کدام قسمت از ECG (به عنوان مثال، شکل ۲۹-۵) مربوط به رپلاریزاسیون بطنی است؟
الف. موج P
ب. مدت زمان QRS
ج. موج T
د. موج U
ی. فاصله روابط عمومی
۲. Which of the following normally has a slowly depolarizing “prepotential”?
A. Sinoatrial node
B. Atrial muscle cells
C. Bundle of His
D. Purkinje fibers
E. Ventricular muscle cells
۲. کدام یک از موارد زیر به طور معمول دارای یک “پیش پتانسیل” دپلاریزاسیون آهسته است؟
الف. گره سینوسی دهلیزی
ب. سلول های عضلانی دهلیزی
ج. بسته نرم افزاری او
د. الیاف پورکنژ
ی. سلول های عضلانی بطنی
۳. In second-degree heart block
A. the ventricular rate is lower than the atrial rate.
B. the ventricular ECG complexes are distorted.
C. there is a high incidence of ventricular tachycardia.
D. stroke volume is decreased.
E. cardiac output is increased.
۳. در بلوک قلبی درجه دو
الف. ضربان بطنی کمتر از ضربان دهلیزی است.
ب. کمپلکس های ECG بطنی تحریف شده اند.
ج. بروز بالای تاکی کاردی بطنی وجود دارد.
د. حجم ضربه کاهش یافته است.
ی. برون ده قلبی افزایش یافته است.
۴. Currents caused by opening of which of the following channels contribute to the repolarization phase of the action potential of ventricular muscle fibers?
A. Na+ channels
B. Cl channels
C. Ca2+ channels
D. K+ channels
E. HCO3- channels
۴. جریان های ناشی از باز شدن کدام یک از کانال های زیر به فاز رپلاریزاسیون پتانسیل عمل فیبرهای عضلانی بطنی کمک می کند؟
الف. کانال های +Na
ب. کانال های Cl
ج. کانال های +Ca۲
د. کانال های +K
ی. کانال های -HCO۳
۵. In complete heart block
A. fainting may occur because the atria are unable to pump blood into the ventricles.
B. ventricular fibrillation is common.
C. the atrial rate is lower than the ventricular rate.
D. fainting may occur because of prolonged periods during which the ventricles fail to contract.
۵. در بلوک کامل قلب
الف. غش ممکن است رخ دهد زیرا دهلیزها قادر به پمپاژ خون به داخل بطن نیستند.
ب. فیبریلاسیون بطنی شایع است.
ج. ضربان دهلیزی کمتر از ضربان بطنی است.
د. غش ممکن است به دلیل دوره های طولانی که طی آن بطن ها منقبض نمی شوند رخ دهد.
کلیک کنید «منابع»
🚀 با ما همراه شوید!
تازهترین مطالب و آموزشهای مغز و اعصاب را از دست ندهید. با فالو کردن کانال تلگرام آیندهنگاران مغز، از ما حمایت کنید!
