مبانی علوم اعصاب اریک کندل؛ درد؛ پردردی؛ منشاء هایپرآلژزی

دعای مطالعه [ نمایش ]
بِسْمِ الله الرَّحْمنِ الرَّحیمِ
اَللّهُمَّ اَخْرِجْنى مِنْ ظُلُماتِ الْوَهْمِ
خدايا مرا بيرون آور از تاريكىهاى وهم،
وَ اَكْرِمْنى بِنُورِ الْفَهْمِ
و به نور فهم گرامى ام بدار،
اَللّهُمَّ افْتَحْ عَلَيْنا اَبْوابَ رَحْمَتِكَ
خدايا درهاى رحمتت را به روى ما بگشا،
وَانْشُرْ عَلَيْنا خَزائِنَ عُلُومِكَ بِرَحْمَتِكَ يا اَرْحَمَ الرّاحِمينَ
و خزانههاى علومت را بر ما باز كن به امید رحمتت اى مهربانترين مهربانان.
«مبانی علوم اعصاب» اثر دکتر اریک کندل و همکاران، یکی از جامعترین و معتبرترین منابع در حوزه علوم اعصاب محسوب میشود.
ترجمه دقیق این کتاب، با مدیریت داریوش طاهری و تحت نظارت برند علمی آیندهنگاران مغز، با الهام از تلاشهای علمی و تدریس اساتیدی همچون دکتر محمدتقی جغتایی و دکتر ثریا مهرابی، به فارسی برگردانده شده است.
این ترجمه، دسترسی به دانش عمیق علوم اعصاب را برای دانشجویان و پژوهشگران رشتههای پزشکی، علوم اعصاب، روانشناسی، علوم شناختی، هوش مصنوعی، گفتاردرمانی، مهندسی پزشکی و تمام علاقهمندان به درک عملکرد ذهن و مغز فراهم کرده و گامی در راستای ارتقای دانش و بهبود کیفیت زندگی است.
» کتاب مبانی علوم اعصاب اریک کندل
» » فصل ۲۰: فصل درد؛ قسمت دوم
در حال ویرایش
Principles of Neural Science; Eric R. Kandel
»» Pain
Hyperalgesia Has Both Peripheral and Central Origins
هایپرآلژزی هم منشأ محیطی و هم منشأ مرکزی دارد
Hyperalgesia Has Both Peripheral and Central Origins
هایپرآلژزی هم منشأ محیطی و هم منشأ مرکزی دارد
Up to this point, we have considered the conveyance of noxious signals in the normal physiological state. But the normal process of sensory signaling can be dramatically altered when peripheral tissue is damaged, resulting in an increase in pain sensitivity or hyperalgesia. This condition can be elicited by sensitizing peripheral nociceptors through repetitive exposure to noxious stimuli (Figure 20-7).
تا این مرحله، ما انتقال سیگنالهای مضر را در حالت فیزیولوژیکی طبیعی بررسی کردهایم. اما روند طبیعی سیگنالدهی حسی میتواند به طور چشمگیری تغییر کند، زمانی که بافت محیطی آسیب میبیند، که منجر به افزایش حساسیت به درد یا هیپرآلژزی میشود. این وضعیت میتواند با حساس کردن گیرندههای درد محیطی از طریق قرار گرفتن مکرر در معرض محرکهای مضر ایجاد شود (شکل 20-7).
The sensitization is triggered by a complex mix of chemicals released from damaged cells that accumulate at the site of tissue injury. This cocktail contains peptides and proteins such as bradykinin, substance P, and nerve growth factor, as well as molecules such as ATP, histamine, serotonin, prostaglandins, leukotrienes, and acetylcholine. Many of these chemical mediators are released from distinct cell types, but together they act to decrease the threshold of nociceptor activation.
این حساسیت توسط ترکیبی پیچیده از مواد شیمیایی آزاد شده از سلولهای آسیبدیده که در محل آسیب بافتی تجمع مییابند، ایجاد میشود. این کوکتل حاوی پپتیدها و پروتئینهایی مانند برادیکینین، ماده P و فاکتور رشد عصبی و همچنین مولکولهایی مانند ATP، هیستامین، سروتونین، پروستاگلاندینها، لوکوترینها و استیل کولین است. بسیاری از این واسطههای شیمیایی از انواع سلولهای متمایز آزاد میشوند، اما در کنار هم، آستانه فعالسازی گیرنده درد را کاهش میدهند.

Figure 20-5 Neuropeptides and their receptors in the superficial dorsal horn of the rat spinal cord. (Images reproduced, with permission, from A. Basbaum.)
شکل 20-5 نوروپپتیدها و گیرندههای آنها در شاخ پشتی سطحی نخاع موش صحرایی. (تصاویر با اجازه، از A. Basbaum کپی شدهاند.)
A. The terminals of unmyelinated primary sensory neurons are a major source of substance P in the superficial dorsal horn. Substance P activates the neurokinin-1 (NK1) receptor, which is expressed by neurons in the superficial dorsal horn, the majority of which are projection neurons.
الف) پایانههای نورونهای حسی اولیه بدون میلین، منبع اصلی ماده P در شاخ پشتی سطحی هستند. ماده P گیرنده نوروکینین-1 (NK1) را فعال میکند که توسط نورونهای شاخ پشتی سطحی بیان میشود، که اکثر آنها نورونهای بیرونزننده هستند.
B. Enkephalin is localized in interneurons and found in the same region of the dorsal horn as terminals containing substance P The μ-opioid receptor, which is targeted by enkephalins, is expressed by neurons in the superficial dorsal horn and also, presynaptically, on the terminals of sensory neurons.
ب. انکفالین در نورونهای رابط قرار دارد و در همان ناحیهای از شاخ پشتی یافت میشود که پایانههای حاوی ماده P قرار دارند. گیرنده μ-اپیوئیدی که توسط انکفالینها هدف قرار میگیرد، توسط نورونهای شاخ پشتی سطحی و همچنین، به صورت پیشسیناپسی، روی پایانههای نورونهای حسی بیان میشود.



Figure 20-6 Transmitter storage in the synaptic terminals of primary nociceptive neurons in the dorsal spinal cord.
شکل 20-6 ذخیره انتقال دهنده در پایانه های سیناپسی نورون های اولیه درد در نخاع پشتی.
A. The terminal of a C fiber on the dendrite (D) of a dorsal horn neuron has two classes of synaptic vesicles that contain different transmitters. Small electron-lucent vesicles contain glutamate, whereas large dense-cored vesicles store neuropeptides. (Image reproduced, with permission, from H. J. Ralston III.)
الف) انتهای یک فیبر C روی دندریت (D) یک نورون شاخ پشتی دارای دو دسته وزیکول سیناپسی است که حاوی فرستندههای متفاوتی هستند. وزیکولهای کوچک الکترون-لوسنت حاوی گلوتامات هستند، در حالی که وزیکولهای بزرگ با هسته متراکم، نوروپپتیدها را ذخیره میکنند. (تصویر با اجازه، از H. J. Ralston III بازتولید شده است.)
B. Glutamate and the peptide substance P (marked by large and small gold particles, respectively) are scattered in the axoplasm of a sensory neuron terminal in lamina II of the dorsal horn. Dense core vesicles also store calcitonin gene-related peptide (CGRP). (Reproduced, with permission, from De Biasi and Rustioni 1990.)
ب. گلوتامات و ماده پپتیدی P (که به ترتیب با ذرات بزرگ و کوچک طلا مشخص شدهاند) در آکوپلاسم یک پایانه نورون حسی در لامینای II شاخ پشتی پراکنده شدهاند. وزیکولهای هسته متراکم همچنین پپتید مرتبط با ژن کلسیتونین (CGRP) را ذخیره میکنند. (با اجازه، از De Biasi و Rustioni 1990 بازتولید شده است.)
Where do these chemicals come from, and what exactly do they do? Histamine is released from mast cells after tissue injury and activates polymodal nociceptors. The lipid anandamide, an endogenous cannabinoid agonist, is released under conditions of inflammation, activates the TRPV1 channel, and may trigger pain associated with inflammation. ATP, acetylcholine, and serotonin are released from damaged endothelial cells and platelets; they act indirectly to sensitize nociceptors by triggering the release of chemical agents such as prostaglandins and bradykinin from peripheral cells.
این مواد شیمیایی از کجا میآیند و دقیقاً چه کاری انجام میدهند؟ هیستامین پس از آسیب بافتی از ماست سلها آزاد میشود و گیرندههای درد چندوجهی را فعال میکند. لیپید آناندامید، یک آگونیست کانابینوئیدی درونزا، تحت شرایط التهاب آزاد میشود، کانال TRPV1 را فعال میکند و ممکن است درد مرتبط با التهاب را تحریک کند. ATP، استیل کولین و سروتونین از سلولهای اندوتلیال آسیبدیده و پلاکتها آزاد میشوند. آنها بهطور غیرمستقیم با تحریک آزادسازی عوامل شیمیایی مانند پروستاگلاندینها و برادیکینین از سلولهای محیطی، گیرندههای درد را حساس میکنند.
Bradykinin is one of the most active pain-producing agents. Its potency stems in part from the fact that it directly activates Aδ and C nociceptors and increases the synthesis and release of prostaglandins from nearby cells. Prostaglandins are metabolites of arachidonic acid that are generated through the activity of cyclooxygenase (COX) enzymes that cleave arachidonic acid (Chapter 14). The COX-2 enzyme is preferentially induced under conditions of peripheral inflammation, contributing to enhanced pain sensitivity. The enzymatic pathways of prostaglandin synthesis are targets of commonly used analgesic drugs. Aspirin and other nonsteroidal anti-inflammatory analgesics, such as ibuprofen and naproxen, are effective in controlling pain because they block the activity of the COX enzymes, reducing prostaglandin synthesis.
برادیکینین یکی از فعالترین عوامل تولید درد است. قدرت آن تا حدی ناشی از این واقعیت است که مستقیماً گیرندههای درد Aδ و C را فعال میکند و سنتز و آزادسازی پروستاگلاندینها را از سلولهای مجاور افزایش میدهد. پروستاگلاندینها متابولیتهای اسید آراشیدونیک هستند که از طریق فعالیت آنزیمهای سیکلواکسیژناز (COX) که اسید آراشیدونیک را تجزیه میکنند، تولید میشوند (فصل 14). آنزیم COX-2 به طور ترجیحی تحت شرایط التهاب محیطی القا میشود و به افزایش حساسیت به درد کمک میکند. مسیرهای آنزیمی سنتز پروستاگلاندین، اهداف داروهای مسکن رایج هستند. آسپرین و سایر مسکنهای ضدالتهاب غیراستروئیدی، مانند ایبوپروفن و ناپروکسن، در کنترل درد مؤثر هستند زیرا فعالیت آنزیمهای COX را مسدود میکنند و سنتز پروستاگلاندین را کاهش میدهند.
Activity of peripheral nociceptors can also produce all of the cardinal signs of inflammation, including heat (calor), redness (rubor), and swelling (tumor). Heat and redness result from the dilation of peripheral blood vessels, whereas swelling results from plasma extravasation, a process in which proteins, cells, and fluids are able to penetrate postcapillary venules. Release of the neuropeptides substance P and CGRP from the peripheral terminals of C fibers provokes plasma extravasation and vasodilation, respectively. Because this form of inflammation depends on neural activity, it has been termed neurogenic inflammation (Figure 20-8). Importantly, as profound peripheral vasodilation is a critical trigger of many migraine headaches, the development of antibodies to CGRP, which counteract the vasodilation by scavenging CGRP, offers significant hope for a new migraine therapy.
فعالیت گیرندههای درد محیطی همچنین میتواند تمام علائم اصلی التهاب، از جمله گرما (کالری)، قرمزی (قرمزی) و تورم (تومور) را ایجاد کند. گرما و قرمزی ناشی از اتساع رگهای خونی محیطی است، در حالی که تورم ناشی از خروج پلاسما است، فرآیندی که در آن پروتئینها، سلولها و مایعات قادر به نفوذ به وریدچههای پس مویرگی هستند. آزاد شدن ماده نوروپپتیدی P و CGRP از پایانههای محیطی فیبرهای C به ترتیب باعث خروج پلاسما و اتساع عروق میشود. از آنجا که این نوع التهاب به فعالیت عصبی بستگی دارد، به آن التهاب نوروژنیک گفته میشود (شکل 20-8). نکته مهم این است که از آنجایی که اتساع عمیق عروق محیطی عامل مهمی در بسیاری از سردردهای میگرنی است، ایجاد آنتیبادیهای CGRP که با جمعآوری CGRP با اتساع عروق مقابله میکنند، امید قابل توجهی برای درمان جدید میگرن ارائه میدهد.

Figure 20-7 Hyperalgesia results from sensitization of nociceptors. (Reproduced, with permission, from Raja, Campbell, and Meyer 1984. Copyright © 1984, Oxford University Press.)
شکل 20-7 هیپرآلژزی ناشی از حساس شدن گیرندههای درد است. (با اجازه، از Raja، Campbell و Meyer 1984 کپی شده است. حق چاپ © 1984، انتشارات دانشگاه آکسفورد.)
A. Mechanical thresholds for pain were recorded at sites A, B, and C before and after burns at sites A and D. The areas of reddening (flare) and mechanical hyperalgesia resulting from the burns are shown on the hand of one subject. In all subjects, the area of mechanical hyperalgesia was larger than the area of flare. Mechanical hyperalgesia was present even after the flare disappeared.
الف. آستانههای مکانیکی درد در محلهای A، B و C قبل و بعد از سوختگی در محلهای A و D ثبت شدند. نواحی قرمزی (شعله ور شدن) و هیپرآلژزی مکانیکی ناشی از سوختگی روی دست یکی از آزمودنیها نشان داده شده است. در همه آزمودنیها، ناحیه هیپرآلژزی مکانیکی بزرگتر از ناحیه شعله ور شدن بود. هیپرآلژزی مکانیکی حتی پس از ناپدید شدن شعله ور شدن نیز وجود داشت.
B. Mean mechanical pain thresholds before and after burns. The mechanical threshold for pain is significantly decreased after the burn.
ب. میانگین آستانه درد مکانیکی قبل و بعد از سوختگی. آستانه درد مکانیکی پس از سوختگی به طور قابل توجهی کاهش یافته است.
The release of substance P and CGRP from the peripheral terminals of sensory neurons is also responsible for the axon reflex, a physiological process characterized by vasodilation in the vicinity of a cutaneous injury. Pharmacological antagonists of substance P are able to block neurogenic inflammation and vasodilation in humans; this discovery illustrates how knowledge of nociceptive mechanisms can be applied in improving clinical therapies for pain.
آزادسازی ماده P و CGRP از پایانههای محیطی نورونهای حسی همچنین مسئول رفلکس آکسون است، یک فرآیند فیزیولوژیکی که با گشاد شدن عروق در مجاورت آسیب پوستی مشخص میشود. آنتاگونیستهای دارویی ماده P قادر به مسدود کردن التهاب نوروژنیک و گشاد شدن عروق در انسان هستند. این کشف نشان میدهد که چگونه میتوان از دانش مکانیسمهای درد در بهبود درمانهای بالینی درد استفاده کرد.
In addition to these small molecules and peptides, neurotrophins are causative agents in pain. Nerve growth factor (NGF) and brain-derived neurotrophic factor (BDNF) are particularly active in inflammatory pain states. The synthesis of BDNF is upregulated in many inflamed peripheral tissues (Figure 20-9). NGF- neutralizing molecules are effective analgesic agents in animal models of persistent pain. Indeed, inhibition of NGF function and signaling blocks pain sensation as effectively as COX inhibitors and opiates. Several promising clinical trials using antibodies to NGF for the management of knee osteoarthritis have been reported, once again demonstrating the translation of basic science to the clinic.
علاوه بر این مولکولهای کوچک و پپتیدها، نوروتروفینها عوامل ایجاد کننده درد هستند. فاکتور رشد عصبی (NGF) و فاکتور نوروتروفیک مشتق از مغز (BDNF) به ویژه در حالتهای درد التهابی فعال هستند. سنتز BDNF در بسیاری از بافتهای محیطی ملتهب افزایش مییابد (شکل 20-9). مولکولهای خنثی کننده NGF، عوامل مسکن موثری در مدلهای حیوانی درد مداوم هستند. در واقع، مهار عملکرد و سیگنالینگ NGF به همان اندازه مهارکنندههای COX و مواد افیونی، احساس درد را مسدود میکند. چندین آزمایش بالینی امیدوارکننده با استفاده از آنتیبادیهای NGF برای مدیریت آرتروز زانو گزارش شده است که بار دیگر انتقال علوم پایه به بالین را نشان میدهد.
What accounts for the enhanced sensitivity of dorsal horn neurons to nociceptor signals? Under conditions of persistent injury, C fibers fire repetitively and the response of dorsal horn neurons increases progressively (Figure 20-10A). The gradual enhancement in the excitability of dorsal horn neurons has been termed “win- dup” and is thought to involve N-methyl-D-aspartate (NMDA)-type glutamate receptors (Figure 20-108).
چه چیزی باعث افزایش حساسیت نورونهای شاخ پشتی به سیگنالهای گیرنده درد میشود؟ در شرایط آسیب مداوم، فیبرهای C به طور مکرر تحریک میشوند و پاسخ نورونهای شاخ پشتی به طور پیشروندهای افزایش مییابد (شکل 20-10A). افزایش تدریجی تحریکپذیری نورونهای شاخ پشتی “wind-dup” نامیده شده است و تصور میشود که گیرندههای گلوتامات نوع N-متیل-D-آسپارتات (NMDA) را درگیر میکند (شکل 20-108).
Repeated exposure to noxious stimuli therefore results in long-term changes in the response of dorsal horn neurons through mechanisms that are similar to those underlying the long-term potentiation of synaptic responses in many circuits in the brain. In essence, these prolonged changes in the excitability of dorsal horn neurons constitute a “memory” of the state of C-fiber input. This phenomenon has been termed central sensitization to distinguish it from sensitization at the peripheral terminals of the dorsal horn neurons, a process that involves activation of the enzymatic pathways of prostaglandin synthesis.
بنابراین، قرار گرفتن مکرر در معرض محرکهای مضر، از طریق مکانیسمهایی که مشابه مکانیسمهای زیربنایی تقویت طولانیمدت پاسخهای سیناپسی در بسیاری از مدارهای مغز هستند، منجر به تغییرات طولانیمدت در پاسخ نورونهای شاخ پشتی میشود. در اصل، این تغییرات طولانیمدت در تحریکپذیری نورونهای شاخ پشتی، یک “حافظه” از وضعیت ورودی فیبر C را تشکیل میدهند. این پدیده به عنوان حساسسازی مرکزی نامیده شده است تا آن را از حساسسازی در پایانههای محیطی نورونهای شاخ پشتی متمایز کند، فرآیندی که شامل فعالسازی مسیرهای آنزیمی سنتز پروستاگلاندین میشود.
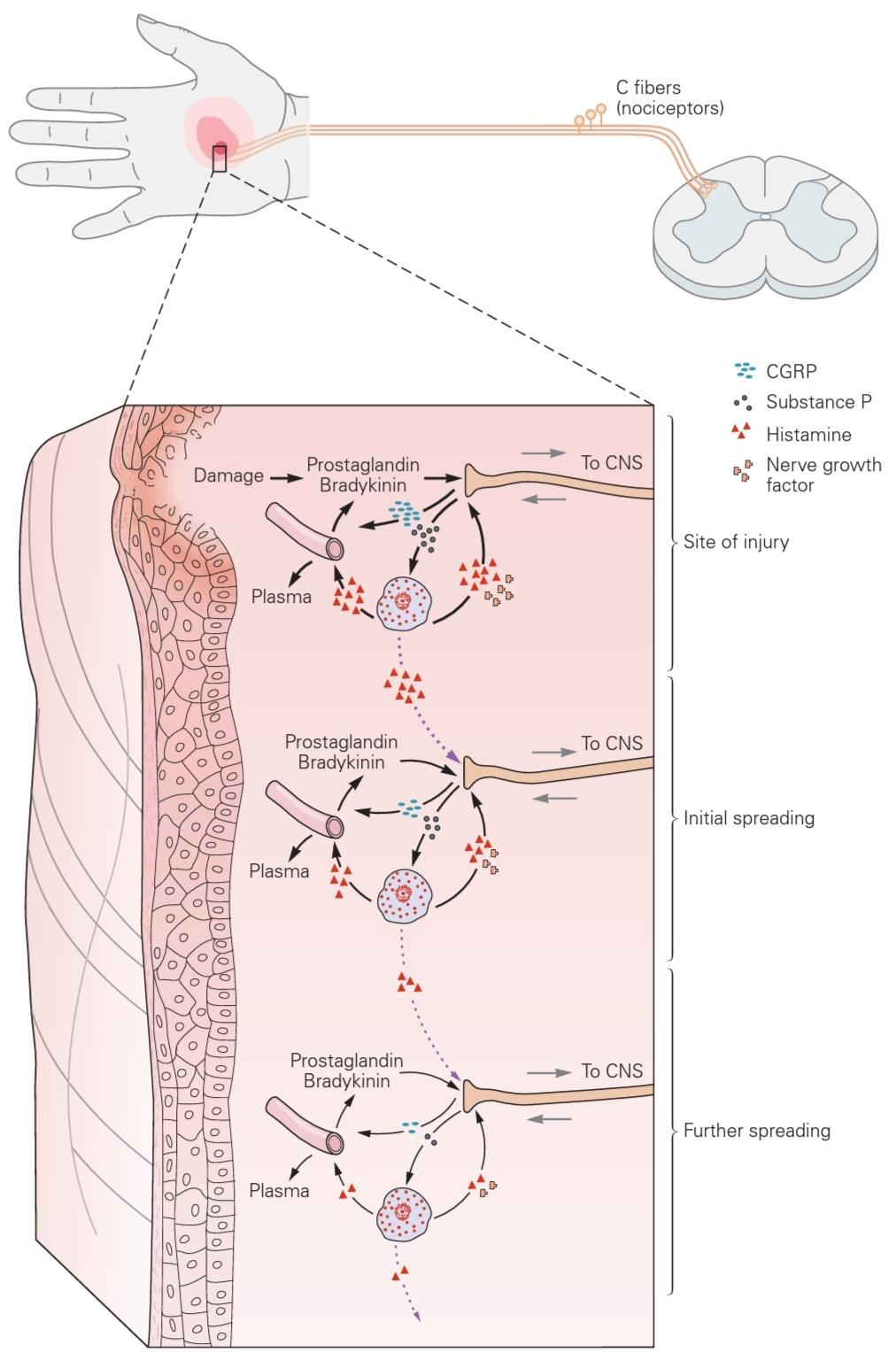
Figure 20-8 Neurogenic inflammation. Injury or tissue damage releases bradykinin and prostaglandins, which activate or sensitize nociceptors. Activation of nociceptors leads to the release of substance P and calcitonin gene-related peptide (CGRP). Substance P acts on mast cells (light blue) in the vicinity of sensory endings to evoke degranulation and the release of histamine, which directly excites nociceptors.
شکل 20-8 التهاب نوروژنیک. آسیب یا صدمه بافتی، برادیکینین و پروستاگلاندینها را آزاد میکند که گیرندههای درد را فعال یا حساس میکنند. فعال شدن گیرندههای درد منجر به آزاد شدن ماده P و پپتید مرتبط با ژن کلسیتونین (CGRP) میشود. ماده P بر روی سلولهای ماست (آبی روشن) در مجاورت پایانههای حسی اثر میکند تا دگرانولاسیون و آزاد شدن هیستامین را تحریک کند که مستقیماً گیرندههای درد را تحریک میکند.
Substance P also produces plasma extravasation and edema, and CGRP produces dilation of peripheral blood vessels (leading to reddening of the skin); the resultant inflammation causes additional liberation of bradykinin. These mechanisms also occur in healthy tissue, where they contribute to secondary or spreading hyperalgesia. (Abbreviation: CNS, central nervous system.)
ماده P همچنین باعث خروج پلاسما و ادم میشود و CGRP باعث اتساع رگهای خونی محیطی (منجر به قرمزی پوست) میشود؛ التهاب حاصل باعث آزادسازی بیشتر برادیکینین میشود. این مکانیسمها در بافت سالم نیز رخ میدهند، جایی که به پردردی ثانویه یا منتشر کمک میکنند. (مخفف: CNS، سیستم عصبی مرکزی.)

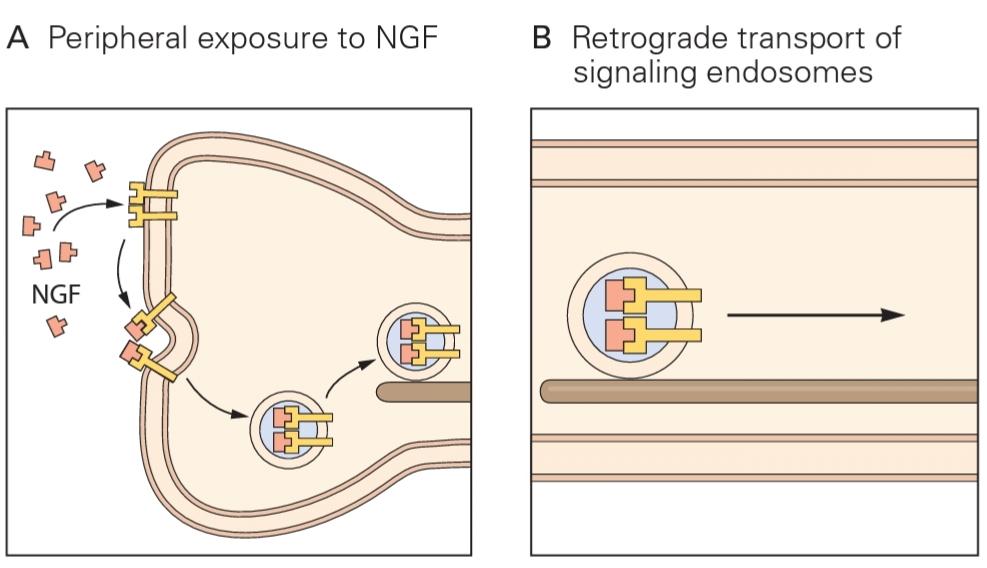

Figure 20-9 Neurotrophins are pain mediators. Local production of inflammatory cytokines such as interleukin-1 (IL-1) and tumor necrosis factor (TNF) promotes the synthesis and release of nerve growth factor (NGF) from several cell types in the periphery. Nerve growth factor binds to TrkA receptors on primary nociceptive terminals (A), triggering upregulation in expression of ion channels that increase nociceptor excitability. Retrograde transport of signaling endosomes to the cell body (B) results in enhanced expression of brain-derived neurotrophic factor (BDNF) (C), and its release from sensory terminals in the spinal cord (D) further increases excitability of dorsal horn neurons.
شکل 20-9 نوروتروفینها واسطههای درد هستند. تولید موضعی سیتوکینهای التهابی مانند اینترلوکین-1 (IL-1) و فاکتور نکروز تومور (TNF) سنتز و آزادسازی فاکتور رشد عصبی (NGF) را از چندین نوع سلول در محیط پیرامونی افزایش میدهد. فاکتور رشد عصبی به گیرندههای TrkA در پایانههای اولیه درد (A) متصل میشود و باعث افزایش بیان کانالهای یونی میشود که تحریکپذیری گیرنده درد را افزایش میدهد. انتقال رتروگراد اندوزومهای سیگنالدهنده به جسم سلولی (B) منجر به افزایش بیان فاکتور نوروتروفیک مشتق از مغز (BDNF) (C) میشود و آزادسازی آن از پایانههای حسی در نخاع (D) تحریکپذیری نورونهای شاخ پشتی را بیشتر افزایش میدهد.
The sensitization of dorsal horn neurons also involves recruitment of second-messenger pathways and activation of protein kinases that have been implicated in memory storage in other regions of the central nervous system. One consequence of this enzymatic cascade is the expression of immediate- early genes that encode transcription factors such as c-fos, which are thought to activate effector proteins that sensitize dorsal horn neurons to sensory inputs. Most importantly, central sensitization of “pain” transmission circuitry in the dorsal horn is the process that can decrease pain thresholds (allodynia) and lead to spontaneous pain (ie, ongoing pain in the absence of peripheral stimulation).
حساس شدن نورونهای شاخ پشتی همچنین شامل جذب مسیرهای پیامرسان ثانویه و فعال شدن پروتئین کینازهایی است که در ذخیره حافظه در سایر مناطق سیستم عصبی مرکزی نقش دارند. یکی از پیامدهای این آبشار آنزیمی، بیان ژنهای فوری-اولیه است که فاکتورهای رونویسی مانند c-fos را رمزگذاری میکنند، که تصور میشود پروتئینهای مؤثر را فعال میکنند که نورونهای شاخ پشتی را به ورودیهای حسی حساس میکنند. مهمتر از همه، حساس شدن مرکزی مدار انتقال “درد” در شاخ پشتی فرآیندی است که میتواند آستانه درد (آلودینی) را کاهش دهد و منجر به درد خودبهخودی (یعنی درد مداوم در غیاب تحریک محیطی) شود.
Central sensitization is also a major contributor to neuropathic pain due to nerve injury. Here again, there is increased excitability of dorsal horn circuits mediated by NMDA receptors. There is also loss of inhibitory controls in the dorsal horn. Under normal conditions, GABAergic inhibitory interneurons in the dorsal horn are not only tonically active but are also turned on by activity of large-diameter, nonnociceptive Aẞ fibers (Figure 20-11A). Peripheral nerve damage decreases the GABAergic controls, thus exacerbating the hyperactivity of these nociceptive pathways (Figure 20-11B). Recent studies also implicate nerve injury-induced activation of microglia and consequent reduced GABAergic inhibition in the central sensitization process (Figures 20-11C and 20-12). Together, these changes contribute to mechanical allodynia (ie, pain provoked by normally innocuous mechanical stimulation). Mechanical allodynia can also develop because of an inappropriate engagement of dorsal horn nociceptive pathway circuits by the Aẞ myelinated afferents. In fact, spread of pain (secondary hyperalgesia) can occur because uninjured Aẞ afferents outside of the area of injury can inappropriately activate dorsal horn circuits that have undergone central sensitization.
حساسیت مرکزی نیز یکی از عوامل اصلی درد نوروپاتیک ناشی از آسیب عصبی است. در اینجا نیز، افزایش تحریکپذیری مدارهای شاخ پشتی که توسط گیرندههای NMDA واسطهگری میشوند، وجود دارد. همچنین از دست دادن کنترلهای مهاری در شاخ پشتی وجود دارد. در شرایط عادی، نورونهای رابط مهاری GABAergic در شاخ پشتی نه تنها از نظر تونیک فعال هستند، بلکه توسط فعالیت فیبرهای Aẞ با قطر بزرگ و غیردردزا نیز روشن میشوند (شکل 20-11A). آسیب اعصاب محیطی کنترلهای GABAergic را کاهش میدهد، در نتیجه بیشفعالی این مسیرهای دردزا را تشدید میکند (شکل 20-11B). مطالعات اخیر همچنین فعال شدن میکروگلیا ناشی از آسیب عصبی و در نتیجه کاهش مهار GABAergic را در فرآیند حساسیت مرکزی دخیل میدانند (شکلهای 20-11C و 20-12). این تغییرات در کنار هم به آلودینیای مکانیکی (یعنی درد ناشی از تحریک مکانیکی معمولاً بیضرر) کمک میکنند. آلودینیای مکانیکی همچنین میتواند به دلیل درگیری نامناسب مدارهای مسیر درد شاخ پشتی توسط آورانهای میلیندار Aẞ ایجاد شود. در واقع، گسترش درد (هیپرآلژزی ثانویه) میتواند رخ دهد زیرا آورانهای Aẞ آسیب ندیده در خارج از ناحیه آسیب میتوانند مدارهای شاخ پشتی را که تحت حساسیت مرکزی قرار گرفتهاند، به طور نامناسبی فعال کنند.

Figure 20-10 Mechanisms for enhanced excitability of dorsal horn neurons.
شکل 20-10 مکانیسمهای افزایش تحریکپذیری نورونهای شاخ خلفی.
A. Typical responses of a dorsal horn neuron in the rat to electrical stimuli delivered transcutaneously at a frequency of 1 Hz. With repetitive stimulation, the long-latency component evoked by a C fiber increases gradually, whereas the short-latency component evoked by an A fiber remains constant.
الف. پاسخهای معمول یک نورون شاخ پشتی در موش صحرایی به محرکهای الکتریکی که از طریق پوست با فرکانس ۱ هرتز اعمال میشوند. با تحریک مکرر، جزء تأخیر طولانی که توسط یک فیبر C برانگیخته میشود به تدریج افزایش مییابد، در حالی که جزء تأخیر کوتاه که توسط یک فیبر A برانگیخته میشود ثابت میماند.
B. Dorsal horn neurons receive mono- and polysynaptic input from A and C fiber nociceptors. Elevation of residual Ca2+ in the presynaptic terminal leads to increased release of glutamate and substance P (and CGRP, not shown). Left: Activation of postsynaptic AMPA receptors by Aδ fibers causes a fast transient membrane depolarization, which relieves the Mg2+ block of the NMDA receptors. Right. Activation of the postsynaptic NMDA receptors and neurokinin-1 (NK1) receptors by C fibers generates a long-lasting cumulative depolarization. The cytosolic Ca2+ concentration in the dorsal horn neuron increases because of Ca2+ entry through the NMDA receptor channels and voltage-sensitive Ca2+ channels. The elevated Ca2+ and activation by NK1 receptors of second- messenger systems enhance the performance of the NMDA receptors. Activation of NK1 receptors, cumulative depolarization, elevated cytosolic Ca2+, and other factors regulate the behavior of voltage-gated ion channels responsible for action potentials, resulting in enhanced excitability, all of which contribute to the process of central sensitization. (Abbreviations: AMPA, α-amino-3-hydroxy-5-methylisoxazole-4-propionate; NMDA, N-methyl-D-aspartate)
ب. نورونهای شاخ پشتی، ورودیهای تک سیناپسی و چند سیناپسی را از گیرندههای درد فیبرهای A و C دریافت میکنند. افزایش Ca2+ باقیمانده در پایانه پیشسیناپسی منجر به افزایش آزادسازی گلوتامات و ماده P (و CGRP، نشان داده نشده است) میشود. چپ: فعال شدن گیرندههای AMPA پسسیناپسی توسط فیبرهای Aδ باعث دپلاریزاسیون غشایی گذرا و سریع میشود که بلوک Mg2+ گیرندههای NMDA را تسکین میدهد. راست. فعال شدن گیرندههای NMDA پسسیناپسی و گیرندههای نوروکینین-1 (NK1) توسط فیبرهای C باعث دپلاریزاسیون تجمعی طولانی مدت میشود. غلظت Ca2+ سیتوزولی در نورون شاخ پشتی به دلیل ورود Ca2+ از طریق کانالهای گیرنده NMDA و کانالهای Ca2+ حساس به ولتاژ افزایش مییابد. افزایش Ca2+ و فعال شدن توسط گیرندههای NK1 سیستمهای پیامرسان ثانویه، عملکرد گیرندههای NMDA را افزایش میدهد. فعال شدن گیرندههای NK1، دپلاریزاسیون تجمعی، افزایش Ca2+ سیتوزولی و سایر عوامل، رفتار کانالهای یونی وابسته به ولتاژ مسئول پتانسیلهای عمل را تنظیم میکنند و در نتیجه تحریکپذیری افزایش مییابد که همه اینها در فرآیند حساسسازی مرکزی نقش دارند. (اختصارات: AMPA، α-آمینو-3-هیدروکسی-5-متیل ایزوکسازول-4-پروپیونات؛ NMDA، N-متیل-D-آسپارتات)

Figure 20-11 Nerve injury triggers multiple dorsal horn central sensitization mechanisms that contribute to neuropathic pain.
شکل 20-11 آسیب عصبی، مکانیسمهای حساسیتزایی مرکزی متعددی را در شاخ خلفی نخاع ایجاد میکند که در ایجاد درد نوروپاتیک نقش دارند.
A. Under normal conditions, nociceptors engage dorsal horn pain transmission circuits, via both monosynaptic and polysynaptic (excitatory) inputs to projection neurons of laminae I and V that transmit nociceptive information to the brainstem and thalamus. (See Figure 20-13.) The output of the projection neurons is regulated by GABAergic inhibitory interneurons, which can be activated by nonnociceptive, large-diameter, myelinated Aẞ afferent fibers.
الف) در شرایط عادی، گیرندههای درد، مدارهای انتقال درد شاخ پشتی را از طریق ورودیهای تک سیناپسی و چند سیناپسی (تحریککننده) به نورونهای پروجکشن لامینای I و V که اطلاعات درد را به ساقه مغز و تالاموس منتقل میکنند، درگیر میکنند. (شکل 20-13 را ببینید.) خروجی نورونهای پروجکشن توسط نورونهای رابط مهاری GABAergic تنظیم میشود که میتوانند توسط فیبرهای آوران Aẞ میلیندار و غیر دردزا فعال شوند.
B. Peripheral nerve injury can result in a loss of the inhibitory control exerted by the Aẞ afferents, via loss of GABAergic interneurons, reduced production of GABA, or reduced expression of GABAergic receptors by the projection neurons. Pathophysiological sprouting of Aẞ afferents may also permit nonnociceptive inputs to directly engage the projection neurons (not shown), resulting in the condition of Aẞ-mediated mechanical hypersensitivity/allodynia, a hallmark of neuropathic pain.
ب. آسیب اعصاب محیطی میتواند منجر به از دست رفتن کنترل مهاری اعمال شده توسط آورانهای Aẞ، از طریق از بین رفتن نورونهای رابط گاباارژیک، کاهش تولید گابا یا کاهش بیان گیرندههای گاباارژیک توسط نورونهای برونافکن شود. جوانهزنی پاتوفیزیولوژیک آورانهای Aẞ همچنین ممکن است به ورودیهای غیردردزا اجازه دهد تا مستقیماً نورونهای برونافکن را درگیر کنند (نشان داده نشده است)، که منجر به وضعیت حساسیت بیش از حد مکانیکی/آلودینیای ناشی از Aẞ، یکی از نشانههای درد نوروپاتیک، میشود.
C. Peripheral nerve injury not only activates dorsal horn neurons directly but also activates microglia, which in turn release a host of mediators that enhance neuronal excitability and reduce the inhibitory controls exerted by GABAergic interneurons. Thus, targeting the mediators released from microglia introduces yet another potential approach to the pharmacotherapy of chronic pain.
ج. آسیب عصب محیطی نه تنها نورونهای شاخ خلفی را مستقیماً فعال میکند، بلکه میکروگلیا را نیز فعال میکند که به نوبه خود مجموعهای از واسطهها را آزاد میکند که تحریکپذیری عصبی را افزایش داده و کنترلهای مهاری اعمال شده توسط نورونهای رابط گاباارژیک را کاهش میدهد. بنابراین، هدف قرار دادن واسطههای آزاد شده از میکروگلیا، رویکرد بالقوه دیگری را برای دارودرمانی درد مزمن معرفی میکند.

Figure 20-12 Peripheral nerve injury activates microglia in the dorsal and ventral horns. Schematic drawing and photo- micrograph illustrate the location where microglia are activated after peripheral nerve injury. Activation of microglia in the dorsal horn results from damage (arrow) to the peripheral branch of primary sensory neurons (orange cells). Microglial activation around motor neuron cell bodies in the ventral horn occurs because the same injury damages efferent axons of the motor neurons (green cells). (Micrograph reproduced, with permission, from Julia Kuhn.)
شکل 20-12 آسیب عصب محیطی، میکروگلیا را در شاخهای پشتی و شکمی فعال میکند. طرح شماتیک و عکس میکروسکوپی، محل فعال شدن میکروگلیاها را پس از آسیب عصب محیطی نشان میدهند. فعال شدن میکروگلیاها در شاخ پشتی ناشی از آسیب (فلش) به شاخه محیطی نورونهای حسی اولیه (سلولهای نارنجی) است. فعال شدن میکروگلیا در اطراف اجسام سلولی نورون حرکتی در شاخ شکمی به این دلیل رخ میدهد که همین آسیب به آکسونهای وابران نورونهای حرکتی (سلولهای سبز) آسیب میرساند. (میکروگراف با اجازه از جولیا کوهن، بازنشر شده است.)
»» فصل بعد: فصل ماهیت ساختاری پردازش بینایی
»» تمامی کتاب
