علوم اعصاب پروس؛ انتقال سیناپسی، انواع سیناپس، بوتولیسم و کزاز

دعای مطالعه [ نمایش ]
بِسْمِ الله الرَّحْمنِ الرَّحیمِ
اَللّهُمَّ اَخْرِجْنى مِنْ ظُلُماتِ الْوَهْمِ
خدايا مرا بيرون آور از تاريكىهاى وهم،
وَ اَكْرِمْنى بِنُورِ الْفَهْمِ
و به نور فهم گرامى ام بدار،
اَللّهُمَّ افْتَحْ عَلَيْنا اَبْوابَ رَحْمَتِكَ
خدايا درهاى رحمتت را به روى ما بگشا،
وَانْشُرْ عَلَيْنا خَزائِنَ عُلُومِكَ بِرَحْمَتِكَ يا اَرْحَمَ الرّاحِمينَ
و خزانههاى علومت را بر ما باز كن به امید رحمتت اى مهربانترين مهربانان.
کتاب «علوم اعصاب» اثر پروس و همکاران بهعنوان یکی از جامعترین و معتبرترین منابع در حوزه علوم اعصاب، همچنان مرجع کلیدی برای درک پیچیدگیهای مغز و سیستم عصبی است. این اثر با بهرهگیری از تازهترین پژوهشها و توضیحات دقیق درباره سازوکارهای عصبی، پلی میان دانش پایه علوم اعصاب و کاربردهای بالینی ایجاد میکند و نقشی بیبدیل در آموزش، پژوهش و ارتقای دانش مغز و اعصاب ایفا مینماید.
ترجمه دقیق و علمی این شاهکار توسط برند علمی «آیندهنگاران مغز» به مدیریت داریوش طاهری، دسترسی فارسیزبانان به مرزهای نوین دانش علوم اعصاب را ممکن ساخته و رسالتی علمی برای ارتقای آموزش، فهم عمیقتر عملکرد مغز و سیستم عصبی و توسعه روشهای نوین در حوزه سلامت عصبی فراهم آورده است.
» کتاب علوم اعصاب پروس
» » فصل ۵: انتقال سیناپسی
» Neuroscience
»» Chapter 5: Synaptic Transmission
در حال ویرایش

Overview
THE HUMAN BRAIN CONTAINS 86 billion neurons, each with the ability to influence many other cells. Clearly, sophisticated and highly efficient mechanisms are needed to enable communication among this astronomical number of elements. Such communication is made possible by synapses, the functional contacts between neurons. Two different types of synapses—electrical and chemical—can be distinguished on the basis of their mechanism of transmission. At electrical synapses, current flows through connexons, which are specialized membrane channels that connect two cells at gap junctions. In contrast, chemical synapses enable cell-to-cell communication via the secretion of neurotransmitters; these chemical agents released by the presynaptic neurons produce secondary current flow in postsynaptic neurons by activating specific neurotransmitter receptors. The total number of neurotransmitters is well over 100. Virtually all neurotransmitters undergo a similar cycle of use: synthesis and packaging into synaptic vesicles; release from the presynaptic cell; binding to postsynaptic receptors; and finally, rapid removal or degradation. The influx of Ca2+ through voltage-gated channels triggers the secretion of neurotransmitters; this, in turn, gives rise to a transient increase in Ca2+ concentration in the presynaptic terminal. The rise in Ca2+ concentration causes synaptic vesicles to fuse with the presynaptic plasma membrane and release their contents into the space between the preand postsynaptic cells. Proteins on the surface of the synaptic vesicle and the presynaptic plasma membrane mediate the triggering of exocytosis by Ca2+. Neurotransmitters evoke postsynaptic electrical responses by binding to members of a diverse group of neurotransmitter receptors. There are two major classes of receptors: those in which the receptor molecule is also an ion channel, and those in which the receptor and ion channel are separate entities. These receptors give rise to electrical signals by transmitter-induced opening or closing of the ion channels. Whether the postsynaptic actions of a particular neurotransmitter are excitatory or inhibitory is determined by the ion permeability of the ion channel affected by the transmitter, and by the electrochemical gradient for the permeant ions.
مرور کلی
مغز انسان شامل ۸۶ میلیارد نورون است که هر کدام توانایی تأثیرگذاری بر بسیاری از سلولهای دیگر را دارند. واضح است که برای برقراری ارتباط بین این تعداد نجومی از عناصر، به مکانیسمهای پیچیده و بسیار کارآمدی نیاز است. چنین ارتباطی توسط سیناپسها، تماسهای عملکردی بین نورونها، امکانپذیر میشود. دو نوع مختلف سیناپس – الکتریکی و شیمیایی – را میتوان بر اساس مکانیسم انتقال آنها تشخیص داد. در سیناپسهای الکتریکی، جریان از طریق کانکسونها، که کانالهای غشایی تخصصی هستند که دو سلول را در اتصالات شکافی به هم متصل میکنند، جریان مییابد. در مقابل، سیناپسهای شیمیایی از طریق ترشح انتقالدهندههای عصبی، ارتباط سلول به سلول را ممکن میسازند. این عوامل شیمیایی که توسط نورونهای پیشسیناپسی آزاد میشوند، با فعال کردن گیرندههای انتقالدهنده عصبی خاص، جریان جریان ثانویه را در نورونهای پسسیناپسی ایجاد میکنند. تعداد کل انتقالدهندههای عصبی بیش از ۱۰۰ است. تقریباً همه انتقالدهندههای عصبی چرخه استفاده مشابهی را طی میکنند: سنتز و بستهبندی در وزیکولهای سیناپسی؛ آزاد شدن از سلول پیشسیناپسی؛ اتصال به گیرندههای پسسیناپسی؛ و در نهایت، حذف یا تخریب سریع. ورود +Ca2 از طریق کانالهای وابسته به ولتاژ، ترشح انتقالدهندههای عصبی را تحریک میکند؛ این به نوبه خود باعث افزایش گذرای غلظت +Ca2 در پایانه پیشسیناپسی میشود. افزایش غلظت +Ca2 باعث میشود وزیکولهای سیناپسی با غشای پلاسمایی پیشسیناپسی ادغام شوند و محتویات خود را به فضای بین سلولهای پیشسیناپسی و پسسیناپسی آزاد کنند. پروتئینهای روی سطح وزیکول سیناپسی و غشای پلاسمایی پیشسیناپسی واسطه شروع اگزوسیتوز توسط +Ca2 هستند. انتقالدهندههای عصبی با اتصال به اعضای گروه متنوعی از گیرندههای انتقالدهنده عصبی، پاسخهای الکتریکی پسسیناپسی را ایجاد میکنند. دو دسته اصلی گیرنده وجود دارد: آنهایی که در آنها مولکول گیرنده نیز یک کانال یونی است و آنهایی که در آنها گیرنده و کانال یونی موجودیتهای جداگانهای دارند. این گیرندهها با باز یا بسته شدن کانالهای یونی القا شده توسط فرستنده، سیگنالهای الکتریکی ایجاد میکنند. اینکه آیا اعمال پسسیناپسی یک انتقالدهنده عصبی خاص، تحریکی یا مهاری هستند، توسط نفوذپذیری یونی کانال یونی تحت تأثیر انتقالدهنده و توسط گرادیان الکتروشیمیایی برای یونهای نفوذکننده تعیین میشود.
Two Classes of Synapses
The many kinds of synapses in the human brain fall into two general classes: electrical synapses and chemical synapses. These two classes of synapses can be distinguished based on their structures and the mechanisms they use to transmit signals from the “upstream” neuron, called the presynaptic element, and the “downstream” neuron, termed postsynaptic.
دو دسته سیناپس
انواع سیناپسها در مغز انسان به دو دسته کلی تقسیم میشوند: سیناپسهای الکتریکی و سیناپسهای شیمیایی. این دو دسته سیناپس را میتوان بر اساس ساختار و مکانیسمهایی که برای انتقال سیگنالها از نورون «بالادست» به نام عنصر پیشسیناپسی و نورون «پاییندست» به نام پسسیناپسی استفاده میکنند، از هم متمایز کرد.
The structure of an electrical synapse is shown schematically in Figure 5.1A. Electrical synapses permit direct, passive flow of electrical current from one neuron to another. The usual source of this current is the potential difference generated locally by the presynaptic action potential (see Chapter 3). Current flow at electrical synapses arises at an intercellular specialization called a gap junction, where membranes of the two communicating neurons come extremely close to one another and are linked together (Figure 5.1B). Gap junctions contain a unique type of channel, termed a connexon, which provides the path for electrical current to flow from one neuron to another (see Figure 5.2).
ساختار یک سیناپس الکتریکی به صورت شماتیک در شکل 5.1A نشان داده شده است. سیناپسهای الکتریکی جریان مستقیم و غیرفعال جریان الکتریکی را از یک نورون به نورون دیگر مجاز میدانند. منبع معمول این جریان، اختلاف پتانسیلی است که به صورت محلی توسط پتانسیل عمل پیشسیناپسی ایجاد میشود (به فصل 3 مراجعه کنید). جریان جریان در سیناپسهای الکتریکی در یک تخصص بین سلولی به نام اتصال شکافی ایجاد میشود، جایی که غشاهای دو نورون ارتباطی بسیار به یکدیگر نزدیک میشوند و به هم متصل میشوند (شکل 5.1B). اتصالات شکافی حاوی نوع منحصر به فردی از کانال به نام کانکسون هستند که مسیر جریان الکتریکی را از یک نورون به نورون دیگر فراهم میکند (به شکل 5.2 مراجعه کنید).
The general structure of a chemical synapse is shown schematically in Figure 5.1C. The space between the preand postsynaptic neurons is substantially greater at chemical synapses than at electrical synapses and is called the synaptic cleft. However, the most important structural feature of all chemical synapses is the presence of small, membrane-bounded organelles called synaptic vesicles within the presynaptic terminal. These spherical organelles are filled with one or more neurotransmitters, chemical signals that are secreted from the presynaptic neuron and detected by specialized receptors on the postsynaptic cell (Figure 5.1D). These chemical agents act as messengers between the communicating neurons and give this type of synapse its name.
ساختار کلی یک سیناپس شیمیایی به صورت شماتیک در شکل 5.1C نشان داده شده است. فضای بین نورونهای پیشسیناپسی و پسسیناپسی در سیناپسهای شیمیایی به طور قابل توجهی بیشتر از سیناپسهای الکتریکی است و شکاف سیناپسی نامیده میشود. با این حال، مهمترین ویژگی ساختاری همه سیناپسهای شیمیایی، وجود اندامکهای کوچک و متصل به غشاء به نام وزیکولهای سیناپسی در ترمینال پیشسیناپسی است. این اندامکهای کروی پر از یک یا چند انتقالدهنده عصبی، سیگنالهای شیمیایی هستند که از نورون پیشسیناپسی ترشح میشوند و توسط گیرندههای تخصصی روی سلول پسسیناپسی شناسایی میشوند (شکل 5.1D). این عوامل شیمیایی به عنوان پیامرسان بین نورونهای ارتباطی عمل میکنند و نام خود را به این نوع سیناپس میدهند.
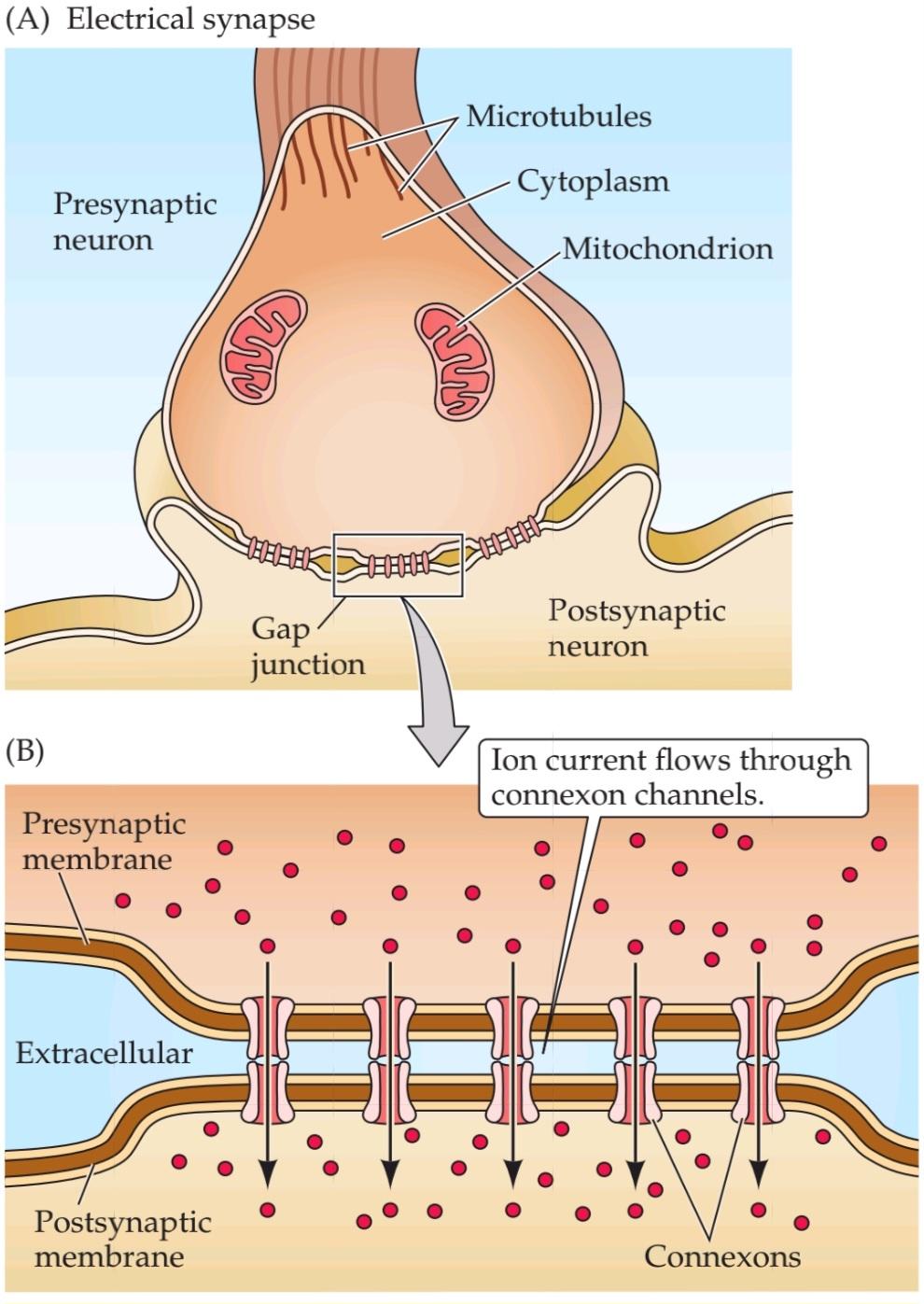
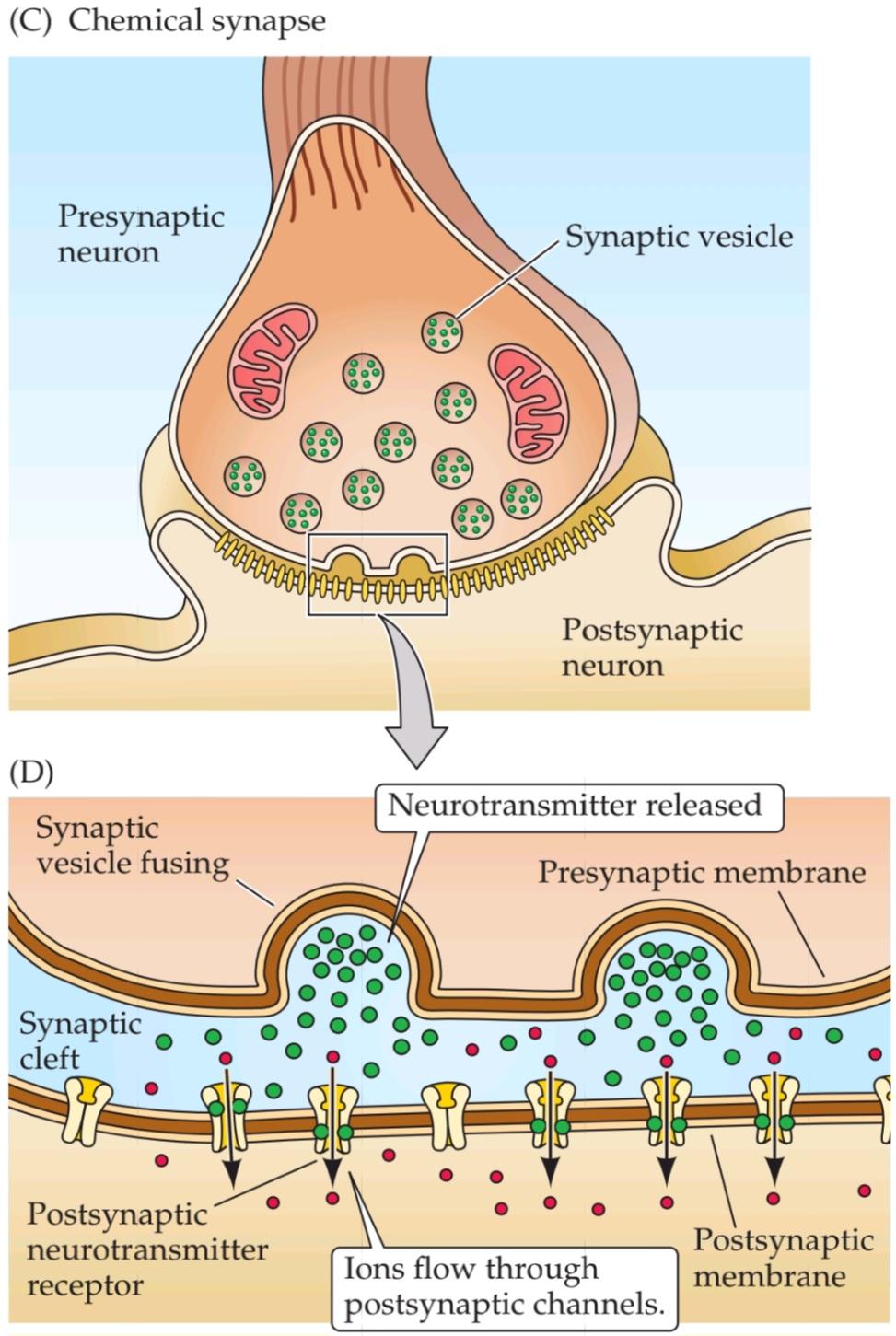
FIGURE 5.1 Electrical and chemical synapses differ fundamentally in their transmission mechanisms. (A) At electrical synapses, gap junctions occur between preand postsynaptic membranes. (B) Gap junctions contain connexon channels that permit current to flow passively from the presynaptic cell to the postsynaptic cell. (C) At chemical synapses, there is no intercellular continuity, and thus no direct flow of current from preto postsynaptic cell. (D) Synaptic current flows across the postsynaptic membrane only in response to the secretion of neurotransmitters, which open or close postsynaptic ion channels after binding to receptor molecules on the postsynaptic membrane.
شکل ۵.۱ سیناپسهای الکتریکی و شیمیایی اساساً در مکانیسمهای انتقال خود متفاوت هستند. (الف) در سیناپسهای الکتریکی، اتصالات شکافدار بین غشاهای پیشسیناپسی و پسسیناپسی وجود دارد. (ب) اتصالات شکافدار حاوی کانالهای کانکسون هستند که اجازه میدهند جریان به صورت غیرفعال از سلول پیشسیناپسی به سلول پسسیناپسی جریان یابد. (ج) در سیناپسهای شیمیایی، هیچ پیوستگی بین سلولی وجود ندارد و بنابراین هیچ جریان مستقیمی از سلول پیشسیناپسی وجود ندارد. (د) جریان سیناپسی فقط در پاسخ به ترشح انتقالدهندههای عصبی، که کانالهای یونی پسسیناپسی را پس از اتصال به مولکولهای گیرنده روی غشای پسسیناپسی باز یا بسته میکنند، از غشای پسسیناپسی عبور میکند.
Signaling Transmission at Electrical Synapses
Figure 5.2A shows an electron micrograph of an electrical synapse from a mammalian brain. As in the diagrams in Figure 5.1A and B, it can be seen that the processes of the presynaptic and postsynaptic neurons are connected via a gap junction (Figure 5.2B). The connexons contained within gap junctions are key to understanding how electrical synapses work (Figure 5.2C). Connexons are composed of a unique family of ion channel proteins, the connexins, which serve as subunits to form connexon channels. There are twenty-one different types of human connexin genes (GJA–GJE) that are expressed in different cell types and yield connexons with diverse physiological properties. All connexins have four transmembrane domains, and all connexons consist of six connexins that come together to form a hemi-channel in both the preand postsynaptic neurons (Figure 5.2D). These hemi-channels are precisely aligned to form a pore that connects the two cells and permits electrical current to flow. The pore of a connexon channel is more than 1 nm in diameter, which is much larger than the pores of the voltage-gated ion channels described in Chapter 4. As a result, a variety of substances can simply diffuse between the cytoplasm of the preand postsynaptic neurons. In addition to ions, substances that diffuse through connexon pores include molecules with molecular weights as great as several hundred daltons. This permits important intracellular metabolites, such as ATP and second messengers (see Chapter 7), to be transferred between neurons.
انتقال سیگنال در سیناپسهای الکتریکی
شکل 5.2A یک ریزنگار الکترونی از یک سیناپس الکتریکی از مغز یک پستاندار را نشان میدهد. همانطور که در نمودارهای شکل 5.1A و B مشاهده میشود، میتوان مشاهده کرد که زوائد نورونهای پیشسیناپسی و پسسیناپسی از طریق یک اتصال شکافی به هم متصل میشوند (شکل 5.2B). کانکسونهای موجود در اتصالات شکافی، کلید درک نحوه عملکرد سیناپسهای الکتریکی هستند (شکل 5.2C). کانکسونها از یک خانواده منحصر به فرد از پروتئینهای کانال یونی، کانکسینها، تشکیل شدهاند که به عنوان زیر واحد برای تشکیل کانالهای کانکسونی عمل میکنند. بیست و یک نوع مختلف از ژنهای کانکسین انسانی (GJA-GJE) وجود دارد که در انواع مختلف سلول بیان میشوند و کانکسونهایی با خواص فیزیولوژیکی متنوع ایجاد میکنند. همه کانکسینها دارای چهار دامنه غشایی هستند و همه کانکسونها از شش کانکسین تشکیل شدهاند که برای تشکیل یک همی کانال در هر دو نورون پیشسیناپسی و پسسیناپسی گرد هم میآیند (شکل 5.2D). این همیکانالها دقیقاً تراز شدهاند تا منفذی را تشکیل دهند که دو سلول را به هم متصل میکند و اجازه جریان الکتریکی را میدهد. منفذ یک کانال کانکسون بیش از 1 نانومتر قطر دارد که بسیار بزرگتر از منافذ کانالهای یونی وابسته به ولتاژ است که در فصل 4 توضیح داده شده است. در نتیجه، انواع مواد میتوانند به سادگی بین سیتوپلاسم نورونهای پیشسیناپسی و پسسیناپسی منتشر شوند. علاوه بر یونها، موادی که از طریق منافذ کانکسون منتشر میشوند شامل مولکولهایی با وزن مولکولی به بزرگی چند صد دالتون هستند. این امر امکان انتقال متابولیتهای مهم درون سلولی، مانند ATP و پیامرسانهای ثانویه (به فصل 7 مراجعه کنید) را بین نورونها فراهم میکند.
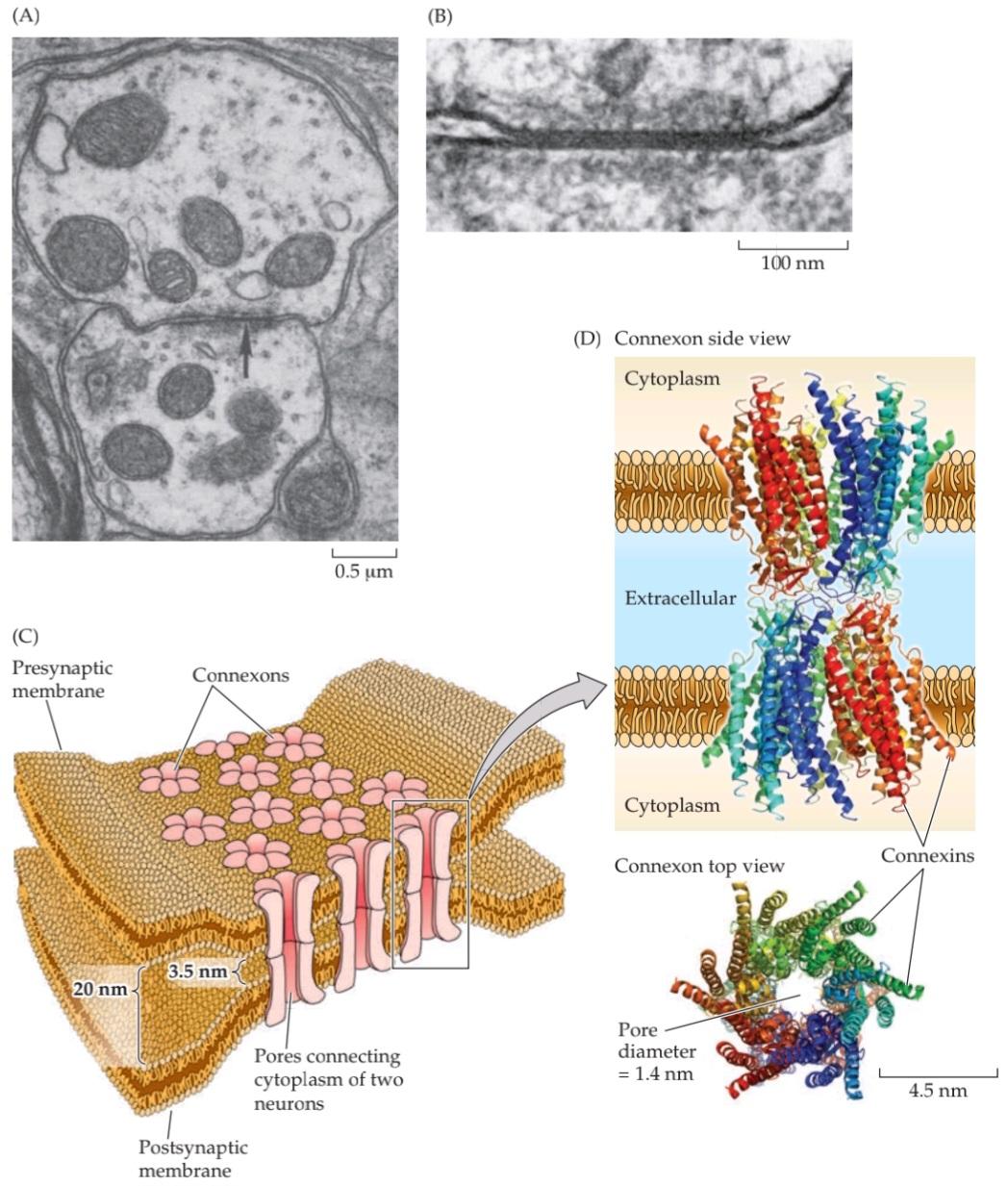
FIGURE 5.2 Structure of electrical synapses. (A) Electron micrograph of an electrical synapse (arrow) connecting two neurons within the inferior olive of a mammalian brain. (B) Higher-magnification electron micrograph of another electrical synapse, showing the gap junction structure characteristic of electrical synapses. (C) Gap junctions consist of connexons, hexameric complexes present in both the preand postsynaptic membranes. Channels assembled from connexons in these two membranes form pores that create electrical continuity between the two cells. (D) Crystallographic structure of connexons. Colors indicate individual connexins, integral membrane proteins that form the subunits of connexons. Side view shows the channels spanning the preand postsynaptic membranes; top view illustrates how six connexin subunits assemble in each membrane to form a channel with an exceptionally large pore. (A,B from Sotelo et al., 1974; D from Maeda et al., 2009.)
شکل ۵.۲ ساختار سیناپسهای الکتریکی. (الف) تصویر میکروسکوپ الکترونی از یک سیناپس الکتریکی (فلش) که دو نورون را در زیتون تحتانی مغز یک پستاندار به هم متصل میکند. (ب) تصویر میکروسکوپ الکترونی با بزرگنمایی بالاتر از یک سیناپس الکتریکی دیگر، که ساختار اتصال شکافی مشخصه سیناپسهای الکتریکی را نشان میدهد. (ج) اتصالات شکافی از کانکسونها، کمپلکسهای ششتایی موجود در هر دو غشای پیشسیناپسی و پسسیناپسی، تشکیل شدهاند. کانالهایی که از کانکسونها در این دو غشا تشکیل شدهاند، منافذی را تشکیل میدهند که پیوستگی الکتریکی بین دو سلول را ایجاد میکنند. (د) ساختار کریستالوگرافی کانکسونها. رنگها نشاندهنده کانکسینهای منفرد، پروتئینهای غشایی جداییناپذیری هستند که زیرواحدهای کانکسونها را تشکیل میدهند. نمای جانبی کانالهایی را نشان میدهد که غشاهای پیشسیناپسی و پسسیناپسی را در بر میگیرند. نمای بالا نشان میدهد که چگونه شش زیرواحد کانکسین در هر غشا جمع میشوند تا کانالی با یک منافذ فوقالعاده بزرگ تشکیل دهند. (الف، ب از Sotelo و همکاران، 1974؛ د از Maeda و همکاران، 2009.)
Although they are a distinct minority, electrical synapses have several functional advantages. One is that transmission is extraordinarily fast: Because passive current flow across connexons is virtually instantaneous, communication can occur without the delay that is characteristic of chemical synapses. The high speed of electrical synaptic transmission is apparent in the operation of the first electrical synapse to be discovered, which resides in the crayfish nervous system. A postsynaptic electrical signal is observed at this synapse within a fraction of a millisecond after the generation of a presynaptic action potential (Figure 5.3A). In fact, at least part of this brief synaptic delay is caused by propagation of the action potential into the presynaptic terminal, so there may be essentially no delay at all in the transmission of electrical signals across the synapse. Such synapses interconnect many of the neurons within the circuit that allows the crayfish to escape from its predators, thus minimizing the time between the presence of a threatening stimulus and a potentially lifesaving motor response.
اگرچه سیناپسهای الکتریکی اقلیت مشخصی هستند، اما چندین مزیت عملکردی دارند. یکی از آنها این است که انتقال فوقالعاده سریع است: از آنجا که جریان غیرفعال در سراسر کانکسونها عملاً آنی است، ارتباط میتواند بدون تأخیری که مشخصه سیناپسهای شیمیایی است، رخ دهد. سرعت بالای انتقال سیناپسی الکتریکی در عملکرد اولین سیناپس الکتریکی کشف شده، که در سیستم عصبی خرچنگ دریایی قرار دارد، آشکار است. یک سیگنال الکتریکی پسسیناپسی در کسری از میلیثانیه پس از تولید پتانسیل عمل پیشسیناپسی در این سیناپس مشاهده میشود (شکل 5.3A). در واقع، حداقل بخشی از این تأخیر سیناپسی کوتاه ناشی از انتشار پتانسیل عمل به ترمینال پیشسیناپسی است، بنابراین ممکن است اساساً هیچ تأخیری در انتقال سیگنالهای الکتریکی در سراسر سیناپس وجود نداشته باشد. چنین سیناپسهایی بسیاری از نورونهای درون مدار را به هم متصل میکنند که به خرچنگ دریایی اجازه میدهد از شکارچیان خود فرار کند، بنابراین زمان بین حضور یک محرک تهدیدکننده و یک پاسخ حرکتی بالقوه نجاتبخش را به حداقل میرسانند.
Another unique advantage of electrical synapses is that transmission can be bidirectional; although some connexons have special features for unidirectional transmission, in most cases current can flow in either direction, depending on which member of the coupled pair is invaded by an action potential. This allows electrical synapses to synchronize electrical activity among populations of neurons.
یکی دیگر از مزایای منحصر به فرد سیناپسهای الکتریکی این است که انتقال میتواند دو طرفه باشد؛ اگرچه برخی از کانکسونها ویژگیهای خاصی برای انتقال یک طرفه دارند، در بیشتر موارد جریان میتواند در هر دو جهت جریان یابد، بسته به اینکه کدام عضو از جفت جفت شده توسط پتانسیل عمل مورد حمله قرار گیرد. این امر به سیناپسهای الکتریکی اجازه میدهد تا فعالیت الکتریکی را در بین جمعیتهای نورونی همگامسازی کنند.
For example, the brainstem neurons that generate rhythmic electrical activity underlying breathing are synchronized by electrical synapses, as are populations of interneurons in the cerebral cortex, thalamus, cerebellum, and other brain regions (Figure 5.3B). Electrical transmission between vasopressinand oxytocin-secreting neurons in the hypothalamus ensures that all cells fire action potentials at about the same time, thus facilitating a synchronized burst of secretion of these hormones into the circulation (see Box 21A). The fact that connexon pores are large enough to allow second messengers to diffuse between cells also permits electrical synapses to synchronize the intracellular signaling of coupled cells. This feature may be particularly important for glial cells, which form large intracellular signaling networks via their gap junctions.
برای مثال، نورونهای ساقه مغز که فعالیت الکتریکی ریتمیک زیربنای تنفس را ایجاد میکنند، توسط سیناپسهای الکتریکی هماهنگ میشوند، همانطور که جمعیتهای نورونهای رابط در قشر مغز، تالاموس، مخچه و سایر نواحی مغز هماهنگ هستند (شکل 5.3B). انتقال الکتریکی بین نورونهای ترشحکننده وازوپرسین و اکسیتوسین در هیپوتالاموس تضمین میکند که همه سلولها تقریباً همزمان پتانسیل عمل ایجاد میکنند، بنابراین ترشح همزمان این هورمونها به گردش خون را تسهیل میکند (به کادر 21A مراجعه کنید). این واقعیت که منافذ کانکسون به اندازه کافی بزرگ هستند که به پیامرسانهای ثانویه اجازه انتشار بین سلولها را میدهند، به سیناپسهای الکتریکی نیز اجازه میدهد تا سیگنالدهی درون سلولی سلولهای جفتشده را هماهنگ کنند. این ویژگی ممکن است به ویژه برای سلولهای گلیال که از طریق اتصالات شکافدار خود شبکههای سیگنالدهی درون سلولی بزرگی را تشکیل میدهند، مهم باشد.


FIGURE 5.3 Function of gap junctions at electrical synapses. (A) Rapid transmission of signals at an electrical synapse in the crayfish. An action potential in the presynaptic neuron causes the postsynaptic neuron to be depolarized within a fraction of a millisecond. (B) Electrical synapses allow synchronization of electrical activity in hippocampal interneurons. In a pair of interneurons connected by electrical synapses, generation of an action potential in one neuron often results in the synchronized firing of an action potential in another neuron (asterisks). (A after Furshpan and Potter, 1959; B after Beierlein et al., 2000.)
شکل ۵.۳ عملکرد اتصالات شکافدار در سیناپسهای الکتریکی. (الف) انتقال سریع سیگنالها در یک سیناپس الکتریکی در خرچنگ دریایی. یک پتانسیل عمل در نورون پیشسیناپسی باعث میشود که نورون پسسیناپسی در کسری از میلیثانیه دپلاریزه شود. (ب) سیناپسهای الکتریکی امکان همگامسازی فعالیت الکتریکی در نورونهای رابط هیپوکامپ را فراهم میکنند. در یک جفت نورون رابط که توسط سیناپسهای الکتریکی به هم متصل شدهاند، تولید یک پتانسیل عمل در یک نورون اغلب منجر به شلیک همزمان یک پتانسیل عمل در نورون دیگر میشود (ستارهها). (الف برگرفته از Furshpan و Potter، 1959؛ ب برگرفته از Beierlein و همکاران، 2000.)
Signaling Transmission at Chemical Synapses
Figure 5.4A shows an electron micrograph of a chemical synapse in the cerebral cortex. This image illustrates the presynaptic terminal, with its abundance of synaptic vesicles, as well as the postsynaptic cell separated by a synaptic cleft. A three-dimensional rendering of this chemical synapse, constructed from many images including the one in Figure 5.4A, reveals these features as well as many more structures, including filamentous elements in both preand postsynaptic processes, as well as structures in the synaptic cleft (Figure 5.4B). In the presynaptic terminal, dense projections (dark blue) are associated with the active zone, the place where synaptic vesicles discharge their neurotransmitters into the synaptic cleft, while the blue structure on the postsynaptic side represents the postsynaptic density, a structure important for postsynaptic signaling at excitatory synapses (see Box 7B).
انتقال سیگنال در سیناپسهای شیمیایی
شکل 5.4A یک ریزنگار الکترونی از یک سیناپس شیمیایی در قشر مغز را نشان میدهد. این تصویر، پایانه پیشسیناپسی را با فراوانی وزیکولهای سیناپسی و همچنین سلول پسسیناپسی که توسط یک شکاف سیناپسی از هم جدا شدهاند، نشان میدهد. یک تصویر سهبعدی از این سیناپس شیمیایی، که از تصاویر زیادی از جمله تصویر موجود در شکل 5.4A ساخته شده است، این ویژگیها و همچنین ساختارهای بسیار بیشتری، از جمله عناصر رشتهای در هر دو فرآیند پیشسیناپسی و پسسیناپسی، و همچنین ساختارهای موجود در شکاف سیناپسی (شکل 5.4B) را نشان میدهد. در پایانه پیشسیناپسی، برآمدگیهای متراکم (آبی تیره) با منطقه فعال، مکانی که وزیکولهای سیناپسی انتقالدهندههای عصبی خود را به شکاف سیناپسی تخلیه میکنند، مرتبط هستند، در حالی که ساختار آبی در سمت پسسیناپسی نشان دهنده تراکم پسسیناپسی است، ساختاری که برای سیگنالدهی پسسیناپسی در سیناپسهای تحریکی مهم است (به کادر 7B مراجعه کنید).
Transmission at chemical synapses is based on the elaborate sequence of events depicted in Figure 5.4C. Prior to transmission, synaptic vesicles are formed and filled with neurotransmitter. Synaptic transmission is initiated when an action potential invades the terminal of the presynaptic neuron. The change in membrane potential caused by the arrival of the action potential leads to the opening of voltage-gated calcium channels in the presynaptic membrane. Because of the steep concentration gradient of Ca2+ across the presynaptic membrane (the external Ca2+ concentration is approximately 10–3 M, whereas the internal Ca2+ concentration is approximately 10–7 M), the opening of these channels causes a rapid influx of Ca2+ into the presynaptic terminal, with the result that the Ca2+ concentration of the cytoplasm in the terminal transiently rises to a much higher value. Elevation of the presynaptic Ca2+ concentration, in turn, allows synaptic vesicles to fuse with the plasma membrane of the presynaptic neuron. The Ca2+-dependent fusion of synaptic vesicles with the terminal membrane causes their contents, most importantly neurotransmitters, to be released into the synaptic cleft, a process called exocytosis.
انتقال در سیناپسهای شیمیایی بر اساس توالی پیچیده وقایع نشان داده شده در شکل 5.4C انجام میشود. قبل از انتقال، وزیکولهای سیناپسی تشکیل شده و با انتقالدهنده عصبی پر میشوند. انتقال سیناپسی زمانی آغاز میشود که یک پتانسیل عمل به ترمینال نورون پیشسیناپسی حمله میکند. تغییر در پتانسیل غشاء ناشی از ورود پتانسیل عمل منجر به باز شدن کانالهای کلسیم وابسته به ولتاژ در غشای پیشسیناپسی میشود. به دلیل شیب غلظت تند +Ca2 در سراسر غشای پیشسیناپسی (غلظت +Ca2 خارجی تقریباً 10-3 M است، در حالی که غلظت +Ca2 داخلی تقریباً 10-7 M است)، باز شدن این کانالها باعث هجوم سریع +Ca2 به ترمینال پیشسیناپسی میشود، در نتیجه غلظت +Ca2 سیتوپلاسم در ترمینال به طور موقت به مقدار بسیار بالاتری افزایش مییابد. افزایش غلظت +Ca2 پیشسیناپسی، به نوبه خود، به وزیکولهای سیناپسی اجازه میدهد تا با غشای پلاسمایی نورون پیشسیناپسی ادغام شوند. همجوشی وابسته به +Ca2 وزیکولهای سیناپسی با غشای انتهایی باعث میشود محتویات آنها، که مهمترین آنها انتقالدهندههای عصبی هستند، به داخل شکاف سیناپسی آزاد شوند، فرآیندی که اگزوسیتوز نامیده میشود.
Following exocytosis, transmitters diffuse across the synaptic cleft and bind to specific receptors on the membrane of the postsynaptic neuron. The binding of neurotransmitter to the receptors causes channels in the postsynaptic membrane to open (or sometimes to close), thus changing the ability of ions to flow across the postsynaptic membrane. The resulting neurotransmitter-induced current flow alters the conductance and (usually) the membrane potential of the postsynaptic neuron, increasing or decreasing the probability that the neuron will fire an action potential. Subsequent removal of the neurotransmitter from the synaptic cleft, by uptake into glial cells or by enzymatic degradation, terminates the action of the neurotransmitter. In this way, information is transmitted transiently from one neuron to another.
پس از اگزوسیتوز، انتقالدهندهها از طریق شکاف سیناپسی پخش میشوند و به گیرندههای خاصی روی غشای نورون پسسیناپسی متصل میشوند. اتصال انتقالدهنده عصبی به گیرندهها باعث باز شدن (یا گاهی بسته شدن) کانالها در غشای پسسیناپسی میشود و در نتیجه توانایی یونها برای عبور از غشای پسسیناپسی را تغییر میدهد. جریان القا شده توسط انتقالدهنده عصبی حاصل، رسانایی و (معمولاً) پتانسیل غشای نورون پسسیناپسی را تغییر میدهد و احتمال ایجاد پتانسیل عمل توسط نورون را افزایش یا کاهش میدهد. حذف بعدی انتقالدهنده عصبی از شکاف سیناپسی، با جذب در سلولهای گلیال یا با تخریب آنزیمی، عمل انتقالدهنده عصبی را خاتمه میدهد. به این ترتیب، اطلاعات به صورت گذرا از یک نورون به نورون دیگر منتقل میشوند.
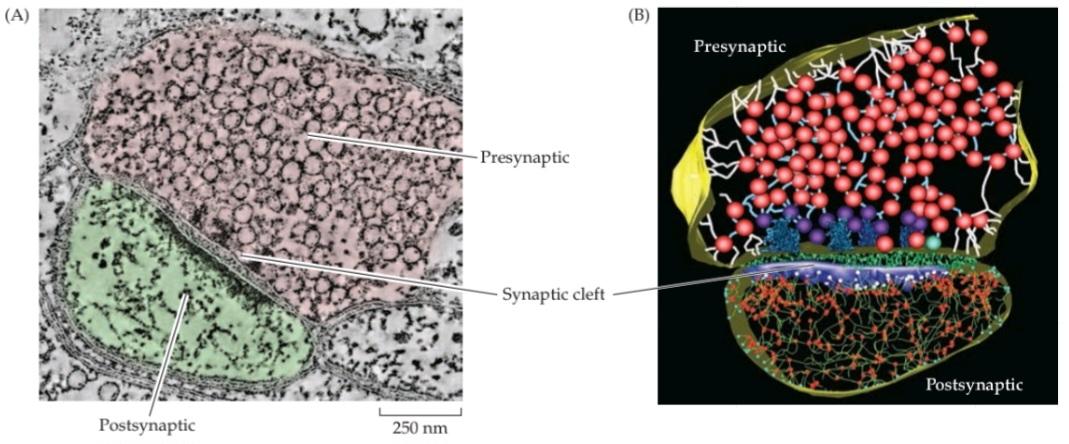
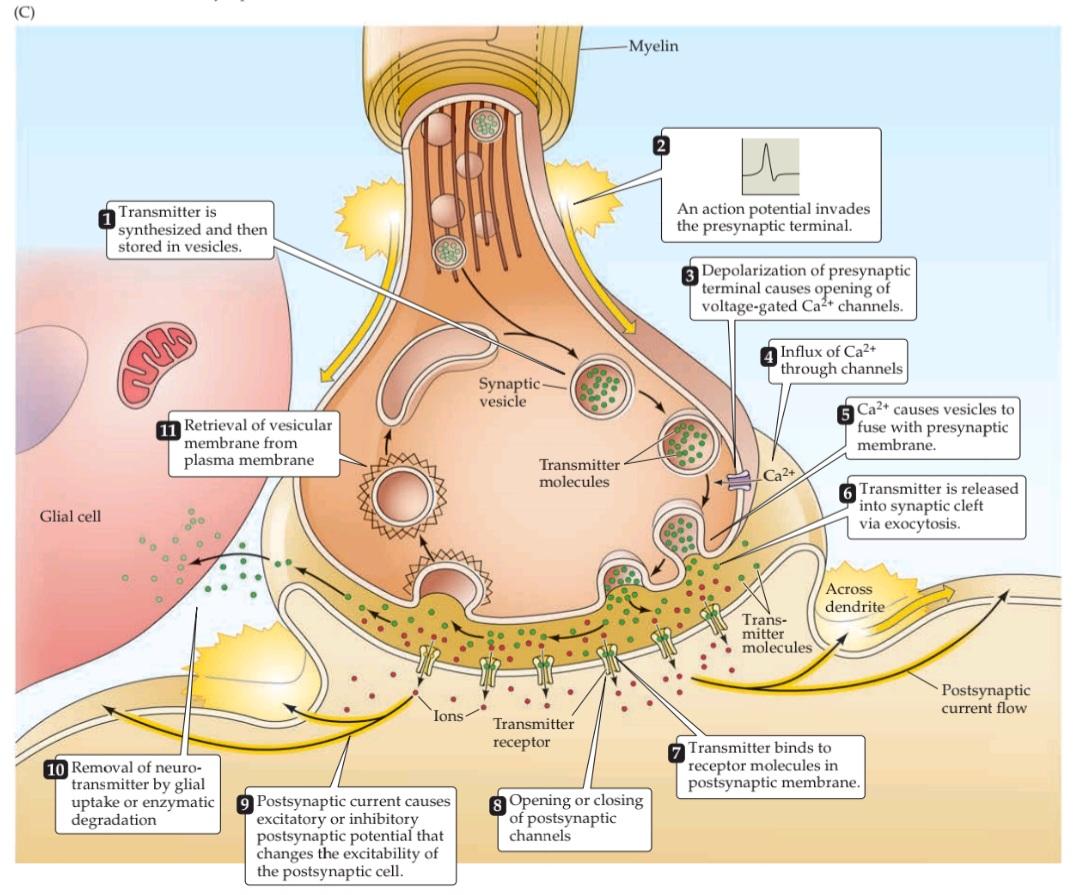
FIGURE 5.4 Structure and function of chemical synapses. (A) Structure of a chemical synapse in the cerebral cortex. A presynaptic terminal (pink) forms a synapse with a postsynaptic dendrite (green). (B) Three-dimensional reconstruction of the synapse shown in (A). Inside the presynaptic terminal, spheres indicate synaptic vesicles at various stages of their trafficking cycle, linear elements indicate intracellular filaments, and dark blue indicates dense projections associated with the active zone. Inside the postsynaptic neuron, the blue structure is the postsynaptic density, green structures represent filaments, red spheres indicate points where the filaments branch. Green material within the synaptic cleft indicates structures of unknown function. (C) Sequence of events involved in transmission at a typical chemical synapse. (A,B from Burette et al., 2012.)
شکل ۵.۴ ساختار و عملکرد سیناپسهای شیمیایی. (الف) ساختار یک سیناپس شیمیایی در قشر مغز. یک پایانه پیشسیناپسی (صورتی) با یک دندریت پسسیناپسی (سبز) یک سیناپس تشکیل میدهد. (ب) بازسازی سهبعدی سیناپس نشان داده شده در (الف). در داخل پایانه پیشسیناپسی، کرهها نشاندهنده وزیکولهای سیناپسی در مراحل مختلف چرخه انتقال آنها هستند، عناصر خطی نشاندهنده رشتههای درون سلولی هستند و آبی تیره نشاندهنده برآمدگیهای متراکم مرتبط با منطقه فعال است. در داخل نورون پسسیناپسی، ساختار آبی نشاندهنده تراکم پسسیناپسی است، ساختارهای سبز نشاندهنده رشتهها هستند، کرههای قرمز نقاطی را نشان میدهند که رشتهها در آنها منشعب میشوند. ماده سبز درون شکاف سیناپسی نشاندهنده ساختارهایی با عملکرد ناشناخته است. (ج) توالی رویدادهای دخیل در انتقال در یک سیناپس شیمیایی معمولی. (الف، ب از بورت و همکاران، 2012.)
Properties of Neurotransmitters
The notion that electrical information can be transferred from one neuron to the next by means of chemical signaling was the subject of intense debate through the first half of the twentieth century. In 1926, the German physiologist Otto Loewi performed a key experiment that supported this idea. Acting on an idea that allegedly came to him in the middle of the night, Loewi proved that electrical stimulation of the vagus nerve slows the heartbeat by releasing a chemical signal that was later shown to be acetylcholine (ACh). ACh is now known to be a neurotransmitter that acts not only in the heart but also at a variety of postsynaptic targets in the central and peripheral nervous systems, preeminently at the neuromuscular junction of striated muscles and in the visceral motor system (see Chapters 6 and 21).
خواص انتقالدهندههای عصبی
این تصور که اطلاعات الکتریکی میتوانند از طریق سیگنالینگ شیمیایی از یک نورون به نورون دیگر منتقل شوند، موضوع بحثهای داغی در نیمه اول قرن بیستم بود. در سال ۱۹۲۶، اتو لووی، فیزیولوژیست آلمانی، آزمایشی کلیدی انجام داد که از این ایده پشتیبانی میکرد. لووی با تکیه بر ایدهای که ظاهراً در نیمه شب به ذهنش خطور کرده بود، ثابت کرد که تحریک الکتریکی عصب واگ با آزاد کردن یک سیگنال شیمیایی که بعداً مشخص شد استیل کولین (ACh) است، ضربان قلب را کند میکند. اکنون مشخص شده است که ACh یک انتقالدهنده عصبی است که نه تنها در قلب، بلکه در اهداف پسسیناپسی متنوعی در سیستمهای عصبی مرکزی و محیطی، بهویژه در محل اتصال عصبی-عضلانی عضلات مخطط و در سیستم حرکتی احشایی عمل میکند (به فصلهای ۶ و ۲۱ مراجعه کنید).
Formal criteria have been established to definitively identify a substance as a neurotransmitter. These criteria have led to the identification of more than 100 different neurotransmitters, which can be classified into two broad categories: small-molecule neurotransmitters, such as ACh, and neuropeptides (see Chapter 6). Having more than one transmitter diversifies the physiological repertoire of synapses. Multiple neurotransmitters can produce different types of responses on individual postsynaptic cells. For example, a neuron can be excited by one type of neurotransmitter and inhibited by another type of neurotransmitter. The speed of postsynaptic responses produced by different transmitters also differs, allowing control of electrical signaling over different timescales. In general, small-molecule neurotransmitters mediate rapid synaptic actions, whereas neuropeptides tend to modulate slower, ongoing neuronal functions. In some cases, neurons synthesize and release two or more different neurotransmitters; in this case, the molecules are called co-transmitters. Co-transmitters can be differentially released according to the pattern of synaptic activity, so that the signaling properties of such synapses change dynamically according to the rate of activity.
معیارهای رسمی برای شناسایی قطعی یک ماده به عنوان انتقالدهنده عصبی تعیین شدهاند. این معیارها منجر به شناسایی بیش از ۱۰۰ انتقالدهنده عصبی مختلف شدهاند که میتوانند به دو دسته کلی طبقهبندی شوند: انتقالدهندههای عصبی مولکول کوچک، مانند ACh، و نوروپپتیدها (به فصل ۶ مراجعه کنید). داشتن بیش از یک انتقالدهنده، مجموعه فیزیولوژیکی سیناپسها را متنوع میکند. انتقالدهندههای عصبی متعدد میتوانند انواع مختلفی از پاسخها را در سلولهای پسسیناپسی منفرد ایجاد کنند. به عنوان مثال، یک نورون میتواند توسط یک نوع انتقالدهنده عصبی تحریک و توسط نوع دیگری از انتقالدهنده عصبی مهار شود. سرعت پاسخهای پسسیناپسی تولید شده توسط انتقالدهندههای مختلف نیز متفاوت است و امکان کنترل سیگنالدهی الکتریکی را در مقیاسهای زمانی مختلف فراهم میکند. به طور کلی، انتقالدهندههای عصبی مولکول کوچک واسطه اعمال سریع سیناپسی هستند، در حالی که نوروپپتیدها تمایل دارند عملکردهای عصبی کندتر و مداوم را تعدیل کنند. در برخی موارد، نورونها دو یا چند انتقالدهنده عصبی مختلف را سنتز و آزاد میکنند. در این حالت، مولکولها، انتقالدهندههای کمکی نامیده میشوند. انتقالدهندههای کمکی میتوانند طبق الگوی فعالیت سیناپسی به صورت متفاوتی آزاد شوند، به طوری که خواص سیگنالدهی چنین سیناپسهایی به صورت پویا با توجه به میزان فعالیت تغییر میکند.
Effective synaptic transmission requires close control of the concentration of neurotransmitters within the synaptic cleft. Neurons have therefore developed a sophisticated ability to regulate the synthesis, packaging, release, and degradation (or removal) of neurotransmitters to achieve the desired levels of transmitter molecules. The synthesis of small-molecule neurotransmitters occurs locally within presynaptic terminals. The precursor molecules required to make new molecules of neurotransmitter are usually taken into the nerve terminal by transporters found in the plasma membrane of the terminal (see Figure 4.13E). The enzymes that synthesize these neurotransmitters are present in the cytoplasm of the presynaptic terminal, and the newly synthesized transmitters are then loaded into synaptic vesicles via another type of transporter located in the vesicular membrane. Most small-molecule neurotransmitters are packaged in vesicles 40 to 60 nm in diameter, the centers of which appear clear in electron micrographs (see Figure 5.4A); accordingly, these vesicles are referred to as small clear-core vesicles. Neuropeptides are synthesized in the cell body of a neuron, and peptide-filled vesicles are transported along an axon and down to the synaptic terminal via axonal transport. Neuropeptides are packaged into synaptic vesicles that range from 90 to 250 nm in diameter. Because the centers of these vesicles appear electron-dense in electron micrographs, they are referred to as large dense-core vesicles.
انتقال سیناپسی مؤثر نیاز به کنترل دقیق غلظت انتقالدهندههای عصبی در شکاف سیناپسی دارد. بنابراین، نورونها توانایی پیچیدهای را برای تنظیم سنتز، بستهبندی، آزادسازی و تخریب (یا حذف) انتقالدهندههای عصبی برای دستیابی به سطوح مطلوب مولکولهای انتقالدهنده ایجاد کردهاند. سنتز انتقالدهندههای عصبی مولکول کوچک به صورت محلی در پایانههای پیشسیناپسی رخ میدهد. مولکولهای پیشساز مورد نیاز برای ساخت مولکولهای جدید انتقالدهنده عصبی معمولاً توسط ناقلهایی که در غشای پلاسمایی پایانه یافت میشوند، به پایانه عصبی منتقل میشوند (شکل 4.13E را ببینید). آنزیمهایی که این انتقالدهندههای عصبی را سنتز میکنند در سیتوپلاسم پایانه پیشسیناپسی وجود دارند و سپس انتقالدهندههای تازه سنتز شده از طریق نوع دیگری از ناقل واقع در غشای وزیکولی به وزیکولهای سیناپسی بارگذاری میشوند. اکثر انتقالدهندههای عصبی مولکول کوچک در وزیکولهایی با قطر 40 تا 60 نانومتر بستهبندی میشوند که مراکز آنها در میکروگرافهای الکترونی واضح به نظر میرسند (شکل 5.4A را ببینید). بر این اساس، به این وزیکولها، وزیکولهای کوچک با هسته شفاف گفته میشود. نوروپپتیدها در جسم سلولی یک نورون سنتز میشوند و وزیکولهای پر از پپتید از طریق انتقال آکسونی در امتداد آکسون و به سمت ترمینال سیناپسی منتقل میشوند. نوروپپتیدها در وزیکولهای سیناپسی بستهبندی میشوند که قطر آنها از ۹۰ تا ۲۵۰ نانومتر متغیر است. از آنجا که مراکز این وزیکولها در میکروگرافهای الکترونی متراکم به نظر میرسند، به آنها وزیکولهای بزرگ با هسته متراکم گفته میشود.
After a neurotransmitter has been secreted into the synaptic cleft, it must be removed to enable the postsynaptic cell to engage in another cycle of synaptic transmission. The removal of neurotransmitters involves diffusion away from the postsynaptic receptors, in combination with reuptake into nerve terminals or surrounding glial cells, degradation by specific enzymes, or a combination of these mechanisms. Specific transporter proteins remove most small-molecule neurotransmitters (or their metabolites) from the synaptic cleft, ultimately delivering them back to the presynaptic terminal for reuse (see Chapter 6).
پس از ترشح یک انتقالدهنده عصبی به شکاف سیناپسی، باید آن را حذف کرد تا سلول پسسیناپسی بتواند در چرخه دیگری از انتقال سیناپسی شرکت کند. حذف انتقالدهندههای عصبی شامل انتشار از گیرندههای پسسیناپسی، همراه با جذب مجدد به پایانههای عصبی یا سلولهای گلیال اطراف، تخریب توسط آنزیمهای خاص یا ترکیبی از این مکانیسمها است. پروتئینهای ناقل خاص، اکثر انتقالدهندههای عصبی مولکول کوچک (یا متابولیتهای آنها) را از شکاف سیناپسی حذف میکنند و در نهایت آنها را برای استفاده مجدد به پایانه پیشسیناپسی بازمیگردانند (به فصل 6 مراجعه کنید).
Quantal Release of Neurotransmitters
Much of the evidence leading to the present understanding of chemical synaptic transmission was obtained from experiments examining the release of ACh at neuromuscular junctions. These synapses between spinal motor neurons and skeletal muscle cells are simple, large, and peripherally located, making them particularly amenable to experimental analysis. Such synapses occur at specializations called end plates because of the saucerlike appearance of the site on the muscle fiber where the presynaptic axon elaborates its terminals (Figure 5.5A). Most of the pioneering work on neuromuscular transmission was performed during the 1950s and 1960s by Bernard Katz and his collaborators at University College London. Although Katz worked primarily on the frog neuromuscular junction, numerous subsequent experiments have confirmed the applicability of his observations to transmission at all chemical synapses.
آزادسازی کوانتالی انتقالدهندههای عصبی
بخش عمدهای از شواهدی که منجر به درک فعلی از انتقال سیناپسی شیمیایی شده است، از آزمایشهایی که آزادسازی استیل کولین را در اتصالات عصبی-عضلانی بررسی میکنند، به دست آمده است. این سیناپسها بین نورونهای حرکتی نخاعی و سلولهای ماهیچه اسکلتی ساده، بزرگ و در حاشیه قرار دارند و به طور خاص برای تجزیه و تحلیل تجربی قابل استفاده هستند. چنین سیناپسهایی در تخصصهایی به نام صفحات انتهایی وجود دارند، زیرا ظاهر بشقابمانند محل روی فیبر عضلانی، جایی که آکسون پیشسیناپسی پایانههای خود را میسازد، آنها را به هم متصل میکند (شکل 5.5A). بیشتر کارهای پیشگامانه در مورد انتقال عصبی-عضلانی در دهههای 1950 و 1960 توسط برنارد کاتز و همکارانش در کالج دانشگاهی لندن انجام شد. اگرچه کاتز در درجه اول روی اتصال عصبی-عضلانی قورباغه کار میکرد، آزمایشهای متعدد بعدی، کاربرد مشاهدات او را در انتقال در همه سیناپسهای شیمیایی تأیید کردهاند.
When an intracellular microelectrode is used to record the membrane potential of a muscle cell, an action potential in the presynaptic motor neuron can be seen to elicit a transient depolarization of the postsynaptic muscle fiber. This change in membrane potential, called an end plate potential (EPP), is normally large enough to bring the membrane potential of the muscle cell well above the threshold for producing a postsynaptic action potential (Figure 5.5B). The postsynaptic action potential triggered by the EPP causes the muscle fiber to contract. Unlike at electrical synapses, there is a pronounced delay between the time that the presynaptic motor neuron is stimulated and when the EPP occurs in the postsynaptic muscle cell. This synaptic delay is characteristic of all chemical synapses.
وقتی از یک میکروالکترود درون سلولی برای ثبت پتانسیل غشای یک سلول ماهیچهای استفاده میشود، میتوان مشاهده کرد که یک پتانسیل عمل در نورون حرکتی پیشسیناپسی باعث ایجاد یک دپلاریزاسیون گذرا در فیبر ماهیچهای پسسیناپسی میشود. این تغییر در پتانسیل غشا، که پتانسیل صفحه انتهایی (EPP) نامیده میشود، معمولاً به اندازهای بزرگ است که پتانسیل غشای سلول ماهیچهای را بسیار بالاتر از آستانه تولید پتانسیل عمل پسسیناپسی میآورد (شکل 5.5B). پتانسیل عمل پسسیناپسی که توسط EPP ایجاد میشود، باعث انقباض فیبر ماهیچهای میشود. برخلاف سیناپسهای الکتریکی، بین زمانی که نورون حرکتی پیشسیناپسی تحریک میشود و زمانی که EPP در سلول ماهیچهای پسسیناپسی رخ میدهد، تأخیر قابل توجهی وجود دارد. این تأخیر سیناپسی مشخصه همه سیناپسهای شیمیایی است.
One of Katz’s seminal findings, in studies carried out with Paul Fatt in 1951, was that spontaneous changes in muscle cell membrane potential occur even in the absence of stimulation of the presynaptic motor neuron (Figure 5.5C). These changes have the same shape as EPPs but are much smaller (typically less than 1 mV in amplitude, compared with an EPP of more than 50 mV). Both EPPs and these small, spontaneous events are sensitive to pharmacological agents that block postsynaptic acetylcholine receptors, such as curare (see Box 6A). These and other parallels between EPPs and the spontaneously occurring depolarizations led Katz and his colleagues to call these spontaneous events miniature end plate potentials, or MEPPs.
یکی از یافتههای مهم کاتز، در مطالعاتی که با پاول فت در سال ۱۹۵۱ انجام شد، این بود که تغییرات خودبهخودی در پتانسیل غشای سلول عضلانی حتی در غیاب تحریک نورون حرکتی پیشسیناپسی رخ میدهد (شکل ۵.۵C). این تغییرات شکل مشابهی با EPPها دارند اما بسیار کوچکتر هستند (معمولاً دامنه آنها کمتر از ۱ میلیولت است، در مقایسه با EPP با دامنه بیش از ۵۰ میلیولت). هم EPPها و هم این رویدادهای کوچک و خودبهخودی به عوامل دارویی که گیرندههای استیل کولین پسسیناپسی را مسدود میکنند، مانند کورار (به کادر ۶A مراجعه کنید) حساس هستند. این موارد و سایر شباهتها بین EPPها و دپلاریزاسیونهای خودبهخودی، کاتز و همکارانش را بر آن داشت تا این رویدادهای خودبهخودی را پتانسیلهای صفحه انتهایی مینیاتوری یا MEPP بنامند.
The relationship between the full-blown end plate potential and MEPPs was clarified by careful analysis of the EPPs. The magnitude of the EPP provides a convenient electrical assay of neurotransmitter secretion from a motor neuron terminal; however, measuring it is complicated by the need to prevent muscle contraction from dislodging the microelectrode. The usual means of eliminating muscle contractions is either to lower Ca2+ concentration in the extracellular medium or to partially block the postsynaptic ACh receptors with the drug curare. As expected from the scheme illustrated in Figure 5.4C, lowering the Ca2+ concentration reduces neurotransmitter secretion, thus reducing the magnitude of the EPP below the threshold for postsynaptic action potential production and allowing it to be measured more precisely. Under such conditions, stimulation of the motor neuron produces very small EPPs that fluctuate in amplitude from trial to trial (Figure 5.5D). These fluctuations give considerable insight into the mechanisms responsible for neurotransmitter release. In particular, the variable evoked response in low Ca2+ is now known to result from the release of unit amounts of ACh by the presynaptic nerve terminal. Indeed, the amplitude of the smallest evoked EPP response is strikingly similar to the size of single MEPPs (compare Figure 5.5C and D). Further supporting this similarity, increments in the EPP response (Figure 5.6A) occur in units about the size of single MEPPs (Figure 5.6B). These “quantal” fluctuations in the amplitude of EPPs indicated to Katz and his colleague Jose del Castillo that EPPs are made up of individual units, each equivalent to a MEPP.
رابطه بین پتانسیل کامل صفحه انتهایی و MEPPها با تجزیه و تحلیل دقیق EPPها روشن شد. بزرگی EPP یک سنجش الکتریکی مناسب از ترشح انتقالدهنده عصبی از یک ترمینال نورون حرکتی فراهم میکند. با این حال، اندازهگیری آن به دلیل نیاز به جلوگیری از جابجایی میکروالکترود توسط انقباض عضله پیچیده است. روش معمول برای از بین بردن انقباضات عضلانی، کاهش غلظت +Ca2 در محیط خارج سلولی یا مسدود کردن نسبی گیرندههای ACh پسسیناپسی با کورار دارویی است. همانطور که از طرح نشان داده شده در شکل 5.4C انتظار میرود، کاهش غلظت +Ca2 ترشح انتقالدهنده عصبی را کاهش میدهد، بنابراین بزرگی EPP را به زیر آستانه تولید پتانسیل عمل پسسیناپسی کاهش میدهد و امکان اندازهگیری دقیقتر آن را فراهم میکند. در چنین شرایطی، تحریک نورون حرکتی EPPهای بسیار کوچکی تولید میکند که دامنه آنها از آزمایش به آزمایش دیگر نوسان دارد (شکل 5.5D). این نوسانات بینش قابل توجهی در مورد مکانیسمهای مسئول آزادسازی انتقالدهنده عصبی ارائه میدهند. به طور خاص، اکنون مشخص شده است که پاسخ برانگیخته متغیر در غلظت پایین کلسیم (+Ca2) ناشی از آزادسازی مقادیر واحد استیل کولین توسط پایانه عصبی پیش سیناپسی است. در واقع، دامنه کوچکترین پاسخ EPP برانگیخته به طرز چشمگیری مشابه اندازه MEPP های منفرد است (شکل 5.5C و D را مقایسه کنید). علاوه بر تأیید این شباهت، افزایش در پاسخ EPP (شکل 5.6A) در واحدهایی تقریباً به اندازه MEPP های منفرد رخ میدهد (شکل 5.6B). این نوسانات “کوانتالی” در دامنه EPP ها به کاتز و همکارش خوزه دل کاستیلو نشان داد که EPP ها از واحدهای جداگانهای تشکیل شدهاند که هر کدام معادل یک MEPP هستند.
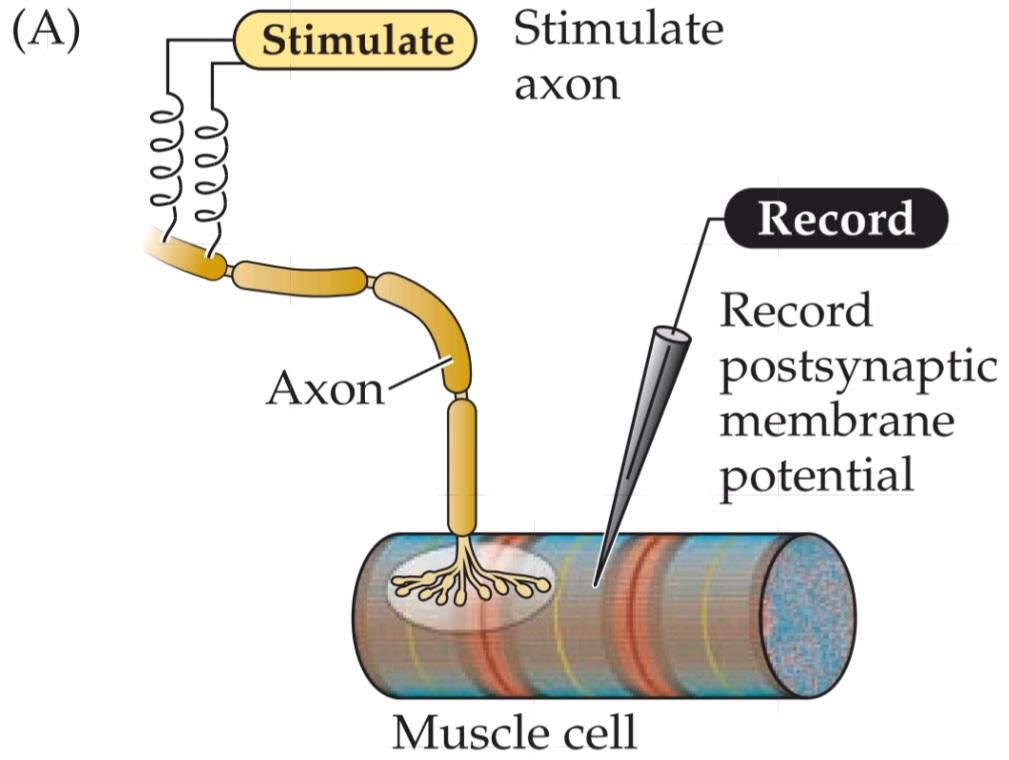



FIGURE 5.5 Synaptic transmission at the neuromuscular junction. (A) Experimental arrangement: The axon of the motor neuron innervating the muscle fiber is stimulated with an extracellular electrode, while an intracellular microelectrode is inserted into the postsynaptic muscle cell to record its electrical responses. (B) End plate potentials (shaded area) evoked by stimulation of a motor neuron are normally above threshold and therefore produce an action potential in the postsynaptic muscle cell. (C) Spontaneous miniature EPPs (MEPPs) occur in the absence of presynaptic stimulation. (D) When the neuromuscular junction is bathed in a solution that has a low concentration of Ca2+, stimulating the motor neuron evokes EPPs whose amplitudes are reduced to about the size of MEPPs. (After Fatt and Katz, 1952.)
شکل ۵.۵ انتقال سیناپسی در محل اتصال عصبی-عضلانی. (الف) چیدمان آزمایش: آکسون نورون حرکتی که فیبر عضلانی را عصبدهی میکند با یک الکترود خارج سلولی تحریک میشود، در حالی که یک میکروالکترود درون سلولی برای ثبت پاسخهای الکتریکی آن به سلول عضلانی پس سیناپسی وارد میشود. (ب) پتانسیلهای صفحه انتهایی (ناحیه سایهدار) که توسط تحریک یک نورون حرکتی برانگیخته میشوند، معمولاً بالاتر از آستانه هستند و بنابراین یک پتانسیل عمل در سلول عضلانی پس سیناپسی ایجاد میکنند. (ج) EPP های مینیاتوری خودبهخودی (MEPP) در غیاب تحریک پیش سیناپسی رخ میدهند. (د) هنگامی که محل اتصال عصبی-عضلانی در محلولی با غلظت کم +Ca2 غوطهور میشود، تحریک نورون حرکتی EPP هایی را برانگیخته میکند که دامنه آنها به اندازه MEPP ها کاهش مییابد. (بعد از Fatt and Katz، 1952.)
The idea that EPPs represent the simultaneous release of many MEPP-like units can be tested statistically. A method of statistical analysis based on the independent occurrence of unitary events (called Poisson statistics) predicts what the distribution of EPP amplitudes would look like during a large number of trials of motor neuron stimulation, under the assumption that EPPs are built up from unitary events represented by MEPPs (see Figure 5.6B). The distribution of EPP amplitudes determined experimentally was found to be just that expected if transmitter release from the motor neuron is indeed quantal (the red curve in Figure 5.6A). Such analyses confirmed the idea that release of acetylcholine does indeed occur in discrete packets, each equivalent to a MEPP. In short, a presynaptic action potential causes a postsynaptic EPP because it synchronizes the release of many transmitter quanta.
این ایده که EPPها نشاندهندهی آزادسازی همزمان بسیاری از واحدهای شبیه MEPP هستند، میتواند از نظر آماری مورد آزمایش قرار گیرد. یک روش تحلیل آماری مبتنی بر وقوع مستقل رویدادهای واحد (به نام آمار پواسون) پیشبینی میکند که توزیع دامنههای EPP در طول تعداد زیادی از آزمایشهای تحریک نورون حرکتی، با این فرض که EPPها از رویدادهای واحدی که توسط MEPPها نشان داده میشوند، ساخته شدهاند (شکل 5.6B را ببینید)، چگونه خواهد بود. توزیع دامنههای EPP که به صورت تجربی تعیین شدهاند، در صورتی که آزادسازی فرستنده از نورون حرکتی واقعاً کوانتالی باشد (منحنی قرمز در شکل 5.6A)، دقیقاً همانطور که انتظار میرفت، مشخص شد. چنین تحلیلهایی این ایده را تأیید کردند که آزادسازی استیل کولین در واقع در بستههای گسسته رخ میدهد که هر کدام معادل یک MEPP هستند. به طور خلاصه، یک پتانسیل عمل پیش سیناپسی باعث یک EPP پس سیناپسی میشود زیرا آزادسازی بسیاری از کوانتهای فرستنده را همزمان میکند.

FIGURE 5.6 Quantized distribution of EPP amplitudes evoked in a low-Ca2+ solution. Peaks of EPP amplitudes (A) tend to occur in integer multiples of the mean amplitude of MEPPs, whose amplitude distribution is shown in (B). The leftmost bar in the EPP amplitude distribution shows trials in which presynaptic stimulation failed to elicit an EPP in the muscle cell. The red curve indicates the prediction of a statistical model based on the assumption that the EPPs result from the independent release of multiple MEPP-like quanta. The observed match, including the predicted number of failures, supports this interpretation. (After Boyd and Martin, 1955.)
شکل ۵.۶ توزیع کوانتیزه دامنههای EPP ایجاد شده در محلول کم +Ca2. قلههای دامنههای EPP (A) معمولاً در مضربهای صحیحی از میانگین دامنه MEPPها رخ میدهند که توزیع دامنه آنها در (B) نشان داده شده است. سمت چپترین نوار در توزیع دامنه EPP، آزمایشهایی را نشان میدهد که در آنها تحریک پیشسیناپسی نتوانسته EPP را در سلول عضلانی ایجاد کند. منحنی قرمز نشاندهنده پیشبینی یک مدل آماری بر اساس این فرض است که EPPها ناشی از آزادسازی مستقل چندین کوانتوم شبیه MEPP هستند. تطابق مشاهده شده، از جمله تعداد پیشبینیشده شکستها، از این تفسیر پشتیبانی میکند. (به نقل از بوید و مارتین، 1955.)
Release of Transmitters from Synaptic Vesicles
The discovery of the quantal release of packets of neurotransmitter immediately raised the question of how such quanta are formed and discharged into the synaptic cleft. At about the time Katz and his colleagues were using physiological methods to discover quantal release of neurotransmitter, electron microscopy revealed, for the first time, the presence of synaptic vesicles in presynaptic terminals. Putting these two discoveries together, Katz and others proposed that synaptic vesicles loaded with transmitter are the source of the quanta. Subsequent biochemical studies confirmed that synaptic vesicles are the repositories of transmitters. These studies have shown that ACh is highly concentrated in the synaptic vesicles of motor neurons, where it is present at a concentration of about 100 mM. Given the diameter of a small clear-core synaptic vesicle (~50 nm), approximately 10,000 molecules of neurotransmitter are contained in a single vesicle. This number corresponds quite nicely to the amount of ACh that must be applied to a neuromuscular junction to mimic a MEPP, providing further support for the idea that quanta arise from discharge of the contents of single synaptic vesicles.
آزادسازی انتقالدهندهها از وزیکولهای سیناپسی
کشف آزادسازی کوانتالی بستههای انتقالدهنده عصبی بلافاصله این سوال را مطرح کرد که چگونه چنین کوانتایی تشکیل و به شکاف سیناپسی تخلیه میشود. تقریباً در زمانی که کاتز و همکارانش از روشهای فیزیولوژیکی برای کشف آزادسازی کوانتالی انتقالدهنده عصبی استفاده میکردند، میکروسکوپ الکترونی برای اولین بار وجود وزیکولهای سیناپسی را در پایانههای پیشسیناپسی آشکار کرد. کاتز و دیگران با کنار هم قرار دادن این دو کشف، پیشنهاد کردند که وزیکولهای سیناپسی پر از انتقالدهنده، منبع کوانتایی هستند. مطالعات بیوشیمیایی بعدی تأیید کردند که وزیکولهای سیناپسی مخازن انتقالدهندهها هستند. این مطالعات نشان دادهاند که استیلکولین در وزیکولهای سیناپسی نورونهای حرکتی بسیار متمرکز است، جایی که غلظت آن حدود 100 میلیمولار است. با توجه به قطر یک وزیکول سیناپسی کوچک با هسته شفاف (حدود ۵۰ نانومتر)، تقریباً ۱۰۰۰۰ مولکول انتقالدهنده عصبی در یک وزیکول واحد وجود دارد. این عدد به خوبی با مقدار استیلکولینی که باید به یک اتصال عصبی-عضلانی اعمال شود تا یک MEPP را تقلید کند، مطابقت دارد و این ایده را که کوانتومها از تخلیه محتویات وزیکولهای سیناپسی واحد ناشی میشوند، بیشتر تأیید میکند.
To prove that quanta are caused by the fusion of individual synaptic vesicles with the plasma membrane, it is necessary to show that each fused vesicle produces a single quantal event in the postsynaptic cell. This challenge was met in the late 1970s, when John Heuser, Tom Reese, and colleagues correlated measurements of vesicle fusion with the quantal content of EPPs at the neuromuscular junction (Figure 5.7A). They used electron microscopy to determine the number of vesicles that fused with the presynaptic plasma membrane at the active zones of presynaptic terminals (Figure 5.7B). By treating terminals with different concentrations of a drug (4-aminopyridine, or 4-AP) that enhances the number of quanta released by single action potentials, it was possible to vary the amount of quantal release, determined from parallel electrical measurements of the quantal content of the EPPs. A comparison of the number of synaptic vesicle fusions observed with the electron microscope and the number of quanta released at the synapse showed a good correlation between these two measures (Figure 5.7C). These results remain one of the strongest lines of support for the idea that a quantum of transmitter release is due to fusion of a single synaptic vesicle with the presynaptic membrane. Subsequent evidence, based on other means of measuring vesicle fusion, has left no doubt about the validity of this interpretation, thereby establishing that chemical synaptic transmission results from the discharge of neurotransmitters from synaptic vesicles.
برای اثبات اینکه کوانتومها در اثر ادغام وزیکولهای سیناپسی منفرد با غشای پلاسما ایجاد میشوند، لازم است نشان داده شود که هر وزیکول ادغامشده یک رویداد کوانتوم واحد در سلول پسسیناپسی ایجاد میکند. این چالش در اواخر دهه 1970 مطرح شد، زمانی که جان هویزر، تام ریس و همکارانشان اندازهگیریهای ادغام وزیکولها را با محتوای کوانتوم EPPها در محل اتصال عصبی-عضلانی مرتبط کردند (شکل 5.7A). آنها از میکروسکوپ الکترونی برای تعیین تعداد وزیکولهایی که با غشای پلاسمایی پیشسیناپسی در مناطق فعال پایانههای پیشسیناپسی ادغام شدند استفاده کردند (شکل 5.7B). با تیمار پایانهها با غلظتهای مختلف یک دارو (4-آمینوپیریدین یا 4-AP) که تعداد کوانتومهای آزاد شده توسط پتانسیلهای عمل واحد را افزایش میدهد، تغییر مقدار آزادسازی کوانتوم، که از اندازهگیریهای الکتریکی موازی محتوای کوانتوم EPPها تعیین میشود، امکانپذیر بود. مقایسه تعداد ادغام وزیکولهای سیناپسی مشاهده شده با میکروسکوپ الکترونی و تعداد کوانتومهای آزاد شده در سیناپس، همبستگی خوبی را بین این دو معیار نشان داد (شکل 5.7C). این نتایج همچنان یکی از قویترین خطوط حمایتی برای این ایده است که یک کوانتوم از آزادسازی فرستنده به دلیل ادغام یک وزیکول سیناپسی واحد با غشای پیشسیناپسی است. شواهد بعدی، بر اساس سایر روشهای اندازهگیری ادغام وزیکول، هیچ شکی در مورد اعتبار این تفسیر باقی نگذاشته است و بدین ترتیب ثابت میکند که انتقال سیناپسی شیمیایی ناشی از تخلیه انتقالدهندههای عصبی از وزیکولهای سیناپسی است.


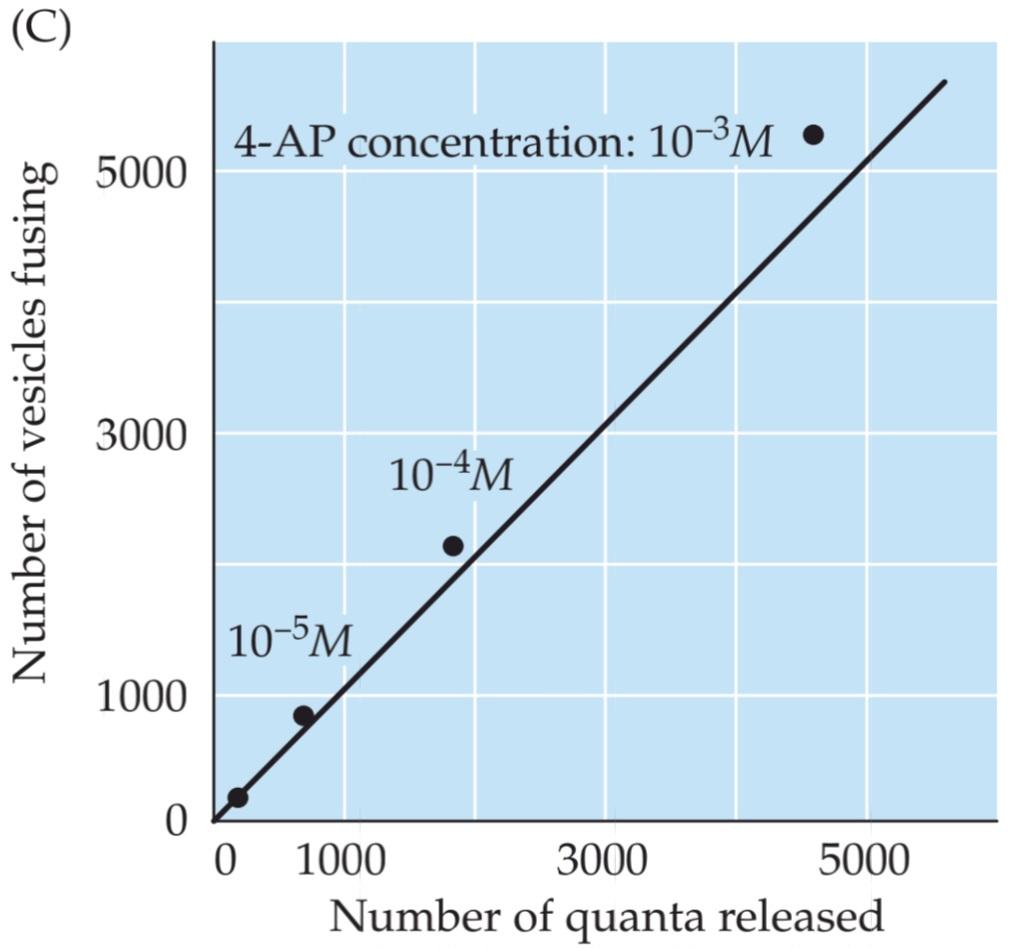
FIGURE 5.7 Relationship between synaptic vesicle exocytosis and quantal transmitter release. (A) Electron micrograph of a frog neuromuscular synapse. This synapse includes a presynaptic motor neuron that innervates a postsynaptic muscle cell and is covered by a type of glial cell called a Schwann cell. The active zone of the presynaptic terminal is the site of synaptic vesicle exocytosis. (B) Top: Active zone of an unstimulated presynaptic terminal. While many synaptic vesicles are present, including several that are docked at the active zone (arrows), none are fusing with the presynaptic plasma membrane. Bottom: Active zone of a terminal stimulated by an action potential; stimulation causes fusion (arrows) of synaptic vesicles with the presynaptic membrane. (C) Comparison of the number of observed vesicle fusion events with the number of quanta released by a presynaptic action potential. Transmitter release was varied by using different concentrations of a drug (4-AP) that affects the duration of the presynaptic action potential, thus changing the amount of calcium that enters during the action potential. The diagonal line is the 1:1 relationship expected if each vesicle that opened released a single quantum of transmitter. (C after Heuser et al., 1979; A and B courtesy of J. Heuser.).
شکل ۵.۷ رابطه بین اگزوسیتوز وزیکول سیناپسی و آزادسازی فرستنده کوانتومی. (الف) تصویر میکروسکوپ الکترونی از سیناپس عصبی-عضلانی قورباغه. این سیناپس شامل یک نورون حرکتی پیشسیناپسی است که یک سلول عضلانی پسسیناپسی را عصبدهی میکند و توسط نوعی سلول گلیال به نام سلول شوان پوشیده شده است. ناحیه فعال ترمینال پیشسیناپسی محل اگزوسیتوز وزیکول سیناپسی است. (ب) بالا: ناحیه فعال یک ترمینال پیشسیناپسی تحریک نشده. در حالی که بسیاری از وزیکولهای سیناپسی وجود دارند، از جمله چندین وزیکول که در ناحیه فعال متصل شدهاند (فلشها)، هیچکدام با غشای پلاسمایی پیشسیناپسی ادغام نمیشوند. پایین: ناحیه فعال یک ترمینال که توسط یک پتانسیل عمل تحریک میشود؛ تحریک باعث ادغام (فلشها) وزیکولهای سیناپسی با غشای پیشسیناپسی میشود. (ج) مقایسه تعداد رویدادهای ادغام وزیکول مشاهده شده با تعداد کوانتومهای آزاد شده توسط یک پتانسیل عمل پیش سیناپسی. آزادسازی فرستنده با استفاده از غلظتهای مختلف دارویی (4-AP) که بر مدت زمان پتانسیل عمل پیش سیناپسی تأثیر میگذارد، تغییر داده شد و در نتیجه مقدار کلسیمی که در طول پتانسیل عمل وارد میشود را تغییر داد. خط مورب، رابطه 1:1 مورد انتظار است اگر هر وزیکولی که باز میشود، یک کوانتوم فرستنده آزاد کند. (C پس از Heuser و همکاران، 1979؛ A و B با احترام از J. Heuser.).
Local Recycling of Synaptic Vesicles
The fusion of synaptic vesicles causes new membrane to be added to the plasma membrane of the presynaptic terminal, but the addition is not permanent. Although a bout of exocytosis can dramatically increase the surface area of presynaptic terminals, this extra membrane is removed within a few minutes. Heuser and Reese performed another important set of experiments showing that the fused vesicle membrane is actually retrieved and taken back into the cytoplasm of the nerve terminal (a process called endocytosis).
بازیافت موضعی وزیکولهای سیناپسی
ادغام وزیکولهای سیناپسی باعث میشود غشای جدیدی به غشای پلاسمایی پایانه پیشسیناپسی اضافه شود، اما این اضافه شدن دائمی نیست. اگرچه یک دوره اگزوسیتوز میتواند به طور چشمگیری سطح پایانههای پیشسیناپسی را افزایش دهد، اما این غشای اضافی ظرف چند دقیقه برداشته میشود. هویزر و ریس مجموعه آزمایشهای مهم دیگری انجام دادند که نشان میداد غشای وزیکول ادغامشده در واقع بازیابی شده و به سیتوپلاسم پایانه عصبی بازگردانده میشود (فرآیندی به نام اندوسیتوز).
The experiments, again carried out at the frog neuromuscular junction, were based on filling the synaptic cleft with horseradish peroxidase (HRP), an enzyme that produces a dense reaction product that is visible in an electron microscope. Under appropriate experimental conditions, endocytosis could then be visualized by the uptake of HRP into the nerve terminal (Figure 5.8). To activate endocytosis, the presynaptic terminal was stimulated with a train of action potentials, and the subsequent fate of the HRP was followed by electron microscopy. Immediately following stimulation, the HRP was found in special endocytotic organelles called coated vesicles, which form from membrane budded off via coated pits (see Figure 5.8B). A few minutes later, however, the coated vesicles had disappeared, and the HRP was found in a different organelle, the endosome (see Figure 5.8C). Finally, within an hour after the terminal had been stimulated, the HRP reaction product appeared inside synaptic vesicles (see Figure 5.8D).
آزمایشها، که دوباره در محل اتصال عصبی-عضلانی قورباغه انجام شد، بر اساس پر کردن شکاف سیناپسی با پراکسیداز ترب کوهی (HRP) بود، آنزیمی که یک محصول واکنش متراکم تولید میکند که در میکروسکوپ الکترونی قابل مشاهده است. تحت شرایط آزمایشگاهی مناسب، اندوسیتوز را میتوان با جذب HRP به ترمینال عصبی مشاهده کرد (شکل 5.8). برای فعال کردن اندوسیتوز، ترمینال پیشسیناپسی با قطاری از پتانسیلهای عمل تحریک شد و سرنوشت بعدی HRP با میکروسکوپ الکترونی دنبال شد. بلافاصله پس از تحریک، HRP در اندامکهای اندوسیتوزی خاصی به نام وزیکولهای پوششدار یافت شد که از غشای جوانهزده از طریق گودالهای پوششدار تشکیل میشوند (شکل 5.8B را ببینید). با این حال، چند دقیقه بعد، وزیکولهای پوششدار ناپدید شدند و HRP در اندامک متفاوتی، اندوزوم، یافت شد (شکل 5.8C را ببینید). در نهایت، ظرف یک ساعت پس از تحریک پایانه، محصول واکنش HRP درون وزیکولهای سیناپسی ظاهر شد (شکل 5.8D را ببینید).
These observations indicate that synaptic vesicle membrane is recycled within the presynaptic terminal via the sequence summarized in Figure 5.8E. In this process, called the synaptic vesicle cycle, the retrieved vesicular membrane passes through several intracellular compartments—such as coated vesicles and endosomes—and is eventually used to make new synaptic vesicles. After synaptic vesicles are re-formed, they are stored in a reserve pool within the cytoplasm until they need to participate again in neurotransmitter release. These vesicles are mobilized from the reserve pool, docked at the presynaptic plasma membrane, and primed to participate in exocytosis once again. More recent experiments, employing a fluorescent label rather than HRP, have determined the time course of synaptic vesicle recycling. These studies indicate that the entire vesicle cycle requires approximately 1 minute, with membrane budding during endocytosis requiring 10 to 20 seconds of this time. As can be seen from the 1-millisecond delay in transmission following excitation of the presynaptic terminal (see Figure 5.5B), membrane fusion during exocytosis is much more rapid than budding during endocytosis. Thus, all of the recycling steps interspersed between membrane fusion and subsequent regeneration of a new vesicle are completed in less than a minute.
این مشاهدات نشان میدهد که غشای وزیکول سیناپسی از طریق توالی خلاصه شده در شکل 5.8E در ترمینال پیشسیناپسی بازیافت میشود. در این فرآیند که چرخه وزیکول سیناپسی نامیده میشود، غشای وزیکول بازیابی شده از چندین محفظه درون سلولی – مانند وزیکولهای پوششدار و اندوزومها – عبور میکند و در نهایت برای ساخت وزیکولهای سیناپسی جدید استفاده میشود. پس از تشکیل مجدد وزیکولهای سیناپسی، آنها در یک مخزن ذخیره در سیتوپلاسم ذخیره میشوند تا زمانی که دوباره نیاز به شرکت در آزادسازی انتقالدهنده عصبی داشته باشند. این وزیکولها از مخزن ذخیره بسیج میشوند، به غشای پلاسمایی پیشسیناپسی متصل میشوند و برای شرکت دوباره در اگزوسیتوز آماده میشوند. آزمایشهای جدیدتر، با استفاده از یک برچسب فلورسنت به جای HRP، سیر زمانی بازیافت وزیکول سیناپسی را تعیین کردهاند. این مطالعات نشان میدهد که کل چرخه وزیکول تقریباً به 1 دقیقه زمان نیاز دارد و جوانه زدن غشا در طول اندوسیتوز به 10 تا 20 ثانیه از این زمان نیاز دارد. همانطور که از تأخیر ۱ میلیثانیهای در انتقال پس از تحریک پایانه پیشسیناپسی (شکل ۵.۵B را ببینید) مشاهده میشود، ادغام غشا در طول اگزوسیتوز بسیار سریعتر از جوانه زدن در طول اندوسیتوز است. بنابراین، تمام مراحل بازیافت بین ادغام غشا و بازسازی بعدی یک وزیکول جدید در کمتر از یک دقیقه تکمیل میشود.

FIGURE 5.8 Local recycling of synaptic vesicles in presynaptic terminals. (A) Horseradish peroxidase (HRP) introduced into the synaptic cleft is used to follow the fate of membrane retrieved from the presynaptic plasma membrane. Stimulation of endocytosis by presynaptic action potentials causes HRP to be taken up into the presynaptic terminals via a pathway that includes (B) coated pits and coated vesicles and (C) endosomes. (D) Eventually, the HRP is found in newly formed synaptic vesicles. (E) Interpretation of the results shown in A–D. Calcium-regulated fusion of vesicles with the presynaptic membrane is followed by endocytotic retrieval of vesicular membrane via coated vesicles and endosomes, and subsequent re-formation of new synaptic vesicles. (After Heuser and Reese, 1973.)
شکل ۵.۸ بازیافت موضعی وزیکولهای سیناپسی در پایانههای پیشسیناپسی. (الف) پراکسیداز ترب کوهی (HRP) که به شکاف سیناپسی وارد میشود، برای دنبال کردن سرنوشت غشای بازیابی شده از غشای پلاسمایی پیشسیناپسی استفاده میشود. تحریک اندوسیتوز توسط پتانسیلهای عمل پیشسیناپسی باعث میشود HRP از طریق مسیری که شامل (ب) گودالهای پوششدار و وزیکولهای پوششدار و (ج) اندوزومها میشود، به پایانههای پیشسیناپسی منتقل شود. (د) در نهایت، HRP در وزیکولهای سیناپسی تازه تشکیل شده یافت میشود. (ه) تفسیر نتایج نشان داده شده در A-D. ادغام وزیکولها با غشای پیشسیناپسی که توسط کلسیم تنظیم میشود، با بازیابی اندوسیتوزی غشای وزیکولی از طریق وزیکولها و اندوزومهای پوششدار و متعاقباً تشکیل مجدد وزیکولهای سیناپسی جدید دنبال میشود. (به نقل از هویزر و ریس، ۱۹۷۳)
The precursors to synaptic vesicles originally are produced in the endoplasmic reticulum and Golgi apparatus in the neuronal cell body. Because of the long distance between the cell body and the presynaptic terminal in most neurons, transport of vesicles from the soma would not permit rapid replenishment of synaptic vesicles during continuous neural activity. Thus, local recycling is well suited to the peculiar anatomy of neurons, giving nerve terminals the means to provide a continual supply of synaptic vesicles.
پیشسازهای وزیکولهای سیناپسی در اصل در شبکه آندوپلاسمی و دستگاه گلژی در جسم سلولی نورونها تولید میشوند. به دلیل فاصله زیاد بین جسم سلولی و پایانه پیشسیناپسی در اکثر نورونها، انتقال وزیکولها از جسم سلولی اجازه جایگزینی سریع وزیکولهای سیناپسی را در طول فعالیت عصبی مداوم نمیدهد. بنابراین، بازیافت موضعی با آناتومی خاص نورونها کاملاً سازگار است و به پایانههای عصبی وسیلهای برای تأمین مداوم وزیکولهای سیناپسی میدهد.
The Role of Calcium in Transmitter Secretion
As was apparent in the experiments of Katz and others described in the preceding sections, lowering the concentration of Ca2+ outside a presynaptic motor nerve terminal reduces the size of the EPP (compare Figure 5.5B and D). Moreover, measurement of the number of transmitter quanta released under such conditions shows that the reason the EPP gets smaller is that lowering Ca2+ concentration decreases the number of vesicles that fuse with the plasma membrane of the terminal. An important insight into how Ca2+ regulates the fusion of synaptic vesicles was the discovery that presynaptic terminals have voltage-gated Ca2+ channels in their plasma membranes (see Chapter 4).
نقش کلسیم در ترشح انتقالدهنده
همانطور که در آزمایشهای کاتز و دیگران که در بخشهای قبلی توضیح داده شد، مشخص شد، کاهش غلظت +Ca2 در خارج از پایانه عصب حرکتی پیشسیناپسی، اندازه EPP را کاهش میدهد (شکل 5.5B و D را مقایسه کنید). علاوه بر این، اندازهگیری تعداد کوانتومهای انتقالدهنده آزاد شده در چنین شرایطی نشان میدهد که دلیل کوچکتر شدن EPP این است که کاهش غلظت +Ca2، تعداد وزیکولهایی را که با غشای پلاسمایی پایانه ادغام میشوند، کاهش میدهد. یک بینش مهم در مورد چگونگی تنظیم ادغام وزیکولهای سیناپسی توسط +Ca2، کشف این بود که پایانههای پیشسیناپسی دارای کانالهای +Ca2 وابسته به ولتاژ در غشای پلاسمایی خود هستند (به فصل 4 مراجعه کنید).
The first indication of presynaptic Ca2+ channels was provided by Katz and Ricardo Miledi. They observed that presynaptic terminals treated with tetrodotoxin (which blocks voltage-gated Na+ channels; see Chapter 3) could still produce a peculiarly prolonged type of action potential. The explanation for this surprising finding was that current was still flowing through Ca2+ channels, substituting for the current ordinarily carried by the blocked Na+ channels. Subsequent voltage clamp experiments, performed by Rodolfo Llinás and others at a giant presynaptic terminal of the squid (Figure 5.9A), confirmed the presence of voltage-gated Ca2+ channels in the presynaptic terminal (Figure 5.9B). Such experiments showed that the amount of neurotransmitter released is very sensitive to the exact amount of Ca2+ that enters. Furthermore, blockade of these Ca2+ channels with drugs also inhibits transmitter release (see Figure 5.9B, right). These observations establish that the voltage-gated Ca2+ channels are directly involved in synaptic transmission: Presynaptic action potentials open these Ca2+ channels, yielding an influx of Ca2+ into the presynaptic terminal.
اولین نشانه از کانالهای +Ca2 پیشسیناپسی توسط کاتز و ریکاردو میلدی ارائه شد. آنها مشاهده کردند که پایانههای پیشسیناپسی تحت درمان با تترودوتوکسین (که کانالهای +Na وابسته به ولتاژ را مسدود میکند؛ به فصل 3 مراجعه کنید) هنوز هم میتوانند یک نوع پتانسیل عمل طولانی مدت و عجیب ایجاد کنند. توضیح این یافته شگفتانگیز این بود که جریان هنوز از طریق کانالهای +Ca2 جریان دارد و جایگزین جریانی میشود که معمولاً توسط کانالهای +Na مسدود شده حمل میشود. آزمایشهای بعدی گیره ولتاژ، که توسط رودولفو لیناس و دیگران در یک پایانه پیشسیناپسی غولپیکر ماهی مرکب انجام شد (شکل 5.9A)، وجود کانالهای +Ca2 وابسته به ولتاژ را در پایانه پیشسیناپسی تأیید کرد (شکل 5.9B). چنین آزمایشهایی نشان داد که مقدار انتقالدهنده عصبی آزاد شده به مقدار دقیق +Ca2 که وارد میشود بسیار حساس است. علاوه بر این، مسدود کردن این کانالهای +Ca2 با داروها نیز آزادسازی فرستنده را مهار میکند (به شکل 5.9B، سمت راست مراجعه کنید). این مشاهدات ثابت میکند که کانالهای +Ca2 وابسته به ولتاژ مستقیماً در انتقال سیناپسی نقش دارند: پتانسیلهای عمل پیشسیناپسی این کانالهای +Ca2 را باز میکنند و باعث ورود +Ca2 به ترمینال پیشسیناپسی میشوند.

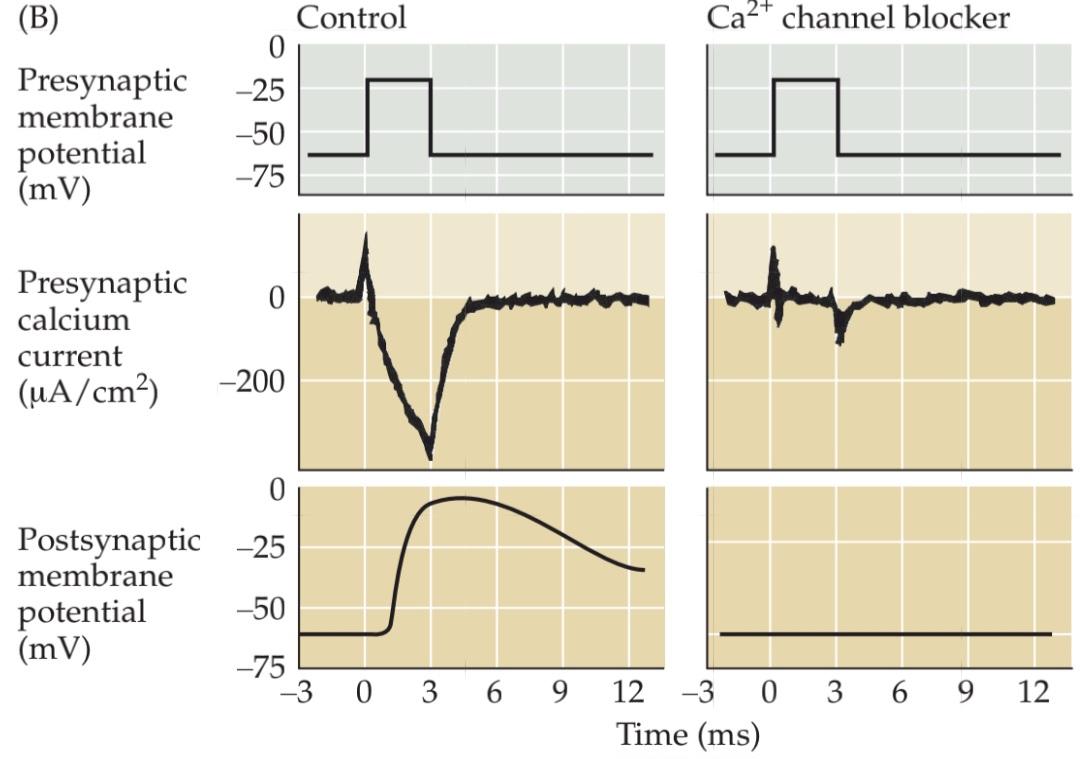
FIGURE 5.9 Entry of Ca2+ through presynaptic voltagegated calcium channels causes transmitter release. Experimental setup using an extraordinarily large synapse in the squid. The voltage clamp method detects currents flowing across the presynaptic membrane when the membrane potential is depolarized. (B) Pharmacological agents that block currents flowing through Na+ and K+ channels reveal a remaining inward current flowing through Ca2+ This influx of calcium triggers transmitter secretion, as indicated by a change in the postsynaptic membrane potential. Treatment of the same presynaptic terminal with cadmium, a calcium channel blocker, eliminates both the presynaptic calcium current and the postsynaptic response.(After Augustine and Eckert, 1984.)
شکل ۵.۹ ورود +Ca2 از طریق کانالهای کلسیمی وابسته به ولتاژ پیشسیناپسی باعث آزادسازی فرستنده میشود. چیدمان آزمایش با استفاده از یک سیناپس فوقالعاده بزرگ در ماهی مرکب. روش گیره ولتاژ، جریانهای جاری در غشای پیشسیناپسی را هنگامی که پتانسیل غشا دپلاریزه میشود، تشخیص میدهد. (ب) عوامل دارویی که جریانهای جاری از طریق کانالهای +Na و +K را مسدود میکنند، یک جریان داخلی باقیمانده را که از طریق +Ca2 جریان مییابد، نشان میدهند. این هجوم کلسیم باعث ترشح فرستنده میشود، همانطور که با تغییر در پتانسیل غشای پسسیناپسی نشان داده میشود. تیمار همان ترمینال پیشسیناپسی با کادمیوم، یک مسدودکننده کانال کلسیم، هم جریان کلسیم پیشسیناپسی و هم پاسخ پسسیناپسی را از بین میبرد. (به نقل از آگوستین و اکرت، ۱۹۸۴.)
As is the case for many other forms of neuronal signaling (see Chapter 7), Ca2+ serves as a second messenger during transmitter release. Ca2+ entering into presynaptic terminals accumulates within the terminal, as can be seen with microscopic imaging of terminals filled with Ca2+-sensitive dyes (Figure 5.10A). The presynaptic second messenger function of Ca2+ has been directly shown in two complementary ways. First, microinjection of Ca2+ into presynaptic terminals triggers transmitter release even in the absence of presynaptic action potentials (Figure 5.10B). Second, presynaptic microinjection of calcium chelators (chemicals that bind Ca2+ and keep its concentration buffered at low levels) prevents presynaptic action potentials from causing transmitter secretion Figure 5.10C). These results prove beyond any doubt that a rise in presynaptic Ca2+ concentration is both necessary and sufficient for neurotransmitter release. While Ca2+ is a universal trigger for transmitter release, not all transmitters are released with the same speed. For example, while secretion of ACh from motor neurons requires only a fraction of a millisecond (see Figure 5.5), release of neuropeptides requires high-frequency bursts of action potentials for many seconds. These differences in the rate of release probably arise from differences in the spatial arrangement of vesicles relative to presynaptic Ca2+ channels, yielding differences in the time course of local Ca2+ signaling.
همانطور که در مورد بسیاری از اشکال دیگر سیگنالینگ عصبی صدق میکند (به فصل 7 مراجعه کنید)، +Ca2 در طول آزادسازی فرستنده به عنوان یک پیامرسان ثانویه عمل میکند. +Ca2 که وارد پایانههای پیشسیناپسی میشود، در داخل پایانه تجمع مییابد، همانطور که با تصویربرداری میکروسکوپی از پایانههای پر از رنگهای حساس به +Ca2 قابل مشاهده است (شکل 5.10A). عملکرد پیامرسان ثانویه پیشسیناپسی +Ca2 به دو روش مکمل به طور مستقیم نشان داده شده است. اول، تزریق ریز +Ca2 به پایانههای پیشسیناپسی، آزادسازی فرستنده را حتی در غیاب پتانسیلهای عمل پیشسیناپسی تحریک میکند (شکل 5.10B). دوم، تزریق ریز پیشسیناپسی شلاتورهای کلسیم (مواد شیمیایی که به +Ca2 متصل میشوند و غلظت آن را در سطوح پایین بافر نگه میدارند) از ایجاد ترشح فرستنده توسط پتانسیلهای عمل پیشسیناپسی جلوگیری میکند (شکل 5.10C). این نتایج بدون هیچ شکی ثابت میکنند که افزایش غلظت +Ca2 پیشسیناپسی برای آزادسازی انتقالدهنده عصبی هم لازم و هم کافی است. اگرچه +Ca2 یک محرک جهانی برای آزادسازی انتقالدهنده است، اما همه انتقالدهندهها با سرعت یکسانی آزاد نمیشوند. به عنوان مثال، در حالی که ترشح ACh از نورونهای حرکتی تنها به کسری از میلیثانیه نیاز دارد (شکل 5.5 را ببینید)، آزادسازی نوروپپتیدها به انفجارهای فرکانس بالای پتانسیلهای عمل برای ثانیههای زیادی نیاز دارد. این تفاوتها در سرعت آزادسازی احتمالاً ناشی از تفاوت در چیدمان فضایی وزیکولها نسبت به کانالهای +Ca2 پیشسیناپسی است که منجر به تفاوت در سیر زمانی سیگنالینگ +Ca2 موضعی میشود.


FIGURE 5.10 Evidence that a rise in presynaptic Ca2+ concentration triggers transmitter release from presynaptic terminals. (A) Fluorescence microscopy measurements of presynaptic Ca2+ concentration at the squid giant synapse (see Figure 5.9A). A train of presynaptic action potentials causes a rise in Ca2+ concentration, as revealed by a dye (called fura-2) that fluoresces more strongly when the Ca2+ concentration increases (colors). (B) Microinjection of Ca2+ into a squid giant presynaptic terminal triggers transmitter release, measured as a depolarization of the postsynaptic membrane potential. (C) Microinjection of BAPTA, a Ca2+ chelator, into a squid giant presynaptic terminal prevents transmitter release. (A from Smith et al., 1993; B after Miledi, 1973; C after Adler et al., 1991.)
شکل ۵.۱۰ شواهدی مبنی بر اینکه افزایش غلظت +Ca2 پیشسیناپسی باعث آزاد شدن فرستنده از پایانههای پیشسیناپسی میشود. (الف) اندازهگیریهای میکروسکوپی فلورسانس از غلظت +Ca2 پیشسیناپسی در سیناپس غولپیکر ماهی مرکب (شکل 5.9A را ببینید). یک رشته پتانسیل عمل پیشسیناپسی باعث افزایش غلظت +Ca2 میشود، همانطور که توسط یک رنگ (به نام fura-2) نشان داده شده است که با افزایش غلظت +Ca2، فلورسانس بیشتری دارد (رنگها). (ب) تزریق ریز +Ca2 به پایانه پیشسیناپسی غولپیکر ماهی مرکب باعث آزاد شدن فرستنده میشود که به عنوان دپلاریزاسیون پتانسیل غشای پسسیناپسی اندازهگیری میشود. (ج) تزریق ریز BAPTA، یک کلاتور +Ca2، به پایانه پیشسیناپسی غولپیکر ماهی مرکب از آزاد شدن فرستنده جلوگیری میکند. (الف از اسمیت و همکاران، 1993؛ ب از میلدی، 1973؛ ج از آدلر و همکاران، 1991.)
Molecular Mechanisms of Synaptic Vesicle Cycling
Precisely how an increase in presynaptic Ca2+ concentration goes on to trigger vesicle fusion and neurotransmitter release is not fully understood. Molecular studies have identified and characterized the proteins found on synaptic vesicles (Figure 5.11A) and their binding partners on the presynaptic plasma membrane and cytoplasm. Most, if not all, of these proteins act at one or more steps in the synaptic vesicle cycle (Figure 5.11B).
مکانیسمهای مولکولی چرخه وزیکول سیناپسی
اینکه دقیقاً چگونه افزایش غلظت +Ca2 پیشسیناپسی باعث ادغام وزیکولها و آزادسازی انتقالدهنده عصبی میشود، بهطور کامل درک نشده است. مطالعات مولکولی پروتئینهای موجود در وزیکولهای سیناپسی (شکل 5.11A) و شرکای اتصال آنها در غشای پلاسمایی پیشسیناپسی و سیتوپلاسم را شناسایی و توصیف کردهاند. اکثر این پروتئینها، اگر نگوییم همه، در یک یا چند مرحله از چرخه وزیکول سیناپسی عمل میکنند (شکل 5.11B).
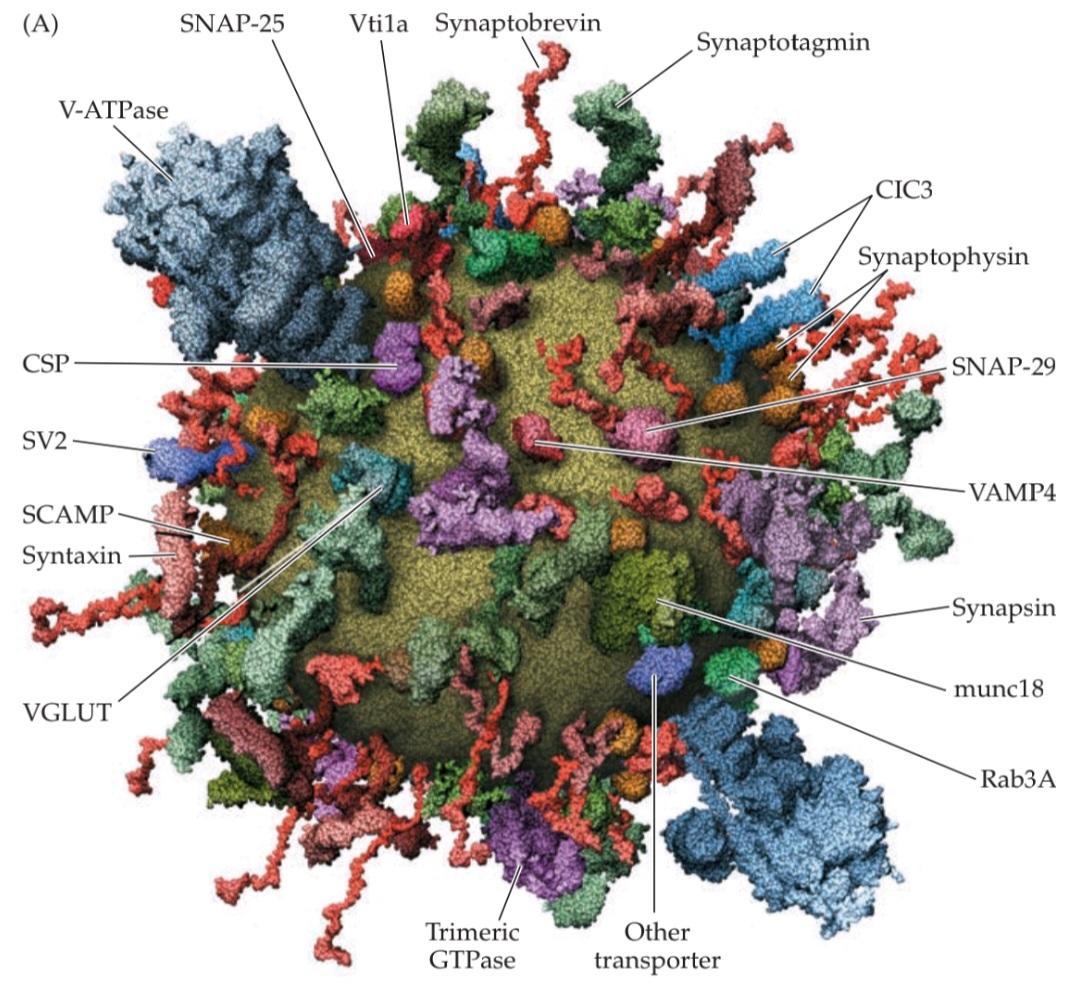

FIGURE 5.11 Presynaptic proteins and their roles in synaptic vesicle cycling. (A) Model of the molecular organization of a synaptic vesicle. The cytoplasmic surface of the vesicle membrane is densely covered by proteins, only 70% of which are shown here. (B) The vesicle trafficking cycle shown in Figure 5.8E is now known to be mediated by numerous presynaptic proteins, including some of those shown in (A), with different proteins participating in different reactions. (A from Takamori et al., 2006.)
شکل ۵.۱۱ پروتئینهای پیشسیناپسی و نقش آنها در چرخه وزیکول سیناپسی. (الف) مدل سازماندهی مولکولی یک وزیکول سیناپسی. سطح سیتوپلاسمی غشای وزیکول به طور متراکم توسط پروتئینها پوشیده شده است که تنها 70٪ از آنها در اینجا نشان داده شده است. (ب) اکنون مشخص شده است که چرخه انتقال وزیکول که در شکل 5.8E نشان داده شده است، توسط پروتئینهای پیشسیناپسی متعددی، از جمله برخی از پروتئینهای نشان داده شده در (الف)، انجام میشود و پروتئینهای مختلف در واکنشهای مختلف شرکت میکنند. (الف از تاکاموری و همکاران، 2006.)
Several lines of evidence indicate that the protein synapsin, which reversibly binds to synaptic vesicles, may keep these vesicles tethered within the reserve pool by cross-linking vesicles to each other. Mobilization of these reserve pool vesicles is caused by phosphorylation of synapsin by proteins kinases, most notably the Ca2+/calmodulin-dependent protein kinase, type II (CaMKII; see Chapter 7), which allows synapsin to dissociate from the vesicles. Once vesicles are free from their reserve pool tethers, they make their way to the plasma membrane and are then attached to this membrane by docking reactions that involve SNARE proteins (see below). A series of priming reactions then prepares the vesicular and plasma membranes for fusion. A large number of proteins are involved in priming, including some proteins that are also involved in other types of membrane fusion events common to all cells (see Figure 5.11B). For example, two proteins originally found to be important for the fusion of vesicles with membranes of the Golgi apparatus, the ATPase NSF (NEM-sensitive fusion protein) and SNAPs (soluble NSF-attachment proteins), are also involved in priming synaptic vesicles for fusion. These two proteins work by regulating the assembly of other proteins that are called SNAREs (SNAP receptors). Many of the other proteins involved in priming—such as munc13, munc18, complexin, snapin, syntaphilin, and tomosyn— also interact with the SNAREs.
شواهد متعددی نشان میدهد که پروتئین سیناپسین، که به طور برگشتپذیر به وزیکولهای سیناپسی متصل میشود، ممکن است این وزیکولها را با اتصال عرضی وزیکولها به یکدیگر، در مخزن ذخیره نگه دارد. حرکت این وزیکولهای مخزن ذخیره ناشی از فسفوریلاسیون سیناپسین توسط پروتئین کینازها، به ویژه پروتئین کیناز وابسته به +Ca2/کالمودولین نوع II (CaMKII؛ به فصل 7 مراجعه کنید) است که به سیناپسین اجازه میدهد از وزیکولها جدا شود. هنگامی که وزیکولها از بندهای مخزن ذخیره خود آزاد میشوند، راه خود را به غشای پلاسمایی باز میکنند و سپس با واکنشهای اتصال که شامل پروتئینهای SNARE هستند (به زیر مراجعه کنید)، به این غشا متصل میشوند. سپس مجموعهای از واکنشهای آغازگر، غشاهای وزیکولی و پلاسما را برای ادغام آماده میکند. تعداد زیادی از پروتئینها در آغازگر دخیل هستند، از جمله برخی از پروتئینهایی که در انواع دیگر رویدادهای ادغام غشایی مشترک در همه سلولها نیز دخیل هستند (به شکل 5.11B مراجعه کنید). برای مثال، دو پروتئین که در ابتدا برای ادغام وزیکولها با غشاهای دستگاه گلژی مهم تشخیص داده شدند، یعنی ATPase NSF (پروتئین ادغام حساس به NEM) و SNAPها (پروتئینهای محلول اتصال NSF)، در آمادهسازی وزیکولهای سیناپسی برای ادغام نیز نقش دارند. این دو پروتئین با تنظیم مونتاژ پروتئینهای دیگری که SNARE (گیرندههای SNAP) نامیده میشوند، عمل میکنند. بسیاری از پروتئینهای دیگر دخیل در آمادهسازی – مانند munc13، munc18، کمپلکسین، اسناپین، سینتافیلین و توموسین – نیز با SNAREها تعامل دارند.
One of the main purposes of priming is to organize SNARE proteins into the correct conformation for membrane fusion. One of the SNARE proteins, synaptobrevin, is in the membrane of synaptic vesicles, while two other SNARE proteins called syntaxin and SNAP-25 are found primarily on the plasma membrane. These SNARE proteins can form a macromolecular complex that spans the two membranes, thus bringing them into close apposition (Figure 5.12A). Such an arrangement is well suited to promote the fusion of the two membranes, and several lines of evidence suggest that this is what actually occurs. One important observation is that toxins that cleave the SNARE proteins block neurotransmitter release (Clinical Applications). In addition, putting SNARE proteins into artificial lipid membranes and allowing these proteins to form complexes with each other causes the membranes to fuse.
یکی از اهداف اصلی آمادهسازی، سازماندهی پروتئینهای SNARE در ساختار صحیح برای ادغام غشا است. یکی از پروتئینهای SNARE، سیناپتوبرووین، در غشای وزیکولهای سیناپسی است، در حالی که دو پروتئین SNARE دیگر به نامهای سینتاکسین و SNAP-25 عمدتاً در غشای پلاسما یافت میشوند. این پروتئینهای SNARE میتوانند یک کمپلکس ماکرومولکولی تشکیل دهند که دو غشا را در بر میگیرد و بنابراین آنها را در مجاورت نزدیک قرار میدهد (شکل 5.12A). چنین ترتیبی برای تقویت ادغام دو غشا بسیار مناسب است و شواهد متعددی نشان میدهد که این همان چیزی است که در واقع اتفاق میافتد. یک مشاهده مهم این است که سمومی که پروتئینهای SNARE را تجزیه میکنند، آزادسازی انتقالدهنده عصبی را مسدود میکنند (کاربردهای بالینی). علاوه بر این، قرار دادن پروتئینهای SNARE در غشاهای لیپیدی مصنوعی و اجازه دادن به این پروتئینها برای تشکیل کمپلکس با یکدیگر، باعث ادغام غشاها میشود.
Because the SNARE proteins do not bind Ca2+, still other molecules must be responsible for Ca2+ regulation of neurotransmitter release. Numerous presynaptic proteins, including calmodulin, CAPS, and munc-13, are capable of binding Ca2+. However, it appears that Ca2+ regulation of neurotransmitter release usually is conferred by synaptotagmins, a family of proteins found in the membrane of synaptic vesicles (see Figure 5.12A). Synaptotagmin binds Ca2+ at concentrations similar to those required to trigger vesicle fusion within the presynaptic terminal, and this property allows synaptotagmin to act as a Ca2+ sensor that triggers vesicle fusion by signaling the elevation of Ca2+ within the terminal. In support of this idea, disruption of synaptotagmin in the presynaptic terminals of mice, fruit flies, squid, and other experimental animals impairs Ca2+-dependent neurotransmitter release. In fact, deletion of only one of the 17 synaptotagmin genes (SYT) of mice is a lethal mutation, causing the mice to die soon after birth. It is thought that Ca2+ binding to synaptotagmin leads to exocytosis by changing the chemical properties of synaptotagmin, thereby allowing it to insert into the plasma membrane. This causes the plasma membrane to locally curve and leads to fusion of the two membranes. Thus, SNARE proteins bring the two membranes close together, while Ca2+-induced changes in synaptotagmin then produce the final curvature that enables rapid fusion of these membranes (Figure 5.12B).
از آنجا که پروتئینهای SNARE به +Ca2 متصل نمیشوند، هنوز مولکولهای دیگری باید مسئول تنظیم +Ca2 آزادسازی انتقالدهنده عصبی باشند. پروتئینهای پیشسیناپسی متعددی، از جمله کالمودولین، CAPS و munc-13، قادر به اتصال +Ca2 هستند. با این حال، به نظر میرسد که تنظیم +Ca2 آزادسازی انتقالدهنده عصبی معمولاً توسط سیناپتوتاگمینها، خانوادهای از پروتئینهای موجود در غشای وزیکولهای سیناپسی، انجام میشود (شکل 5.12A را ببینید). سیناپتوتاگمین، +Ca2 را در غلظتهایی مشابه غلظتهای مورد نیاز برای شروع ادغام وزیکول در ترمینال پیشسیناپسی متصل میکند و این ویژگی به سیناپتوتاگمین اجازه میدهد تا به عنوان یک حسگر +Ca2 عمل کند که با سیگنالدهی افزایش +Ca2 در ترمینال، ادغام وزیکول را آغاز میکند. در تأیید این ایده، اختلال در سیناپتوتاگمین در پایانههای پیشسیناپسی موشها، مگسهای میوه، ماهی مرکب و سایر حیوانات آزمایشگاهی، آزادسازی انتقالدهنده عصبی وابسته به +Ca2 را مختل میکند. در واقع، حذف تنها یکی از 17 ژن سیناپتوتاگمین (SYT) موشها یک جهش کشنده است که باعث میشود موشها اندکی پس از تولد بمیرند. تصور میشود که اتصال +Ca2 به سیناپتوتاگمین با تغییر خواص شیمیایی سیناپتوتاگمین منجر به اگزوسیتوز میشود و در نتیجه به آن اجازه میدهد تا وارد غشای پلاسما شود. این امر باعث میشود غشای پلاسما به صورت موضعی خمیده شود و منجر به ادغام دو غشا شود. بنابراین، پروتئینهای SNARE دو غشا را به هم نزدیک میکنند، در حالی که تغییرات القا شده توسط +Ca2 در سیناپتوتاگمین، انحنای نهایی را ایجاد میکند که ادغام سریع این غشاها را ممکن میسازد (شکل 5.12B).


FIGURE 5.12 Molecular mechanisms of exocytosis during neurotransmitter release. (A) Structure of the SNARE complex. The vesicular SNARE, synaptobrevin (blue), forms a helical complex with the plasma membrane SNAREs syntaxin (red) and SNAP-25 (green). Also shown is the structure of synaptotagmin, a vesicular Ca2+-binding protein, with bound Ca2+ indicated by spheres. (B) A model for Ca2+-triggered vesicle fusion. During docking of the synaptic vesicle, SNARE proteins on the vesicle and plasma membranes form a complex (as in A) that brings together the two membranes. Synaptotagmin binds to this SNARE complex. Subsequent binding of Ca2+ to synaptotagmin causes the cytoplasmic region of this protein to insert into the plasma membrane to produce the membrane curvature that catalyzes membrane fusion. (A from Sutton et al., 1998 and Madej et al., 2014; B after Zhou et al., 2015.)
شکل ۵.۱۲ مکانیسمهای مولکولی اگزوسیتوز در طول آزادسازی انتقالدهنده عصبی. (الف) ساختار کمپلکس SNARE. SNARE وزیکولی، سیناپتوبرووین (آبی)، یک کمپلکس مارپیچی با سینتاکسین غشای پلاسمایی SNAREها (قرمز) و SNAP-25 (سبز) تشکیل میدهد. همچنین ساختار سیناپتوتاگمین، یک پروتئین متصل شونده به +Ca2 وزیکولی، با +Ca2 متصل که با کره نشان داده شده است، نشان داده شده است. (ب) مدلی برای همجوشی وزیکول ناشی از +Ca2. در طول اتصال وزیکول سیناپسی، پروتئینهای SNARE روی وزیکول و غشاهای پلاسمایی یک کمپلکس (مانند شکل A) تشکیل میدهند که دو غشا را به هم نزدیک میکند. سیناپتوتاگمین به این کمپلکس SNARE متصل میشود. اتصال بعدی +Ca2 به سیناپتوتاگمین باعث میشود ناحیه سیتوپلاسمی این پروتئین وارد غشای پلاسما شود تا انحنای غشایی را ایجاد کند که همجوشی غشا را کاتالیز میکند. (الف از ساتون و همکاران، ۱۹۹۸ و مادج و همکاران، ۲۰۱۴؛ ب از ژو و همکاران، ۲۰۱۵.)
CLINICAL APPLICATIONS
Disorders That Affect the Presynaptic Terminal
Defects in various steps in the exocytosis and endocytosis of synaptic vesicles have been shown to be at the root of several rare but debilitating neurological diseases.
کاربردهای بالینی
اختلالاتی که بر پایانه پیش سیناپسی تأثیر میگذارند
نقص در مراحل مختلف اگزوسیتوز و اندوسیتوز وزیکولهای سیناپسی، ریشه چندین بیماری عصبی نادر اما ناتوانکننده است.
Myasthenic syndromes
In myasthenic syndromes, abnormal transmission at neuromuscular synapses leads to weakness and fatigability of skeletal muscles. Some of these syndromes affect the acetylcholinesterase that degrades acetylcholine in the synaptic cleft; others arise from autoimmune attack of acetylcholine receptors (see Clinical Applications, Chapter 6); and yet others affect acetylcholine release from motor neurons. One of the best understood myasthenic syndromes is Lambert-Eaton myasthenic syndrome, or LEMS, an occasional complication in patients with certain kinds of cancers. Biopsies of muscle tissue removed from LEMS patients allow intracellular recordings identical to those in Figure 5.5. These recordings from affected tissues show that when a motor neuron is stimulated, the number of quanta contained in EPPs is greatly reduced while the size of individual quanta is unaffected. Several lines of evidence indicate that this reduc-tion in neurotransmitter release is due to a loss of voltage-gated Ca2+ channels in the presynaptic terminal of motor neurons (see Figure A); perhaps most compelling are anatomical studies that reveal a lowered density of Ca2+ channels in the presynaptic plasma membrane.
سندرمهای میاستنی
در سندرمهای میاستنی، انتقال غیرطبیعی در سیناپسهای عصبی-عضلانی منجر به ضعف و خستگی عضلات اسکلتی میشود. برخی از این سندرمها بر استیل کولین استراز که استیل کولین را در شکاف سیناپسی تجزیه میکند، تأثیر میگذارند. برخی دیگر از حمله خودایمنی گیرندههای استیل کولین ناشی میشوند (به کاربردهای بالینی، فصل 6 مراجعه کنید)؛ و برخی دیگر بر آزادسازی استیل کولین از نورونهای حرکتی تأثیر میگذارند. یکی از شناختهشدهترین سندرمهای میاستنی، سندرم میاستنی لامبرت-ایتون یا LEMS است که عارضهای گاه به گاه در بیماران مبتلا به انواع خاصی از سرطان است. بیوپسیهای بافت عضلانی برداشته شده از بیماران LEMS امکان ثبتهای درون سلولی مشابه با موارد موجود در شکل 5.5 را فراهم میکند. این ثبتها از بافتهای آسیبدیده نشان میدهند که وقتی یک نورون حرکتی تحریک میشود، تعداد کوانتومهای موجود در EPPها به میزان زیادی کاهش مییابد در حالی که اندازه کوانتومهای منفرد تحت تأثیر قرار نمیگیرد. شواهد متعددی نشان میدهند که این کاهش در آزادسازی انتقالدهندههای عصبی به دلیل از بین رفتن کانالهای +Ca2 وابسته به ولتاژ در پایانه پیشسیناپسی نورونهای حرکتی است (شکل A را ببینید)؛ شاید قانعکنندهترین آنها مطالعات آناتومیکی باشند که تراکم کمتر کانالهای +Ca2 را در غشای پلاسمایی پیشسیناپسی نشان میدهند.
The loss of presynaptic Ca2+ channels in LEMS patients apparently arises from an autoimmune disorder. Their blood has a very high concentration of antibodies that bind to Ca2+ channels, and it seems likely that these antibodies are the primary cause of LEMS. For example, removal of Ca2+ channel antibodies from the blood of LEMS patients by plasma exchange reduces muscle weakness. Similarly, immunosuppressant drugs also can alleviate LEMS symptoms. Perhaps most telling, injecting these antibodies into experimental animals elicits muscle weakness and abnormal neuromuscular transmission.
ظاهراً از بین رفتن کانالهای پیشسیناپسی +Ca2 در بیماران LEMS ناشی از یک اختلال خودایمنی است. خون آنها غلظت بسیار بالایی از آنتیبادیهایی دارد که به کانالهای +Ca2 متصل میشوند و به نظر میرسد که این آنتیبادیها علت اصلی LEMS هستند. به عنوان مثال، حذف آنتیبادیهای کانال +Ca2 از خون بیماران LEMS با تعویض پلاسما، ضعف عضلانی را کاهش میدهد. به طور مشابه، داروهای سرکوبکننده سیستم ایمنی نیز میتوانند علائم LEMS را کاهش دهند. شاید گویاترین نکته، تزریق این آنتیبادیها به حیوانات آزمایشگاهی باشد که باعث ضعف عضلانی و انتقال عصبی-عضلانی غیرطبیعی میشود.
Why the immune system generates antibodies against Ca2+ channels is not clear. Most LEMS patients have small-cell carcinoma, a form of lung cancer that may somehow initiate the immune response to Ca2+ channels. Whatever the origin, the binding of antibodies to Ca2+ channels reduces the ability of these channels to carry Ca2+ current. It is this antibody-induced defect in presynaptic Ca2+ entry that accounts for the muscle weakness associated with LEMS.
اینکه چرا سیستم ایمنی آنتیبادیهایی علیه کانالهای +Ca2 تولید میکند، مشخص نیست. اکثر بیماران LEMS مبتلا به کارسینوم سلول کوچک هستند، نوعی سرطان ریه که ممکن است به نحوی پاسخ ایمنی به کانالهای +Ca2 را آغاز کند. منشأ این امر هرچه که باشد، اتصال آنتیبادیها به کانالهای +Ca2 توانایی این کانالها را در حمل جریان +Ca2 کاهش میدهد. این نقص ناشی از آنتیبادی در ورود +Ca2 پیشسیناپسی است که ضعف عضلانی مرتبط با LEMS را توضیح میدهد.
Congenital myasthenic syndromes are genetic disorders that, like LEMS, cause muscle weakness by affecting neuromuscular transmission. Several congenital myasthenic syndromes also arise from defects in acetylcholine release from the motor neuron terminal. Neuromuscular synapses in some of these patients have EPPs with reduced quantal content, a deficit that is especially prominent when the synapse is activated repeatedly. Electron microscopy shows that presynaptic motor nerve terminals have a greatly reduced number of synaptic vesicles. The defect in neurotransmitter release evidently results from an inadequate number of synaptic vesicles available for release during sustained presynaptic activity. The origins of this shortage of synaptic vesicles is not clear, but could result either from an impairment in endocytosis in the nerve terminal (see Figure A) or from a reduced supply of vesicle components from the motor neuron cell body.
سندرمهای میاستنی مادرزادی، اختلالات ژنتیکی هستند که مانند LEMS، با تأثیر بر انتقال عصبی-عضلانی، باعث ضعف عضلانی میشوند. چندین سندرم میاستنی مادرزادی نیز از نقص در آزادسازی استیل کولین از پایانه نورون حرکتی ناشی میشوند. سیناپسهای عصبی-عضلانی در برخی از این بیماران دارای EPPهایی با محتوای کمی کاهشیافته هستند، نقصی که به ویژه هنگامی که سیناپس به طور مکرر فعال میشود، برجسته است. میکروسکوپ الکترونی نشان میدهد که پایانههای عصبی حرکتی پیشسیناپسی تعداد بسیار کمی وزیکول سیناپسی دارند. نقص در آزادسازی انتقالدهنده عصبی ظاهراً ناشی از تعداد ناکافی وزیکولهای سیناپسی موجود برای آزادسازی در طول فعالیت پیشسیناپسی پایدار است. منشأ این کمبود وزیکولهای سیناپسی مشخص نیست، اما میتواند ناشی از اختلال در اندوسیتوز در پایانه عصبی (شکل A را ببینید) یا از کاهش عرضه اجزای وزیکول از جسم سلولی نورون حرکتی باشد.
Still other patients suffering from familial infantile myasthenia appear to have neuromuscular weakness that arises from reductions in the size of individual quanta rather than the number of quanta released. Motor nerve terminals from these patients have synaptic vesicles that are typical in number but smaller than usual in diameter. This finding suggests a different type of genetic lesion that somehow alters formation of new synaptic vesicles following endocytosis, leading to less acetylcholine in each vesicle.
با این حال، به نظر میرسد سایر بیمارانی که از میاستنی مادرزادی خانوادگی رنج میبرند، ضعف عصبی-عضلانی دارند که ناشی از کاهش اندازه کوانتومهای منفرد است، نه تعداد کوانتومهای آزاد شده. پایانههای عصبی حرکتی این بیماران دارای وزیکولهای سیناپسی هستند که از نظر تعداد معمول اما از نظر قطر کوچکتر از حد معمول هستند. این یافته نشان دهنده نوع متفاوتی از ضایعه ژنتیکی است که به نوعی تشکیل وزیکولهای سیناپسی جدید را پس از اندوسیتوز تغییر میدهد و منجر به استیل کولین کمتر در هر وزیکول میشود.
Botulism and tetanus
Impairment of synaptic transmitter release also results from poisoning by anaerobic Clostridium bacteria. This genus of microorganisms produces some of the most potent toxins known, including several botulinum toxins and tetanus toxin. Both botulism and tetanus are potentially deadly disorders.
بوتولیسم و کزاز
اختلال در آزادسازی فرستنده سیناپسی همچنین ناشی از مسمومیت با باکتریهای بیهوازی کلستریدیوم است. این جنس از میکروارگانیسمها برخی از قویترین سموم شناخته شده، از جمله چندین سم بوتولینوم و سم کزاز را تولید میکنند. هم بوتولیسم و هم کزاز اختلالات بالقوه کشندهای هستند.
Botulism can occur by consuming food containing Clostridium bacteria, or by infection of wounds with the spores of these ubiquitous organisms. In either case, the presence of the toxin can cause paralysis of peripheral neuromuscular synapses due to impaired neurotransmitter release. This interference with neuromuscular transmission causes skeletal muscle weakness; in extreme cases respiratory failure results from paralysis of the diaphragm and other muscles required for breathing. Botulinum toxins also block synapses innervating the smooth muscles of several organs, giving rise to visceral motor dysfunction. This paralysis of neuromuscular transmission also serves as the basis for clinical use of botulinum toxin in cosmetic surgery and other applications where highly local relaxation of muscle contraction is of therapeutic benefit to the patient.
بوتولیسم میتواند با مصرف غذای حاوی باکتری کلستریدیوم یا با عفونت زخمها با اسپورهای این ارگانیسمهای فراگیر رخ دهد. در هر دو مورد، وجود سم میتواند به دلیل اختلال در آزادسازی انتقالدهندههای عصبی، باعث فلج سیناپسهای عصبی-عضلانی محیطی شود. این تداخل در انتقال عصبی-عضلانی باعث ضعف عضلات اسکلتی میشود. در موارد شدید، نارسایی تنفسی ناشی از فلج دیافراگم و سایر عضلات مورد نیاز برای تنفس است. سموم بوتولینوم همچنین سیناپسهایی را که عضلات صاف چندین اندام را عصبدهی میکنند، مسدود میکنند و باعث اختلال عملکرد حرکتی احشایی میشوند. این فلج انتقال عصبی-عضلانی همچنین به عنوان مبنایی برای استفاده بالینی از سم بوتولینوم در جراحی زیبایی و سایر کاربردهایی که در آنها شل شدن موضعی شدید انقباض عضلات برای بیمار مفید است، عمل میکند.
(A) Presynaptic targets of several neurological.
(الف) اهداف پیشسیناپسی چندین سیستم عصبی.
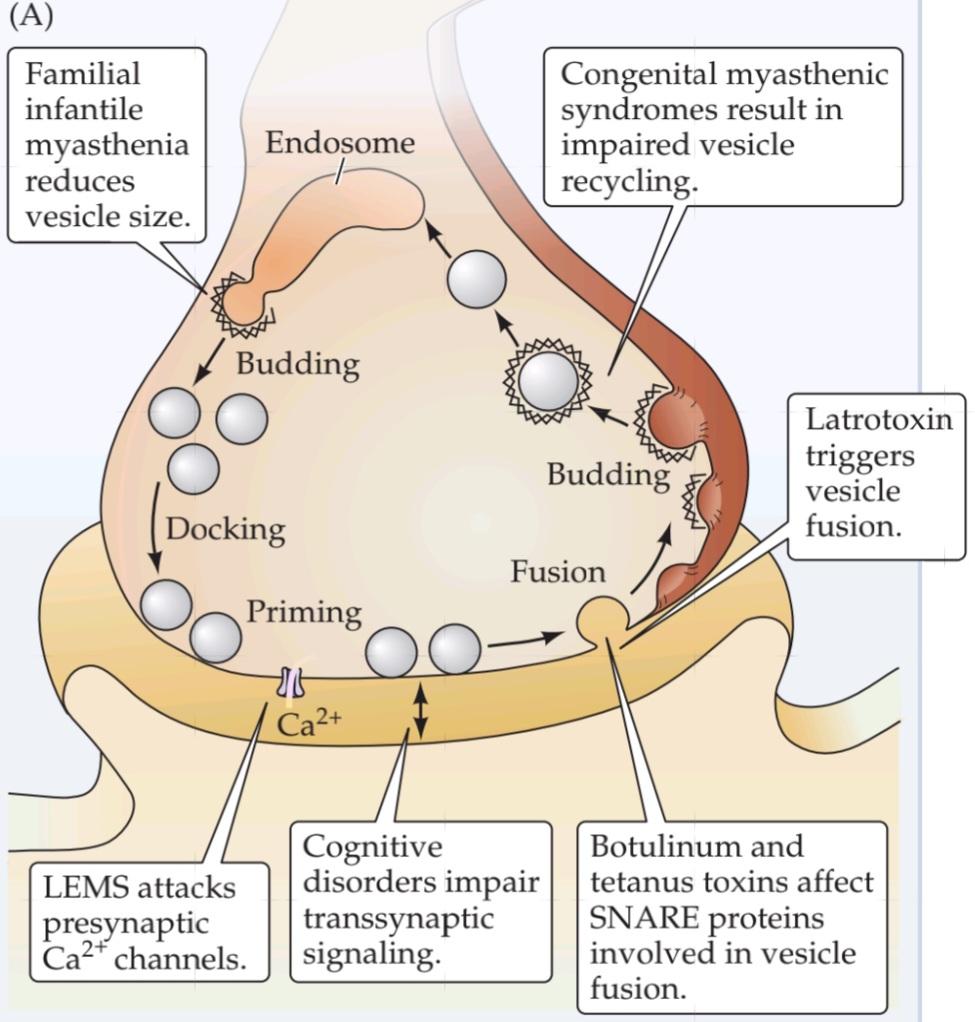
Tetanus typically results from the contamination of puncture wounds by Clostridium bacteria that produce tetanus toxin. In contrast to botulism, tetanus poisoning blocks the release of inhibitory transmitters from interneurons in the spinal cord. This effect causes a loss of synaptic inhibition on spinal motor neurons (see Chapter 16), producing hyperexcitation of skeletal muscle and tetanic contractions in affected muscles (hence the name of the disease).
کزاز معمولاً ناشی از آلودگی زخمهای سوراخ شده توسط باکتریهای کلستریدیوم است که سم کزاز تولید میکنند. برخلاف بوتولیسم، مسمومیت کزاز، آزادسازی فرستندههای مهاری از نورونهای رابط در نخاع را مسدود میکند. این اثر باعث از بین رفتن مهار سیناپسی در نورونهای حرکتی نخاعی میشود (به فصل 16 مراجعه کنید)، که باعث تحریک بیش از حد عضلات اسکلتی و انقباضات کزازی در عضلات آسیب دیده میشود (از این رو نام بیماری از همین جا آمده است).
Although the clinical consequences of tetanus toxin are dramatically different from those of botulinum toxins, clever and patient biochemical work has shown that these toxins have a common mechanism of action: they are highly specific proteases that inhibit neurotransmitter release by cleaving the SNARE proteins involved in fusion of synaptic vesicles with the presynaptic plasma membrane (see Figure B). Tetanus toxin and botulinum toxin types B, D, F, and G specifically cleave the vesicle SNARE protein synaptobrevin. Other botulinum toxins cleave syntaxin (type C) and SNAP-25 (types A and E), SNARE proteins found on the presynaptic plasma membrane. Destruction of these presynaptic proteins is the basis for the inhibitory actions of clostridial toxins on neurotransmitter release.
اگرچه عواقب بالینی سم کزاز به طور چشمگیری با سموم بوتولینوم متفاوت است، اما کارهای بیوشیمیایی هوشمندانه و صبورانه نشان داده است که این سموم مکانیسم عمل مشترکی دارند: آنها پروتئازهای بسیار اختصاصی هستند که با تجزیه پروتئینهای SNARE که در ادغام وزیکولهای سیناپسی با غشای پلاسمایی پیشسیناپسی نقش دارند، آزادسازی انتقالدهنده عصبی را مهار میکنند (شکل B را ببینید). سم کزاز و انواع سم بوتولینوم B، D، F و G به طور خاص پروتئین سیناپتوبرووین وزیکول SNARE را تجزیه میکنند. سایر سموم بوتولینوم، سینتاکسین (نوع C) و SNAP-25 (انواع A و E) را تجزیه میکنند، پروتئینهای SNARE که در غشای پلاسمایی پیشسیناپسی یافت میشوند. تخریب این پروتئینهای پیشسیناپسی اساس اقدامات مهاری سموم کلستریدیایی بر آزادسازی انتقالدهندههای عصبی است.
The different actions of these toxins on synaptic transmission at excitatory motor versus inhibitory synapses apparently result from the fact that these toxins are taken up by different types of neurons: Whereas the botulinum toxins are tak-en up by motor neurons, tetanus toxin is preferentially targeted to interneurons. The differential uptake of toxins presumably arises from the presence of different types of toxin receptors on the two types of neurons.
عملکرد متفاوت این سموم بر انتقال سیناپسی در سیناپسهای حرکتی تحریکی در مقابل سیناپسهای مهاری ظاهراً ناشی از این واقعیت است که این سموم توسط انواع مختلفی از نورونها جذب میشوند: در حالی که سموم بوتولینوم توسط نورونهای حرکتی جذب میشوند، سم کزاز ترجیحاً به سمت نورونهای رابط هدف قرار میگیرد. جذب متفاوت سموم احتمالاً ناشی از وجود انواع مختلف گیرندههای سم بر روی دو نوع نورون است.
(B) Cleavage of SNARE proteins by clostridial toxins. Indicated are the sites of proteolysis by tetanus toxin (TeTX) and various types of botulinum toxin (BoTX). (From Sutton et al., 1998.)
(ب) تجزیه پروتئینهای SNARE توسط سموم کلستریدیومی. مکانهای پروتئولیز توسط سم کزاز (TeTX) و انواع مختلف سم بوتولینوم (BoTX) نشان داده شده است. (از ساتون و همکاران، ۱۹۹۸.)
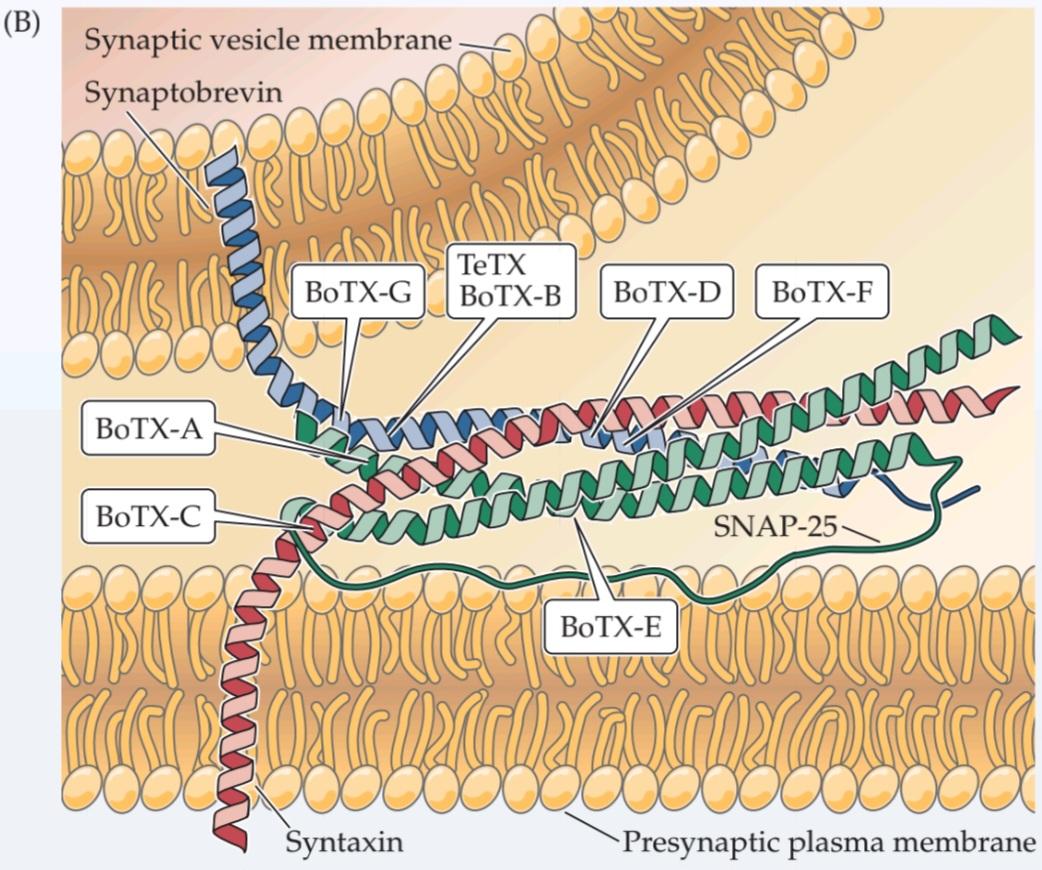
Insights from α–latrotoxin
Latrodectism refers to the severe muscle pain and cramping experienced by patients bitten by the black widow spider, Latrodectus. These symptoms arise from the presynaptic neurotoxin a-latrotoxin, present in black widow spider venom; this toxin causes a massive discharge of neurotransmitter from presynaptic terminals. Although neurotransmitter release ordinarily requires Ca2+, a-latrotoxin is capable of releasing neurotransmitter even when Ca2+ is absent from the extracellular medium. Although it is not yet clear how the toxin triggers Ca2+-independent exocytosis, we know that a-latrotoxin binds to two different types of presynaptic proteins that may mediate its actions. One group of binding partners for a-latrotoxin is the neurexins, a group of integral membrane proteins found in presynaptic terminals. Neurexins bind to synaptotagmin, the presynaptic Ca2+ sensor, and this interaction may allow a-latrotoxin to bypass the usual Ca2+ requirement for triggering vesicle fusion. Another type of presynaptic protein that can bind to a-latrotoxin is called CL1 (based on its previous names, Ca2+-independent receptor for latrotoxin and latrophilin-1). CL1 is a relative of the G-protein-coupled receptors that mediate the actions of neurotransmitters and other extracellular chemical signals (see Figure 5.14B). Thus, the binding of a-latrotoxin to CL1 could activate an intracellular signal transduction cascade involved in the Ca2+-independent actions of a-latrotoxin. While more work is needed to establish the definitive roles of neurexins and CL1 in a-latrotoxin action, these two proteins are probably the basis for the toxin’s potent presynaptic activity.
بینشهایی از α-لاتروتوکسین
لاترودکتیسم به درد و گرفتگی شدید عضلانی اشاره دارد که بیمارانی که توسط عنکبوت بیوه سیاه، لاترودکتوس، گزیده شدهاند، تجربه میکنند. این علائم ناشی از نوروتوکسین پیشسیناپسی a-لاتروتوکسین، موجود در زهر عنکبوت بیوه سیاه، است. این سم باعث تخلیه گسترده انتقالدهنده عصبی از پایانههای پیشسیناپسی میشود. اگرچه آزادسازی انتقالدهنده عصبی معمولاً به +Ca2 نیاز دارد، a-لاتروتوکسین قادر به آزادسازی انتقالدهنده عصبی حتی در غیاب +Ca2 در محیط خارج سلولی است. اگرچه هنوز مشخص نیست که چگونه این سم باعث اگزوسیتوز مستقل از +Ca2 میشود، اما میدانیم که a-لاتروتوکسین به دو نوع مختلف از پروتئینهای پیشسیناپسی متصل میشود که ممکن است واسطه اعمال آن باشند. یک گروه از شرکای اتصال برای a-لاتروتوکسین، نورکسینها هستند، گروهی از پروتئینهای غشایی جداییناپذیر که در پایانههای پیشسیناپسی یافت میشوند. نورکسینها به سیناپتوتاگمین، حسگر +Ca2 پیشسیناپسی، متصل میشوند و این تعامل ممکن است به a-لاتروتوکسین اجازه دهد تا از نیاز معمول +Ca2 برای شروع ادغام وزیکولها عبور کند. نوع دیگری از پروتئین پیشسیناپسی که میتواند به a-لاتروتوکسین متصل شود، CL1 نامیده میشود (براساس نامهای قبلی آن، گیرنده مستقل از +Ca2 برای لاتروتوکسین و لاتروفیلین-1). CL1 از خویشاوندان گیرندههای جفتشده با پروتئین G است که واسطه اعمال انتقالدهندههای عصبی و سایر سیگنالهای شیمیایی خارج سلولی هستند (شکل 5.14B را ببینید). بنابراین، اتصال a-لاتروتوکسین به CL1 میتواند یک آبشار انتقال سیگنال درون سلولی را فعال کند که در اعمال مستقل از +Ca2 آلفا-لاتروتوکسین دخیل است. در حالی که برای تعیین نقشهای قطعی نورکسینها و CL1 در عملکرد آلفا-لاتروتوکسین، کار بیشتری لازم است، این دو پروتئین احتمالاً اساس فعالیت قوی پیشسیناپسی این سم هستند.
In addition to their possible role in latrodectism, neurexins have been linked variety of cognitive disorders. Mutations in the neurexin gene have been identified in several patients suffering from schizophrenia, a psychiatric disease causing delusions, hallucinations, and loss of emotional expression (see Box 18B). Neurexins are known to play an important role in signaling across the synaptic cleft by binding to a family of postsynaptic membrane proteins called neuroligins. Remarkably, mutations in neuroligins also have been associated with autism, a spectrum of psychiatric disorders characterized by impaired social interaction, communication problems, and other behavioral disorders. While a direct connection between neurexins or neuroligins and these psychiatric disorders has not yet been established, it seems likely that defects in these transsynaptic signaling partners may serve as a central mechanism underlying several psychiatric disorders.
علاوه بر نقش احتمالی آنها در لاترودکتیسم، نورکسینها با انواع اختلالات شناختی مرتبط بودهاند. جهش در ژن نورکسین در چندین بیمار مبتلا به اسکیزوفرنی، یک بیماری روانی که باعث توهم، هذیان و از دست دادن بیان عاطفی میشود، شناسایی شده است (به کادر 18B مراجعه کنید). نورکسینها با اتصال به خانوادهای از پروتئینهای غشای پس سیناپسی به نام نورولیگینها، نقش مهمی در سیگنالدهی در شکاف سیناپسی ایفا میکنند. نکته قابل توجه این است که جهش در نورولیگینها همچنین با اوتیسم، طیفی از اختلالات روانی که با اختلال در تعامل اجتماعی، مشکلات ارتباطی و سایر اختلالات رفتاری مشخص میشوند، مرتبط بوده است. در حالی که هنوز ارتباط مستقیمی بین نورکسینها یا نورولیگینها و این اختلالات روانی برقرار نشده است، به نظر میرسد که نقص در این شرکای سیگنالدهی ترانس سیناپسی ممکن است به عنوان یک مکانیسم مرکزی زیربنایی چندین اختلال روانی عمل کند.
In summary, not only does research into synaptic vesicle trafficking illuminate the causes of numerous neurological and psychiatric disorders, but research into these diseases in turn has provided tools—such as clostridial toxins and a-latrotoxin—that have proven valuable in elucidating the basic mechanisms of synaptic vesicle trafficking.
به طور خلاصه، تحقیقات در مورد جابجایی وزیکولهای سیناپسی نه تنها علل اختلالات عصبی و روانی متعددی را روشن میکند، بلکه تحقیقات در مورد این بیماریها به نوبه خود ابزارهایی – مانند سموم کلستریدیال و آلفا-لاتروتوکسین – را فراهم کرده است که در روشن شدن مکانیسمهای اساسی جابجایی وزیکولهای سیناپسی ارزشمند بودهاند.
Still other proteins appear to be involved at the endocytosis steps of the synaptic vesicle cycle (Figure 5.13). The most important protein involved in endocytotic budding of vesicles from the plasma membrane is clathrin. Clathrin has a unique structure that is called a triskelion because of its three-legged appearance; these triskelia can assemble to form a cagelike coating around the vesicle membrane (see Figure 5.13A). Several adaptor proteins, such as AP-2 and AP-180, connect clathrin to the proteins and lipids of this membrane. These adaptor proteins, as well as other proteins such as amphiphysin, epsin, and Eps-15, help assemble individual triskelia into structures that resemble geodesic domes (see Figure 5.13A, bottom). Such domelike structures form coated pits that initiate membrane budding, increasing the curvature of the budding membrane until it forms a coated vesicle-like structure that remains connected to the plasma membrane via a narrow lipid stalk (Figure 5.13C). Another protein, called dynamin, forms a ringlike coil that surrounds the lipid stalk (see Figure 5.13B). This coil causes the final pinching-off of membrane that severs the stalk and completes the production of coated vesicles. Coated vesicles then are transported away from the plasma membrane by the cytoskeletal protein actin. This allows the clathrin coats to be removed by an ATPase, Hsc70, with another protein, auxilin, serving as a co-factor that recruits Hsc70 to the coated vesicle. Other proteins, such as synaptojanin, are also important for vesicle uncoating. Uncoated vesicles can then continue their journey through the recycling process, eventually becoming refilled with neurotransmitter due to the actions of neurotransmitter transporters in the vesicle membrane. These transporters exchange protons within the vesicle for neurotransmitter; the acidic interior of the vesicle is produced by a proton pump that also is located in the vesicle membrane.
به نظر میرسد پروتئینهای دیگری نیز در مراحل اندوسیتوز چرخه وزیکول سیناپسی دخیل هستند (شکل 5.13). مهمترین پروتئین دخیل در جوانه زدن اندوسیتوزی وزیکولها از غشای پلاسما، کلاترین است. کلاترین ساختار منحصر به فردی دارد که به دلیل ظاهر سهپایهاش، تریسکیلیون نامیده میشود. این تریسکیلیاها میتوانند برای تشکیل یک پوشش قفسمانند در اطراف غشای وزیکول جمع شوند (شکل 5.13A را ببینید). چندین پروتئین آداپتور، مانند AP-2 و AP-180، کلاترین را به پروتئینها و لیپیدهای این غشا متصل میکنند. این پروتئینهای آداپتور، و همچنین پروتئینهای دیگری مانند آمفیفیزین، اپسین و Eps-15، به جمع شدن تریسکیلیاهای منفرد در ساختارهایی شبیه گنبدهای ژئودزیک کمک میکنند (شکل 5.13A، پایین را ببینید). چنین ساختارهای گنبدی شکلی، گودالهای پوششداری را تشکیل میدهند که جوانهزنی غشاء را آغاز میکنند و انحنای غشاء جوانهزده را افزایش میدهند تا زمانی که یک ساختار وزیکولمانند پوششدار تشکیل شود که از طریق یک ساقه لیپیدی باریک به غشای پلاسمایی متصل میماند (شکل 5.13C). پروتئین دیگری به نام دینامین، یک کلاف حلقهای شکل تشکیل میدهد که ساقه لیپیدی را احاطه میکند (شکل 5.13B را ببینید). این کلاف باعث جدا شدن نهایی غشاء میشود که ساقه را جدا کرده و تولید وزیکولهای پوششدار را تکمیل میکند. سپس وزیکولهای پوششدار توسط پروتئین اسکلت سلولی اکتین از غشای پلاسمایی دور میشوند. این امر به پوششهای کلاترین اجازه میدهد تا توسط یک ATPase، Hsc70، با پروتئین دیگری به نام اکسیلین که به عنوان یک کوفاکتور عمل میکند و Hsc70 را به وزیکول پوششدار جذب میکند، برداشته شوند. پروتئینهای دیگری مانند سیناپتوجنین نیز برای از بین بردن پوشش وزیکول مهم هستند. وزیکولهای بدون پوشش میتوانند سفر خود را از طریق فرآیند بازیافت ادامه دهند و در نهایت به دلیل عملکرد ناقلهای انتقالدهنده عصبی در غشای وزیکول، دوباره با انتقالدهنده عصبی پر شوند. این ناقلها پروتونها را در داخل وزیکول با انتقالدهنده عصبی مبادله میکنند؛ فضای داخلی اسیدی وزیکول توسط یک پمپ پروتون تولید میشود که آن هم در غشای وزیکول قرار دارد.



FIGURE 5.13 Molecular mechanisms of endocytosis following neurotransmitter release. (A) Individual clathrin triskelia assemble together to form membrane coats involved in membrane budding during endocytosis. (B) Dynamin forms ringlike coils around the lipid stalks of budding membranes; these rings disconnect vesicle membrane from plasma membrane during endocytosis. (C) A model for membrane budding during endocytosis. Following addition of synaptic vesicle membrane during exocytosis, clathrin triskelia attach to the vesicular membrane. Adaptor proteins, such as AP-2 and AP180, aid their attachment. Polymerization of clathrin causes the membrane to curve and constrict, allowing dynamin to pinch off the coated vesicle. Subsequent uncoating of the vesicle, by Hsc70 and auxilin, yields a recycled synaptic vesicle. (A fromFotin et al., 2004; B from Ruebold et al., 2015; C after Shupliakov et al., 2010.)
شکل ۵.۱۳ مکانیسمهای مولکولی اندوسیتوز پس از آزادسازی انتقالدهنده عصبی. (الف) کلاترین تریسکیلیاهای منفرد با هم جمع میشوند تا پوششهای غشایی دخیل در جوانهزنی غشا در طول اندوسیتوز را تشکیل دهند. (ب) دینامین، حلقههای حلقهای شکل را در اطراف ساقههای لیپیدی غشاهای جوانهزننده تشکیل میدهد؛ این حلقهها غشای وزیکول را از غشای پلاسما در طول اندوسیتوز جدا میکنند. (ج) مدلی برای جوانهزنی غشا در طول اندوسیتوز. پس از اضافه شدن غشای وزیکول سیناپسی در طول اگزوسیتوز، کلاترین تریسکیلیا به غشای وزیکولی متصل میشود. پروتئینهای آداپتور، مانند AP-2 و AP180، به اتصال آنها کمک میکنند. پلیمریزاسیون کلاترین باعث انحنا و انقباض غشا میشود و به دینامین اجازه میدهد تا وزیکول پوششدار را جدا کند. برداشتن پوشش بعدی وزیکول، توسط Hsc70 و اکسیلین، یک وزیکول سیناپسی بازیافتی ایجاد میکند. (الف از فوتین و همکاران، ۲۰۰۴؛ ب از روبولد و همکاران، ۲۰۱۵؛ ج از شوپلیاکوف و همکاران، ۲۰۱۰.)
In summary, a complex cascade of proteins, acting in a defined temporal and spatial order, allows neurons to secrete transmitters. This molecular cascade underlies the powerful ability of the brain to use its synapses to process and store information.
به طور خلاصه، آبشاری پیچیده از پروتئینها، که با نظم زمانی و مکانی مشخصی عمل میکنند، به نورونها اجازه میدهند تا فرستندههایی ترشح کنند. این آبشار مولکولی، زیربنای توانایی قدرتمند مغز در استفاده از سیناپسهایش برای پردازش و ذخیره اطلاعات است.
Neurotransmitter Receptors
The generation of postsynaptic electrical signals is also understood in considerable depth. Such studies began in 1907, when the British physiologist John N. Langley introduced the concept of receptor molecules to explain the specific and potent actions of certain chemicals on muscle and nerve cells. We now know that neurotransmitterreceptors are proteins that are embedded in the plasma membrane of postsynaptic cells and have an extracellular neurotransmitter binding site that detects the presence of neurotransmitters in the synaptic cleft.
گیرندههای انتقالدهنده عصبی
تولید سیگنالهای الکتریکی پسسیناپسی نیز به طور قابل توجهی درک شده است. چنین مطالعاتی در سال ۱۹۰۷ آغاز شد، زمانی که فیزیولوژیست بریتانیایی، جان ان. لانگلی، مفهوم مولکولهای گیرنده را برای توضیح اقدامات خاص و قوی برخی مواد شیمیایی بر روی سلولهای عضلانی و عصبی معرفی کرد. اکنون میدانیم که گیرندههای انتقالدهنده عصبی پروتئینهایی هستند که در غشای پلاسمایی سلولهای پسسیناپسی تعبیه شدهاند و دارای یک محل اتصال انتقالدهنده عصبی خارج سلولی هستند که وجود انتقالدهندههای عصبی را در شکاف سیناپسی تشخیص میدهد.
There are two broad families of receptor proteins that differ in their mechanism of transducing transmitter binding into postsynaptic responses. The receptors in one family contain a membrane-spanning domain that forms an ion channel (Figure 5.14A). These receptors combine transmitter-binding and channel functions into a single molecular entity and thus are called ionotropic receptors (Greek tropos, “to move in response to a stimulus”) or ligand-gated ion channels.
دو خانوادهی گسترده از پروتئینهای گیرنده وجود دارد که در مکانیسم انتقال اتصال فرستنده به پاسخهای پسسیناپسی متفاوت هستند. گیرندههای یک خانواده حاوی یک دامنهی غشایی هستند که یک کانال یونی را تشکیل میدهد (شکل 5.14A). این گیرندهها عملکردهای اتصال فرستنده و کانال را در یک موجودیت مولکولی واحد ترکیب میکنند و بنابراین گیرندههای یونوتروپیک (تروپوس یونانی، “حرکت در پاسخ به یک محرک”) یا کانالهای یونی دریچهدار لیگاندی نامیده میشوند.
The second family of neurotransmitter receptor is metabotropic receptors, so called because the eventual movement of ions through a channel depends on intervening metabolic steps. These receptors do not have ion channels as part of their structure; instead, they have an intracellular domain that indirectly affects channels though the activation of intermediate molecules called G-proteins (Figure 5.14B). Neurotransmitter binding to these receptors activates G-proteins, which then dissociate from the receptor and interact directly with ion channels or bind to other effector proteins, such as enzymes, that make intracellular messengers that open or close ion channels. Thus, G-proteins can be thought of as transducers that couple neurotransmitter binding to a receptor with regulation of postsynaptic ion channels. For this reason, metabotropic receptors are also called G-protein-coupled receptors. The postsynaptic signaling events initiated by metabotropic receptors are described in Chapter 7.
خانواده دوم گیرندههای انتقالدهنده عصبی، گیرندههای متابوتروپیک هستند، که به این دلیل به این نام خوانده میشوند که حرکت نهایی یونها از طریق یک کانال به مراحل متابولیکی مداخلهگر بستگی دارد. این گیرندهها کانالهای یونی را به عنوان بخشی از ساختار خود ندارند؛ در عوض، آنها یک دامنه درون سلولی دارند که به طور غیرمستقیم از طریق فعالسازی مولکولهای واسطهای به نام پروتئینهای G بر کانالها تأثیر میگذارد (شکل 5.14B). اتصال انتقالدهنده عصبی به این گیرندهها، پروتئینهای G را فعال میکند، که سپس از گیرنده جدا میشوند و مستقیماً با کانالهای یونی تعامل میکنند یا به سایر پروتئینهای مؤثر، مانند آنزیمها، متصل میشوند که پیامرسانهای درون سلولی را میسازند که کانالهای یونی را باز یا بسته میکنند. بنابراین، پروتئینهای G را میتوان به عنوان مبدلهایی در نظر گرفت که اتصال انتقالدهنده عصبی به یک گیرنده را با تنظیم کانالهای یونی پسسیناپسی جفت میکنند. به همین دلیل، گیرندههای متابوتروپیک، گیرندههای جفتشده با پروتئین G نیز نامیده میشوند. رویدادهای سیگنالینگ پسسیناپسی که توسط گیرندههای متابوتروپیک آغاز میشوند، در فصل 7 شرح داده شدهاند.


FIGURE 5.14 Two different types of neurotransmitter receptors. (A) Ligand-gated ion channels combine receptor and channel functions in a single protein complex. (B) Me tabotropic receptors usually activate G-proteins, which modulate ion channels directly or indirectly through intracellular effector enzymes and second messengers.
شکل ۵.۱۴ دو نوع مختلف از گیرندههای انتقالدهنده عصبی. (الف) کانالهای یونی دریچهدار لیگاندی، عملکردهای گیرنده و کانال را در یک کمپلکس پروتئینی واحد ترکیب میکنند. (ب) گیرندههای metabotropic معمولاً پروتئینهای G را فعال میکنند که کانالهای یونی را به طور مستقیم یا غیرمستقیم از طریق آنزیمهای مؤثر درون سلولی و پیامرسانهای ثانویه تنظیم میکنند.
These two families of postsynaptic receptors give rise to postsynaptic actions that range from less than a millisecond to minutes, hours, or even days. Ionotropic receptors generally mediate rapid postsynaptic effects. Examples are the EPP produced at neuromuscular synapses by ACh (see Figure 5.5B), as well as the postsynaptic responses produced at certain glutamatergic synapses and GABAergic synapses (see Figure 5.19B). In these cases, the postsynaptic potentials arise within a millisecond or two of an action potential invading the presynaptic terminal and last for only a few tens of milliseconds or less. In contrast, the activation of metabotropic receptors typically produces much slower responses, ranging from hundreds of milliseconds to minutes or even longer. The comparative slowness of metabotropic receptor actions reflects the fact that multiple proteins need to bind to each other sequentially in order to produce the final physiological response. Importantly, many transmitters can activate both ionotropic and metabotropic receptors to produce both fast and slow postsynaptic potentials (sometimes even at the same synapse).
این دو خانواده از گیرندههای پسسیناپسی باعث ایجاد اعمال پسسیناپسی میشوند که از کمتر از یک میلیثانیه تا چند دقیقه، چند ساعت یا حتی چند روز متغیر است. گیرندههای یونوتروپیک عموماً واسطه اثرات پسسیناپسی سریع هستند. به عنوان مثال میتوان به EPP تولید شده در سیناپسهای عصبی-عضلانی توسط ACh (شکل 5.5B را ببینید) و همچنین پاسخهای پسسیناپسی تولید شده در سیناپسهای گلوتاماترژیک خاص و سیناپسهای گاباارژیک اشاره کرد (شکل 5.19B را ببینید). در این موارد، پتانسیلهای پسسیناپسی در عرض یک یا دو میلیثانیه از یک پتانسیل عمل که به ترمینال پیشسیناپسی حمله میکند، ایجاد میشوند و تنها چند ده میلیثانیه یا کمتر دوام میآورند. در مقابل، فعال شدن گیرندههای متابوتروپیک معمولاً پاسخهای بسیار کندتری ایجاد میکند، از صدها میلیثانیه تا چند دقیقه یا حتی بیشتر. کندی نسبی اعمال گیرندههای متابوتروپیک نشان دهنده این واقعیت است که برای ایجاد پاسخ فیزیولوژیکی نهایی، پروتئینهای متعدد باید به طور متوالی به یکدیگر متصل شوند. نکته مهم این است که بسیاری از انتقالدهندهها میتوانند گیرندههای یونوتروپیک و متابوتروپیک را فعال کنند تا پتانسیلهای پسسیناپسی سریع و کند (گاهی حتی در همان سیناپس) تولید کنند.
Postsynaptic Membrane Permeability Changes during Synaptic Transmission
Just as studies of the neuromuscular synapse paved the way for understanding neurotransmitter release mechanisms, this peripheral synapse has been equally valuable for understanding the mechanisms that allow neurotransmitter receptors to generate postsynaptic signals. The binding of ACh to postsynaptic receptors opens ion channels in the muscle fiber membrane. This effect can be demonstrated directly by using the patch clamp method (see Box 4A) to measure the minute postsynaptic currents that flow when two molecules of individual ACh bind to receptors, as Erwin Neher and Bert Sakmann first did in 1976. Exposure of the extracellular surface of a patch of postsynaptic membrane to ACh causes single-channel currents to flow for a few milliseconds (Figure 5.15A). This shows that ACh binding to its receptors opens ligand-gated ion channels, much in the way that changes in membrane potential open voltage-gated ion channels (see Chapter 4).
تغییرات نفوذپذیری غشای پس سیناپسی در طول انتقال سیناپسی
همانطور که مطالعات سیناپس عصبی-عضلانی راه را برای درک مکانیسمهای آزادسازی انتقالدهنده عصبی هموار کرد، این سیناپس محیطی نیز به همان اندازه برای درک مکانیسمهایی که به گیرندههای انتقالدهنده عصبی اجازه میدهند سیگنالهای پس سیناپسی تولید کنند، ارزشمند بوده است. اتصال ACh به گیرندههای پس سیناپسی، کانالهای یونی را در غشای فیبر عضلانی باز میکند. این اثر را میتوان مستقیماً با استفاده از روش گیره وصله (به کادر 4A مراجعه کنید) برای اندازهگیری جریانهای پس سیناپسی جزئی که هنگام اتصال دو مولکول ACh منفرد به گیرندهها جریان مییابند، نشان داد، همانطور که اروین نهر و برت ساکمن برای اولین بار در سال 1976 انجام دادند. قرار گرفتن سطح خارج سلولی یک تکه از غشای پس سیناپسی در معرض ACh باعث میشود جریانهای تک کانالی برای چند میلیثانیه جریان یابند (شکل 5.15A). این نشان میدهد که اتصال ACh به گیرندههایش، کانالهای یونی دریچهدار لیگاندی را باز میکند، بسیار شبیه به روشی که پتانسیل غشا را تغییر میدهد و کانالهای یونی دریچهدار ولتاژی را باز میکند (به فصل 4 مراجعه کنید).
The electrical actions of ACh are greatly multiplied when an action potential in a presynaptic motor neuron causes the release of millions of molecules of ACh into the synaptic cleft. In this more physiological case, the transmitter molecules bind to many thousands of ACh receptors packed in a dense array on the postsynaptic membrane, transiently opening a very large number of postsynaptic ion channels. Although individual ACh receptors generate a microscopic current of only a few picoamperes (Figure 5.15B1), the opening of a large number of channels are opened synchronously when ACh is secreted from presynaptic terminals (Figure 5.15B2,3). The macroscopic current resulting from the summed opening of many ion channels is called the end plate current, or EPC. Because the EPC normally is inward, it causes the postsynaptic membrane potential to depolarize. This depolarizing change in potential is the EPP (Figure 5.15C), which typically triggers a postsynaptic action potential by opening voltage-gated Na+ and K+ channels (see Figure 5.5B).
وقتی یک پتانسیل عمل در یک نورون حرکتی پیشسیناپسی باعث آزاد شدن میلیونها مولکول ACh به داخل شکاف سیناپسی میشود، اعمال الکتریکی ACh به میزان زیادی افزایش مییابد. در این مورد فیزیولوژیکیتر، مولکولهای فرستنده به هزاران گیرنده ACh که در یک آرایه متراکم روی غشای پسسیناپسی قرار گرفتهاند، متصل میشوند و به طور موقت تعداد بسیار زیادی کانال یونی پسسیناپسی را باز میکنند. اگرچه گیرندههای ACh منفرد جریان میکروسکوپی تنها چند پیکوآمپر تولید میکنند (شکل 5.15B1)، باز شدن تعداد زیادی کانال به طور همزمان هنگام ترشح ACh از پایانههای پیشسیناپسی باز میشود (شکل 5.15B2,3). جریان ماکروسکوپی حاصل از مجموع باز شدن بسیاری از کانالهای یونی، جریان صفحه انتهایی یا EPC نامیده میشود. از آنجا که EPC معمولاً به سمت داخل است، باعث دپلاریزه شدن پتانسیل غشای پسسیناپسی میشود. این تغییر دپلاریزه کننده در پتانسیل، EPP است (شکل 5.15C)، که معمولاً با باز کردن کانالهای +Na و +K وابسته به ولتاژ، پتانسیل عمل پس سیناپسی را فعال میکند (شکل 5.5B را ببینید).
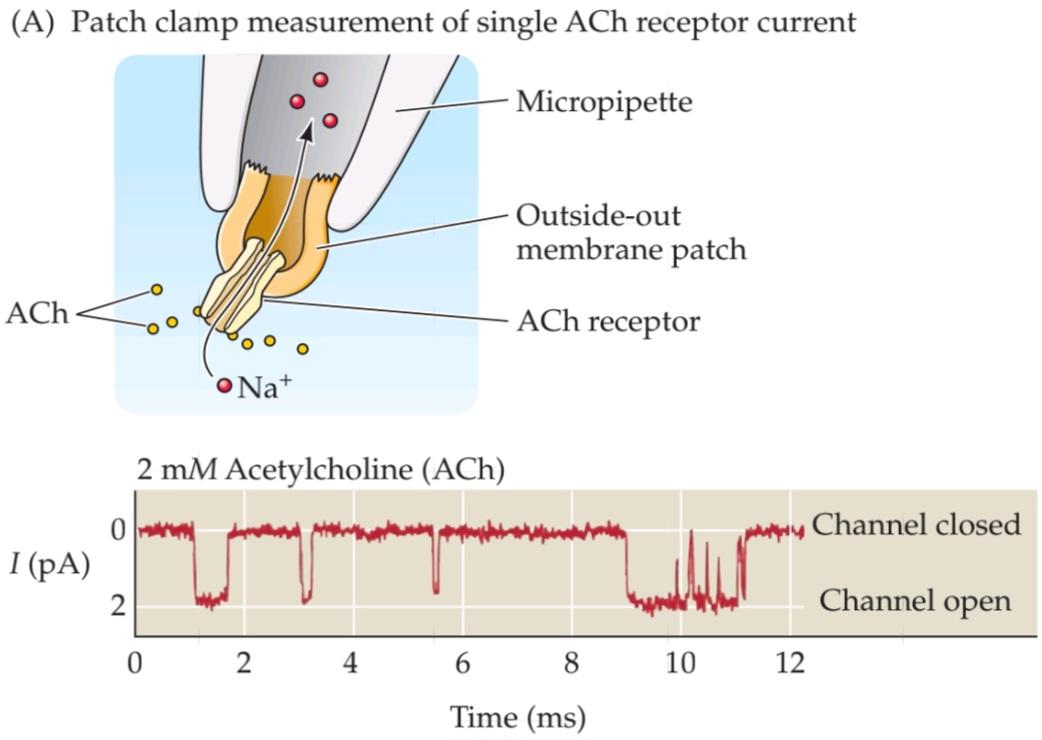


FIGURE 5.15 Activation of ACh receptors at neuromuscular synapses. (A) Patch clamp measurement of single ACh receptor currents from a patch of membrane removed from the postsynaptic muscle cell. When ACh is applied to the extracellular surface of the membrane, the repeated brief opening of a single channel can be observed as downward deflections corresponding to inward current (i.e., positive ions flowing into the cell). (B) Synchronized opening of many ACh-activated channels at a synapse being voltage clamped. (1) If a single channel is examined during the release of ACh from the presynaptic terminal, the channel can be seen to open transiently. (2) If several channels are examined together, ACh release opens the channels almost synchronously. (3) The opening of a very large number of postsynaptic channels produces a macroscopic EPC. (C) In a normal muscle cell (i.e., not being voltage clamped), the inward EPC depolarizes the postsynaptic muscle cell, giving rise to an EPP. Typically, this depolarization generates an action potential (not shown; see Figure 5.5B).
شکل ۵.۱۵ فعال شدن گیرندههای ACh در سیناپسهای عصبی-عضلانی. (الف) اندازهگیری جریانهای گیرنده ACh منفرد از یک تکه غشاء که از سلول عضلانی پس سیناپسی جدا شده است، با استفاده از گیره وصلهای. هنگامی که ACh به سطح خارج سلولی غشاء اعمال میشود، باز شدن کوتاه و مکرر یک کانال منفرد را میتوان به صورت انحرافهای رو به پایین مربوط به جریان داخلی (یعنی یونهای مثبت که به داخل سلول جریان مییابند) مشاهده کرد. (ب) باز شدن همزمان بسیاری از کانالهای فعال شده توسط ACh در سیناپسی که تحت فشار ولتاژ قرار دارد. (1) اگر یک کانال منفرد در حین آزادسازی ACh از پایانه پیش سیناپسی بررسی شود، میتوان مشاهده کرد که کانال به صورت گذرا باز میشود. (2) اگر چندین کانال با هم بررسی شوند، آزادسازی ACh کانالها را تقریباً همزمان باز میکند. (3) باز شدن تعداد بسیار زیادی از کانالهای پس سیناپسی یک EPC ماکروسکوپی ایجاد میکند. (ج) در یک سلول عضلانی طبیعی (یعنی بدون محدودیت ولتاژ)، EPC داخلی، سلول عضلانی پس سیناپسی را دپلاریزه میکند و منجر به EPP میشود. معمولاً این دپلاریزاسیون یک پتانسیل عمل ایجاد میکند (نشان داده نشده است؛ به شکل 5.5B مراجعه کنید).
The identity of the ions that flow during the EPC can be determined via the same approaches used to identify the roles of Na+ and K+ fluxes in the currents underlying action potentials (see Chapter 3). Key to such an analysis is identifying the membrane potential at which no current flows during transmitter action. When the potential of the postsynaptic muscle cell is controlled by the voltage clamp method (Figure 5.16A), the magnitude of the membrane potential clearly affects the amplitude and polarity of EPCs (Figure 5.16B). Thus, when the postsynaptic membrane potential is made more negative than the resting potential, the amplitude of the EPC becomes larger, whereas this current is reduced when the membrane potential is made more positive. At approximately 0 mV, no EPC is detected, and at even more positive potentials, the current reverses its polarity, becoming outward rather than inward (Figure 5.16C). The potential where the EPC reverses, about 0 mV in the case of the neuromuscular junction, is called the reversal potential.
هویت یونهایی که در طول EPC جریان مییابند را میتوان از طریق همان رویکردهایی که برای شناسایی نقش شارهای +Na و +K در جریانهای زمینهساز پتانسیلهای عمل استفاده میشوند، تعیین کرد (به فصل 3 مراجعه کنید). کلید چنین تحلیلی، شناسایی پتانسیل غشایی است که در آن هیچ جریانی در طول عمل فرستنده جریان نمییابد. هنگامی که پتانسیل سلول ماهیچه پس سیناپسی با روش گیره ولتاژ کنترل میشود (شکل 5.16A)، بزرگی پتانسیل غشا به وضوح بر دامنه و قطبیت EPCها تأثیر میگذارد (شکل 5.16B). بنابراین، هنگامی که پتانسیل غشای پس سیناپسی منفیتر از پتانسیل استراحت میشود، دامنه EPC بزرگتر میشود، در حالی که این جریان با مثبتتر شدن پتانسیل غشا کاهش مییابد. در تقریباً 0 میلیولت، هیچ EPC شناسایی نمیشود و در پتانسیلهای حتی مثبتتر، جریان قطبیت خود را معکوس میکند و به جای اینکه به سمت داخل باشد، به سمت خارج میرود (شکل 5.16C). پتانسیلی که در آن EPC معکوس میشود، حدود 0 میلیولت در مورد اتصال عصبی-عضلانی، پتانسیل معکوس نامیده میشود.
As was the case for currents flowing through voltage-gated ion channels (see Chapter 4), the magnitude of the EPC at any membrane potential is given by the product of the ion conductance activated by ACh (gACh) and the electrochemical driving force on the ions flowing through ligand-gated channels. Thus, the value of the EPC is given by the relationship
همانطور که در مورد جریانهای عبوری از کانالهای یونی دریچهدار ولتاژی صدق میکرد (به فصل ۴ مراجعه کنید)، مقدار EPC در هر پتانسیل غشایی توسط حاصلضرب رسانایی یونی فعال شده توسط ACh (gACh) و نیروی محرکه الکتروشیمیایی روی یونهای عبوری از کانالهای دریچهدار لیگاندی بدست میآید. بنابراین، مقدار EPC توسط رابطه زیر بدست میآید:

where Erev is the reversal potential for the EPC. This relationship predicts that the EPC will be an inward current at potentials more negative than Erev because the electrochemical driving force, Vm – Erev , is a negative number. Furthermore, the EPC will become smaller at potentials approaching Erev because the driving force is reduced. At potentials more positive than Erev , the EPC is outward because the driving force is reversed in direction (that is, positive). Because the channels opened by ACh are largely insensitive to membrane voltage, gACh will depend only on the number of channels opened by ACh, which depends in turn on the concentration of ACh in the synaptic cleft. Thus, the magnitude and polarity of the postsynaptic membrane potential determine the direction and amplitude of the EPC solely by altering the driving force on ions flowing through the receptor channels opened by ACh.
که در آن Erev پتانسیل معکوس برای EPC است. این رابطه پیشبینی میکند که EPC در پتانسیلهای منفیتر از Erev یک جریان رو به داخل خواهد بود زیرا نیروی محرکه الکتروشیمیایی، Vm – Erev، یک عدد منفی است. علاوه بر این، EPC در پتانسیلهای نزدیک به Erev کوچکتر میشود زیرا نیروی محرکه کاهش مییابد. در پتانسیلهای مثبتتر از Erev، EPC به سمت خارج است زیرا نیروی محرکه در جهت معکوس (یعنی مثبت) است. از آنجا که کانالهای باز شده توسط ACh تا حد زیادی به ولتاژ غشا حساس نیستند، gACh فقط به تعداد کانالهای باز شده توسط ACh بستگی دارد که به نوبه خود به غلظت ACh در شکاف سیناپسی بستگی دارد. بنابراین، بزرگی و قطبیت پتانسیل غشای پس سیناپسی، جهت و دامنه EPC را تنها با تغییر نیروی محرکه روی یونهای جاری از طریق کانالهای گیرنده باز شده توسط ACh تعیین میکند.
When Vm is at the reversal potential, Vm – Erev is equal to 0 and there is no net driving force on the ions that can permeate the receptor-activated channel. The identity of the ions that flow during the EPC can be deduced by observing how the reversal potential of the EPC compares with the equilibrium potential for various ion species (Figure 5.16D). For example, if ACh were to open an ion channel permeable only to K+, then the reversal potential of the EPC would be at the equilibrium potential for K+, which for a muscle cell is close to –100 mV. If the ACh-activated channels were permeable only to Na+, then the reversal potential of the current would be approximately +70 mV, the Na+ equilibrium potential of muscle cells; if these channels were permeable only to Cl–, then the reversal potential would be approximately –50 mV. By this reasoning, ACh-activated channels cannot be permeable to only one of these ions, because the reversal potential of the EPC is not near the equilibrium potential for any of them (see Figure 5.16C). However, if these channels were permeable to both Na+ and K+, then the reversal potential of the EPC would be between +70 mV and –100 mV.
وقتی Vm در پتانسیل معکوس باشد، Vm – Erev برابر با 0 است و هیچ نیروی محرکه خالصی بر روی یونهایی که میتوانند از کانال فعالشده توسط گیرنده عبور کنند، وجود ندارد. هویت یونهایی که در طول EPC جریان مییابند را میتوان با مشاهده چگونگی مقایسه پتانسیل معکوس EPC با پتانسیل تعادل برای گونههای مختلف یونی استنباط کرد (شکل 5.16D). به عنوان مثال، اگر ACh یک کانال یونی را که فقط به +K نفوذپذیر است باز کند، پتانسیل معکوس EPC در پتانسیل تعادل برای +K خواهد بود، که برای یک سلول عضلانی نزدیک به -100 میلیولت است. اگر کانالهای فعالشده توسط ACh فقط به +Na نفوذپذیر باشند، پتانسیل معکوس جریان تقریباً 70+ میلیولت، پتانسیل تعادل +Na سلولهای عضلانی، خواهد بود. اگر این کانالها فقط به Cl- نفوذپذیر باشند، پتانسیل معکوس تقریباً 50- میلیولت خواهد بود. با این استدلال، کانالهای فعالشده با ACh نمیتوانند فقط به یکی از این یونها نفوذپذیر باشند، زیرا پتانسیل برگشت EPC نزدیک به پتانسیل تعادل برای هیچکدام از آنها نیست (شکل 5.16C را ببینید). با این حال، اگر این کانالها به هر دو یون +Na و +K نفوذپذیر باشند، پتانسیل برگشت EPC بین 70+ میلیولت و 100- میلیولت خواهد بود.


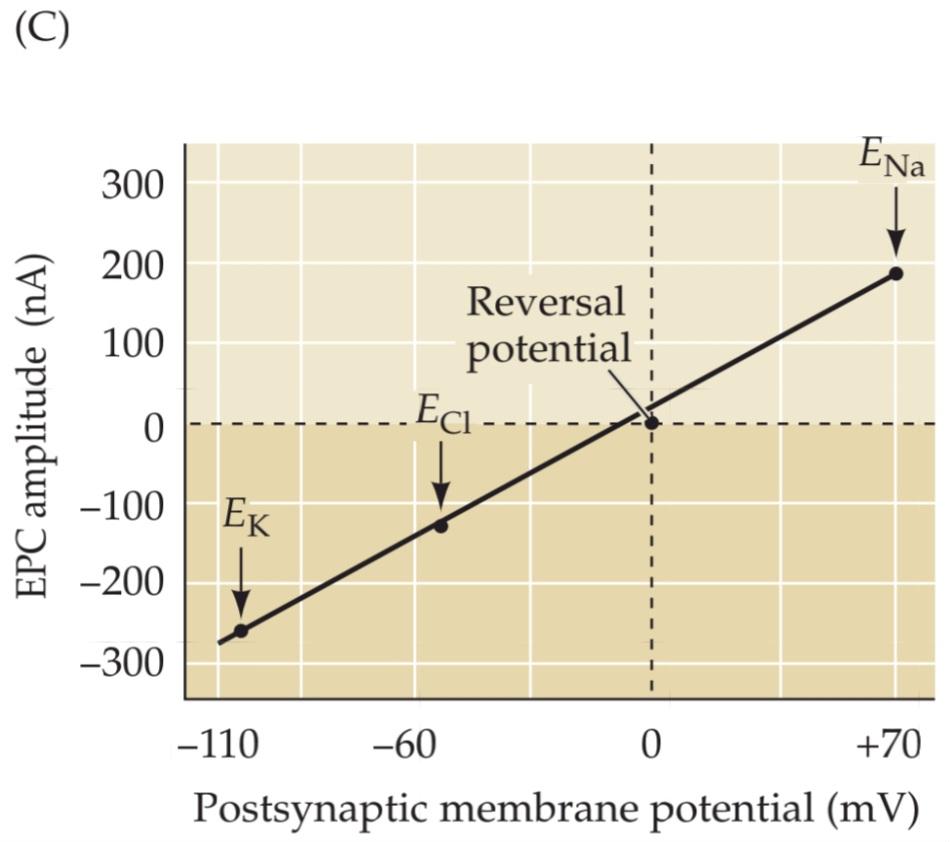

FIGURE 5.16 Influence of the postsynaptic membrane potential on end plate currents. (A) A postsynaptic muscle fiber is voltage clamped using two electrodes, while the presynaptic neuron is electrically stimulated to cause the release of ACh from presynaptic terminals. This experimental arrangement allows the recording of EPCs produced by ACh. (B) Amplitude and time course of EPCs generated by stimulating the presynaptic motor neuron while the postsynaptic cell is voltage clamped at four different membrane potentials. (C) The relationship between the peak amplitude of EPCs and postsynaptic membrane potential is nearly linear, with a reversal potential (the voltage at which the direction of the current changes from inward to outward) close to 0 mV. Also indicated on this graph are the equilibrium potentials of Na+, K+, and Cl– ions. (D) The identity of the ions permeating postsynaptic receptors is revealed by the reversal potential (Erev). Activation of postsynaptic channels permeable only to K+ (yellow) results in currents reversing at E , near –100 mV, while activation of terminalspostsynaptic Na+ channels results in currents reversing at ENa, near +70 mV (red). Cl–-selective currents reverse at ECl, near –50 mV (green). (A–C after Takeuchi and Takeuchi, 1960.)
شکل ۵.۱۶ تأثیر پتانسیل غشای پس سیناپسی بر جریانهای صفحه انتهایی. (الف) یک فیبر عضلانی پس سیناپسی با استفاده از دو الکترود تحت ولتاژ ثابت قرار میگیرد، در حالی که نورون پیشسیناپسی به صورت الکتریکی تحریک میشود تا باعث آزاد شدن استیل کولین از پایانههای پیشسیناپسی شود. این چیدمان آزمایشگاهی امکان ثبت EPCهای تولید شده توسط استیل کولین را فراهم میکند. (ب) دامنه و سیر زمانی EPCهای تولید شده با تحریک نورون حرکتی پیشسیناپسی در حالی که سلول پس سیناپسی در چهار پتانسیل غشایی مختلف تحت ولتاژ ثابت قرار میگیرد. (ج) رابطه بین دامنه اوج EPCها و پتانسیل غشای پس سیناپسی تقریباً خطی است، با پتانسیل معکوس (ولتاژی که در آن جهت جریان از داخل به خارج تغییر میکند) نزدیک به 0 میلیولت. همچنین در این نمودار پتانسیلهای تعادلی یونهای +Na+، K و Cl- نشان داده شده است. (د) هویت یونهای نفوذکننده به گیرندههای پس سیناپسی توسط پتانسیل معکوس (Erev) آشکار میشود. فعال شدن کانالهای پسسیناپسی که فقط به +K نفوذپذیر هستند (زرد) منجر به معکوس شدن جریانها در E، نزدیک به 100- میلیولت میشود، در حالی که فعال شدن کانالهای پسسیناپسی +Na ترمینال منجر به معکوس شدن جریانها در ENa، نزدیک به 70+ میلیولت (قرمز) میشود. جریانهای انتخابی Cl- در ECl، نزدیک به 50- میلیولت (سبز) معکوس میشوند. (A-C برگرفته از Takeuchi و Takeuchi، 1960.)
The fact that EPCs reverse at approximately 0 mV is therefore consistent with the idea that ACh-activated ion channels are almost equally permeable to both Na+ and K+. This hypothesis was tested in 1960, by the Japanese husband and wife team of Akira and Noriko Takeuchi, by altering the extracellular concentration of these two ions. As predicted, the magnitude and reversal potential of the EPC were changed by altering the concentration gradient of each ion. Lowering the external Na+ concentration, which makes ENa more negative, produces a negative shift in Erev (Figure 5.17A), whereas elevating external K+ concentration, which makes EK more positive, causes Erev to shift to a more positive potential (Figure 5.17B). Such experiments establish that the ACh-activated ion channels are in fact permeable to both Na+ and K+.
این واقعیت که EPCها تقریباً در 0 میلیولت معکوس میشوند، با این ایده سازگار است که کانالهای یونی فعالشده با ACh تقریباً به طور مساوی نسبت به +Na و +K نفوذپذیر هستند. این فرضیه در سال 1960 توسط تیم زن و شوهر ژاپنی آکیرا و نوریکو تاکوچی، با تغییر غلظت خارج سلولی این دو یون، مورد آزمایش قرار گرفت. همانطور که پیشبینی میشد، بزرگی و پتانسیل معکوس EPC با تغییر گرادیان غلظت هر یون تغییر کرد. کاهش غلظت +Na خارجی، که ENa را منفیتر میکند، باعث تغییر منفی در Erev میشود (شکل 5.17A)، در حالی که افزایش غلظت +K خارجی، که EK را مثبتتر میکند، باعث میشود Erev به پتانسیل مثبتتری تغییر کند (شکل 5.17B). چنین آزمایشهایی نشان میدهند که کانالهای یونی فعالشده با ACh در واقع نسبت به +Na و +K نفوذپذیر هستند.

FIGURE 5.17 Reversal potential of the end plate current changes when ion gradients change. (A) Lowering the external Na+ concentration causes EPCs to reverse at more negative potentials. (B) Raising the external K+ concentration makes the reversal potential more positive. (After Takeuchi and Takeuchi, 1960.)
شکل ۵.۱۷ پتانسیل معکوس جریان صفحه انتهایی با تغییر گرادیان یونی تغییر میکند. (الف) کاهش غلظت +Na خارجی باعث میشود EPCها در پتانسیلهای منفیتر معکوس شوند. (ب) افزایش غلظت +K خارجی پتانسیل معکوس را مثبتتر میکند. (برگرفته از Takeuchi و Takeuchi، ۱۹۶۰.)
Relationship between Ion Fluxes and Postsynaptic Potential Changes
Defining the ion fluxes occurring during the EPC permits understanding of how these ion fluxes generate the EPP. If the membrane potential of the muscle fiber is kept at EK (approximately –100 mV), the EPC will arise entirely from an influx of Na+ because at this potential there is no driving force on K+. In the absence of a voltage clamp to prevent postsynaptic membrane potential changes, such an influx of Na+ would cause a large depolarization and yield a large depolarizing EPP (Figure 5.18A). At the usual resting membrane potential of –90 mV, there is a small driving force on K+, but a much greater one on Na+. This means that much more Na+ flows into the muscle cell than K+ flows out (Figure 5.18B, left); the net influx of cations causes an EPC somewhat smaller than that measured at –100 mV and yields a depolarizing EPP that is also somewhat smaller than the EPP measured at –100 mV (Figure 5.18B, right). Thus, at the resting membrane potential, the EPP is generated primarily by Na+ influx, along with a small efflux of K+. At the reversal potential of 0 mV, Na+ influx and K+ efflux are exactly balanced, so no net current flows during the opening of channels by ACh binding (Figure 5.18C). This yields neither an EPC nor an EPP. At potentials more positive than Erev the balance reverses; for example, at ENa there is no influx of Na+ and a large efflux of K+ because of the large driving force on K+ (Figure 5.18D). This produces an outward EPC and a hyperpolarizing EPP. In summary, the polarity and magnitude of the EPC (Figure 5.18E) depend on the electrochemical driving force on the permeant ions, which in turn determines the polarity and magnitude of the EPP (Figure 5.18F). EPPs will depolarize when the membrane potential is more negative than Erev , and hyperpo-larize when the membrane potential is more positive than Erev. The general rule, then, is that the action of a transmitter drives the postsynaptic membrane potential toward Erev for the particular ion channels being activated.
رابطه بین شار یونی و تغییرات پتانسیل پس سیناپسی
تعریف شار یونی که در طول EPC رخ میدهد، امکان درک چگونگی تولید EPP توسط این شارهای یونی را فراهم میکند. اگر پتانسیل غشای فیبر عضلانی در EK (تقریباً 100- میلیولت) نگه داشته شود، EPC کاملاً از هجوم +Na ناشی میشود زیرا در این پتانسیل هیچ نیروی محرکهای بر +K وجود ندارد. در غیاب یک گیره ولتاژ برای جلوگیری از تغییرات پتانسیل غشای پس سیناپسی، چنین هجومی از +Na باعث دپلاریزاسیون زیادی میشود و EPP دپلاریزه کننده بزرگی را به همراه دارد (شکل 5.18A). در پتانسیل استراحت معمول غشاء 90- میلیولت، نیروی محرکه کمی بر +K وجود دارد، اما نیروی محرکه بر +Na بسیار بیشتر است. این بدان معناست که +Na بسیار بیشتری نسبت به +K از سلول عضلانی خارج میشود (شکل 5.18B، سمت چپ). ورود خالص کاتیونها باعث ایجاد EPC تا حدودی کوچکتر از EPP اندازهگیری شده در 100- میلیولت میشود و EPP دپلاریزه کنندهای را ایجاد میکند که آن هم تا حدودی کوچکتر از EPP اندازهگیری شده در 100- میلیولت است (شکل 5.18B، سمت راست). بنابراین، در پتانسیل استراحت غشاء، EPP در درجه اول توسط ورود +Na، همراه با خروج کمی +K تولید میشود. در پتانسیل معکوس 0 میلیولت، ورود +Na و خروج +K دقیقاً متعادل هستند، بنابراین هیچ جریان خالصی در طول باز شدن کانالها توسط اتصال ACh جریان نمییابد (شکل 5.18C). این نه EPC و نه EPP ایجاد میکند. در پتانسیلهای مثبتتر از Erev، تعادل معکوس میشود. به عنوان مثال، در ENa به دلیل نیروی محرکه بزرگ روی +K، ورود +Na و خروج زیاد +K وجود ندارد (شکل 5.18D). این امر باعث ایجاد EPC به سمت بیرون و EPP فوق قطبی میشود. به طور خلاصه، قطبیت و بزرگی EPC (شکل 5.18E) به نیروی محرکه الکتروشیمیایی روی یونهای نفوذکننده بستگی دارد که به نوبه خود قطبیت و بزرگی EPP را تعیین میکند (شکل 5.18F). EPPها وقتی پتانسیل غشا منفیتر از Erev باشد، دپلاریزه میشوند و وقتی پتانسیل غشا مثبتتر از Erev باشد، هایپرپلاریزه میشوند. بنابراین، قاعده کلی این است که عمل یک فرستنده، پتانسیل غشای پس سیناپسی را به سمت Erev برای کانالهای یونی خاص فعال شده هدایت میکند.
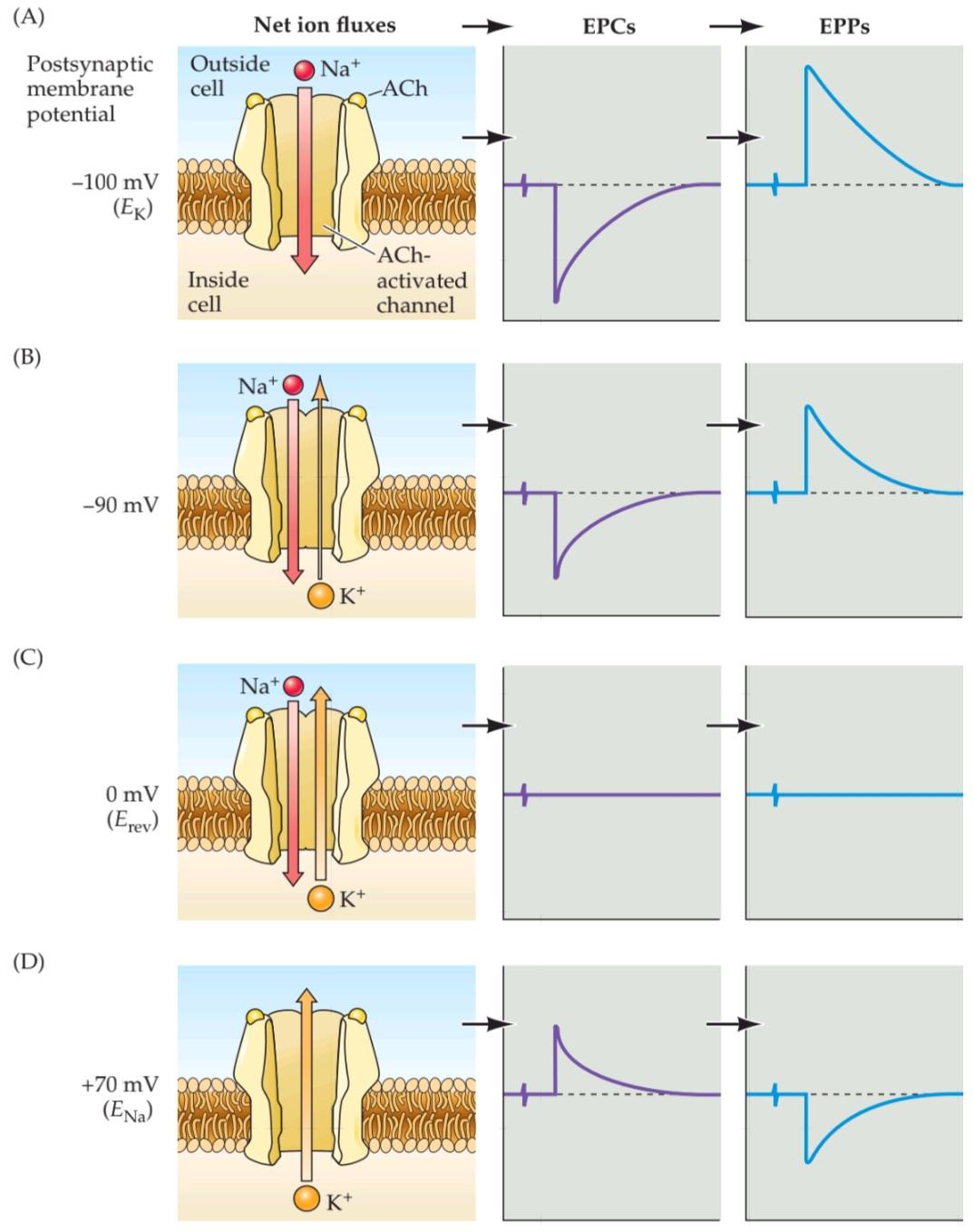

FIGURE 5.18 Na+ and K+ movements during EPCs and EPPs. (A–D) Each of the postsynaptic potentials indicated at the left results in different relative fluxes of Na+ and K+ (net ion fluxes). These ion flux-es determine the amplitude and polarity of the EPCs, which in turn determine the EPPs. Note that at about 0 mV the Na+ flux is exactly balanced by an opposite K+ flux, resulting in no net current flow, and hence no change in the membrane potential. (E) EPCs are inward at potentials more negative than Erev and outward at potentials more positive than Erev. (F) EPPs depolarize the postsynaptic cell at potentials more negative than Erev. At potentials more positive than Erev, EPPs hyperpolarize the cell.
شکل ۵.۱۸ حرکات +Na و +K در طول EPCها و EPPها. (A-D) هر یک از پتانسیلهای پسسیناپسی نشان داده شده در سمت چپ منجر به شارهای نسبی متفاوتی از +Na و +K (شارهای خالص یون) میشود. این شارهای یونی دامنه و قطبیت EPCها را تعیین میکنند که به نوبه خود EPPها را تعیین میکنند. توجه داشته باشید که در حدود 0 میلیولت، شار +Na دقیقاً با شار +K مخالف متعادل میشود و در نتیجه هیچ جریان خالصی جریان نمییابد و از این رو هیچ تغییری در پتانسیل غشا ایجاد نمیشود. (E) EPCها در پتانسیلهای منفیتر از Erev به سمت داخل و در پتانسیلهای مثبتتر از Erev به سمت خارج هستند. (F) EPPها در پتانسیلهای منفیتر از Erev سلول پسسیناپسی را دپلاریزه میکنند. در پتانسیلهای مثبتتر از Erev، EPPها سلول را هایپرپلاریزه میکنند.
Although this discussion has focused on the neuromuscular junction, similar mechanisms generate postsynaptic responses at all chemical synapses: Transmitter binding to postsynaptic receptors produces a postsynaptic conductance change as ion channels are opened (or sometimes closed). The postsynaptic conductance is increased if—as at the neuromuscular junction—channels are opened, and is decreased if channels are closed. This conductance change typically generates an electrical current, the postsynaptic current (PSC), which in turn changes the postsynaptic membrane potential to produce a postsynaptic potential (PSP). As in the specific case of the EPP at the neuromuscular junction, PSPs are depolarizing if their reversal potential is more positive than the resting membrane potential and hyperpolarizing if their reversal potential is more negative.
اگرچه این بحث بر روی اتصال عصبی-عضلانی متمرکز شده است، مکانیسمهای مشابهی پاسخهای پسسیناپسی را در تمام سیناپسهای شیمیایی ایجاد میکنند: اتصال فرستنده به گیرندههای پسسیناپسی با باز شدن (یا گاهی بسته شدن) کانالهای یونی، تغییر رسانایی پسسیناپسی ایجاد میکند. اگر کانالها باز باشند – مانند اتصال عصبی-عضلانی – رسانایی پسسیناپسی افزایش مییابد و اگر کانالها بسته باشند، کاهش مییابد. این تغییر رسانایی معمولاً یک جریان الکتریکی، جریان پسسیناپسی (PSC) ایجاد میکند که به نوبه خود پتانسیل غشای پسسیناپسی را برای تولید پتانسیل پسسیناپسی (PSP) تغییر میدهد. همانطور که در مورد خاص EPP در اتصال عصبی-عضلانی، PSPها اگر پتانسیل برگشت آنها مثبتتر از پتانسیل غشای استراحت باشد، دپلاریزه میشوند و اگر پتانسیل برگشت آنها منفیتر باشد، هایپرپلاریزه میشوند.
The conductance changes and the PSPs that typically accompany them are the ultimate outcome of most chemical synaptic transmission, concluding a sequence of electrical and chemical events that begins with the invasion of an action potential into the terminals of a presynaptic neuron. In many ways, the events that produce PSPs at synapses are similar to those that generate action potentials in axons; in both cases, conductance changes produced by ion channels lead to ion current flow that changes the membrane potential.
تغییرات رسانایی و PSPهایی که معمولاً با آنها همراه هستند، نتیجه نهایی اکثر انتقالهای سیناپسی شیمیایی هستند و به دنبالهای از رویدادهای الکتریکی و شیمیایی ختم میشوند که با هجوم یک پتانسیل عمل به پایانههای یک نورون پیشسیناپسی آغاز میشود. از بسیاری جهات، رویدادهایی که PSPها را در سیناپسها تولید میکنند، مشابه رویدادهایی هستند که پتانسیلهای عمل را در آکسونها ایجاد میکنند. در هر دو مورد، تغییرات رسانایی ایجاد شده توسط کانالهای یونی منجر به جریان جریان یونی میشود که پتانسیل غشا را تغییر میدهد.
Excitatory and Inhibitory Postsynaptic Potentials
PSPs ultimately alter the probability that an action potential will be produced in the postsynaptic cell. At the neuromuscular junction, synaptic action increases the probability that an action potential will occur in the postsynaptic muscle cell; indeed, the large amplitude of the EPP ensures that an action potential always is triggered. At many other synapses, PSPs similarly increase the probability of firing a postsynaptic action potential. However, still other synapses actually decrease the probability that the postsynaptic cell will generate an action potential. PSPs are called excitatory (or EPSPs) if they increase the likelihood of a postsynaptic action potential occurring, and inhibitory (or IPSPs) if they decrease this likelihood. Given that most neurons receive inputs from both excitatory and inhibitory synapses, it is important to understand more precisely the mechanisms that determine whether a particular synapse excites or inhibits its postsynaptic partner.
پتانسیلهای پسسیناپسی تحریکی و مهاری
PSPها در نهایت احتمال تولید یک پتانسیل عمل در سلول پسسیناپسی را تغییر میدهند. در محل اتصال عصبی-عضلانی، عمل سیناپسی احتمال وقوع یک پتانسیل عمل در سلول عضلانی پسسیناپسی را افزایش میدهد؛ در واقع، دامنه بزرگ EPP تضمین میکند که یک پتانسیل عمل همیشه فعال میشود. در بسیاری از سیناپسهای دیگر، PSPها به طور مشابه احتمال شلیک یک پتانسیل عمل پسسیناپسی را افزایش میدهند. با این حال، سیناپسهای دیگر در واقع احتمال تولید یک پتانسیل عمل توسط سلول پسسیناپسی را کاهش میدهند. PSPها اگر احتمال وقوع یک پتانسیل عمل پسسیناپسی را افزایش دهند، تحریکی (یا EPSP) و اگر این احتمال را کاهش دهند، مهاری (یا IPSP) نامیده میشوند. با توجه به اینکه اکثر نورونها ورودیها را از هر دو سیناپس تحریکی و مهاری دریافت میکنند، درک دقیقتر مکانیسمهایی که تعیین میکنند یک سیناپس خاص، شریک پسسیناپسی خود را تحریک یا مهار میکند، مهم است.
The principles of excitation just described for the neuromuscular junction are pertinent to all excitatory synapses. The principles of postsynaptic inhibition are much the same as for excitation, and they are also quite general. In both cases, neurotransmitters binding to receptors open or close ion channels in the postsynaptic cell. Whether a postsynaptic response is an EPSP or an IPSP depends on the type of channel that is coupled to the receptor, and on the concentration of permeant ions inside and outside the cell. In fact, the only distinction between postsynaptic excitation and inhibition is the reversal potential of the PSP in relation to the threshold voltage for generating action potentials in the postsynaptic cell.
اصول تحریک که برای اتصال عصبی-عضلانی شرح داده شد، برای همه سیناپسهای تحریکی نیز صادق است. اصول مهار پسسیناپسی تقریباً مشابه با تحریک است و همچنین کاملاً عمومی است. در هر دو مورد، انتقالدهندههای عصبی متصل به گیرندهها، کانالهای یونی را در سلول پسسیناپسی باز یا بسته میکنند. اینکه یک پاسخ پسسیناپسی EPSP باشد یا IPSP، به نوع کانالی که به گیرنده متصل است و به غلظت یونهای نفوذپذیر در داخل و خارج سلول بستگی دارد. در واقع، تنها تمایز بین تحریک پسسیناپسی و مهار، پتانسیل معکوس PSP در رابطه با ولتاژ آستانه برای تولید پتانسیلهای عمل در سلول پسسیناپسی است.
Consider, for example, a neuronal synapse that uses glutamate as the transmitter. Many such synapses have receptors that, like the ACh receptors at neuromuscular synapses, open ion channels that are nonselectively permeable to cations (see Chapter 6). When these glutamate receptors are activated, both Na+ and K+ flow across the postsynaptic membrane, yielding an Erev of approximately 0 mV for the resulting postsynaptic current. If the resting potential of the postsynaptic neuron is –60 mV, the resulting EPSP will depolarize by bringing the postsynaptic membrane potential toward 0 mV. For the hypothetical neuron shown in Figure 5.19A, the action potential threshold voltage is –40 mV. Thus, a glutamate-induced EPSP will increase the probability that this neuron produces an action potential, defining the synapse as excitatory.
به عنوان مثال، یک سیناپس عصبی را در نظر بگیرید که از گلوتامات به عنوان فرستنده استفاده میکند. بسیاری از این سیناپسها گیرندههایی دارند که مانند گیرندههای ACh در سیناپسهای عصبی-عضلانی، کانالهای یونی را باز میکنند که به طور غیرانتخابی نسبت به کاتیونها نفوذپذیر هستند (به فصل 6 مراجعه کنید). وقتی این گیرندههای گلوتامات فعال میشوند، هم +Na و هم +K از غشای پسسیناپسی عبور میکنند و Erev تقریباً 0 میلیولت برای جریان پسسیناپسی حاصل ایجاد میکنند. اگر پتانسیل استراحت نورون پسسیناپسی 60- میلیولت باشد، EPSP حاصل با رساندن پتانسیل غشای پسسیناپسی به سمت 0 میلیولت، دپلاریزه میشود. برای نورون فرضی نشان داده شده در شکل 5.19A، ولتاژ آستانه پتانسیل عمل 40- میلیولت است. بنابراین، EPSP القا شده توسط گلوتامات احتمال تولید پتانسیل عمل توسط این نورون را افزایش میدهد و سیناپس را به عنوان سیناپس تحریکی تعریف میکند.
As an example of inhibitory postsynaptic action, consider a neuronal synapse that uses GABA as its transmitter. At such synapses, the GABA receptors typically open channels that are selectively permeable to Cl–, and the action of GABA causes Cl– to flow across the postsynaptic membrane. Consider a case where ECl is –70 mV, as is the case for some neu-rons, so that the postsynaptic resting potential of –60 mV isless negative than ECl. The resulting positive electrochemical driving force (Vm – Erev) will cause negatively charged Cl– to flow into the cell and produce a hyperpolarizing IPSP (Figure 5.19B). This hyperpolarizing IPSP will take the postsynaptic membrane away from the action potential threshold of –40 mV, clearly inhibiting the postsynaptic cell.
به عنوان مثالی از عمل مهاری پس سیناپسی، یک سیناپس عصبی را در نظر بگیرید که از GABA به عنوان فرستنده خود استفاده میکند. در چنین سیناپسهایی، گیرندههای GABA معمولاً کانالهایی را باز میکنند که به طور انتخابی نسبت به Cl- نفوذپذیر هستند و عمل GABA باعث میشود Cl- از غشای پس سیناپسی جریان یابد. موردی را در نظر بگیرید که ECl برابر با 70- میلیولت باشد، همانطور که برای برخی از نورونها صادق است، به طوری که پتانسیل استراحت پس سیناپسی 60- میلیولت کمتر از ECl منفی است. نیروی محرک الکتروشیمیایی مثبت حاصل (Vm – Erev) باعث میشود Cl- با بار منفی به داخل سلول جریان یابد و یک IPSP فوق قطبی ایجاد کند (شکل 5.19B). این IPSP فوق قطبی، غشای پس سیناپسی را از آستانه پتانسیل عمل 40- میلیولت دور میکند و به وضوح سلول پس سیناپسی را مهار میکند.
Surprisingly, inhibitory synapses need not produce hyperpolarizing IPSPs. For instance, if ECl were –50 mV instead of –70 mV, then the negative electrochemical driving force would cause Cl– to flow out of the cell and produce a depolarizing IPSP (Figure 5.19C). However, the synapse would still be inhibitory: Given that the reversal potential of the IPSP still is more negative than the action potential threshold (–40 mV), the depolarizing IPSP would inhibit because the postsynaptic membrane potential would be kept more negative than the threshold for action potential initiation. Another way to think about this peculiar situation is that if another excitatory input onto this neuron brought the cell’s membrane potential to –41 mV—just below the threshold for firing an action potential—the IPSP would then hyperpolarize the membrane potential toward –50 mV, bringing the potential away from the action potential threshold. Thus, while EPSPs depolarize the postsynaptic cell, IPSPs can either hyperpolarize or depolarize; indeed, an inhibitory conductance change may produce no potential change at all and still exert an inhibitory effect by making it more difficult for an EPSP to evoke an action potential in the postsynaptic cell.
جالب اینجاست که سیناپسهای مهاری نیازی به تولید IPSP هایپرپلاریزه کننده ندارند. برای مثال، اگر ECl به جای 70- میلیولت، 50- میلیولت باشد، نیروی محرک الکتروشیمیایی منفی باعث میشود Cl- از سلول خارج شود و IPSP دپلاریزه کننده تولید کند (شکل 5.19C). با این حال، سیناپس همچنان مهاری خواهد بود: با توجه به اینکه پتانسیل معکوس IPSP هنوز منفیتر از آستانه پتانسیل عمل (40- میلیولت) است، IPSP دپلاریزه کننده مهار میکند زیرا پتانسیل غشای پس سیناپسی منفیتر از آستانه شروع پتانسیل عمل نگه داشته میشود. راه دیگری برای فکر کردن در مورد این وضعیت عجیب این است که اگر یک ورودی تحریکی دیگر به این نورون، پتانسیل غشای سلول را به 41- میلیولت – درست زیر آستانه شلیک پتانسیل عمل – برساند، IPSP پتانسیل غشا را به سمت 50- میلیولت هایپرپلاریزه میکند و پتانسیل را از آستانه پتانسیل عمل دور میکند. بنابراین، در حالی که EPSP ها سلول پس سیناپسی را دپلاریزه میکنند، IPSP ها میتوانند یا هایپرپلاریزه یا دپلاریزه شوند؛ در واقع، یک تغییر رسانایی مهاری ممکن است هیچ تغییر پتانسیلی ایجاد نکند و همچنان با دشوارتر کردن ایجاد پتانسیل عمل در سلول پس سیناپسی توسط EPSP، اثر مهاری خود را اعمال کند.
Although the particulars of postsynaptic action can be complex, a simple rule distinguishes postsynaptic excitation from inhibition: An EPSP has a reversal potential more positive than the action potential threshold, whereas an IPSP has a reversal potential more negative than threshold (Figure 5.19D). Intuitively, this rule can be understood by realizing that an EPSP will tend to depolarize the membrane potential so that it exceeds threshold, whereas an IPSP will always act to keep the membrane potential more negative than the threshold potential.
اگرچه جزئیات عمل پس سیناپسی میتواند پیچیده باشد، اما یک قانون ساده، تحریک پس سیناپسی را از مهار متمایز میکند: یک EPSP پتانسیل معکوسی مثبتتر از آستانه پتانسیل عمل دارد، در حالی که یک IPSP پتانسیل معکوسی منفیتر از آستانه دارد (شکل 5.19D). به طور شهودی، این قانون را میتوان با درک این نکته درک کرد که یک EPSP تمایل دارد پتانسیل غشا را دپلاریزه کند تا از آستانه فراتر رود، در حالی که یک IPSP همیشه طوری عمل میکند که پتانسیل غشا را منفیتر از پتانسیل آستانه نگه دارد.



FIGURE 5.19 Reversal potentials and threshold potentials determine postsynaptic excitation and inhibition. (A) If the reversal potential for a PSP (0 mV) is more positive than the action potential threshold (–40 mV), the effect of a transmitter is excitatory, and it generates EPSPs. (B) If the reversal potential for a PSP is more negative than the action potential threshold, the transmitter is inhibitory and generates IPSPs. (C) IPSPs can nonetheless depolarize the postsynaptic cell if their reversal potential is between the resting potential and the action potential threshold. (D) The general rule of postsynaptic action is: If the reversal potential is more positive than threshold, excitation results; inhibition occurs if the reversal potential is more negative than threshold.
شکل ۵.۱۹ پتانسیلهای معکوس و پتانسیلهای آستانه، تحریک و مهار پسسیناپسی را تعیین میکنند. (الف) اگر پتانسیل معکوس برای یک PSP (0 میلیولت) مثبتتر از آستانه پتانسیل عمل (40- میلیولت) باشد، اثر یک فرستنده تحریکی است و EPSP تولید میکند. (ب) اگر پتانسیل معکوس برای یک PSP منفیتر از آستانه پتانسیل عمل باشد، فرستنده مهاری است و IPSP تولید میکند. (ج) با این وجود، IPSPها میتوانند سلول پسسیناپسی را دپلاریزه کنند اگر پتانسیل معکوس آنها بین پتانسیل استراحت و آستانه پتانسیل عمل باشد. (د) قانون کلی عمل پسسیناپسی این است: اگر پتانسیل معکوس مثبتتر از آستانه باشد، تحریک حاصل میشود؛ اگر پتانسیل معکوس منفیتر از آستانه باشد، مهار رخ میدهد.
Summation of Synaptic Potentials
The PSPs produced at most synapses in the brain are much smaller than those at the neuromuscular junction; indeed, EPSPs produced by individual excitatory synapses may be only a fraction of a millivolt and are usually well below the threshold for generating postsynaptic action potentials. How, then, can such synapses transmit information if their PSPs are subthreshold? The answer is that neurons in the central nervous system are typically innervated by thousands of synapses, and the PSPs produced by each active synapse can sum together—in space and in time—to determine the behavior of the postsynaptic neuron.
جمع پتانسیلهای سیناپسی
PSP های تولید شده در اکثر سیناپسهای مغز بسیار کوچکتر از آنهایی هستند که در محل اتصال عصبی-عضلانی وجود دارند. در واقع، EPSP های تولید شده توسط سیناپسهای تحریکی منفرد ممکن است تنها کسری از میلیولت باشند و معمولاً بسیار پایینتر از آستانه تولید پتانسیلهای عمل پس سیناپسی هستند. پس چگونه چنین سیناپسهایی میتوانند اطلاعات را منتقل کنند اگر PSP های آنها زیرآستانه باشند؟ پاسخ این است که نورونها در سیستم عصبی مرکزی معمولاً توسط هزاران سیناپس عصبدهی میشوند و PSP های تولید شده توسط هر سیناپس فعال میتوانند – در فضا و در زمان – با هم جمع شوند تا رفتار نورون پس سیناپسی را تعیین کنند.
Consider the highly simplified case of a neuron that is innervated by two excitatory synapses, each generating a subthreshold EPSP, and an inhibitory synapse that produces an IPSP (Figure 5.20A). While activation of either one of the excitatory synapses alone (E1 or E2 in Figure 5.20B) produces a subthreshold EPSP, activation of both excitatory synapses at about the same time causes the two EPSPs to sum together. If the sum of the two EPSPs (E1 + E2) depolarizes the postsynaptic neuron sufficiently to reach the threshold potential, a postsynaptic action potential results. Summation thus allows subthreshold EPSPs to influence action potential production. Likewise, an IPSP generated by an inhibitory synapse (I) can sum (algebraically speaking) with a subthreshold EPSP to reduce its amplitude (E1 + I) or can sum with suprathreshold EPSPs to prevent the postsynaptic neuron from reaching threshold (E1 + I + E2).
مورد بسیار سادهشدهای از یک نورون را در نظر بگیرید که توسط دو سیناپس تحریکی عصبدهی میشود، که هر کدام یک EPSP زیرآستانهای تولید میکنند، و یک سیناپس مهاری که IPSP تولید میکند (شکل 5.20A). در حالی که فعال شدن هر یک از سیناپسهای تحریکی به تنهایی (E1 یا E2 در شکل 5.20B) یک EPSP زیرآستانهای تولید میکند، فعال شدن هر دو سیناپس تحریکی تقریباً همزمان باعث میشود که دو EPSP با هم جمع شوند. اگر مجموع دو EPSP (E1 + E2) نورون پسسیناپسی را به اندازه کافی دپلاریزه کند تا به پتانسیل آستانه برسد، یک پتانسیل عمل پسسیناپسی حاصل میشود. بنابراین، جمع شدن به EPSPهای زیرآستانهای اجازه میدهد تا بر تولید پتانسیل عمل تأثیر بگذارند. به همین ترتیب، یک IPSP تولید شده توسط یک سیناپس مهاری (I) میتواند (به صورت جبری) با یک EPSP زیرآستانهای جمع شود تا دامنه آن کاهش یابد (E1 + I) یا میتواند با EPSP های فوقآستانهای جمع شود تا از رسیدن نورون پسسیناپسی به آستانه (E1 + I + E2) جلوگیری شود.

FIGURE 5.20 Summation of postsynaptic potentials.(A) A microelectrode records the postsynaptic potentials produced by the activity of two excitatory synapses (E1 and E2) and an inhibitory synapse (I). (B) Electrical responses to synaptic activation. Stimulating either excitatory synapse (E1 or E2) produces a subthreshold EPSP, whereas stimulating both synapses at the same time (E1 + E2) produces a suprathreshold EPSP that evokes a postsynaptic action potential (shown in blue). Activation of the inhibitory synapse alone (I) results in a hyperpolarizing IPSP. Summing this IPSP (dashed red line) with the EPSP (dashed yellow line) produced by one excitatory synapse (E1 + I) reduces the amplitude of the EPSP (solid orange line), while summing it with the suprathreshold EPSP produced by activating synapses E1 and E2 keeps the postsynaptic neuron below threshold, so that no action potential is evoked.
شکل۵.۲۰ جمعبندی پتانسیلهای پسسیناپسی. (الف) یک میکروالکترود پتانسیلهای پسسیناپسی تولید شده توسط فعالیت دو سیناپس تحریکی (E1 و E2) و یک سیناپس مهاری (I) را ثبت میکند. (ب) پاسخهای الکتریکی به فعالسازی سیناپسی. تحریک هر یک از سیناپسهای تحریکی (E1 یا E2) یک EPSP زیرآستانهای تولید میکند، در حالی که تحریک همزمان هر دو سیناپس (E1 + E2) یک EPSP فوقآستانهای تولید میکند که یک پتانسیل عمل پسسیناپسی را ایجاد میکند (با رنگ آبی نشان داده شده است). فعال شدن سیناپس مهاری به تنهایی (I) منجر به IPSP فوققطبی میشود. جمع این IPSP (خط قرمز خطچین) با EPSP (خط زرد خطچین) تولید شده توسط یک سیناپس تحریکی (E1 + I) دامنه EPSP (خط نارنجی پررنگ) را کاهش میدهد، در حالی که جمع آن با EPSP فوق آستانه تولید شده توسط سیناپسهای فعال E1 و E2، نورون پسسیناپسی را زیر آستانه نگه میدارد، به طوری که هیچ پتانسیل عملی برانگیخته نمیشود.
In short, the summation of EPSPs and IPSPs by a postsynaptic neuron permits a neuron to integrate the electrical information provided by all the inhibitory and excitatory synapses acting on it at any moment. Whether the sum of active synaptic inputs results in the production of an action potential depends on the balance between excitation and inhibition. If the sum of all EPSPs and IPSPs results in a depolarization of sufficient amplitude to the membrane potential above threshold, then the postsynaptic cell will produce an action potential. Conversely, if inhibition prevails, then the postsynaptic cell will remain silent. Typically, the balance between EPSPs and IPSPs changes continually over time, depending on the number of excitatory and inhibitory synapses active at a given moment and the magnitude of the current at each active synapse. Summation is therefore a tug-of-war between all excitatory and inhibitory postsynaptic currents; the outcome of the contest determines whether or not a postsynaptic neuron fires an action potential and thereby becomes an active element in the neural circuits to which it belongs.
به طور خلاصه، جمع EPSPها و IPSPها توسط یک نورون پس سیناپسی به یک نورون اجازه میدهد تا اطلاعات الکتریکی ارائه شده توسط تمام سیناپسهای مهاری و تحریکی که در هر لحظه بر روی آن عمل میکنند را ادغام کند. اینکه آیا مجموع ورودیهای سیناپسی فعال منجر به تولید پتانسیل عمل میشود یا خیر، به تعادل بین تحریک و مهار بستگی دارد. اگر مجموع تمام EPSPها و IPSPها منجر به دپلاریزاسیون با دامنه کافی برای پتانسیل غشاء بالاتر از آستانه شود، سلول پس سیناپسی یک پتانسیل عمل تولید خواهد کرد. برعکس، اگر مهار غالب باشد، سلول پس سیناپسی ساکت خواهد ماند. به طور معمول، تعادل بین EPSPها و IPSPها به مرور زمان به طور مداوم تغییر میکند، بسته به تعداد سیناپسهای تحریکی و مهاری فعال در یک لحظه معین و بزرگی جریان در هر سیناپس فعال. بنابراین جمعبندی، یک مسابقه طنابکشی بین تمام جریانهای پس سیناپسی تحریکی و مهاری است. نتیجهی این رقابت تعیین میکند که آیا یک نورون پسسیناپسی پتانسیل عمل ایجاد میکند یا خیر و در نتیجه به عنصری فعال در مدارهای عصبی که به آن تعلق دارد تبدیل میشود یا خیر.
In conclusion, at chemical synapses neurotransmitter release from presynaptic terminals initiates a series of postsynaptic events that culminate in a transient change in the probability of a postsynaptic action potential occurring (Figure 5.21). Such synaptic signaling allows neurons to form the intricate synaptic circuits that play fundamental roles in brain information processing. Recent work further suggests that glial cells also contribute to synaptic signaling, adding another dimension to information processing in the brain (Box 5A).
در نتیجه، در سیناپسهای شیمیایی، آزادسازی انتقالدهندههای عصبی از پایانههای پیشسیناپسی، مجموعهای از رویدادهای پسسیناپسی را آغاز میکند که منجر به تغییر گذرا در احتمال وقوع پتانسیل عمل پسسیناپسی میشود (شکل 5.21). چنین سیگنالدهی سیناپسی به نورونها اجازه میدهد تا مدارهای سیناپسی پیچیدهای را تشکیل دهند که نقشهای اساسی در پردازش اطلاعات مغز ایفا میکنند. تحقیقات اخیر نشان میدهد که سلولهای گلیال نیز در سیگنالدهی سیناپسی نقش دارند و بُعد دیگری به پردازش اطلاعات در مغز میافزایند (کادر 5A).
BOX 5A ◊ The Tripartite Synapse
Up to this point, the discussion has considered signaling between presynaptic neurons and their postsynaptic targets to be a private dialogue between these two cells. However, recent work suggests that this synaptic conver-sation may involve glial cells as well.
کادر ۵A ◊ سیناپس سهجانبه
تا این لحظه، بحث، سیگنالدهی بین نورونهای پیشسیناپسی و اهداف پسسیناپسی آنها را به عنوان یک گفتگوی خصوصی بین این دو سلول در نظر گرفته است. با این حال، تحقیقات اخیر نشان میدهد که این گفتگوی سیناپسی ممکن است سلولهای گلیال را نیز درگیر کند.
As mentioned in Chapter 1, glial cells support neurons in several ways. For example, it is well established that glia regulate the extracellular environment by removing K+ that accumulates during action potential generation and by removing neurotransmitters at the conclusion of synaptic transmission. Consistent with such roles, glia seem to occupy virtually all of the non-neuronal volume of the brain. This means that glia are found in very close association with synapses (see Figure A); a given synapse typically is no more than a few hundred nanometers away from a glial cell. Glia form exceedingly fine processes that completely envelop synapses (see Figure B), an intimate association that raises the possibility of a signaling role for glia at synapses.
همانطور که در فصل 1 ذکر شد، سلولهای گلیال از چندین طریق از نورونها پشتیبانی میکنند. به عنوان مثال، به خوبی ثابت شده است که گلیا با حذف +K که در طول تولید پتانسیل عمل تجمع مییابد و با حذف انتقالدهندههای عصبی در پایان انتقال سیناپسی، محیط خارج سلولی را تنظیم میکند. مطابق با چنین نقشهایی، به نظر میرسد گلیا تقریباً تمام حجم غیر نورونی مغز را اشغال میکند. این بدان معناست که گلیا در ارتباط بسیار نزدیکی با سیناپسها یافت میشوند (شکل A را ببینید)؛ یک سیناپس مشخص معمولاً بیش از چند صد نانومتر از یک سلول گلیال فاصله ندارد. گلیا زوائد بسیار ظریفی را تشکیل میدهند که سیناپسها را به طور کامل میپوشانند (شکل B را ببینید)، ارتباط نزدیکی که احتمال نقش سیگنالدهی گلیا در سیناپسها را افزایش میدهد.
(A) Electron microscopy image of a synapse between a presynaptic terminal (pre) and postsynaptic neuron (post), with a glial cell (astrocyte; astro) immediately adjacent to the synapse.
(الف) تصویر میکروسکوپ الکترونی از یک سیناپس بین یک نورون پیشسیناپسی (پیش) و یک نورون پسسیناپسی (پست)، با یک سلول گلیال (آستروسیت؛ آسترو) که بلافاصله در مجاورت سیناپس قرار دارد.
(B) Three-dimensional structure of the contact between a glial cell (blue) surrounding dendrites of four postsynaptic neurons (different colors).
(ب) ساختار سهبعدی تماس بین یک سلول گلیال (آبی) که دندریتهای چهار نورون پسسیناپسی (رنگهای مختلف) را احاطه کرده است.

The first support for such a role came from the discovery that glia respond to application of neurotransmitters. The list of neurotransmitters that elicit responses in glia now includes acetylcholine, glutamate, GABA, and many others. These responses are mediated by the same sorts of neurotransmitter receptors that are employed in synaptic signaling, most often the metabotropic receptors that are coupled to intracellular signaling cascades (see Figure 5.14B). In some cases, neurotransmitters produce changes in the membrane potential of glia. More often, these neurotransmitters cause transient changes in intracellular calcium concentration within the glial cell. These intracellular calcium signals often are observed to trigger calcium waves that spread both within a single glial cell and also propagate between glia (see Figure C).
اولین تایید برای چنین نقشی از کشف این موضوع ناشی شد که گلیا به کاربرد انتقالدهندههای عصبی پاسخ میدهد. فهرست انتقالدهندههای عصبی که در گلیا پاسخ ایجاد میکنند، اکنون شامل استیل کولین، گلوتامات، گابا و بسیاری دیگر است. این پاسخها توسط همان نوع گیرندههای انتقالدهنده عصبی که در سیگنالدهی سیناپسی به کار میروند، و اغلب گیرندههای متابوتروپیک که به آبشارهای سیگنالدهی درون سلولی متصل هستند، واسطهگری میشوند (شکل 5.14B را ببینید). در برخی موارد، انتقالدهندههای عصبی تغییراتی در پتانسیل غشای گلیا ایجاد میکنند. اغلب، این انتقالدهندههای عصبی باعث تغییرات گذرا در غلظت کلسیم درون سلولی در سلول گلیال میشوند. این سیگنالهای کلسیم درون سلولی اغلب مشاهده میشوند که امواج کلسیم را تحریک میکنند که هم در یک سلول گلیال واحد پخش میشوند و هم بین گلیاها منتشر میشوند (شکل C را ببینید).
(C) Application of glutamate (at arrow) increases intracellular Ca2+ (white) in cultured glia. Examination of these cells at different times indicates that the calciumsignals spread as a wave through neighboring glia.
(ج) استفاده از گلوتامات (در فلش) باعث افزایش +Ca2 درون سلولی (سفید) در گلیاهای کشت شده میشود. بررسی این سلولها در زمانهای مختلف نشان میدهد که سیگنالهای کلسیم به صورت موجی از طریق گلیاهای همسایه پخش میشوند.
 (D) Transient elevation of Ca2+ whitin a single glial cell (arrow) enhances transmission at an excitatory synapse in the hippocampus. (A.B from witcher et al., 2007; C from Cornell-Bell et al. 1990; D after Perea and Araque, 2007.)
(D) Transient elevation of Ca2+ whitin a single glial cell (arrow) enhances transmission at an excitatory synapse in the hippocampus. (A.B from witcher et al., 2007; C from Cornell-Bell et al. 1990; D after Perea and Araque, 2007.)
(د) افزایش گذرای کلسیم در یک سلول گلیال (فلش) انتقال را در یک سیناپس تحریکی در هیپوکامپ افزایش میدهد. (A.B از witcher و همکاران، ۲۰۰۷؛ C از Cornell-Bell و همکاران، ۱۹۹۰؛ D پس از Perea و Araque، ۲۰۰۷.)
These transient rises in intracellular calcium serve as second messenger signals (see Chapter 7) that trigger a number of physiological responses in glia. The most remarkable response is the release of several molecules—such as glutamate, GABA, and ATP—that are traditionally considered to be neurotransmitters. Release of such “gliotransmitters” occurs both via the calcium-triggered exocytotic mechanisms employed in presynaptic terminals of neurons (see Figure 5.4C), as well as via unconventional release mechanisms such as permeation through certain ion channels.
این افزایشهای گذرا در کلسیم درون سلولی به عنوان سیگنالهای پیامرسان ثانویه عمل میکنند (به فصل 7 مراجعه کنید) که تعدادی از پاسخهای فیزیولوژیکی را در گلیا آغاز میکنند. قابل توجهترین پاسخ، آزادسازی چندین مولکول – مانند گلوتامات، GABA و ATP – است که به طور سنتی به عنوان انتقالدهندههای عصبی در نظر گرفته میشوند. آزادسازی چنین “گلیوترنسمیترهایی” هم از طریق مکانیسمهای اگزوسیتوزی ناشی از کلسیم که در پایانههای پیشسیناپسی نورونها به کار میروند (به شکل 5.4C مراجعه کنید) و هم از طریق مکانیسمهای آزادسازی غیرمتعارف مانند نفوذ از طریق کانالهای یونی خاص رخ میدهد.
The ability both to respond to and to release neurotransmitters potentially makes glia participants in synaptic signaling. Indeed, release of neurotransmitters from a variety of presynaptic terminals has been found to elicit responses in glia. Furthermore, release of gliotransmitters has been found to regulate transmission at numerous synapses (see Figure D). In some cases, glia regulate release of transmitters from presynaptic terminals, while in other cases they alter postsynaptic responsiveness. Glia can also alter the ability of synapses to undergo activity-dependent, plastic changes in synaptic transmission (see Chapter 8).
توانایی پاسخ دادن و آزاد کردن انتقالدهندههای عصبی به طور بالقوه باعث میشود که گلیا در سیگنالدهی سیناپسی شرکت کند. در واقع، مشخص شده است که آزاد شدن انتقالدهندههای عصبی از انواع پایانههای پیشسیناپسی، پاسخهایی را در گلیا ایجاد میکند. علاوه بر این، مشخص شده است که آزاد شدن انتقالدهندههای گلیوترانسمیتر، انتقال را در سیناپسهای متعدد تنظیم میکند (شکل D را ببینید). در برخی موارد، گلیا آزاد شدن انتقالدهندهها را از پایانههای پیشسیناپسی تنظیم میکند، در حالی که در موارد دیگر، آنها پاسخدهی پسسیناپسی را تغییر میدهند. گلیا همچنین میتواند توانایی سیناپسها را برای انجام تغییرات انعطافپذیر وابسته به فعالیت در انتقال سیناپسی تغییر دهد (به فصل 8 مراجعه کنید).
This ability of glia to participate in synaptic signaling has led to the concept of the tripartite synapse, a three-way junction involving the presynaptic terminal, the postsynaptic process, and neighboring glia. While there is still debate about the physiological significance of such neuron–glia interactions, the ability of glia to release neurotransmitters, similar to presynaptic terminals, and to respond to neurotransmitters, similar to postsynaptic neurons, is dramatically changing our view of brain signaling mechanisms.
این توانایی گلیا برای شرکت در سیگنالینگ سیناپسی منجر به مفهوم سیناپس سهجانبه شده است، یک اتصال سهطرفه شامل ترمینال پیشسیناپسی، فرآیند پسسیناپسی و گلیاهای همسایه. در حالی که هنوز در مورد اهمیت فیزیولوژیکی چنین تعاملات نورون-گلیا بحث وجود دارد، توانایی گلیا در آزادسازی انتقالدهندههای عصبی، مشابه ترمینالهای پیشسیناپسی، و پاسخ به انتقالدهندههای عصبی، مشابه نورونهای پسسیناپسی، به طور چشمگیری دیدگاه ما را در مورد مکانیسمهای سیگنالینگ مغز تغییر میدهد.
Summary
Synapses communicate the information carried by action potentials from one neuron to the next in neural circuits. The mechanisms underlying postsynaptic potentials generated during synaptic transmission are closely related to the mechanisms that generate other types of neuronal electrical signals, namely, ionic flow through membrane channels. In the case of electrical synapses, these channels are connexons; direct but passive flow of current through connexons is the basis for transmission. In the case of chemical synapses, channels with smaller and more selective pores are activated by the binding of neurotransmitters to postsynaptic receptors following release of the neurotransmitters from the presynaptic terminal. The large number of neurotransmitters in the nervous system can be divided into two broad classes: small-molecule transmitters and neuropeptides. Neurotransmitters are synthesized from defined precursors by regulated enzymatic pathways, packaged into one of several types of synaptic vesicles, and released into the synaptic cleft in a Ca2+-dependent manner. Transmitter agents are released presynaptically in units, or quanta, reflecting their storage within synaptic vesicles. Vesicles discharge their contents into the synaptic cleft when the presynaptic depolarization generated by the invasion of an action potential opens voltage-gated calcium channels, allowing Ca2+ to enter the presynaptic terminal. Calcium triggers neurotransmitter release by binding to the Ca2+ sensor protein, synaptotagmin, working in concert with SNARE proteins found on both vesicle and plasma membranes. Postsynaptic receptors are a diverse group of proteins that transduce binding of neurotransmitters into electrical signals by opening or closing postsynaptic ion channels. Two broadly different families of neurotransmitter receptors have evolved to carry out the postsynaptic signaling actions of neurotransmitters. The postsynaptic currents produced by the synchronous opening or closing of ion channels change the conductance of the postsynaptic cell, thus increasing or decreasing its excitability. Conductance changes that increase the probability of firing an action potential are excitatory, whereas those that decrease the probability of generating an action potential are inhibitory. Because postsynaptic neurons are usually innervated by many different inputs, the integrated effect of the conductance changes underlying all EPSPs and IPSPs produced in a postsynaptic cell at any moment determines whether or not the cell fires an action potential. The postsynaptic effects of neurotransmitters are terminated by the degradation of the transmitter in the synaptic cleft, by transport of the transmitter back into cells, or by diffusion out of the synaptic cleft. The response elicited at a given synapse depends on the type of neurotransmitter released and the postsynaptic complement of receptors and associated channels.
خلاصه
سیناپسها اطلاعات حمل شده توسط پتانسیلهای عمل را از یک نورون به نورون بعدی در مدارهای عصبی منتقل میکنند. مکانیسمهای زیربنایی پتانسیلهای پسسیناپسی تولید شده در طول انتقال سیناپسی، ارتباط نزدیکی با مکانیسمهایی دارند که انواع دیگر سیگنالهای الکتریکی عصبی، یعنی جریان یونی از طریق کانالهای غشایی را تولید میکنند. در مورد سیناپسهای الکتریکی، این کانالها کانکسون هستند؛ جریان مستقیم اما غیرفعال جریان از طریق کانکسونها اساس انتقال است. در مورد سیناپسهای شیمیایی، کانالهایی با منافذ کوچکتر و انتخابیتر با اتصال انتقالدهندههای عصبی به گیرندههای پسسیناپسی پس از آزادسازی انتقالدهندههای عصبی از ترمینال پیشسیناپسی فعال میشوند. تعداد زیادی از انتقالدهندههای عصبی در سیستم عصبی را میتوان به دو دسته گسترده تقسیم کرد: انتقالدهندههای مولکولی کوچک و نوروپپتیدها. انتقالدهندههای عصبی از پیشسازهای تعریفشده توسط مسیرهای آنزیمی تنظیمشده سنتز میشوند، در یکی از چندین نوع وزیکول سیناپسی بستهبندی میشوند و به صورت وابسته به +Ca2 به شکاف سیناپسی آزاد میشوند. عوامل انتقالدهنده به صورت پیشسیناپسی در واحدها یا کوانتومها آزاد میشوند که نشاندهنده ذخیره آنها در وزیکولهای سیناپسی است. وزیکولها محتویات خود را به شکاف سیناپسی تخلیه میکنند، زمانی که دپلاریزاسیون پیشسیناپسی ناشی از تهاجم یک پتانسیل عمل، کانالهای کلسیم وابسته به ولتاژ را باز میکند و به +Ca2 اجازه ورود به ترمینال پیشسیناپسی را میدهد. کلسیم با اتصال به پروتئین حسگر +Ca2، سیناپتوتاگمین، که با پروتئینهای SNARE موجود در غشاهای وزیکول و پلاسما هماهنگ است، آزادسازی انتقالدهنده عصبی را آغاز میکند. گیرندههای پسسیناپسی گروه متنوعی از پروتئینها هستند که با باز یا بسته کردن کانالهای یونی پسسیناپسی، اتصال انتقالدهندههای عصبی را به سیگنالهای الکتریکی تبدیل میکنند. دو خانواده کاملاً متفاوت از گیرندههای انتقالدهنده عصبی برای انجام اعمال سیگنالدهی پسسیناپسی انتقالدهندههای عصبی تکامل یافتهاند. جریانهای پسسیناپسی تولید شده توسط باز یا بسته شدن همزمان کانالهای یونی، رسانایی سلول پسسیناپسی را تغییر میدهند و در نتیجه تحریکپذیری آن را افزایش یا کاهش میدهند. تغییرات رسانایی که احتمال شلیک یک پتانسیل عمل را افزایش میدهند، تحریکی هستند، در حالی که آنهایی که احتمال تولید یک پتانسیل عمل را کاهش میدهند، مهاری هستند. از آنجا که نورونهای پسسیناپسی معمولاً توسط ورودیهای مختلف زیادی عصبدهی میشوند، اثر یکپارچه تغییرات رسانایی که زیربنای همه EPSPها و IPSPهای تولید شده در یک سلول پسسیناپسی در هر لحظه است، تعیین میکند که آیا سلول پتانسیل عمل شلیک میکند یا خیر. اثرات پسسیناپسی انتقالدهندههای عصبی با تخریب انتقالدهنده در شکاف سیناپسی، با انتقال مجدد انتقالدهنده به داخل سلولها یا با انتشار به خارج از شکاف سیناپسی خاتمه مییابد. پاسخ ایجاد شده در یک سیناپس معین به نوع انتقالدهنده عصبی آزاد شده و مکمل پسسیناپسی گیرندهها و کانالهای مرتبط بستگی دارد.

FIGURE 5.21 Overview of postsynaptic signaling. Neurotransmitter released from presynaptic terminals binds to its cognate postsynaptic receptor, which causes the opening or closing of specific postsynaptic ion channels. The resulting conductance change causes current to flow, which may change the membrane potential. The postsynaptic cell sums (or integrates) all of the EPSPs and IPSPs, resulting in moment-to-moment control of action potential generation.
شکل ۵.۲۱ مروری بر سیگنالینگ پسسیناپسی. انتقالدهنده عصبی آزاد شده از پایانههای پیشسیناپسی به گیرنده پسسیناپسی همریشه خود متصل میشود که باعث باز یا بسته شدن کانالهای یونی پسسیناپسی خاص میشود. تغییر رسانایی حاصل باعث ایجاد جریان میشود که ممکن است پتانسیل غشا را تغییر دهد. سلول پسسیناپسی تمام EPSPها و IPSPها را جمع (یا ادغام) میکند و در نتیجه کنترل لحظه به لحظه تولید پتانسیل عمل را به دست میآورد.
ADDITIONAL READING
کلیک کنید «Reviews»
Ackermann, F., J. A. Gregory and L. Brodin (2012) Key events in synaptic vesicle endocytosis. Chapter 1 in Molecular Regulation of Endocytosis, B. Ceresa (ed.). Rijeka, Croatia: Intech.
Augustine, G. J. and H. Kasai (2006) Bernard Katz, quantal transmitter release, and the foundations of presynaptic physiology. J. Physiol. (Lond.) 578: 623–625.
Hestrin, S. and M. Galarreta (2005) Electrical synapses define networks of neocortical GABAergic neurons. Trends Neurosci. 28: 304–309.
Lefkowitz, R. J. (2007) Seven transmembrane receptors: something old, something new. Acta Physiol. (Oxf.) 190: 9–19.
Rizzoli, S. O. (2014) Synaptic vesicle recycling: steps and principles. EMBO J. 33: 788–822.
کلیک کنید «Important original papers»
Adler, E., M. Adler, G. J. Augustine, M. P. Charlton and S. N. Duffy (1991) Alien intracellular calcium chelators attenuate
neurotransmitter release at the squid giant synapse. J. Neurosci. 11: 1496–1507.
Augustine, G. J. and R. Eckert (1984) Divalent cations differentially support transmitter release at the squid giant synapse. J. Physiol. (Lond.) 346: 257–271.
Beierlein, M., J. R. Gibson and B. W. Connors (2000) A network of electrically coupled interneurons drives synchronized inhibition in neocortex. Nature Neurosci. 3: 904–910.
Boyd, I. A. and A. R. Martin (1955) The end-plate potential in mammalian muscle. J. Physiol. (Lond.) 132: 74–91.
Burette, A. C. and 6 others (2012) Electron tomographic analysis of synaptic ultrastructure. J. Comp. Neurol. 520: 2697–2711.
Curtis, D. R., J. W. Phillis and J. C. Watkins (1959) Chemical excitation of spinal neurons. Nature 183: 611–612.
Dale, H. H., W. Feldberg and M. Vogt (1936) Release of acetylcholine at voluntary motor nerve endings. J. Physiol. 86: 353–380.
del Castillo, J. and B. Katz (1954) Quantal components of the end plate potential. J. Physiol. (Lond.) 124: 560–573.
Fatt, P. and B. Katz (1951) An analysis of the end plate potential recorded with an intracellular electrode. J. Physiol. (Lond.) 115: 320–370.
Fatt, P. and B. Katz (1952) Spontaneous subthreshold activity at motor nerve endings. J. Physiol. (Lond.) 117: 109–128.
Fotin, A. and 6 others (2004) Molecular model for a complete clathrin lattice from electron cryomicroscopy. Nature 432: 573–579.
Furshpan, E. J. and D. D. Potter (1959) Transmission at the giant motor synapses of the crayfish. J. Physiol. (Lond.) 145: 289–325.
Harris, B. A., J. D. Robishaw, S. M. Mumby and A. G. Gilman (1985) Molecular cloning of complementary DNA for the alpha subunit of the G protein that stimulates adenylate cyclase. Science 229: 1274–1277.
Heuser, J. E. and T. S. Reese (1973) Evidence for recycling of synaptic vesicle membrane during transmitter release at the frog neuromuscular junction. J. Cell Biol. 57: 315–344.
Heuser, J. E. and 5 others (1979) Synaptic vesicle exocytosis captured by quick freezing and correlated with quantal transmitter release. J. Cell Biol. 81: 275–300.
Imig, C. and 8 others (2014) The morphological and molecular nature of synaptic vesicle priming at presynaptic active zones. Neuron 84: 416–431.
Loewi, O. (1921) Über humorale Übertragbarkeit der Herznerven-wirkung. Pflügers Arch. 189: 239–242.
Maeda, S. and 6 others (2009) Structure of the connexin 26 gap junction channel at 3.5 A˚ resolution. Nature 458: 597–602.
Miledi, R. (1973) Transmitter release induced by injection of calcium ions into nerve terminals. Proc. R. Soc. Lond. B 183: 421–425.
Neher, E. and B. Sakmann (1976) Single-channel currents recorded from membrane of denervated frog muscle fibres. Nature 260: 799–802.
Reubold, T. F. and 12 others (2015) Crystal structure of the dynamin tetramer. Nature 525: 404–408.
Smith, S. J., J. Buchanan, L. R. Osses, M. P. Charlton and G. J. Augustine (1993) The spatial distribution of calcium signals in squid presynaptic terminals. J. Physiol. (Lond.) 472: 573–593.
Sotelo, C., R. Llinas and R. Baker (1974) Structural study of inferior olivary nucleus of the cat: morphological correlates of electrotonic coupling. J. Neurophysiol. 37: 541–559.
Sutton, R. B., D. Fasshauer, R. Jahn and A. T. Brünger (1998) Crystal structure of a SNARE complex involved in synaptic exocytosis at 2.4 Å resolution. Nature 395: 347–353.
Takamori, S. and 21 others (2006) Molecular anatomy of a trafficking organelle. Cell 127: 831–846.
Takeuchi, A. and N. Takeuchi (1960) On the permeability of end-plate membrane during the action of transmitter. J. Physiol. (Lond.) 154: 52–67.
Wickman, K. and 7 others (1994) Recombinant Gbg activates the muscarinic-gated atrial potassium channel IKACh. Nature 368: 255–257.
Zhou, Q. and 19 others (2015) Architecture of the synaptotagmin-SNARE machinery for neuronal exocytosis. Nature 525: 62–67.
کلیک کنید «Books»
Katz, B. (1969) The Release of Neural Transmitter Substances. Liverpool: Liverpool University Press.
Nestler, E., S. Hyman, D. M. Holtzman and R. Malenka (2015) Molecular Neuropharmacology: A Foundation for Clinical Neuroscience, 3rd Edition. New York: McGraw Hill.
Peters, A., S. L. Palay and H. deF. Webster (1991) The Fine Structure of the Nervous System: Neurons and Their Supporting Cells, 3rd Edition. Oxford: Oxford University Press.
Go to the NEUROSCIENCE 6e Companion Website at oup-arc.com/access/purves-6e for Web Topics, Animations, Flashcards, and more. Go to DASHBOARD for additional resources and assessments.
