علوم اعصاب پروس؛ حواس شیمیایی: حس بویایی و حس چشایی

دعای مطالعه [ نمایش ]
بِسْمِ الله الرَّحْمنِ الرَّحیمِ
اَللّهُمَّ اَخْرِجْنى مِنْ ظُلُماتِ الْوَهْمِ
خدايا مرا بيرون آور از تاريكىهاى وهم،
وَ اَكْرِمْنى بِنُورِ الْفَهْمِ
و به نور فهم گرامى ام بدار،
اَللّهُمَّ افْتَحْ عَلَيْنا اَبْوابَ رَحْمَتِكَ
خدايا درهاى رحمتت را به روى ما بگشا،
وَانْشُرْ عَلَيْنا خَزائِنَ عُلُومِكَ بِرَحْمَتِكَ يا اَرْحَمَ الرّاحِمينَ
و خزانههاى علومت را بر ما باز كن به امید رحمتت اى مهربانترين مهربانان.
کتاب «علوم اعصاب» اثر پروس و همکاران بهعنوان یکی از جامعترین و معتبرترین منابع در حوزه علوم اعصاب (Neuroscience)، همچنان مرجع کلیدی برای درک پیچیدگیهای مغز و سیستم عصبی است. این اثر با بهرهگیری از تازهترین پژوهشها و توضیحات دقیق درباره سازوکارهای عصبی، پلی میان دانش پایه علوم اعصاب و کاربردهای بالینی ایجاد میکند و نقشی بیبدیل در آموزش، پژوهش و ارتقای دانش مغز و اعصاب ایفا مینماید.
ترجمه دقیق و علمی این شاهکار توسط برند علمی «آیندهنگاران مغز» به مدیریت داریوش طاهری، دسترسی فارسیزبانان به مرزهای نوین دانش علوم اعصاب را ممکن ساخته و رسالتی علمی برای ارتقای آموزش، فهم عمیقتر عملکرد مغز و سیستم عصبی و توسعه روشهای نوین در حوزه سلامت عصبی فراهم آورده است.
» کتاب مبانی علوم اعصاب پروس
» » فصل ۱۵؛ حواس شیمیایی
»
»» Chapter 15; The Chemical Senses
در حال ویرایش

Overview
THREE SENSORY SYSTEMS ARE ASSOCIATED with the nose and mouth: the olfactory (smell), vomeronasal (pheromone sensation), and gustatory (taste) systems. Each detects chemicals in the environment. The olfactory system detects airborne molecules called odorants that provide information about animals and plants, help identify food and noxious substances, as well as signals regarding self versus others. Olfactory information thus influences social interactions, reproduction, defensive responses, and feeding. In most mammals except, notably, humans-a second chemosensory system, the vomeronasal system, detects airborne odors from predators, prey, and potential mates. The gustatory system detects ingested tastants (primarily wateror fatsoluble molecules) that provide information about the quality, quantity, and safety of ingested food. For smell, vomeronasal chemosensation, and most aspects of taste, the initiation of sensory transduction relies on G-protein coupled receptors (GPCRs) and second-messenger mediated signaling. In each system, there are a large number of receptor genes that encode GPCRs with capacity to bind specific odorants or tastants. The stimulus selectivity for olfactory receptor molecules remains mostly unknown; however, specific vomeronasal receptor molecules are selective either for sex specific odorants in males versus females or for odorants of predators versus prey. Specific dimeric combinations of taste receptor molecules are selective for the five basic classes of taste stimuli. Information from primary sensory receptors in the nose or tongue is relayed to CNS regions that guide a broad range of social and defensive behaviors. Despite this anatomical knowledge, the central representation of conscious olfactory perception remains uncertain. The central representation of vomeronasal information activates hypothalamic and amygdala circuitry to influence sexual, homeostatic, or predator-avoidance behaviors. The central representation of taste is by far the best understood of the chemical senses: Information about each of the five major taste categories is preserved as five representations from the tongue in the insular cortex, where taste is processed. From an evolutionary perspective, the chemical senses particularly olfaction and vomeronasal sensation are deemed to be the “oldest” or “most primitive,” yet they are in many ways the least understood of the sensory modalities.
مرور کلی
سه سیستم حسی با بینی و دهان مرتبط هستند: سیستمهای بویایی (بویایی)، وومرونازال (حس فرومون) و چشایی (چشایی). هر کدام مواد شیمیایی موجود در محیط را تشخیص میدهند. سیستم بویایی مولکولهای موجود در هوا به نام بوها را تشخیص میدهد که اطلاعاتی در مورد حیوانات و گیاهان ارائه میدهند، به شناسایی غذا و مواد مضر و همچنین سیگنالهایی در مورد خود در مقابل دیگران کمک میکنند. بنابراین اطلاعات بویایی بر تعاملات اجتماعی، تولید مثل، پاسخهای دفاعی و تغذیه تأثیر میگذارد. در اکثر پستانداران به جز، به ویژه انسان، یک سیستم شیمیایی-حسی دوم، سیستم وومرونازال، بوهای موجود در هوا را از شکارچیان، طعمهها و جفتهای بالقوه تشخیص میدهد. سیستم چشایی، طعمهای بلعیده شده (عمدتاً مولکولهای محلول در آب یا چربی) را تشخیص میدهد که اطلاعاتی در مورد کیفیت، کمیت و ایمنی غذای بلعیده شده ارائه میدهند. برای بو، حس شیمیایی وومرونازال و بیشتر جنبههای چشایی، شروع انتقال حسی به گیرندههای جفتشده با پروتئین G (GPCRs) و سیگنالدهی واسطهگریشده توسط پیامرسان ثانویه متکی است. در هر سیستم، تعداد زیادی ژن گیرنده وجود دارد که GPCRهایی را با ظرفیت اتصال به بوها یا طعمدهندههای خاص رمزگذاری میکنند. گزینشپذیری محرک برای مولکولهای گیرنده بویایی عمدتاً ناشناخته مانده است. با این حال، مولکولهای گیرنده خاص وومرونازال یا برای بوهای خاص جنس در مردان در مقابل زنان یا برای بوهای شکارچیان در مقابل طعمه گزینشی هستند. ترکیبات دیمری خاص مولکولهای گیرنده چشایی برای پنج دسته اصلی محرکهای چشایی گزینشی هستند. اطلاعات از گیرندههای حسی اولیه در بینی یا زبان به نواحی CNS منتقل میشود که طیف وسیعی از رفتارهای اجتماعی و دفاعی را هدایت میکنند. با وجود این دانش آناتومیکی، بازنمایی مرکزی درک بویایی آگاهانه همچنان نامشخص است. بازنمایی مرکزی اطلاعات وومرونازال، مدارهای هیپوتالاموس و آمیگدال را فعال میکند تا بر رفتارهای جنسی، هموستاتیک یا اجتناب از شکارچی تأثیر بگذارد. بازنمایی مرکزی چشایی تاکنون شناختهشدهترین حس شیمیایی بوده است: اطلاعات مربوط به هر یک از پنج دسته اصلی چشایی به صورت پنج بازنمایی از زبان در قشر اینسولار، جایی که چشایی پردازش میشود، حفظ میشود. از دیدگاه تکاملی، حسهای شیمیایی، به ویژه حس بویایی و حس ومرونازال، «قدیمیترین» یا «ابتداییترین» حسها تلقی میشوند، با این حال از بسیاری جهات، کمترین شناخت را از روشهای حسی دارند.
Organization of the Olfactory System
The olfactory system the most thoroughly studied component of the chemosensory triad processes information about the identity, concentration, and quality of a wide range of airborne, volatile chemical stimuli called odorants. Odorants interact with olfactory receptor neurons found in an epithelial sheet, the olfactory epithelium, that lines the interior of the nose (Figure 15.1A,B). Axons arising from receptor cells project through the cribiform plate (a thin perforated region of the skull that separates the olfactory epithelium from the brain) directly to neurons in the olfactory bulb, which in turn sends projections to the pyriform cortex in the temporal lobe, as well as to other structures in the forebrain, via an axon pathway known as the olfactory tract (Figure 15.1C,D).
سازماندهی سیستم بویایی
سیستم بویایی – که کاملترین جزء مورد مطالعه در سهگانه شیمیایی-حسی است، اطلاعات مربوط به هویت، غلظت و کیفیت طیف وسیعی از محرکهای شیمیایی فرار موجود در هوا به نام بوها را پردازش میکند. بوها با نورونهای گیرنده بویایی که در یک صفحه اپیتلیال، اپیتلیوم بویایی، که قسمت داخلی بینی را میپوشاند، یافت میشوند، تعامل دارند (شکل 15.1A، B). آکسونهای ناشی از سلولهای گیرنده از طریق صفحه کریبیفرم (یک ناحیه سوراخدار نازک از جمجمه که اپیتلیوم بویایی را از مغز جدا میکند) مستقیماً به نورونهای پیاز بویایی میروند، که به نوبه خود از طریق یک مسیر آکسونی معروف به دستگاه بویایی، به قشر پیریفورم در لوب گیجگاهی و همچنین به سایر ساختارهای مغز پیشین، پروجکشن ارسال میکند (شکل 15.1C، D).
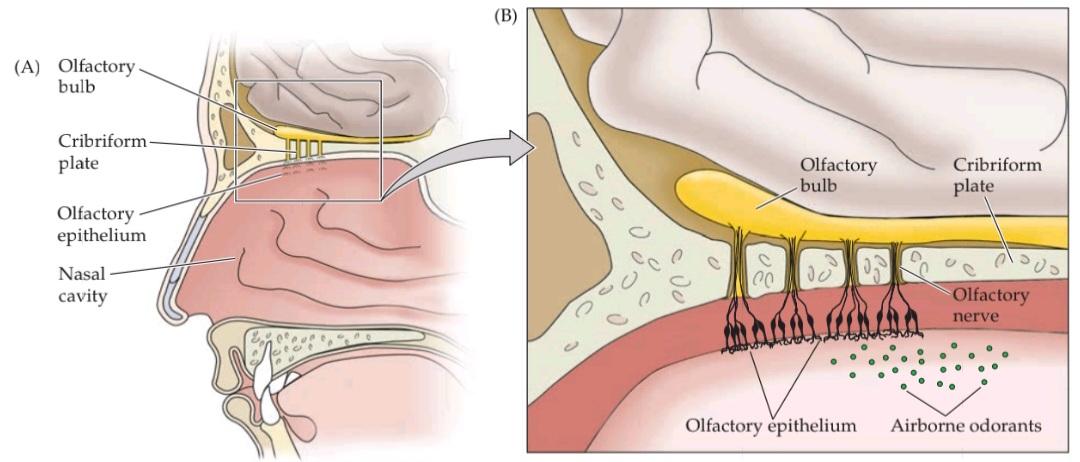
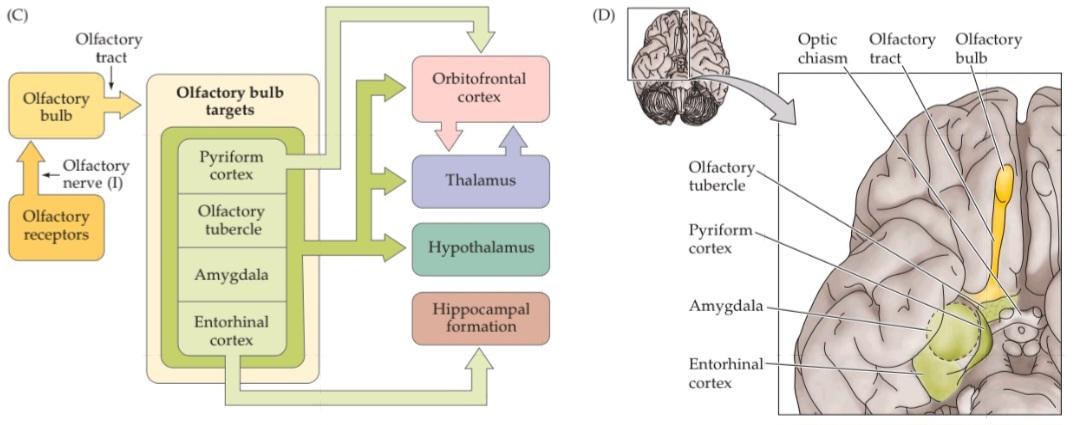

FIGURE 15.1 Organization of the human olfactory system. (A) Peripheral and central components of the primary olfactory pathway. (B) Enlargement of region boxed in (A), showing the relationship between the olfactory epithelium (which contains the ORNS) and the olfactory bulb (the central target of ORNS). (C) The basic pathways for processing olfactory information. (D) Central components and basic connections of the olfactory system. (E) Functional MRI images of coronal sections through the human brain at the level of (1) the orbitofrontal cortex, (2) the pyriform cortex and olfactory bulbs, and (3) the amygdala. Maximum focal activation in response to odor presentation (in this case correlated either with pleasantness [1] or intensity [2,3]), is seen in the orbitofrontal and pyriform cortices as well as in the amygdala. (E from Rolls et al., 2003.)
شکل ۱۵.۱ سازماندهی سیستم بویایی انسان. (الف) اجزای محیطی و مرکزی مسیر بویایی اولیه. (ب) بزرگ شدن ناحیه مشخص شده در کادر (الف)، که رابطه بین اپیتلیوم بویایی (که شامل ORNS است) و پیاز بویایی (هدف مرکزی ORNS) را نشان میدهد. (ج) مسیرهای اساسی برای پردازش اطلاعات بویایی. (د) اجزای مرکزی و اتصالات اساسی سیستم بویایی. (ه) تصاویر MRI عملکردی از مقاطع کرونالی مغز انسان در سطح (1) قشر اوربیتوفرونتال، (2) قشر پیریفورم و پیازهای بویایی، و (3) آمیگدال. حداکثر فعالسازی کانونی در پاسخ به ارائه بو (در این مورد با خوشایندی [1] یا شدت [2،3] مرتبط است)، در قشرهای اوربیتوفرونتال و پیریفورم و همچنین در آمیگدال مشاهده میشود. (ای از رولز و همکاران، ۲۰۰۳.)
The olfactory system is unique among the sensory systems in that it does not include a thalamic relay from primary receptors en route to a cortical region that processes the sensory information. Instead, after synapses are made by axon terminals of olfactory receptor neurons onto projection neurons in the olfactory bulb, olfactory sensory information is relayed to and then processed in the pyriform cortex, a three-layered archicortex dedicated to olfaction and considered to be phylogenetically older than the six layered neocortex. Although this initial pathway bypasses the thalamus, the thalamus does play an important role in subsequent stages of olfaction. Olfactory information from pyriform cortex is relayed to the thalamus en route to association areas in the neocortex, where further processing occurs (see Figure 15.1C). Together, the pyriform cortex and the multimodal sensory association areas of the neocortex are thought to be essential for the conscious appreciation of odorants as well as the association of odors with other sensory characteristics of environmental stimuli. The olfactory bulb relays information directly to several other targets in addition to the pyriform cortex, including the hypothalamus and amygdala (see Figure 15.1C,D). The neural computations that occur in these regions influence motor, visceral, and emotional reactions to chemosensory stimuli, particularly those relevant to feeding, reproduction, and aggression (Figure 15.1E).
سیستم بویایی در بین سیستمهای حسی منحصر به فرد است زیرا شامل یک رله تالاموس از گیرندههای اولیه در مسیر به ناحیه قشری که اطلاعات حسی را پردازش میکند، نیست. در عوض، پس از اینکه سیناپسها توسط پایانههای آکسون نورونهای گیرنده بویایی به نورونهای برونریزی در پیاز بویایی ساخته میشوند، اطلاعات حسی بویایی به قشر پیریفورم، یک قشر سه لایه که به بویایی اختصاص دارد و از نظر فیلوژنتیکی قدیمیتر از نئوکورتکس شش لایه در نظر گرفته میشود، منتقل و سپس در آن پردازش میشوند. اگرچه این مسیر اولیه از تالاموس عبور میکند، اما تالاموس نقش مهمی در مراحل بعدی بویایی ایفا میکند. اطلاعات بویایی از قشر پیریفورم به تالاموس در مسیر به نواحی ارتباطی در نئوکورتکس منتقل میشود، جایی که پردازش بیشتر رخ میدهد (شکل 15.1C را ببینید). تصور میشود که قشر پیریفورم و نواحی ارتباطی حسی چندوجهی نئوکورتکس با هم برای درک آگاهانه بوها و همچنین ارتباط بوها با سایر ویژگیهای حسی محرکهای محیطی ضروری هستند. پیاز بویایی علاوه بر قشر پیریفورم، اطلاعات را مستقیماً به چندین هدف دیگر، از جمله هیپوتالاموس و آمیگدال، منتقل میکند (شکل 15.1C، D را ببینید). محاسبات عصبی که در این مناطق رخ میدهد، بر واکنشهای حرکتی، احشایی و عاطفی به محرکهای شیمیایی-حسی، به ویژه آنهایی که مربوط به تغذیه، تولید مثل و پرخاشگری هستند، تأثیر میگذارد (شکل 15.1E).
Despite its phylogenetic age and the unusual trajectory of olfactory information to the neocortex, the olfactory system abides by the same principle that governs other sensory modalities: Sensory stimuli in this case, airborne chemicals-interact with receptors at the periphery and are transduced and encoded into electrical signals, which are relayed via synaptic transmission to higher order centers. Unlike other sensory systems, very little is known about the neural representation of olfactory information in the central nervous system. For example, the somatosensory and visual cortices described in the preceding chapters feature topographic maps of the relevant receptor surface, and the auditory cortex features a computational map of frequencies. Whether analogous maps exist in the pyriform cortex (or the olfactory bulb) is not yet known. Indeed, until recently it was difficult to imagine how sensory qualities might be represented in an orderly olfactory map (e.g., odor identity, intensity, or behavioral significance), or what features of chemosensory stimuli might be processed in parallel (as occurs in other sensory systems).
علیرغم قدمت فیلوژنتیکی و مسیر غیرمعمول اطلاعات بویایی به نئوکورتکس، سیستم بویایی از همان اصلی پیروی میکند که بر سایر روشهای حسی حاکم است: محرکهای حسی – در این مورد، مواد شیمیایی موجود در هوا – با گیرندههای محیطی تعامل دارند و به سیگنالهای الکتریکی تبدیل و رمزگذاری میشوند که از طریق انتقال سیناپسی به مراکز مرتبه بالاتر منتقل میشوند. برخلاف سایر سیستمهای حسی، اطلاعات بسیار کمی در مورد نمایش عصبی اطلاعات بویایی در سیستم عصبی مرکزی وجود دارد. به عنوان مثال، قشرهای حسی-پیکری و بینایی که در فصلهای قبل توضیح داده شدهاند، نقشههای توپوگرافی سطح گیرنده مربوطه را نشان میدهند و قشر شنوایی دارای یک نقشه محاسباتی از فرکانسها است. اینکه آیا نقشههای مشابهی در قشر پیریفورم (یا پیاز بویایی) وجود دارد یا خیر، هنوز مشخص نیست. در واقع، تا همین اواخر تصور اینکه چگونه میتوان ویژگیهای حسی را در یک نقشه بویایی منظم نمایش داد (مثلاً هویت بو، شدت یا اهمیت رفتاری) یا اینکه چه ویژگیهایی از محرکهای شیمیایی-حسی ممکن است به صورت موازی پردازش شوند (همانطور که در سایر سیستمهای حسی رخ میدهد) دشوار بود.
Olfactory Perception in Humans
In humans, olfaction is often considered the least acute of the senses, and many animals obviously possess far superior olfactory abilities. The greater chemosensory sophistication of such animals may be explained by increased numbers of olfactory receptor neurons and odorant receptor proteins in an expanded olfactory epithelium, as well as by a relatively larger portion of the forebrain devoted to olfaction (Figure 15.2). In a 70-kg human, the surface area of the olfactory epithelium is approximately 10 cm2; in contrast, in a rat it is 15 cm2, in a 3-kg cat it is about 20 cm2, in dogs it is 150 to 170 cm2, and in bloodhounds bred for their increased olfactory sensitivity it increases to 380 cm2.
ادراک بویایی در انسان
در انسان، بویایی اغلب به عنوان کمحواسترین حس در نظر گرفته میشود و بسیاری از حیوانات آشکارا از تواناییهای بویایی بسیار بالاتری برخوردارند. پیچیدگی بیشتر حس شیمیایی چنین حیواناتی را میتوان با افزایش تعداد نورونهای گیرنده بویایی و پروتئینهای گیرنده بو در یک اپیتلیوم بویایی گسترشیافته، و همچنین با اختصاص بخش نسبتاً بزرگتری از مغز پیشین به بویایی توضیح داد (شکل ۱۵.۲). در یک انسان ۷۰ کیلوگرمی، مساحت سطح اپیتلیوم بویایی تقریباً ۱۰ سانتیمتر مربع است؛ در مقابل، در یک موش صحرایی ۱۵ سانتیمتر مربع، در یک گربه ۳ کیلوگرمی حدود ۲۰ سانتیمتر مربع، در سگها ۱۵۰ تا ۱۷۰ سانتیمتر مربع و در سگهای شکاری خونگی که به دلیل افزایش حساسیت بویایی پرورش داده میشوند، به ۳۸۰ سانتیمتر مربع افزایش مییابد.


FIGURE 15.2 Odorant perception in mammals. (A) Comparison of the surface area (bars) of the olfactory epithelium and the number of ORNS in a human, a rat, a “typical” dog, and a bloodhound (bred for maximum olfactory discrimination). (B) Proportional sizes of the olfactory bulb in rat and human brains; the bulbs comprise relatively more of the fore- brain in rats than they do in humans. (A, data from Shier et al., 2004.)
شکل ۱۵.۲ ادراک بو در پستانداران. (الف) مقایسه مساحت سطح (میلهها) اپیتلیوم بویایی و تعداد ORNS در انسان، موش صحرایی، سگ «معمولی» و سگ بلاد هاند (که برای حداکثر تمایز بویایی پرورش داده شده است). (ب) اندازههای متناسب پیاز بویایی در مغز موش صحرایی و انسان؛ پیازهای بویایی در موشها نسبت به انسان، بخش نسبتاً بیشتری از مغز پیشین را تشکیل میدهند. (الف، دادههای Shier و همکاران، ۲۰۰۴.)

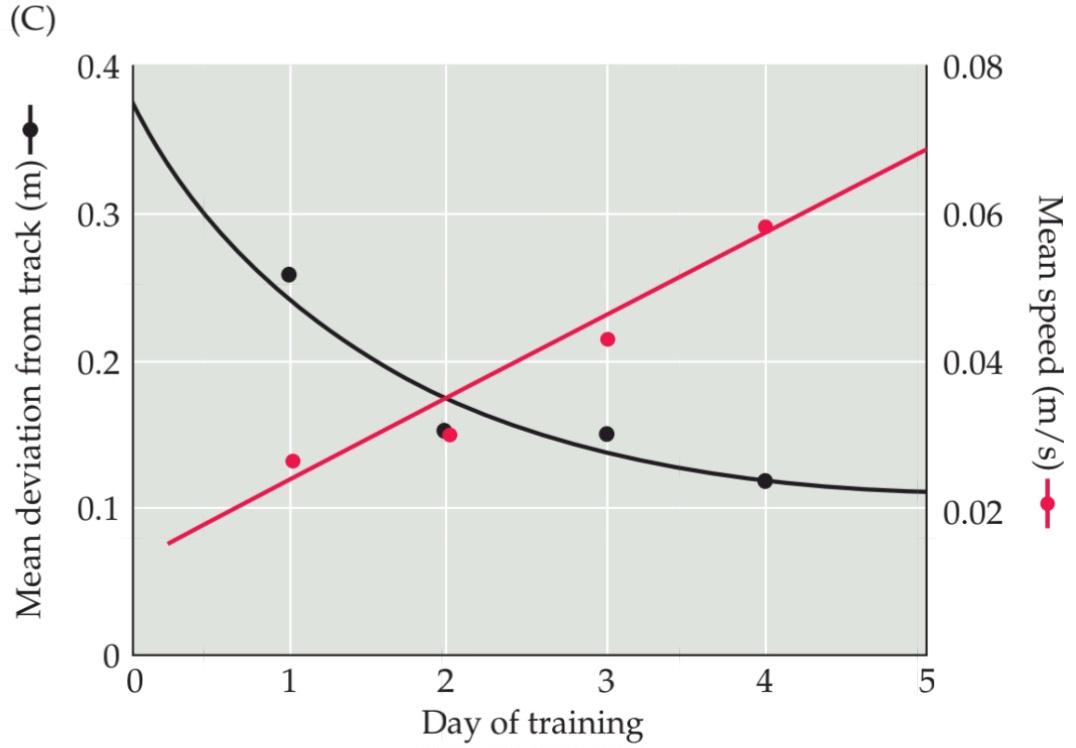
FIGURE 15.3 Humans can track scents at low concentrations over long distances. (A) The yellow line indicates the scent trail established by dragging a pheasant through a field (the pheasant, immobilized, is seen at the bottom of the picture). The red line indicates the path of a pointer tracking the scent. The dog’s tracking includes several orthogonal digressions, which are common when a new scent is present at relatively low concentrations in a complex odor environment. (B) The yellow line shows a scent trail established with chocolate essential oil; the red line indicates the trail of a human tracking the scent. Like the dog, the human makes orthogonal digressions. (C) Learning curves for human scent tracking. Over a short training period, humans can acquire great- er skill and accuracy tracking a scent at low concentrations (black trace). This improvement indicates that the olfactory system has the capacity for enhanced performance, perhaps by increased sensitivity to a learned signal over back ground ‘odor noise.” Humans also acquire greater speed in tracking scents at low concentration over a small number of trials (red trace). Apparently, olfactory sensation, like other sensory modalities, can be used in complex tasks in which performance speed as well as accuracy can be enhanced by repetition. (After Porter et al., 2007.)
شکل ۱۵.۳ انسانها میتوانند بوها را در غلظتهای پایین و در فواصل طولانی ردیابی کنند. (الف) خط زرد نشان دهندهی رد بویی است که با کشیدن یک قرقاول در یک مزرعه ایجاد شده است (قرقاول، بیحرکت، در پایین تصویر دیده میشود). خط قرمز نشان دهندهی مسیر یک نشانگر است که بو را ردیابی میکند. ردیابی سگ شامل چندین انحراف متعامد است که زمانی که یک بوی جدید در غلظتهای نسبتاً کم در یک محیط بویایی پیچیده وجود دارد، رایج است. (ب) خط زرد نشان دهندهی یک رد بویی است که با روغن اسانس شکلات ایجاد شده است؛ خط قرمز نشان دهندهی رد یک انسان است که بو را ردیابی میکند. انسان نیز مانند سگ، انحرافهای متعامد ایجاد میکند. (ج) منحنیهای یادگیری برای ردیابی بوی انسان. در طول یک دوره آموزشی کوتاه، انسانها میتوانند مهارت و دقت بیشتری در ردیابی یک بو در غلظتهای پایین (رد سیاه) کسب کنند. این بهبود نشان میدهد که سیستم بویایی ظرفیت افزایش عملکرد را دارد، شاید با افزایش حساسیت به یک سیگنال آموخته شده نسبت به «نویز بو»ی پسزمینه. انسانها همچنین در تعداد کمی از آزمایشها، سرعت بیشتری در ردیابی بوها در غلظت کم به دست میآورند (رد قرمز). ظاهراً، حس بویایی، مانند سایر روشهای حسی، میتواند در کارهای پیچیدهای مورد استفاده قرار گیرد که در آنها سرعت عملکرد و همچنین دقت با تکرار افزایش مییابد. (After Porter et al., 2007.)
With such a quantitative disadvantage, the human nose seems ill suited for certain tasks, such as following a scent to a specific target, that are second nature to a cat or dog.
با چنین نقص کمی، به نظر میرسد بینی انسان برای انجام وظایف خاصی، مانند دنبال کردن یک بو تا رسیدن به یک هدف خاص، که برای گربه یا سگ امری ذاتی است، مناسب نیست.
Nevertheless, humans can, when challenged, use their somewhat modest olfactory endowment to “sniff out” a scent trail. Moreover, we seem to use scent tracking strategies that are similar to those of our more olfactorally gifted counterparts: We pursue a tracking path that constantly bisects the linear scent trail (Figure 15.3A,B); we sniff frequently; our sniffing increases as scent tracking is learned; and our performance improves with practice (Figure 15.3C). Thus, although humans do not rely on olfaction as a major source of information, the human olfactory system has the capacity to use chemosensory information to track targets and locate items of interest in space.
با این وجود، انسانها میتوانند، در صورت مواجهه با چالش، از استعداد بویایی نسبتاً کم خود برای “بو کشیدن” یک مسیر بو استفاده کنند. علاوه بر این، به نظر میرسد ما از استراتژیهای ردیابی بو استفاده میکنیم که مشابه استراتژیهای همتایان با استعداد بویایی بیشتر ما است: ما یک مسیر ردیابی را دنبال میکنیم که دائماً مسیر بوی خطی را به دو قسمت تقسیم میکند (شکل 15.3A، B)؛ ما مرتباً بو میکشیم؛ با یادگیری ردیابی بو، بو کشیدن ما افزایش مییابد؛ و عملکرد ما با تمرین بهبود مییابد (شکل 15.3C). بنابراین، اگرچه انسانها به بویایی به عنوان منبع اصلی اطلاعات تکیه نمیکنند، سیستم بویایی انسان ظرفیت استفاده از اطلاعات شیمیایی-حسی را برای ردیابی اهداف و یافتن موارد مورد علاقه در فضا دارد.
Humans are also quite good at detecting and identifying individual airborne odorants with a wide range of aesthetic (unpleasant/pleasant) and behavioral (irritant/ attractant) significance. Ozone (the smell that accompanies lightning and electrical arcing) becomes an irritant above relatively low concentrations. The human olfactory system can detect ozone reliably at approximately 10 molecules per billion in room air. Similarly, humans can identify D limonene, the major element of citrus smells, fairly reliably at 15 molecules per billion in room air (Figure 15.4A). Other molecules are detected only at much higher concentrations. For example, some estimates place human sensitivity to the odor of ethanol at 2000 molecules per billion.
انسانها همچنین در تشخیص و شناسایی بوهای منفرد موجود در هوا با طیف وسیعی از اهمیت زیباییشناختی (ناخوشایند/دلپذیر) و رفتاری (محرک/جذبکننده) بسیار خوب هستند. ازن (بوی همراه رعد و برق و قوس الکتریکی) در غلظتهای بالاتر از حد متوسط، به یک ماده محرک تبدیل میشود. سیستم بویایی انسان میتواند ازن را تقریباً در غلظت 10 مولکول در هر میلیارد در هوای اتاق به طور قابل اعتمادی تشخیص دهد. به طور مشابه، انسانها میتوانند D لیمونن، عنصر اصلی بوی مرکبات، را به طور نسبتاً قابل اعتمادی در غلظت 15 مولکول در هر میلیارد در هوای اتاق شناسایی کنند (شکل 15.4A). سایر مولکولها فقط در غلظتهای بسیار بالاتر تشخیص داده میشوند. به عنوان مثال، برخی تخمینها حساسیت انسان به بوی اتانول را 2000 مولکول در هر میلیارد قرار میدهند.
A further complication in rationalizing the perception of odors is that their quality may change with odorant concentration. For example, at low concentrations the molecule indole has a “floral” odor, whereas at higher concentrations it smells “putrid” (Figure 15.4B). The human olfactory system is also capable of making perceptual distinctions based on small changes in molecular structure; for example, the molecule D-carvone smells like spearmint, whereas Lcarvone smells like the caraway seeds found in rye bread (Figure 15.4C).
یک پیچیدگی دیگر در توجیه درک بوها این است که کیفیت آنها ممکن است با غلظت بو تغییر کند. به عنوان مثال، در غلظتهای پایین، مولکول ایندول بوی “گل” دارد، در حالی که در غلظتهای بالاتر بوی “متعفن” میدهد (شکل 15.4B). سیستم بویایی انسان همچنین قادر به ایجاد تمایزات ادراکی بر اساس تغییرات کوچک در ساختار مولکولی است؛ برای مثال، مولکول D-کاروون بوی نعناع میدهد، در حالی که Lکاروون بوی دانههای زیره سیاه موجود در نان چاودار را میدهد (شکل 15.4C).
There have been many attempts to classify odors into categories that parallel the division of the visible light spectrum into red, blue, and green (which correspond to the molecular specificity of photopigments in photoreceptors). Despite these efforts, there is no indication that any currently available arbitrary scheme reflects biologically significant categories of odorants. However, one of the most consistent aspects of olfactory perception is the classification of odors as either pleasant and attractive or unpleasant and repulsive. These basic properties of olfactory stimuli their “aesthetic” qualities (or lack thereof)- are apparently represented in distinct cortical regions that mediate olfactory perception (Figure 15.4D). This suggests that perceived aesthetic properties of odorants have distinct representations in the forebrain, including in distinct regions of the cerebral cortex. Most naturally occurring odors are blends of several odorant molecules, even though they are typically perceived as a single smell (such as the scent of a particular perfume or the bouquet of a wine). Thus, it remains to be determined whether animals “map” odors or their attractive or repellent qualities based on single perceptual attributes.
تلاشهای زیادی برای طبقهبندی بوها به دستههایی مشابه تقسیم طیف نور مرئی به قرمز، آبی و سبز (که با ویژگی مولکولی رنگدانههای نوری در گیرندههای نوری مطابقت دارند) صورت گرفته است. با وجود این تلاشها، هیچ نشانهای وجود ندارد که هیچ طرح دلخواهی که در حال حاضر موجود است، دستههای مهم بیولوژیکی بوها را منعکس کند. با این حال، یکی از ثابتترین جنبههای ادراک بویایی، طبقهبندی بوها به عنوان خوشایند و جذاب یا ناخوشایند و زننده است. این خواص اساسی محرکهای بویایی – یعنی کیفیتهای “زیباییشناختی” آنها (یا فقدان آنها) – ظاهراً در مناطق قشری متمایزی که واسطه ادراک بویایی هستند، نشان داده میشوند (شکل 15.4D). این نشان میدهد که خواص زیباییشناختی درک شده از بوها، نمایشهای متمایزی در مغز پیشین، از جمله در مناطق متمایز قشر مغز، دارند. اکثر بوهای طبیعی ترکیبی از چندین مولکول بو هستند، حتی اگر معمولاً به عنوان یک بوی واحد (مانند رایحه یک عطر خاص یا دسته شراب) درک شوند. بنابراین، هنوز مشخص نیست که آیا حیوانات بوها یا ویژگیهای جاذبه یا دافعه آنها را بر اساس ویژگیهای ادراکی واحد «نقشهبرداری» میکنند یا خیر.

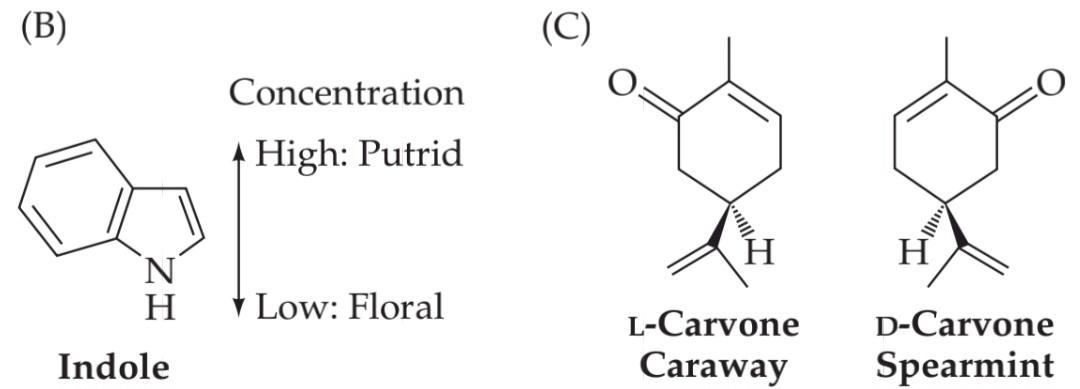

FIGURE 15.4 Human sensitivity to odors. (A) In a con- trolled setting where room air is presented in precise mixtures with single odors, the threshold for detection reflects the concentration at which a human correctly identifies the presence of the odor above chance (50%). Humans can detect ozone, a somewhat unpleasant odor, at approximately 10 parts per billion. The pleasant and nutritionally significant odor of D limonene can be identified at approximately 15 parts per billion. (B) Perception of the molecule indole is concentration dependent. At low concentrations, it is perceived as a pleasant floral smell. At high concentrations, the same molecule (which is produced by bacteria in decomposing organic material) is experienced as putrid. (C) The D and L enantiomers of carvone produce very different olfactory perceptions (spearmint versus caraway) when present at similar concentrations. (D) Functional MRI analysis in typical humans indicates that odorants perceived as “pleasant” versus “unpleasant” elicit maximum activity in distinct regions of the orbitofrontal (white oval) and cingulate (red ovals) cortex. (A, data from Cain et al., 2007; D from Rolls et al., 2003.)
شکل ۱۵.۴ حساسیت انسان به بوها. (الف) در یک محیط کنترلشده که هوای اتاق در مخلوطهای دقیقی با بوهای منفرد ارائه میشود، آستانه تشخیص، غلظتی را نشان میدهد که در آن انسان به درستی وجود بو را بالاتر از حد احتمال (۵۰٪) تشخیص میدهد. انسانها میتوانند ازن، که بویی تا حدودی ناخوشایند است، را تقریباً در ۱۰ قسمت در میلیارد تشخیص دهند. بوی دلپذیر و از نظر تغذیهای مهم D لیمونن را میتوان تقریباً در ۱۵ قسمت در میلیارد شناسایی کرد. (ب) درک مولکول ایندول وابسته به غلظت است. در غلظتهای پایین، آن را به عنوان بوی گل دلپذیر درک میکنند. در غلظتهای بالا، همان مولکول (که توسط باکتریها در تجزیه مواد آلی تولید میشود) به عنوان بوی متعفن تجربه میشود. (ج) انانتیومرهای D و L کاروون وقتی در غلظتهای مشابه وجود داشته باشند، ادراک بویایی بسیار متفاوتی (نعناع در مقابل زیره سیاه) ایجاد میکنند. (د) تجزیه و تحلیل MRI عملکردی در انسانهای معمولی نشان میدهد که بوهایی که به عنوان “خوشایند” در مقابل “ناخوشایند” درک میشوند، حداکثر فعالیت را در نواحی مشخصی از قشر اوربیتوفرونتال (بیضی سفید) و سینگولیت (بیضیهای قرمز) ایجاد میکنند. (الف، دادهها از کین و همکاران، ۲۰۰۷؛ د از رولز و همکاران، ۲۰۰۳.)
Assessing Olfactory Function in the Laboratory or Clinic
Most people are able to consistently identify a broad range of odorants, and they can distinguish distinct odors from one another. Indeed, many clinicians use uniquely scented “probes” such as coffee grounds or soap to test the function of the olfactory nerve (cranial nerve I) as part of the standard cranial nerve examination. But some individuals consistently fail to identify one or more common odors (Figure 15.5A). Such chemosensory deficits, known as anosmias, are often restricted to a single odorant, suggesting that a specific element in the olfactory system either an olfactory receptor gene (see below) or genes that control expression or function of specific odorant receptor genes- is inactivated. Genetic analysis of anosmic individuals has yet to confirm this possibility. Thus, unlike blindness and deafness, olfactory loss is difficult to classify as either peripheral or central in its origins.
ارزیابی عملکرد بویایی در آزمایشگاه یا کلینیک
اکثر افراد قادرند طیف وسیعی از بوها را به طور مداوم شناسایی کنند و میتوانند بوهای متمایز را از یکدیگر تشخیص دهند. در واقع، بسیاری از پزشکان از “کاوشگرهای” منحصر به فرد مانند تفاله قهوه یا صابون برای آزمایش عملکرد عصب بویایی (عصب جمجمهای I) به عنوان بخشی از معاینه استاندارد عصب جمجمهای استفاده میکنند. اما برخی از افراد به طور مداوم در شناسایی یک یا چند بوی رایج شکست میخورند (شکل 15.5A). چنین نقصهای شیمیایی-حسی، که به عنوان آنوسمی شناخته میشوند، اغلب به یک بو محدود میشوند، که نشان میدهد یک عنصر خاص در سیستم بویایی – یا یک ژن گیرنده بویایی (به پایین مراجعه کنید) یا ژنهایی که بیان یا عملکرد ژنهای گیرنده بویایی خاص را کنترل میکنند – غیرفعال شده است. تجزیه و تحلیل ژنتیکی افراد آنوسمی هنوز این احتمال را تأیید نکرده است. بنابراین، برخلاف نابینایی و ناشنوایی، طبقهبندی از دست دادن بویایی به عنوان منشأ محیطی یا مرکزی دشوار است.
Anosmias can be congenital, or they may be acquired following chronic sinus infection or inflammation, traumatic head injury, or exposure to toxins (Clinical Applications). Olfactory loss is also a common consequence of aging (see below). In some cases, such disruption is not a source of great concern (e.g., the transient anosmia that occurs with a severe cold). Nevertheless, it can diminish the enjoyment of food and, if sustained, can lead to decreased appetite, weight loss, and eventual malnutrition (especially in aged individuals). If an anosmia is particularly specific and severe, it can affect a person’s ability to identify and respond appropriately to potentially dangerous odors such as spoiled food, toxic chemicals, or smoke. Anosmias often target perception of distinct noxious odorants. For example, approximately 1 person in 1000 is insensitive to butyl mercaptan, the foul smelling odorant released by skunks. More serious is the inability to detect hydrogen cyanide (1 person in 10), which can be lethal, or ethyl mercaptan, the chemical added to natural gas to enable people to detect gas leaks.
آنوسمی میتواند مادرزادی باشد، یا ممکن است پس از عفونت یا التهاب مزمن سینوس، آسیب تروماتیک سر یا قرار گرفتن در معرض سموم (کاربردهای بالینی) اکتسابی باشد. از دست دادن بویایی نیز یکی از پیامدهای رایج پیری است (به زیر مراجعه کنید). در برخی موارد، چنین اختلالی نگرانی زیادی ایجاد نمیکند (مثلاً آنوسمی گذرا که با سرماخوردگی شدید رخ میدهد). با این وجود، میتواند لذت بردن از غذا را کاهش دهد و در صورت تداوم، میتواند منجر به کاهش اشتها، کاهش وزن و در نهایت سوء تغذیه (به ویژه در افراد مسن) شود. اگر آنوسمی به طور خاص و شدید باشد، میتواند بر توانایی فرد در شناسایی و پاسخ مناسب به بوهای بالقوه خطرناک مانند غذای فاسد، مواد شیمیایی سمی یا دود تأثیر بگذارد. آنوسمی اغلب درک بوهای مضر متمایز را هدف قرار میدهد. به عنوان مثال، تقریباً از هر 1000 نفر، 1 نفر نسبت به بوتیل مرکاپتان، ماده بدبوی آزاد شده توسط راسوها، حساس نیست. جدیتر از آن، ناتوانی در تشخیص سیانید هیدروژن (از هر 10 نفر، یک نفر) است که میتواند کشنده باشد، یا اتیل مرکاپتان، ماده شیمیایی که به گاز طبیعی اضافه میشود تا افراد بتوانند نشت گاز را تشخیص دهند.



FIGURE 15.5 Loss of olfactory sensitivity. (A) Anosmia is the inability to identify common odors. The majority of typical individuals presented with seven common odors (a test frequently used by neurologists) can identify all seven correctly (in this case, baby powder, chocolate, cinnamon, coffee, mothballs, peanut butter, and soap). Persons who are anosmic have difficulty identifying even these common scents. (B) The ability to identify 80 common odorants declines markedly between ages 20 and 70. Such loss of sensory acuity is normal. (C) Maximum activation (red) of orbitofrontal and medial (pyriform cortex/amygdala) cerebral cortex by familiar odors in young and typical (i.e., without dementia) aged individuals. Areas of focal activation remain similar, but there is clearly diminished activity in the older individuals. (A after Cain and Gent, 1986; B after Murphy, 1986; C from Wang et al., 2005.)
شکل ۱۵.۵ از دست دادن حساسیت بویایی. (الف) آنوسمی ناتوانی در شناسایی بوهای رایج است. اکثر افراد معمولی که هفت بوی رایج را تجربه میکنند (آزمایشی که اغلب توسط متخصصان مغز و اعصاب استفاده میشود) میتوانند هر هفت بو را به درستی شناسایی کنند (در این مورد، پودر بچه، شکلات، دارچین، قهوه، نفتالین، کره بادام زمینی و صابون). افرادی که آنوسمیک هستند، حتی در شناسایی این بوهای رایج نیز مشکل دارند. (ب) توانایی شناسایی ۸۰ بو رایج بین سنین ۲۰ تا ۷۰ سال به طور قابل توجهی کاهش مییابد. چنین از دست دادن تیزبینی حسی طبیعی است. (ج) حداکثر فعالسازی (قرمز) قشر مغز اوربیتوفرونتال و میانی (قشر پیریفورم/آمیگدال) توسط بوهای آشنا در افراد جوان و مسن معمولی (یعنی بدون زوال عقل). نواحی فعالسازی کانونی مشابه باقی میمانند، اما فعالیت در افراد مسن به وضوح کاهش مییابد. (الف برگرفته از کین و جنت، ۱۹۸۶؛ ب برگرفته از مورفی، ۱۹۸۶؛ ج برگرفته از وانگ و همکاران، ۲۰۰۵.)
CLINICAL APPLICATIONS
Only One Nose
Our other specialized sensory organs the eyes and earsare that warn against risks to sight and hearing, and a robust industry manufactures protective devices such as goggles, sun- glasses, and ear plugs. Despite its prominence, the nose is often overlooked when it comes to thinking about risks and con sequences. This lack of attention to nasal peril has led to two eerily similar instances of medically induced anosmia resulting from exposure of the olfactory epithelium to zinc, which can be toxic to some tissues. In both cases, the reasonable desire to prevent a perceived “greater evil” polio in the 1930s and the common cold in the 1990s-resulted in treatments that were not only ineffective in respect to their original intent but resulted in significant loss of smell for those who were exposed. In both instances, children were among those most affected.
کاربردهای بالینی
فقط یک بینی
دیگر اندامهای حسی تخصصی ما، چشمها و گوشها، در مورد خطرات بینایی و شنوایی هشدار میدهند و یک صنعت قوی، دستگاههای محافظ مانند عینکهای محافظ، عینکهای آفتابی و گوشگیرها را تولید میکند. با وجود اهمیت بینی، اغلب هنگام فکر کردن به خطرات و عواقب آن نادیده گرفته میشود. این عدم توجه به خطر بینی منجر به دو مورد کاملاً مشابه از آنوسمی ناشی از پزشکی شده است که ناشی از قرار گرفتن اپیتلیوم بویایی در معرض روی است که میتواند برای برخی از بافتها سمی باشد. در هر دو مورد، تمایل معقول برای جلوگیری از یک “شر بزرگتر” – فلج اطفال در دهه 1930 و سرماخوردگی معمولی در دهه 1990 – منجر به درمانهایی شد که نه تنها از نظر هدف اولیه بیاثر بودند، بلکه منجر به از دست دادن قابل توجه بویایی برای کسانی که در معرض آن قرار گرفتند، شدند. در هر دو مورد، کودکان از جمله کسانی بودند که بیشترین آسیب را دیدند.
In the late 1930s, the threat of polio was very real, and weapons to fight this devastating viral disease that preferentially afflicts children were limited. There was an impression that the polio virus could be transmitted via the nasal mucosa (which did not turn out to be the primary route of infection). Many physicians thought that zinc based nasal sprays could protect children from infection, even though there was little evidence for this hypothesis. Desperate times often lead to intemperate measures, however, and several zinc nasal spray treatments were widely administered. Among the most ambitious was a 1937 trial involving 5000 children in Toronto who were given intranasal sprays of zinc sulfate. It soon became clear that the treatment did not prevent polio infection, and in a significant number of children, it had an unanticipated side effect an irreversible loss of the sense of smell. Subsequent animal studies offered an explanation of this unfortunate consequence. Zinc ions cause dramatic, specific damage to ORNs, and elevated concentration or repeated exposure to zinc salts can almost completely destroy the olfactory epithelium (see figure) including, presumably, the stem cells that regenerate ORNS throughout life.
در اواخر دهه ۱۹۳۰، تهدید فلج اطفال بسیار واقعی بود و سلاحهای مبارزه با این بیماری ویروسی ویرانگر که ترجیحاً کودکان را مبتلا میکند، محدود بود. این تصور وجود داشت که ویروس فلج اطفال میتواند از طریق مخاط بینی منتقل شود (که مشخص نشد که مسیر اصلی عفونت است). بسیاری از پزشکان تصور میکردند که اسپریهای بینی مبتنی بر روی میتوانند کودکان را از عفونت محافظت کنند، اگرچه شواهد کمی برای این فرضیه وجود داشت. با این حال، شرایط ناامیدکننده اغلب منجر به اقدامات افراطی میشود و چندین درمان با اسپری بینی روی به طور گسترده تجویز شد. از جمله بلندپروازانهترین آنها، آزمایشی در سال ۱۹۳۷ بود که شامل ۵۰۰۰ کودک در تورنتو بود که به آنها اسپریهای داخل بینی سولفات روی داده شد. خیلی زود مشخص شد که این درمان از عفونت فلج اطفال جلوگیری نمیکند و در تعداد قابل توجهی از کودکان، یک عارضه جانبی پیشبینی نشده – از دست دادن غیرقابل برگشت حس بویایی – داشته است. مطالعات بعدی روی حیوانات، توضیحی برای این پیامد ناگوار ارائه داد. یونهای روی باعث آسیب شدید و خاص به ORNها میشوند و غلظت بالا یا قرار گرفتن مکرر در معرض نمکهای روی میتواند تقریباً به طور کامل اپیتلیوم بویایی (شکل را ببینید) از جمله، احتمالاً، سلولهای بنیادی که ORNS را در طول زندگی بازسازی میکنند، را از بین ببرد.
Observations of zinc toxicity in the olfactory epithelium of animals (recorded in the literature as early as 1947), along with the unfortunate outcome of the 1937 Canadian trial, clearly raised a red flag against the further use of any zinc salt as an intranasal treatment. However, in the 1990s the notion that zinc was an effective antiviral agent (especially against rhinovirus, the cause of the common cold) led to the reemergence of zinc on the market, this time in unregulated dietary supplements and homeopathic remedies. Even though such products generally escape the rigorous oversight afforded prescription and over-the- counter drugs, they often have significant pharmacological effects. Such was the case with Zicam nasal gel, in which the primary active ingredient was a zinc salt, zinc gluconate. Shortly after the introduction of this product, reports emerged of individuals losing their sense of smell after using it. Not surprisingly, zinc gluconate, like zinc sulfate, causes significant cellular damage to the olfactory epithelium and can result in permanent disruption of olfactory sensation. On the basis of the clear risk of permanent damage to olfaction, in 2009 the FDA issued a warning to consumers to stop using zinc gluconate intranasal treatments.
مشاهدات سمیت روی در اپیتلیوم بویایی حیوانات (که در اوایل سال ۱۹۴۷ در مقالات ثبت شده است)، همراه با نتیجه نامطلوب آزمایش کانادایی در سال ۱۹۳۷، به وضوح پرچم قرمزی را علیه استفاده بیشتر از هرگونه نمک روی به عنوان یک درمان داخل بینی بلند کرد. با این حال، در دهه ۱۹۹۰ این تصور که روی یک عامل ضد ویروسی مؤثر است (به ویژه در برابر رینوویروس، علت سرماخوردگی) منجر به ظهور مجدد روی در بازار شد، این بار در مکملهای غذایی بدون نظارت و داروهای هومیوپاتی. اگرچه چنین محصولاتی عموماً از نظارت دقیق داروهای تجویزی و بدون نسخه فرار میکنند، اما اغلب اثرات دارویی قابل توجهی دارند. چنین موردی در مورد ژل بینی زیکام نیز وجود داشت که ماده فعال اصلی آن نمک روی، گلوکونات روی، بود. اندکی پس از معرفی این محصول، گزارشهایی مبنی بر از دست دادن حس بویایی افراد پس از استفاده از آن منتشر شد. جای تعجب نیست که گلوکونات روی، مانند سولفات روی، باعث آسیب سلولی قابل توجهی به اپیتلیوم بویایی میشود و میتواند منجر به اختلال دائمی حس بویایی شود. بر اساس خطر آشکار آسیب دائمی به بویایی، در سال ۲۰۰۹، سازمان غذا و داروی آمریکا (FDA) هشداری به مصرفکنندگان صادر کرد تا استفاده از درمانهای داخل بینی گلوکونات روی را متوقف کنند.
This tale of the same mistake made twice holds two lessons. First, although less attended to than sight and hearing, olfaction is also vulnerable to peripheral insults that can seriously compromise sensation. Second, even seemingly innocuous compounds can pose significant risks that may be known but not recognized due to lack of rigorous oversight. With these two lessons firmly in mind, one hopes that the future does not hold yet another episode of zinc related anosmias.
این داستان که دو بار اشتباه مشابهی تکرار شده، دو درس دارد. اول، اگرچه حس بویایی کمتر از بینایی و شنوایی مورد توجه قرار میگیرد، اما در برابر آسیبهای محیطی نیز آسیبپذیر است که میتواند حس را به طور جدی به خطر بیندازد. دوم، حتی ترکیبات به ظاهر بیضرر نیز میتوانند خطرات قابل توجهی ایجاد کنند که ممکن است شناخته شده باشند اما به دلیل عدم نظارت دقیق، تشخیص داده نشوند. با در نظر گرفتن این دو درس، میتوان امیدوار بود که آینده شاهد دوره دیگری از آنوسمی مرتبط با روی نباشد.
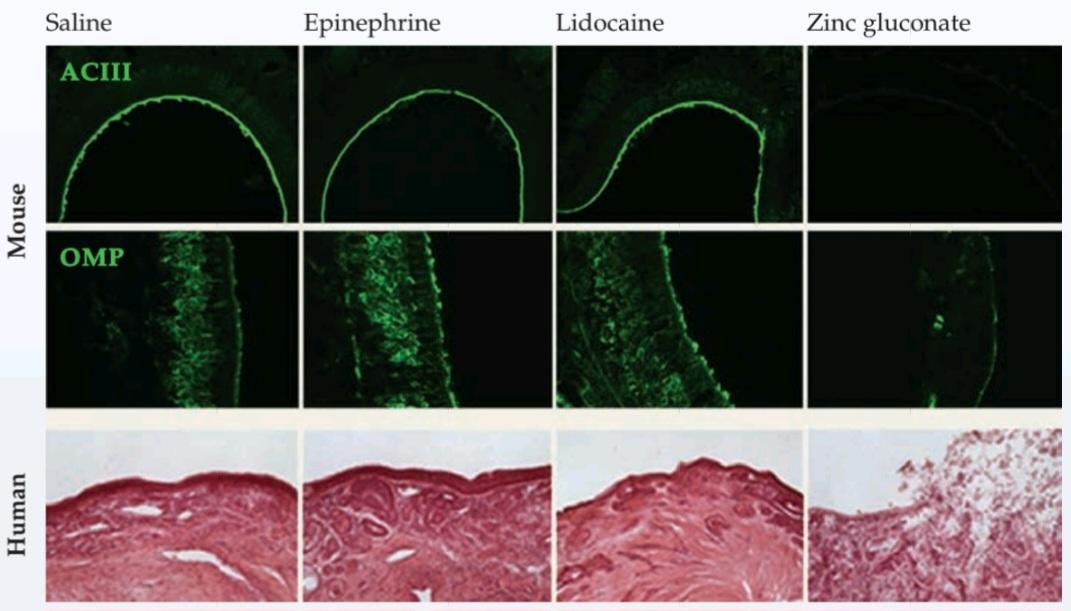
The effects of nasal sprays or gels on ORNS in the mouse and on human olfactory epithelium (OE). The figure shows the consequences of saline, epinephrine, and lidocaine all substances commonly found in preparations applied to OE- compared with those of zinc gluconate. In the mouse, adenylyl cyclase III labeling (ACIII) gauges the integrity of the signal transduction machinery for odorant detection at the ORN dendritic knob, while olfactory marker protein labeling (OMP) indicates the frequency of ORNs labeled by this particular molecular marker. In human OE, the effects of zinc gluconate can be seen in the diminished thickness and vacuolated appearance of the OE. (From Lim et al., 2009.)
اثرات اسپریهای بینی یا ژلها بر ORNS در موش و بر اپیتلیوم بویایی (OE) انسان. شکل، اثرات سالین، اپینفرین و لیدوکائین، تمام موادی که معمولاً در آمادهسازیهای اعمالشده بر OE یافت میشوند را در مقایسه با گلوکونات روی نشان میدهد. در موش، برچسبگذاری آدنیلیل سیکلاز III (ACIII) یکپارچگی دستگاه انتقال سیگنال را برای تشخیص بو در برآمدگی دندریتیک ORN اندازهگیری میکند، در حالی که برچسبگذاری پروتئین نشانگر بویایی (OMP) فراوانی ORNهای برچسبگذاریشده توسط این نشانگر مولکولی خاص را نشان میدهد. در OE انسان، اثرات گلوکونات روی را میتوان در ضخامت کاهشیافته و ظاهر واکوئلهشده OE مشاهده کرد. (از لیم و همکاران، ۲۰۰۹.)
Like other sensory modalities, human olfactory capacity typically decreases with age. If otherwise healthy individuals are challenged to identify a large battery of common odorants, people 20 to 40 years of age can ordinarily identify 50% to 75% of the odors, whereas those between ages 50 and 70 correctly identify only 30% to 45% (Figure 15.5B,C). These changes may reflect either diminished peripheral sensitivity or altered activity of central olfactory structures in otherwise typical aging individuals. A more radically diminished or distorted sense of smell of- ten accompanies neurodegenerative conditions associated with aging, especially Alzheimer’s disease. In fact, odor discrimination (the ability to tell two odors apart, usually measured by a standardized “scratch and sniff” test known as the University of Pennsylvania Smell Identification Test) is often part of a battery of diagnostic tests administered at the early stages of age related dementia and other neuro degenerative diseases.
مانند سایر روشهای حسی، ظرفیت بویایی انسان معمولاً با افزایش سن کاهش مییابد. اگر افراد سالم در شناسایی تعداد زیادی از بوهای رایج با مشکل مواجه شوند، افراد 20 تا 40 ساله معمولاً میتوانند 50 تا 75 درصد از بوها را شناسایی کنند، در حالی که افراد بین 50 تا 70 سال فقط 30 تا 45 درصد را به درستی شناسایی میکنند (شکل 15.5B,C). این تغییرات ممکن است نشاندهنده کاهش حساسیت محیطی یا تغییر فعالیت ساختارهای بویایی مرکزی در افراد مسن باشد. حس بویایی به طور اساسی کاهش یافته یا تحریف شده اغلب با شرایط عصبی مرتبط با پیری، به ویژه بیماری آلزایمر، همراه است. در واقع، تشخیص بو (توانایی تشخیص دو بو از هم، که معمولاً با یک آزمایش استاندارد “خراش و بو کشیدن” معروف به آزمایش شناسایی بوی دانشگاه پنسیلوانیا اندازهگیری میشود) اغلب بخشی از مجموعهای از آزمایشهای تشخیصی است که در مراحل اولیه زوال عقل مرتبط با سن و سایر بیماریهای عصبی دژنراتیو انجام میشود.
In addition to normal and pathological age-related changes in olfaction, olfactory sensation and perception can be disrupted by chemotherapy, eating disorders, diabetes, neurological disorders (olfaction is often compromised early in the course of Parkinson’s disease), and psychotic disorders (especially schizophrenia). Thus, in people with schizophrenia, olfactory hallucinations (i.e., perception of a stimulus that is not actually present in the environment) are among the earliest symptoms of psychosis. One of the earliest signs of dysfunction in individuals ultimately diagnosed with Parkinson’s disease is diminished olfactory function. In individuals on the autistic spectrum, odorant detection thresholds can be lowered, and the experience of neutral or even attractive odors can be reported as unpleasant. The causes of olfactory deficits in this broad range of disorders are not known. Some dysfunction may reflect lost capacity of the olfactory epithelium to maintain neural stem cells or the newly generated neurons that normally replace damaged olfactory receptor neurons over the course of a lifetime (see Figure 15.6) perhaps an early sign of more general pathogenic deficits in maintenance of optimally fuctioning neurons and circuits.
علاوه بر تغییرات طبیعی و پاتولوژیک مرتبط با سن در حس بویایی، حس و ادراک بویایی میتواند توسط شیمیدرمانی، اختلالات خوردن، دیابت، اختلالات عصبی (بویایی اغلب در اوایل بیماری پارکینسون به خطر میافتد) و اختلالات روانپریشی (به ویژه اسکیزوفرنی) مختل شود. بنابراین، در افراد مبتلا به اسکیزوفرنی، توهمات بویایی (یعنی درک محرکی که در واقع در محیط وجود ندارد) از اولین علائم روانپریشی هستند. یکی از اولین نشانههای اختلال عملکرد در افرادی که در نهایت به بیماری پارکینسون مبتلا میشوند، کاهش عملکرد بویایی است. در افراد طیف اوتیسم، آستانه تشخیص بو میتواند کاهش یابد و تجربه بوهای خنثی یا حتی جذاب میتواند به عنوان ناخوشایند گزارش شود. علل نقص بویایی در این طیف وسیع از اختلالات مشخص نیست. برخی از اختلالات عملکردی ممکن است نشاندهندهی از دست رفتن ظرفیت اپیتلیوم بویایی برای حفظ سلولهای بنیادی عصبی یا نورونهای تازه تولید شدهای باشد که معمولاً در طول عمر جایگزین نورونهای گیرندهی بویایی آسیبدیده میشوند (شکل ۱۵.۶ را ببینید) و شاید نشانهی اولیهای از نقصهای بیماریزای عمومیتر در حفظ نورونها و مدارهای با عملکرد بهینه باشد.
Physiological and Behavioral Responses to Olfactory Stimuli
In addition to conscious olfactory perceptions, odorants can elicit a variety of physiological responses. Examples are the visceral motor responses to the aroma of appetizing food (salivation and increased gastric motility) or to a noxious smell (gagging and, in extreme cases, vomiting). Olfaction can also influence reproductive and endocrine functions. For instance, there is some evidence that women living in single sex dormitories tend to have synchronized menstrual cycles, apparently mediated by olfaction. This evidence was reinforced by studies with volunteer women exposed to gauze pads from the underarms of other women at different stages of their menstrual cycles also experience synchronized menses. In addition this synchronization can be disrupted by exposure to analogous gauze pads from men. These responses are thought to reflect in part detection of gender specific odorants (see below). In more recent work, these studies have not been fully replicated, and there is some contention of whether this particular phenomenon is relevant to understanding human olfactory function. Surprisingly, studies of parallel responses in female animals including rodents and non-human primates are similarly inconclusive and controversial. Thus, possibility of human sex specific olfactory influence on reproduction remains uncertain. Olfaction also influences mother child interactions. Infants recognize their mother within hours after birth by smell, preferentially orienting toward their mother’s breasts and showing increased rates of suckling when fed by their mother compared with being fed by other lactating females, or when presented experimentally with their mother’s odor versus that of an unrelated female. A mother’s recognition ability matches that of her infant, and mothers can reliably discriminate their own infant’s odor from that of other infants of similar age. These observations are supported by much more detailed analysis of maternal-offspring bonding and subsequent maternal- pup behavior in rodents and other species.
پاسخهای فیزیولوژیکی و رفتاری به محرکهای بویایی
علاوه بر ادراک بویایی آگاهانه، بوها میتوانند پاسخهای فیزیولوژیکی متنوعی را ایجاد کنند. به عنوان مثال، پاسخهای حرکتی احشایی به عطر غذای اشتهاآور (ترشح بزاق و افزایش تحرک معده) یا به بوی مضر (عق زدن و در موارد شدید، استفراغ) از جمله این موارد هستند. بویایی همچنین میتواند بر عملکردهای تولید مثلی و غدد درون ریز تأثیر بگذارد. به عنوان مثال، شواهدی وجود دارد که نشان میدهد زنانی که در خوابگاههای تک جنسیتی زندگی میکنند، چرخههای قاعدگی هماهنگتری دارند که ظاهراً به واسطه بویایی انجام میشود. این شواهد با مطالعاتی که روی زنان داوطلب که در مراحل مختلف چرخه قاعدگی خود در معرض پدهای گاز استریل از زیر بغل زنان دیگر قرار گرفتهاند، انجام شده است، تقویت شده است. علاوه بر این، این هماهنگی میتواند با قرار گرفتن در معرض پدهای گاز استریل مشابه از مردان مختل شود. تصور میشود که این پاسخها تا حدی منعکس کننده تشخیص بوهای خاص جنسیتی باشند (به پایین مراجعه کنید). در کارهای جدیدتر، این مطالعات به طور کامل تکرار نشدهاند و بحثهایی در مورد اینکه آیا این پدیده خاص با درک عملکرد بویایی انسان مرتبط است یا خیر، وجود دارد. جالب اینجاست که مطالعات مربوط به پاسخهای موازی در حیوانات ماده، از جمله جوندگان و نخستیسانان غیرانسانی، به طور مشابه بینتیجه و بحثبرانگیز هستند. بنابراین، احتمال تأثیر بویایی خاص جنس انسان بر تولید مثل همچنان نامشخص است. حس بویایی همچنین بر تعاملات مادر و کودک تأثیر میگذارد. نوزادان، مادر خود را ظرف چند ساعت پس از تولد از طریق بو تشخیص میدهند، ترجیحاً به سمت سینههای مادر خود متمایل میشوند و هنگامی که توسط مادرشان تغذیه میشوند، در مقایسه با تغذیه توسط سایر مادههای شیرده، یا هنگامی که به صورت تجربی با بوی مادر خود در مقایسه با بوی یک ماده غیرمرتبط مواجه میشوند، میزان مکیدن بیشتری نشان میدهند. توانایی تشخیص مادر با نوزادش مطابقت دارد و مادران میتوانند به طور قابل اعتمادی بوی نوزاد خود را از بوی سایر نوزادان همسن خود تشخیص دهند. این مشاهدات با تجزیه و تحلیل بسیار دقیقتر پیوند مادر و فرزند و رفتار متعاقب مادر و توله در جوندگان و سایر گونهها پشتیبانی میشود.
Olfactory Epithelium and Olfactory Receptor Neurons
The transduction of olfactory information-a series of neural events that ultimately results in the conscious sense of smell begins in the olfactory epithelium, the sheet of neurons and supporting cells that lines approximately half of the surface of the nasal cavity (see Figure 15.1A). The remaining intranasal surface is lined by respiratory epithelium similar to that in the trachea and lungs. Respiratory epithelium primarily maintains appropriate temperature and moisture for inhaled air (which may be important for the presentation of odorants) and provides an immune barrier that protects the nasal cavity from irritation and infection. A layer of thick mucus lines the nasal cavity and protects the exposed neurons, respiratory epithelial cells, and supporting cells of the olfactory epithelium. The mucus also controls the ionic milieu of the olfactory cilia, the primary site of odorant transduction (see below). Mucus is produced by secretory specializations called Bowman’s glands that are distributed throughout the olfactory epithelium. When the mucus layer thickens, as during a cold, olfactory acuity decreases significantly. Two other cell classes, basal cells and sustentacular (supporting) cells, are also present in the olfactory epithelium. The mucus secreted by Bowman’s glands traps and neutralizes some potentially harmful agents. In both the respiratory and olfactory epithelium (Figure 15.6B), immunoglobulins in mucus provide an initial line of defense against harmful antigens. The sustentacular cells also contain enzymes (cytochrome P-450s and others) that catabolize organic chemicals and other potentially damaging molecules. In addition, macrophages found throughout the nasal mucosa isolate and remove harmful material as well as the remains of degenerating cells of the olfactory epithelium. This entire apparatus-mucus layer and epithelium with neural and supporting cells is called the nasal mucosa. Given the unusual direct exposure of the olfactory epithelium to the external environment (outdoor or room air), immune protection is especially important.
اپیتلیوم بویایی و نورونهای گیرنده بویایی
انتقال اطلاعات بویایی – مجموعهای از رویدادهای عصبی که در نهایت منجر به حس بویایی آگاهانه میشود – در اپیتلیوم بویایی، صفحهای از نورونها و سلولهای پشتیبان که تقریباً نیمی از سطح حفره بینی را میپوشاند، آغاز میشود (شکل 15.1A را ببینید). سطح داخل بینی باقی مانده توسط اپیتلیوم تنفسی مشابه نای و ریهها پوشیده شده است. اپیتلیوم تنفسی در درجه اول دما و رطوبت مناسب را برای هوای استنشاقی حفظ میکند (که ممکن است برای ارائه بوها مهم باشد) و یک سد ایمنی ایجاد میکند که حفره بینی را از تحریک و عفونت محافظت میکند. لایهای از مخاط ضخیم، حفره بینی را میپوشاند و از نورونهای در معرض، سلولهای اپیتلیال تنفسی و سلولهای پشتیبان اپیتلیوم بویایی محافظت میکند. مخاط همچنین محیط یونی مژکهای بویایی، محل اصلی انتقال بو را کنترل میکند (به زیر مراجعه کنید). مخاط توسط تخصصهای ترشحی به نام غدد بومن تولید میشود که در سراسر اپیتلیوم بویایی توزیع شدهاند. وقتی لایه مخاطی ضخیم میشود، مانند زمان سرماخوردگی، حس بویایی به طور قابل توجهی کاهش مییابد. دو دسته سلول دیگر، سلولهای پایه و سلولهای نگهدارنده (پشتیبان)، نیز در اپیتلیوم بویایی وجود دارند. مخاط ترشح شده توسط غدد بومن، برخی از عوامل بالقوه مضر را به دام انداخته و خنثی میکند. در هر دو اپیتلیوم تنفسی و بویایی (شکل 15.6B)، ایمونوگلوبولینهای موجود در مخاط، خط دفاعی اولیهای در برابر آنتیژنهای مضر ایجاد میکنند. سلولهای نگهدارنده همچنین حاوی آنزیمهایی (سیتوکروم P-450 و سایر) هستند که مواد شیمیایی آلی و سایر مولکولهای بالقوه مضر را کاتابولیزه میکنند. علاوه بر این، ماکروفاژهای موجود در سراسر مخاط بینی، مواد مضر و همچنین بقایای سلولهای در حال تخریب اپیتلیوم بویایی را جدا و حذف میکنند. کل این دستگاه – لایه مخاطی و اپیتلیوم به همراه سلولهای عصبی و نگهدارنده – مخاط بینی نامیده میشود. با توجه به قرار گرفتن غیرمعمول و مستقیم اپیتلیوم بویایی در معرض محیط خارجی (هوای بیرون یا اتاق)، محافظت ایمنی از اهمیت ویژهای برخوردار است.
The neural portion of the olfactory epithelium is primarily defined by the olfactory receptor neurons (ORNs). These bipolar cells give rise to small-diameter, unmyelinated axons at their basal surface that transmit olfactory information centrally. At the apical surface, an ORN has a single dendritic process that expands into a knoblike protrusion from which several microvilli, called olfactory cilia, extend into a thick layer of mucus (Figure 15.6A). The microvilli are not actual “cilia” based upon the distinctive cytoskeletal arrangement that defines a cilium (see Chapter 22). Instead they are actin based cellular protrusions (more like filopodia seen in growth cones; see Chapter 23) that have scaffolding proteins that localize odorant receptors and signal transduction molecules within the ORN apical dendrite. ORNs have direct access to odorant molecules as air is inspired through the nose into the lungs; however, this access exposes these neurons to airborne pollutants, allergens, microorganisms, and other potentially harmful substances, subjecting them to more or less continual damage. The ultimate solution to the vulnerability of ORNs is to maintain a healthy population by a normal cycle of degeneration and regeneration, analogous to that in other exposed epithelia (such as the intestine and lung). This constant process of degeneration and regeneration is found in all vertebrates, including mammals. ORN regeneration relies on maintaining among the basal cells in the mature olfactory epithelium a population of neural stem cells that divide to give rise to new receptor neurons (Figure 15.6C; see also Chapter 26).
بخش عصبی اپیتلیوم بویایی در درجه اول توسط نورونهای گیرنده بویایی (ORN) تعریف میشود. این سلولهای دوقطبی در سطح پایه خود آکسونهای بدون میلین با قطر کوچک ایجاد میکنند که اطلاعات بویایی را به صورت مرکزی منتقل میکنند. در سطح رأسی، یک ORN دارای یک زائده دندریتیک واحد است که به یک برآمدگی دکمه مانند گسترش مییابد که از آن چندین میکروویلی، به نام مژکهای بویایی، به یک لایه ضخیم از مخاط امتداد مییابند (شکل 15.6A). میکروویلیها بر اساس آرایش اسکلت سلولی متمایزی که یک مژک را تعریف میکند، “مژک” واقعی نیستند (به فصل 22 مراجعه کنید). در عوض، آنها برآمدگیهای سلولی مبتنی بر اکتین هستند (بیشتر شبیه فیلوپودیا که در مخروطهای رشد دیده میشود؛ به فصل 23 مراجعه کنید) که دارای پروتئینهای داربستی هستند که گیرندههای بو و مولکولهای انتقال سیگنال را در دندریت رأسی ORN قرار میدهند. ORNها هنگام دمیدن هوا از طریق بینی به ریهها، به مولکولهای بو دسترسی مستقیم دارند. با این حال، این دسترسی، این نورونها را در معرض آلایندههای موجود در هوا، آلرژنها، میکروارگانیسمها و سایر مواد بالقوه مضر قرار میدهد و آنها را کم و بیش در معرض آسیب مداوم قرار میدهد. راه حل نهایی برای آسیبپذیری ORNها، حفظ جمعیت سالم از طریق یک چرخه طبیعی تخریب و بازسازی است، مشابه آنچه در سایر اپیتلیومهای در معرض خطر (مانند روده و ریه) وجود دارد. این فرآیند مداوم تخریب و بازسازی در همه مهرهداران، از جمله پستانداران، یافت میشود. بازسازی ORNها به حفظ جمعیتی از سلولهای بنیادی عصبی در سلولهای پایه در اپیتلیوم بویایی بالغ متکی است که برای ایجاد نورونهای گیرنده جدید تقسیم میشوند (شکل 15.6C؛ همچنین به فصل 26 مراجعه کنید).


FIGURE 15.6 Structure and function of the olfactory epithelium. (A) Diagram of the olfactory epithelium showing the major cell types: ORNs and their cilia, sustentacular (supporting) cells that detoxify potentially dangerous chemicals, and basal cells. Bowman’s glands produce mucus. Bundles of unmyelinated axons and blood vessels run in the basal part of the mucosa (the lamina propria). ORNs are generated continuously from dividing stem cells maintained among the basal cells of the olfactory epithelium. (B) Distinctions between respiratory and olfactory (neural) epithelium in the nasal cavity. At far left, the nasal cavity of a juvenile mouse, composed of a fairly thin respiratory epithelium and much thicker olfactory epithelium. The arrow indicates the approximate location of the image in the next panel, which shows a sharp boundary between respiratory epithelium (labeled green here, based on expression of the transcription factor forkhead1) and olfactory epithelium. The remaining three panels show distinct cell classes in the olfactory epithelium. ORNs are labeled with olfactory marker protein (OMP: green), a molecule expressed uniquely in these neurons. Supporting (sustentacular) cells express another cell class specific molecule (light brown). At far right, basal cells, the stem cells of the adult olfactory epithelium, are recognized by their expression of the filament protein cytokeratin 5 (dark brown). (C) Olfactory epithelium (OE) regeneration depends on basal cells. A reporter protein genetically labels these cells and their descendants so that they appear red. When the olfactory epithelium is undisturbed, basal cells are seen in their appropriate position. Immediately after a lesion, basal cells begin to proliferate; their progeny are additional basal cells. Within 21 days, all cells in the regenerated epithelium have arisen from basal cells. Regenerated cells include ORNS, which are double labeled (green for OMP expression as well as the red indicating the neuron’s basal cell derivation). (A after Anholt, 1987; B adapted from Rawson and LaMantia, 2006; C from Leung et al., 2007.)
شکل ۱۵.۶ ساختار و عملکرد اپیتلیوم بویایی. (الف) نمودار اپیتلیوم بویایی که انواع اصلی سلولها را نشان میدهد: ORNها و مژکهای آنها، سلولهای نگهدارنده (پشتیبان) که مواد شیمیایی بالقوه خطرناک را سمزدایی میکنند و سلولهای پایه. غدد بومن مخاط تولید میکنند. دستههایی از آکسونهای بدون میلین و رگهای خونی در قسمت پایه مخاط (لامینا پروپریا) قرار دارند. ORNها به طور مداوم از تقسیم سلولهای بنیادی که در بین سلولهای پایه اپیتلیوم بویایی نگهداری میشوند، تولید میشوند. (ب) تمایزات بین اپیتلیوم تنفسی و بویایی (عصبی) در حفره بینی. در سمت چپ، حفره بینی یک موش جوان، متشکل از یک اپیتلیوم تنفسی نسبتاً نازک و اپیتلیوم بویایی بسیار ضخیمتر. فلش محل تقریبی تصویر را در پنل بعدی نشان میدهد که مرز مشخصی بین اپیتلیوم تنفسی (که در اینجا با رنگ سبز مشخص شده است، بر اساس بیان فاکتور رونویسی forkhead1) و اپیتلیوم بویایی را نشان میدهد. سه پنل باقیمانده، طبقات سلولی متمایزی را در اپیتلیوم بویایی نشان میدهند. ORNها با پروتئین نشانگر بویایی (OMP: سبز) برچسبگذاری شدهاند، مولکولی که به طور منحصر به فرد در این نورونها بیان میشود. سلولهای پشتیبان (نگهدارنده) مولکول خاص دیگری از طبقه سلولی (قهوهای روشن) را بیان میکنند. در منتهیالیه سمت راست، سلولهای پایه، سلولهای بنیادی اپیتلیوم بویایی بالغ، با بیان پروتئین رشتهای سیتوکراتین 5 (قهوهای تیره) شناسایی میشوند. (C) بازسازی اپیتلیوم بویایی (OE) به سلولهای پایه بستگی دارد. یک پروتئین گزارشگر به صورت ژنتیکی این سلولها و فرزندان آنها را برچسبگذاری میکند تا قرمز به نظر برسند. هنگامی که اپیتلیوم بویایی دست نخورده باقی بماند، سلولهای پایه در موقعیت مناسب خود دیده میشوند. بلافاصله پس از ضایعه، سلولهای پایه شروع به تکثیر میکنند. فرزندان آنها سلولهای پایه اضافی هستند. ظرف ۲۱ روز، تمام سلولهای موجود در اپیتلیوم بازسازیشده از سلولهای پایهای منشأ گرفتهاند. سلولهای بازسازیشده شامل ORNS هستند که دو بار برچسبگذاری شدهاند (سبز برای بیان OMP و همچنین قرمز نشان دهنده مشتق شدن نورون از سلولهای پایهای است). (الف برگرفته از Anholt، ۱۹۸۷؛ ب اقتباس از Rawson و LaMantia، ۲۰۰۶؛ ج برگرفته از Leung و همکاران، ۲۰۰۷.)
In rodents, most if not all olfactory neurons are renewed every 6 to 8 weeks. This extended time period (6 to 8 weeks represents a significant portion of a mouse or rat’s typical 1.5 to 2 year life span) suggests that neural regeneration is a gradual process. The period for complete turnover has not been defined in humans. Nevertheless, it is clear that ORNS will be regenerated if large populations of extant neurons, but not the neural stem cells that are maintained throughout life in the OE (see Figure 5.6 and Clinical Applications) are eliminated at one time. This can happen due to environmental exposure, viral or bacterial infection (colds and sinus infections), or traumatic head injuries such as whiplash that occurs in automobile accidents (the axons are sheared by the force of the impact due to differential movement of the neural tissue versus the cribiform plate). Unfortunately, this sort of largescale regeneration does not fully restore normal function. In such individuals, after a period of complete anosmia, odor discrimination and identification as well as olfactory-guided behavior are of- ten permanently altered.
در جوندگان، اکثر نورونهای بویایی، اگر نگوییم همه، هر 6 تا 8 هفته تجدید میشوند. این دوره زمانی طولانی (6 تا 8 هفته بخش قابل توجهی از طول عمر معمول 1.5 تا 2 سال موش یا موش صحرایی را نشان میدهد) نشان میدهد که بازسازی عصبی یک فرآیند تدریجی است. دوره گردش کامل در انسان تعریف نشده است. با این وجود، واضح است که اگر جمعیت زیادی از نورونهای موجود، اما نه سلولهای بنیادی عصبی که در طول زندگی در OE حفظ میشوند (به شکل 5.6 و کاربردهای بالینی مراجعه کنید) به طور همزمان حذف شوند، ORNS بازسازی خواهد شد. این امر میتواند به دلیل قرار گرفتن در معرض محیط، عفونت ویروسی یا باکتریایی (سرماخوردگی و عفونتهای سینوسی) یا آسیبهای تروماتیک سر مانند ضربه شلاقی که در تصادفات اتومبیل رخ میدهد (آکسونها به دلیل حرکت افتراقی بافت عصبی در مقابل صفحه کریبیفرم توسط نیروی ضربه بریده میشوند) اتفاق بیفتد. متأسفانه، این نوع بازسازی در مقیاس بزرگ، عملکرد طبیعی را به طور کامل بازیابی نمیکند. در چنین افرادی، پس از یک دوره آنوسمی کامل، تشخیص و شناسایی بو و همچنین رفتار هدایتشده توسط بویایی اغلب به طور دائمی تغییر میکنند.
ORNs are the only neurons with long axons (referred to generally as projection neurons) that project to a distal target and are constantly newly generated from neural stem cells found in the OE in mature individuals. The newly generated ORNs can then grow an axon that establishes new synaptic connections with appropriate targets (see Figure 15.13). In the mature olfactory system, many of the molecules that influence initially neuronal differentiation, axon outgrowth, and synapse formation during development (see Chapters 22 and 23) are apparently retained or reactivated to perform similar functions for regenerating ORNs. Understanding how new ORNs differentiate, extend axons to the brain, and reestablish appropriate functional synaptic connections is obviously relevant to stimulating regeneration of functional connections else where in the brain after injury or disease (see Chapter 26). Indeed, other specialized cell classes in the mature olfactory system are adapted to facilitate constant regeneration. In adults, glial cells called olfactory ensheathing cells surround axons in the olfactory nerve and bulb. These glial cells, which are derived initially from the olfactory epithelium, are believed to support the growth of new axons through a mature nervous system. In experimental therapies following damage to other regions of the CNS (e.g., the spinal cord), olfactory glial cells have been used to construct cellular “bridges” across sites of axonal damage to promote regeneration. Thus, the regenerative capacity of ORNs, with the assistance of other cell types in the olfactory epithelium provides a potentially instructive model for understanding how regeneration of neurons or axons can be stimulated throughout the nervous system. This is a fundamental issue since in all mammals, including humans, cellular regeneration and related functional recovery after central nervous system damage does not occur to a useful degree (see Chapter 26).
ORNها تنها نورونهایی با آکسونهای بلند (که عموماً به عنوان نورونهای پروجکشن شناخته میشوند) هستند که به یک هدف دیستال پرتاب میشوند و دائماً از سلولهای بنیادی عصبی موجود در OE در افراد بالغ به طور جدید تولید میشوند. ORNهای تازه تولید شده سپس میتوانند آکسونی را رشد دهند که ارتباطات سیناپسی جدیدی را با اهداف مناسب برقرار میکند (شکل 15.13 را ببینید). در سیستم بویایی بالغ، بسیاری از مولکولهایی که در ابتدا بر تمایز عصبی، رشد آکسون و تشکیل سیناپس در طول رشد تأثیر میگذارند (به فصلهای 22 و 23 مراجعه کنید) ظاهراً حفظ یا دوباره فعال میشوند تا عملکردهای مشابهی را برای بازسازی ORNها انجام دهند. درک چگونگی تمایز ORNهای جدید، گسترش آکسونها به مغز و برقراری مجدد ارتباطات سیناپسی عملکردی مناسب، بدیهی است که برای تحریک بازسازی اتصالات عملکردی در جاهای دیگر مغز پس از آسیب یا بیماری مرتبط است (به فصل 26 مراجعه کنید). در واقع، سایر ردههای سلولی تخصصی در سیستم بویایی بالغ برای تسهیل بازسازی مداوم سازگار شدهاند. در بزرگسالان، سلولهای گلیال به نام سلولهای غلاف بویایی، آکسونها را در عصب بویایی و پیاز آن احاطه میکنند. اعتقاد بر این است که این سلولهای گلیال که در ابتدا از اپیتلیوم بویایی مشتق میشوند، از رشد آکسونهای جدید از طریق سیستم عصبی بالغ پشتیبانی میکنند. در درمانهای تجربی پس از آسیب به سایر مناطق سیستم عصبی مرکزی (به عنوان مثال، نخاع)، از سلولهای گلیال بویایی برای ساخت “پلهای” سلولی در سراسر محلهای آسیب آکسونی برای ترویج بازسازی استفاده شده است. بنابراین، ظرفیت بازسازی ORNها، با کمک سایر انواع سلولها در اپیتلیوم بویایی، یک مدل بالقوه آموزنده برای درک چگونگی تحریک بازسازی نورونها یا آکسونها در سراسر سیستم عصبی فراهم میکند. این یک مسئله اساسی است زیرا در همه پستانداران، از جمله انسان، بازسازی سلولی و بهبود عملکردی مرتبط پس از آسیب سیستم عصبی مرکزی به میزان قابل توجهی رخ نمیدهد (به فصل 26 مراجعه کنید).
Odor Transduction and Odorant Receptor Proteins
Odor transduction in the olfactory epithelium begins with odorant binding to specific odorant receptor proteins concentrated on the external surface of olfactory cilia. Prior to the identification of odorant receptor proteins, the compartmental sensitivity of the cilia to odors was demonstrated in physiological experiments (Figure 15.7). Odor- ants presented to the cilia of an isolated ORN elicit a robust electrical response; those presented to the cell body do not. Despite their external appearance, olfactory cilia do not have the cytoskeletal features of motile cilia (i.e., the 9+2 arrangement of microtubules). Instead, the actin rich olfactory cilia more closely resemble microvilli of other epithelia (such as the lung and gut) and thus have a greatly expanded cellular surface to which odorants can bind. Many molecules that are crucial for olfactory transduction are either enriched or found exclusively in the cilia, including the odorant receptor proteins that bind and transduce chemosensory information.
انتقال بو و پروتئینهای گیرنده بو
انتقال بو در اپیتلیوم بویایی با اتصال بو به پروتئینهای گیرنده بویایی خاص متمرکز بر سطح خارجی مژکهای بویایی آغاز میشود. قبل از شناسایی پروتئینهای گیرنده بو، حساسیت جزئی مژکها به بوها در آزمایشهای فیزیولوژیکی نشان داده شده بود (شکل 15.7). بوهایی که به مژکهای یک ORN جدا شده ارائه میشوند، پاسخ الکتریکی قوی ایجاد میکنند؛ آنهایی که به جسم سلولی ارائه میشوند، این پاسخ را ایجاد نمیکنند. علیرغم ظاهر خارجیشان، مژکهای بویایی ویژگیهای اسکلت سلولی مژکهای متحرک (یعنی آرایش ۲+۹ میکروتوبولها) را ندارند. در عوض، مژکهای بویایی غنی از اکتین بیشتر شبیه میکروویلیهای سایر اپیتلیومها (مانند ریه و روده) هستند و بنابراین سطح سلولی بسیار گستردهای دارند که بوها میتوانند به آن متصل شوند. بسیاری از مولکولهایی که برای انتقال حس بویایی حیاتی هستند، یا غنی شدهاند یا منحصراً در مژکها یافت میشوند، از جمله پروتئینهای گیرنده بو که به اطلاعات شیمیایی-حسی متصل شده و آنها را انتقال میدهند.

FIGURE 15.7 Receptor potentials are generated in the cilia of receptor neurons. Odorants evoke a large inward (depolarizing) current when applied to the cilia (left), but only a small current when applied to the cell body (right). (After Firestein et al., 1991.)
شکل ۱۵.۷ پتانسیلهای گیرنده در مژکهای نورونهای گیرنده ایجاد میشوند. مواد معطر وقتی به مژکها (چپ) اعمال میشوند، جریان بزرگی به سمت داخل (دپلاریزه کننده) ایجاد میکنند، اما وقتی به جسم سلولی (راست) اعمال میشوند، جریان کمی ایجاد میکنند. (به نقل از فایرستین و همکاران، ۱۹۹۱.)
The central role of odorant receptor proteins in the encoding of olfactory information was acknowledged in 2004 when a Nobel Prize was awarded to Richard Axel and Linda Buck for their discovery of the odorant receptor gene family. Olfactory receptor molecules are homologous to G-protein coupled receptors, a category that includes ẞ-adrenergic and muscarinic acetylcholine receptors, the light responsive rhodopsin, and the cone opsins (see Chapters 6 and 11). In all invertebrates and vertebrates examined thus far, odorant receptor proteins have seven membrane spanning hydrophobic domains, potential odorant binding sites in the extracellular domain of the protein, and the ability to interact with G-proteins at the carboxyl terminal region of their cytoplasmic domain (Figure 15.8A). The amino acid sequences for these molecules show substantial variability in several of the membrane spanning regions, as well as in the extracellular and cytoplasmic domains. The specificity of odorant recognition and signal transduction is presumably the result of this molecular variety of odorant receptor proteins in the nasal epithelium; however, the molecular mechanism by which individual receptors bind specific odorants remains poorly understood.
نقش محوری پروتئینهای گیرنده بو در رمزگذاری اطلاعات بویایی در سال ۲۰۰۴، زمانی که جایزه نوبل به ریچارد اکسل و لیندا باک برای کشف خانواده ژن گیرنده بو اهدا شد، مورد توجه قرار گرفت. مولکولهای گیرنده بویایی با گیرندههای جفتشده با پروتئین G همولوگ هستند، دستهای که شامل گیرندههای استیل کولین ẞ آدرنرژیک و موسکارینی، رودوپسین حساس به نور و اوپسینهای مخروطی میشود (به فصلهای ۶ و ۱۱ مراجعه کنید). در تمام بیمهرگان و مهرهدارانی که تاکنون بررسی شدهاند، پروتئینهای گیرنده بو دارای هفت دامنه آبگریز در سراسر غشاء، مکانهای اتصال بو بالقوه در دامنه خارج سلولی پروتئین و توانایی تعامل با پروتئینهای G در ناحیه انتهای کربوکسیل دامنه سیتوپلاسمی خود هستند (شکل ۱۵.۸A). توالیهای اسید آمینه برای این مولکولها، تنوع قابل توجهی را در چندین ناحیه در سراسر غشاء و همچنین در دامنههای خارج سلولی و سیتوپلاسمی نشان میدهند. احتمالاً اختصاصی بودن تشخیص بو و انتقال سیگنال، نتیجهی این تنوع مولکولی پروتئینهای گیرندهی بو در اپیتلیوم بینی است؛ با این حال، مکانیسم مولکولی که از طریق آن گیرندههای منفرد به بوهای خاص متصل میشوند، هنوز به خوبی شناخته نشده است.
The number of odorant receptor genes, though substantial in all species, varies widely. Nevertheless, in all mammals, odorant receptors are the largest known single gene family, representing 3% to 5% of the genome. Analysis of the human genome has identified approximately 950 odorant receptor genes (Figure 15.8B); the number is similar in other primates, including chimpanzees, which have approximately 1100. Analysis of the mouse genome indicates about 1500 different odorant receptor genes, and in certain dogs, including those noted for their olfactory abilities (Box 15A), the number is around 1200. Additional sequence analysis of apparent mammalian odorant receptor genes, however, suggests that many of these genes-around 60% in humans and chimps versus 15% to 20% in mice and dogs are not transcribed due to changes that have rendered them pseudogenes.* Thus, the number of functional odorant receptor proteins encoded by stably transcribed and translated genes is estimated to be around 400 in humans and chimps versus about 1200 in mice and 1000 in dogs. In mammals, the number of expressed odorant receptors apparently is correlated with the olfactory capacity of different species. Similar analyses of complete genome sequences from the worm C. elegans and the fruit fly D. melanogaster indicate that the worm has approximately 1000 odorant receptor genes, whereas the fruit fly has only about 60. The functional significance of these disparate numbers is not known.
تعداد ژنهای گیرنده بو، اگرچه در همه گونهها قابل توجه است، اما بسیار متفاوت است. با این وجود، در همه پستانداران، گیرندههای بو بزرگترین خانواده ژنی شناخته شده هستند که 3 تا 5 درصد از ژنوم را تشکیل میدهند. تجزیه و تحلیل ژنوم انسان تقریباً 950 ژن گیرنده بو را شناسایی کرده است (شکل 15.8B). این تعداد در سایر نخستیسانان، از جمله شامپانزهها که تقریباً ۱۱۰۰ ژن دارند، مشابه است. تجزیه و تحلیل ژنوم موش حدود ۱۵۰۰ ژن گیرنده بویایی مختلف را نشان میدهد و در برخی از سگها، از جمله آنهایی که به خاطر تواناییهای بویاییشان شناخته شدهاند (کادر ۱۵A)، این تعداد حدود ۱۲۰۰ است. با این حال، تجزیه و تحلیل توالی اضافی ژنهای گیرنده بویایی پستانداران نشان میدهد که بسیاری از این ژنها – حدود ۶۰٪ در انسان و شامپانزه در مقابل ۱۵٪ تا ۲۰٪ در موش و سگ – به دلیل تغییراتی که آنها را به شبهژن تبدیل کرده است، رونویسی نمیشوند.* بنابراین، تعداد پروتئینهای گیرنده بویایی عملکردی که توسط ژنهای رونویسی و ترجمهشده پایدار کدگذاری میشوند، در انسان و شامپانزه حدود ۴۰۰ عدد تخمین زده میشود در حالی که این تعداد در موش حدود ۱۲۰۰ عدد و در سگها ۱۰۰۰ عدد است. در پستانداران، تعداد گیرندههای بویایی بیانشده ظاهراً با ظرفیت بویایی گونههای مختلف مرتبط است. تجزیه و تحلیلهای مشابه از توالیهای کامل ژنوم کرم C. elegans و مگس میوه D. melanogaster نشان میدهد که این کرم تقریباً ۱۰۰۰ ژن گیرنده بو دارد، در حالی که مگس میوه تنها حدود ۶۰ ژن دارد. اهمیت عملکردی این اعداد متفاوت مشخص نیست.
*A pseudogene is a sequence of DNA that contains a promoter and a transcription initiation site, but because of sequence changes, the DNA either cannot be transcribed into a stable mRNA, or the transcript cannot be translated into a protein.
*یک شبهژن، توالیای از DNA است که شامل یک پروموتر و یک جایگاه شروع رونویسی است، اما به دلیل تغییرات توالی، DNA یا نمیتواند به یک mRNA پایدار رونویسی شود، یا رونوشت نمیتواند به پروتئین ترجمه شود.
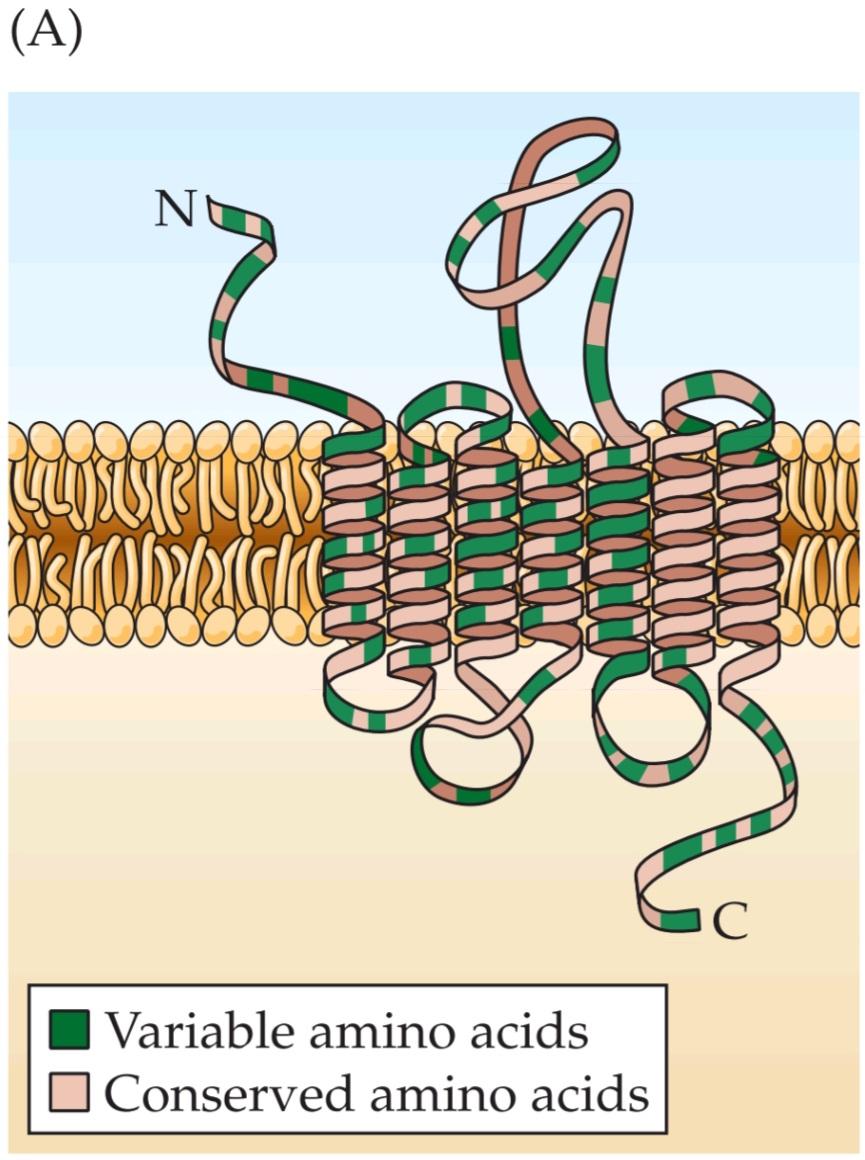

FIGURE 15.8 Odorant receptor proteins. (A) The generic structure of putative olfactory odorant receptors. These proteins have seven transmembrane domains, plus a variable cell surface region and a cytoplasmic tail that interacts with G-proteins. As many as 1000 genes encode proteins of similar inferred structure in several mammalian species, including humans. Each gene presumably encodes a receptor protein that detects a particular set of odorant molecules. (B) Regions encoding the seven transmembrane domains characteristic of G-protein coupled receptors are shown in green on maps of receptor genes in mammals, the nematode C. elegans, and the fruit fly D. melanogaster. The comparative size of each domain, as well as the size of the intervening cytoplasmic or cell surface domains (beige), varies from species to species. In addition, splice sites (red arrowheads) reflect introns in the genomic sequences of the two invertebrates; genes for mammalian odorant receptors lack introns. The number of genes that encode odorant receptors in each of the four species is indicated in the corresponding boxes. (A after Menini, 1999; B after Dryer, 2000.)
شکل ۱۵.۸ پروتئینهای گیرنده بو. (الف) ساختار عمومی گیرندههای بویایی بویایی فرضی. این پروتئینها دارای هفت دامنه غشایی، به علاوه یک ناحیه سطح سلولی متغیر و یک دم سیتوپلاسمی هستند که با پروتئینهای G تعامل دارند. تا ۱۰۰۰ ژن پروتئینهایی با ساختار استنباطی مشابه را در چندین گونه پستاندار، از جمله انسان، رمزگذاری میکنند. هر ژن احتمالاً یک پروتئین گیرنده را رمزگذاری میکند که مجموعه خاصی از مولکولهای بو را تشخیص میدهد. (ب) مناطقی که هفت دامنه غشایی مشخصه گیرندههای جفتشده با پروتئین G را رمزگذاری میکنند، روی نقشههای ژنهای گیرنده در پستانداران، نماتد C. elegans و مگس میوه D. melanogaster به رنگ سبز نشان داده شدهاند. اندازه مقایسهای هر دامنه، و همچنین اندازه دامنههای سیتوپلاسمی یا سطح سلولی مداخلهگر (بژ)، از گونهای به گونه دیگر متفاوت است. علاوه بر این، مکانهای اتصال (نوک پیکانهای قرمز) منعکسکننده اینترونها در توالیهای ژنومی دو بیمهره هستند. ژنهای مربوط به گیرندههای بویایی پستانداران فاقد اینترون هستند. تعداد ژنهایی که گیرندههای بویایی را در هر یک از چهار گونه رمزگذاری میکنند، در کادرهای مربوطه مشخص شده است. (الف، پس از منینی، ۱۹۹۹؛ ب، پس از درایر، ۲۰۰۰.)
BOX 15A ☐ The “Dogtor” Is In
Conventional wisdom holds that having a pet, particularly a dog, is good for your health. Most of us assume that the primary benefits come from the companionship, as well as the daily exercise, that a dog provides. However, there may be more critical benefits of pet ownership that reflect the remarkable acuity of the canine olfactory system. The family dog may in fact be a reliable source of early diagnosis for several cancers-albeit a diagnostician that likes to chew shoes and has a wet nose.
کادر ۱۵A ☐ «سگبان» وارد میشود
عقیده رایج این است که داشتن حیوان خانگی، به ویژه سگ، برای سلامتی شما مفید است. اکثر ما فرض میکنیم که مزایای اصلی آن از همراهی و همچنین ورزش روزانهای که یک سگ فراهم میکند، ناشی میشود. با این حال، ممکن است مزایای حیاتیتری از نگهداری حیوان خانگی وجود داشته باشد که نشاندهنده تیزبینی قابل توجه سیستم بویایی سگ است. سگ خانواده در واقع میتواند منبع قابل اعتمادی برای تشخیص زودهنگام چندین سرطان باشد – البته تشخیصی که دوست دارد کفش بجود و بینی مرطوبی دارد.
In the late 1980s, anecdotal reports emerged that claimed family dogs could use smell to identify moles and other skin blemishes on their owners that turned out to be malignant. In recounting this seemingly strange capacity of several dogs, H. Williams, one of the original discoverers, reported “a patient whose dog constantly sniffed at a mole on her leg. On one occasion, the dog even tried to bite the lesion off…. [The] constant attention [of the dog] prompted her to seek medical advice. The lesion was excised and histology showed the lesion to be a malignant melanoma.”
در اواخر دهه ۱۹۸۰، گزارشهای روایی منتشر شد که ادعا میکرد سگهای خانگی میتوانند از بو برای شناسایی خالها و سایر لکههای پوستی روی صاحبانشان که بدخیم بودند، استفاده کنند. اچ. ویلیامز، یکی از کاشفان اصلی، در شرح این توانایی به ظاهر عجیب چندین سگ، گزارش داد: «بیماری که سگش دائماً خال روی پایش را بو میکشید. در یک مورد، سگ حتی سعی کرد ضایعه را گاز بگیرد… توجه مداوم [سگ] او را وادار به مراجعه به پزشک کرد. ضایعه برداشته شد و بافتشناسی نشان داد که ضایعه یک ملانوم بدخیم است.»
Subsequently, similar diagnoses by individual pets for their owners were reported, including a Labrador retriever that detected a basal cell carcinoma that had developed from an eczema lesion on its master’s skin. A slightly less anecdotal study relied on techniques used to train explosive sniffing dogs for airport security. In this instance, George, a schnauzer, was trained to distinguish malignant melanomas in cell culture from their nonmalignant melanocyte counterparts. George was then introduced to a person who had several moles. One mole caused George to “go crazy”: a biopsy proved that the mole was indeed an early malignant melanoma.
پس از آن، تشخیصهای مشابهی توسط حیوانات خانگی برای صاحبانشان گزارش شد، از جمله یک لابرادور رتریور که کارسینوم سلول بازال را که از یک ضایعه اگزما روی پوست صاحبش ایجاد شده بود، تشخیص داد. یک مطالعه کمی کمتر روایی بر تکنیکهایی که برای آموزش سگهای بوکننده انفجاری برای امنیت فرودگاه استفاده میشد، متکی بود. در این مورد، جورج، یک سگ از نژاد اشناوزر، آموزش دید تا ملانومهای بدخیم را در کشت سلولی از همتایان ملانوسیت غیر بدخیم آنها تشخیص دهد. سپس جورج را به شخصی معرفی کردند که چندین خال داشت. یکی از خالها باعث شد جورج «دیوانه شود»: نمونهبرداری ثابت کرد که آن خال در واقع یک ملانوم بدخیم اولیه است.
Over the ensuing years, further anecdotal evidence suggested that dogs could recognize lung, breast, and bladder cancer using olfaction. These reports remained isolated anecdotes until 2006, when a truly systematic analysis of this apparent diagnostic capacity was published. In this study, five ordinary adult dogs were trained to distinguish exhaled breath samples from patients with lung or breast cancer versus controls who did not have cancer. The dogs were then tested for their ability to distinguish patients from controls in an entirely novel sample population. In this instance, the specificity and sensitivity of the dogs’ ability to detect lung cancer from early to late stages was 99% as accurate as that of conventional biopsy diagnosis. The accuracy of breast cancer detection was slightly lowerap proximately 90% that of conventional methods.
در طول سالهای بعد، شواهد روایی بیشتری نشان داد که سگها میتوانند سرطان ریه، سینه و مثانه را با استفاده از حس بویایی تشخیص دهند. این گزارشها تا سال ۲۰۰۶، زمانی که یک تحلیل واقعاً سیستماتیک از این ظرفیت تشخیصی آشکار منتشر شد، به صورت حکایتهای جداگانه باقی ماندند. در این مطالعه، پنج سگ بالغ معمولی آموزش دیدند تا نمونههای بازدم بیماران مبتلا به سرطان ریه یا سینه را از نمونههای کنترل که سرطان نداشتند، تشخیص دهند. سپس سگها از نظر تواناییشان در تشخیص بیماران از نمونههای کنترل در یک جمعیت نمونه کاملاً جدید آزمایش شدند. در این مورد، ویژگی و حساسیت توانایی سگها در تشخیص سرطان ریه از مراحل اولیه تا نهایی، ۹۹٪ به اندازه تشخیص بیوپسی معمولی دقیق بود. دقت تشخیص سرطان سینه کمی کمتر و تقریباً ۹۰٪ از روشهای مرسوم بود.
A similar study that challenged dogs to discriminate urine from patients with and without bladder cancer had parallel but somewhat less robust results. During the course of this study, however, the dogs consistently identified a presumed “control” sample as that from a patient with cancer. Clinicians were sufficiently alerted to perform further diagnostic tests, and in fact discovered a kidney carcinoma in this individual.
مطالعه مشابهی که سگها را برای تمایز ادرار از بیماران مبتلا به سرطان مثانه و بدون آن به چالش کشید، نتایج مشابهی اما تا حدودی کمتر قوی داشت. با این حال، در طول این مطالعه، سگها به طور مداوم یک نمونه “کنترل” فرضی را به عنوان نمونه بیمار مبتلا به سرطان تشخیص دادند. پزشکان به اندازه کافی هوشیار بودند که آزمایشهای تشخیصی بیشتری انجام دهند و در واقع سرطان کلیه را در این فرد کشف کردند.
Aside from writing a new chapter in the saga of the salutatory relationship between humans and dogs, these observations have several implications for understanding the mechanisms and biological significance of olfactory acuity and selectivity. First, there is evidence that the concentration of alkanes and other volatile organic compounds is increased in air exhaled from patients with lung cancer. Thus, as indicated by preliminary studies of odorant receptor molecule sensitivity, 7 transmembrane G-protein coupled odorant receptors may be specialized to detect and discriminate a wide-and biologically significant spectrum of volatile organic compounds at low concentrations. Second, the discrimination made between patients and controls, either by untrained individual dogs or the trained group of dogs, suggests that subtle distinctions in olfactory perception are clearly represented and can guide behavior. The apparent heightened olfactory ability in dogs may reflect a somewhat larger number of odorant receptors and/or relatively larger olfactory periphery that allow increased sensitivity, or specialized circuitry in the olfactory bulb, pyriform cortex, or other brain regions that assign cognitive significance to distinct olfactory stimuli. Whether this ability has adaptive significance for dogs or is just the ultimate smart pet trick is unclear.
گذشته از نوشتن فصل جدیدی در حماسه رابطه سودمند بین انسان و سگ، این مشاهدات پیامدهای متعددی برای درک مکانیسمها و اهمیت بیولوژیکی حدت بویایی و گزینشپذیری دارند. اول، شواهدی وجود دارد که نشان میدهد غلظت آلکانها و سایر ترکیبات آلی فرار در هوای بازدم بیماران مبتلا به سرطان ریه افزایش مییابد. بنابراین، همانطور که مطالعات اولیه حساسیت مولکول گیرنده بو نشان داده است، 7 گیرنده بویایی متصل به پروتئین G غشایی ممکن است برای تشخیص و تمایز طیف وسیعی از ترکیبات آلی فرار در غلظتهای پایین تخصص یافته باشند. دوم، تمایز ایجاد شده بین بیماران و گروه کنترل، چه توسط سگهای آموزش ندیده و چه توسط گروه آموزش دیده سگها، نشان میدهد که تمایزات ظریف در ادراک بویایی به وضوح نشان داده شده و میتواند رفتار را هدایت کند. توانایی بویایی افزایش یافته ظاهری در سگها ممکن است منعکس کننده تعداد کمی بیشتر گیرندههای بو و/یا حاشیه بویایی نسبتاً بزرگتر باشد که امکان افزایش حساسیت را فراهم میکند، یا مدارهای تخصصی در پیاز بویایی، قشر پیریفورم یا سایر مناطق مغز که اهمیت شناختی را به محرکهای بویایی متمایز اختصاص میدهند. اینکه آیا این توانایی برای سگها اهمیت تطبیقی دارد یا صرفاً ترفند هوشمندانه نهایی برای حیوانات خانگی است، مشخص نیست.
Does this mean the term pet scan will soon take on a new meaning in clinical medicine? Clearly, the complexity of making critical diagnoses and the potential lack of reliability of dogs however well trained render routine use of diagnostic dogs difficult to imagine. Nevertheless, the remarkable olfactory capacity of these animals provides a starting point for an understanding of the molecular specificity of odorant receptors, as well as processing capacity and representations of olfactory information in the CNS. Such understanding may not only illuminate the functional characteristics of the olfactory system; it may provide a natural guide to specific molecules associated with disease states and the design of better diagnostic tools-or at least diagnoses that don’t rely on cold, wet noses.
آیا این بدان معناست که اصطلاح اسکن حیوانات خانگی به زودی معنای جدیدی در پزشکی بالینی پیدا خواهد کرد؟ واضح است که پیچیدگی تشخیصهای حیاتی و عدم قابلیت اطمینان بالقوه سگها هرچند به خوبی آموزش دیده باشند – تصور استفاده معمول از سگهای تشخیصی را دشوار میکند. با این وجود، ظرفیت بویایی قابل توجه این حیوانات نقطه شروعی برای درک ویژگی مولکولی گیرندههای بو و همچنین ظرفیت پردازش و نمایش اطلاعات بویایی در سیستم عصبی مرکزی (CNS) فراهم میکند. چنین درکی نه تنها میتواند ویژگیهای عملکردی سیستم بویایی را روشن کند، بلکه میتواند راهنمای طبیعی برای مولکولهای خاص مرتبط با حالات بیماری و طراحی ابزارهای تشخیصی بهتر – یا حداقل تشخیصهایی که به بینیهای سرد و مرطوب متکی نیستند – ارائه دهد.
Expression in ORNs has been confirmed for only a limited subset of the huge number of odorant receptor genes. Messenger RNAs for different odorant receptor genes are expressed in subsets of ORNs that occur in bilaterally symmetrical zones of olfactory epithelium. Additional evidence for restricted patterns of odorant receptor gene expression in spatially restricted subsets of ORNS comes from molecular genetic experiments (primarily in mice and fruit flies) in which reporter proteins such as B galactosidase or green fluorescent protein (GFP) are inserted into odorant receptor gene locus (Figure 15.9; see also Chapter 1 for a general summary of this approach). Genetic as well as cell biological analyses show that most mammalian ORNs express only one odorant receptor gene. Moreover, the mRNA that is translated to generate the single odorant receptor protein expressed in each ORN is apparently transcribed from only one of the two allelic copies of each odorant receptor gene in the genome (one allele from maternal chromosomes, one allele from paternal chromosomes). The mechanism of this allelic silencing is thought to reflect local chromatin confirmation changes in regions of the genome where odorant receptor genes are clustered. Local transcriptional feedback within each ORN reinforces the selection of one allele and the exclusion of the other so that this allelic choice is maintained. Remarkably, this allelic silencing must be maintained in all of the ORNs that are generated throughout the lifetime of all vertebrates. How the mechanism is established and maintained in the ORN progeny of stem cells resident in the OE remains unknown.
بیان در ORNها تنها برای زیرمجموعه محدودی از تعداد زیادی از ژنهای گیرنده بو تأیید شده است. RNAهای پیامرسان برای ژنهای گیرنده بو مختلف در زیرمجموعههایی از ORNها بیان میشوند که در مناطق متقارن دو طرفه اپیتلیوم بویایی وجود دارند. شواهد بیشتر برای الگوهای محدود بیان ژن گیرنده بو در زیرمجموعههای فضایی محدود ORNS از آزمایشهای ژنتیک مولکولی (عمدتاً در موشها و مگسهای میوه) حاصل میشود که در آنها پروتئینهای گزارشگر مانند B گالاکتوزیداز یا پروتئین فلورسنت سبز (GFP) به جایگاه ژن گیرنده بو وارد میشوند (شکل 15.9؛ همچنین برای خلاصهای کلی از این رویکرد به فصل 1 مراجعه کنید). تجزیه و تحلیلهای ژنتیکی و همچنین بیولوژیکی سلولی نشان میدهد که اکثر ORNهای پستانداران تنها یک ژن گیرنده بو را بیان میکنند. علاوه بر این، mRNAیی که برای تولید پروتئین گیرنده بو بیان شده در هر ORN ترجمه میشود، ظاهراً تنها از یکی از دو نسخه آللی هر ژن گیرنده بو در ژنوم رونویسی میشود (یک آلل از کروموزومهای مادری، یک آلل از کروموزومهای پدری). تصور میشود مکانیسم این خاموشی آللی، منعکس کننده تغییرات موضعی تأیید کروماتین در مناطقی از ژنوم است که ژنهای گیرنده بو در آن خوشهبندی شدهاند. بازخورد رونویسی موضعی در هر ORN، انتخاب یک آلل و حذف آلل دیگر را تقویت میکند تا این انتخاب آللی حفظ شود. نکته قابل توجه این است که این خاموشی آللی باید در تمام ORNهایی که در طول عمر همه مهرهداران تولید میشوند، حفظ شود. چگونگی ایجاد و حفظ این مکانیسم در فرزندان ORN سلولهای بنیادی ساکن در OE هنوز ناشناخته است.


FIGURE 15.9 Odorant receptor gene expression. (A) Individual ORNs labeled immunohistochemically with olfactory marker protein (OMP, green; OMP is selective for all ORNS) and the ORN specific adenylyl cyclase III (red) that is limited to olfactory cilia (inset). The labels are in register with the segregation of signal transduction components to this domain. (B) The distribution of OMP expressing ORNS throughout the entire nasal epithelium of an adult mouse, demonstrated with an OMP-GFP reporter transgene. The protuberances oriented diagonally from left to right represent individual turbinates in the olfactory epithelium. The remaining bony and soft-tissue structures of the nose have been dissected away. (C) The distribution of ORNs expressing the 17 odorant receptor. These cells are restricted to a distinct domain or zone in the epithelium. The inset shows that odorant receptor expressing cells are indeed ciliabearing ORNS. (D) ORNs expressing the M71 odorant receptor are limited to a zone that is completely distinct from that of the 17 receptor. (A courtesy of A.-S. LaMantia; B-D from Bozza et al., 2002.)
شکل ۱۵.۹ بیان ژن گیرنده بو. (الف) ORN های منفرد که به صورت ایمونوهیستوشیمی با پروتئین نشانگر بویایی (OMP، سبز؛ OMP برای همه ORNS ها انتخابی است) و آدنیلیل سیکلاز III اختصاصی ORN (قرمز) که محدود به مژک های بویایی است (تصویر داخل کادر). برچسبها با تفکیک اجزای انتقال سیگنال به این دامنه مطابقت دارند. (ب) توزیع OMP بیان کننده ORNS در سراسر اپیتلیوم بینی یک موش بالغ، که با یک ترانس ژن گزارشگر OMP-GFP نشان داده شده است. برآمدگیهایی که به صورت مورب از چپ به راست جهت گیری شدهاند، نشان دهنده شاخکهای منفرد در اپیتلیوم بویایی هستند. ساختارهای استخوانی و بافت نرم باقی مانده بینی جدا شده اند. (ج) توزیع ORN های بیان کننده گیرنده بو. این سلولها به یک دامنه یا ناحیه مشخص در اپیتلیوم محدود شدهاند. تصویر داخل کادر نشان میدهد که سلولهای بیان کننده گیرنده بو در واقع ORNS دارای مژک هستند. (د) ORN های بیان کننده گیرنده بویایی M71 محدود به ناحیه ای هستند که کاملاً از ناحیه گیرنده 17 متمایز است. (با احترام از A.-S. LaMantia؛ B-D از Bozza و همکاران، 2002.)
Different odors activate molecularly and spatially distinct subsets of ORNs. Furthermore, because only one of the two copies of each odorant receptor gene is expressed in any particular receptor neuron, one of the two alleles for each gene must be silenced in each ORN. Thus, molecular diversity, along with the complex genomic regulation of odorant receptors and the resulting cellular diversity for ORNs, certainly mediates the capacity of olfactory systems to detect and encode a wide range of complex and novel odors in the environment.
بوهای مختلف، زیرمجموعههای مولکولی و فضایی متمایزی از ORNها را فعال میکنند. علاوه بر این، از آنجا که تنها یکی از دو نسخه از هر ژن گیرنده بو در هر نورون گیرنده خاص بیان میشود، یکی از دو آلل برای هر ژن باید در هر ORN خاموش شود. بنابراین، تنوع مولکولی، همراه با تنظیم ژنومی پیچیده گیرندههای بو و تنوع سلولی حاصل برای ORNها، قطعاً واسطه ظرفیت سیستمهای بویایی برای تشخیص و رمزگذاری طیف وسیعی از بوهای پیچیده و جدید در محیط است.
Molecular and Physiological Mechanisms of Olfactory Odor Transduction
Once an odorant is bound to an odor receptor protein, several additional steps are required to generate a receptor potential that converts chemical information into electrical signals that can be interpreted by the brain. In mammals, the principal pathway for generating electrical activity in olfactory receptors involves cyclic nucleotide gated ion channels similar to those found in rod photoreceptors (see Chapter 11). The ORNs express an olfactory specific heterotrimeric G-protein, Golf, whose a subunit dissociates upon odorant binding to receptor proteins and then activates adenylyl cyclase III (ACIII), an olfactory specific adenylate cyclase (Figure 15.10A). Both of these proteins are restricted to the olfactory knob and cilia, consistent with the idea that odor transduction occurs in these domains of the ORN (see Figure 15.6A). Stimulation of odorant receptor molecules leads to an increase in cyclic AMP (CAMP), which opens cyclic nucleotide gated channels that permit the entry of Nat and Ca2+ (mostly Ca2+), thus depolarizing the neuron. This depolarization, amplified by a Ca2+ activated Cl– current, is conducted passively from the cilia to the axon hillock region of the ORN, where action potentials are generated via voltage regulated Na+ channels and transmitted to the olfactory bulb.
مکانیسمهای مولکولی و فیزیولوژیکی انتقال بو از طریق حس بویایی
هنگامی که یک مادهی بوزا به یک پروتئین گیرندهی بو متصل میشود، چندین مرحلهی اضافی برای تولید پتانسیل گیرندهای که اطلاعات شیمیایی را به سیگنالهای الکتریکی قابل تفسیر توسط مغز تبدیل میکند، مورد نیاز است. در پستانداران، مسیر اصلی برای تولید فعالیت الکتریکی در گیرندههای بویایی شامل کانالهای یونی دریچهدار نوکلئوتیدی حلقوی مشابه کانالهای موجود در گیرندههای نوری میلهای است (به فصل 11 مراجعه کنید). ORNها یک پروتئین G هتروتریمری مخصوص بویایی، گلف، را بیان میکنند که زیر واحد a آن پس از اتصال مادهی بوزا به پروتئینهای گیرنده جدا میشود و سپس آدنیلیل سیکلاز (ACIII) III ، یک آدنیلات سیکلاز مخصوص بویایی را فعال میکند (شکل 15.10A). هر دوی این پروتئینها به گره بویایی و مژکها محدود شدهاند، که با این ایده که انتقال بو در این حوزههای ORN رخ میدهد، سازگار است (به شکل 15.6A مراجعه کنید). تحریک مولکولهای گیرنده بو منجر به افزایش AMP حلقوی (CAMP) میشود که کانالهای دریچهدار نوکلئوتیدی حلقوی را باز میکند که اجازه ورود Nat و +Ca2 (عمدتاً +Ca2) را میدهند و در نتیجه نورون را دپلاریزه میکنند. این دپلاریزاسیون، که توسط جریان Cl- فعال شده توسط +Ca2 تقویت میشود، به صورت غیرفعال از مژکها به ناحیه تپه آکسون ORN هدایت میشود، جایی که پتانسیلهای عمل از طریق کانالهای +Na تنظیمشده با ولتاژ تولید شده و به پیاز بویایی منتقل میشوند.
There are also distinct signaling mechanisms for repolarization, recovery, and adaptation in response to odorants.
همچنین مکانیسمهای سیگنالدهی متمایزی برای رپلاریزاسیون، بازیابی و سازگاری در پاسخ به بوها وجود دارد.

FIGURE 15.10 Molecular mechanisms of odorant transduction. (A) Odorants in the mucus bind directly (or are shuttled via odorant binding proteins) to one of many receptor molecules located in the membranes of the cilia. This association activates an odorant-specific G-protein (Golt) that, in turn, activates an adenylate cyclase (ACIII), resulting in the generation of cyclic AMP (CAMP). One target of cAMP is a cationselective channel that, when open, permits the influx of Nat and Ca2+ into the cilia, resulting in depolarization. The ensuing increase in intracellular Ca2+ opens Ca2+ gated Cl- channels that provide most of the depolarization of the olfactory receptor potential. The receptor potential is reduced in magnitude when cAMP is broken down by specific phosphodiesterases to reduce its concentration. At the same time, Ca2+ complexes with calmodulin (Ca2+ CAM) and binds to the channel, reducing its affinity for CAMP. Finally, Ca2+ is extruded through the Ca2+/Na+ exchange pathway. (B) Consequences of inactivation of critical molecules in the odorant signal transduction cascade. The images of ORNs show expression of Golf ACIII, and the cyclic nucleotide gated channel. The traces below show odorant elicited electrical activity in the olfactory epithelium, measured extracellularly using the electro olfactogram (EOG). In the wild type, a robust response results when either pleasant (citralva) or pungent (isomenthone) odors are presented. Inactivating any of the major signal transduction molecules linked to the 7 transmembrane odorant receptors abolishes these responses. (A after Menini, 1999; B from Wong et al., 2000 [wild type OMP]: Belluscio et al., 1998 [Golf]: courtesy of A.-S. LaMantia [ASCII]; Brunet et al., 1996 [cyclic nucleotide gated channel].)
شکل ۱۵.۱۰ مکانیسمهای مولکولی انتقال بو. (الف) بوهای موجود در مخاط مستقیماً به یکی از مولکولهای گیرنده متعدد واقع در غشای مژکها متصل میشوند (یا از طریق پروتئینهای اتصال دهنده بو منتقل میشوند). این ارتباط یک پروتئین G مخصوص بو (Golt) را فعال میکند که به نوبه خود، یک آدنیلات سیکلاز (ACIII) را فعال میکند و منجر به تولید AMP حلقوی (CAMP) میشود. یکی از اهداف cAMP یک کانال کاتیونگزین است که وقتی باز میشود، اجازه ورود Nat و +Ca2 را به مژکها میدهد و منجر به دپلاریزاسیون میشود. افزایش متعاقب +Ca2 درون سلولی، کانالهای Cl- دریچهدار +Ca2 را باز میکند که بیشتر دپلاریزاسیون پتانسیل گیرنده بویایی را فراهم میکنند. پتانسیل گیرنده هنگامی که cAMP توسط فسفودیاسترازهای خاص تجزیه میشود تا غلظت آن کاهش یابد، کاهش مییابد. همزمان،+Ca2 با کالمودولین (Ca2+ CAM) کمپلکس تشکیل میدهد و به کانال متصل میشود و میل ترکیبی آن را با CAMP کاهش میدهد. در نهایت، +Ca2 از طریق مسیر تبادل +Ca2+/Na خارج میشود. (ب) پیامدهای غیرفعال شدن مولکولهای حیاتی در آبشار انتقال سیگنال بو. تصاویر ORNها بیان Golf ACIII و کانال دریچهدار نوکلئوتیدی حلقوی را نشان میدهند. ردپاهای زیر فعالیت الکتریکی ناشی از بو را در اپیتلیوم بویایی نشان میدهند که به صورت خارج سلولی با استفاده از الکتروالفکتوگرام (EOG) اندازهگیری میشود. در نوع وحشی، هنگامی که بوهای دلپذیر (سیترالوا) یا تند (ایزومنتون) ارائه میشوند، پاسخ قوی ایجاد میشود. غیرفعال کردن هر یک از مولکولهای اصلی انتقال سیگنال مرتبط با 7 گیرنده بویایی غشایی، این پاسخها را از بین میبرد. (الف برگرفته از منینی، ۱۹۹۹؛ ب برگرفته از وانگ و همکاران، ۲۰۰۰ [OMP نوع وحشی]: بلوسکیو و همکاران، ۱۹۹۸ [گلف]: با احترام از آ.-س. لامانتیا [ASCII]؛ برونت و همکاران، ۱۹۹۶ [کانال دریچهدار نوکلئوتید حلقوی].)
Most of these mechanisms reflect concurrent increases in Ca2+ and activation of calcium/calmodulin dependent kinase II. In response to elevated Ca2+, an Na+/Ca2+ exchanger extrudes Ca2+ and transports Na+ to repolarize the membrane. Recovery relies on calcium/calmodulin kinase II mediated mechanisms that restore the heterotrimeric Golf and diminish cAMP levels via activation of phosphodiesterases. Finally, adaptation relies on cAMP regulated phosphorylation of intracellular domains of the odorant receptor proteins, as well as engagement of ẞ arrestin (which serves a similar role in photoreceptor adaptation) to modify receptor sensitivity. These mechanisms for adaptation likely play a role in perceived changes in sensitivity to smells, such as initially noticing, but later not sensing, the smell of cigarette smoke in a “smoking” hotel room.
بیشتر این مکانیسمها نشاندهنده افزایش همزمان +Ca2 و فعال شدن کیناز II وابسته به کلسیم/کالمودولین هستند. در پاسخ به افزایش +Ca2، یک مبدل +Na+/Ca2+، Ca2 را خارج کرده و +Na را برای رپلاریزه کردن غشاء منتقل میکند. بازیابی به مکانیسمهای واسطهشده توسط کلسیم/کالمودولین کیناز II متکی است که Golf هتروتریمری را بازیابی کرده و سطح cAMP را از طریق فعالسازی فسفودیاسترازها کاهش میدهند. در نهایت، سازگاری به فسفوریلاسیون تنظیمشده توسط cAMP دامنههای درون سلولی پروتئینهای گیرنده بو و همچنین دخالت ẞ arrestin (که نقش مشابهی در سازگاری گیرنده نوری ایفا میکند) برای تغییر حساسیت گیرنده متکی است. این مکانیسمهای سازگاری احتمالاً در تغییرات درکشده در حساسیت به بوها، مانند توجه اولیه به بوی دود سیگار در یک اتاق هتل “سیگاری” اما عدم حس آن در مراحل بعدی، نقش دارند.
In genetically engineered mice, inactivation of any one of the major signal transduction elements associated with G-protein-coupled oderant receptors (Golf ACIII, or the cyclic nucleotide gated channel) results in a loss of receptor response to odorants in ORNs neurons that otherwise appear normal in these animals (Figure 15.10B). There is also complete loss of behavioral response to most odorants; in other words, the mice are anosmic. This common end point following loss of function of each molecule demonstrates that each signaling stepreceptor mediated G-protein activation, adenylyl cyclase mediated elevation of cAMP levels, and Ca2+ mediated activation of the cyclic nucleotide gated channel contributes to the transduction of odorants. Nevertheless, in mice a few ORNs may use a different G-protein mediated transduction pathway, perhaps explaining some residual chemosensory function following inactivation of Golf ACIII, or the cyclic nucleotide gated channel. These ORNs, however, represent a small portion of the full complement of chemosensory neurons. Moreover, in invertebrates (including Drosophila), some odorant receptors may act as ion channels, directly influencing depolarization (and thus odor transduction) without activating G-proteins. Thus, although the overall molecular structure of odorant receptor proteins has been conserved, these proteins function in diverse ways in different species.
در موشهای مهندسی ژنتیک شده، غیرفعال شدن هر یک از عناصر اصلی انتقال سیگنال مرتبط با گیرندههای بویایی متصل به پروتئین G (Golf ACIII یا کانال دروازهای نوکلئوتید حلقوی) منجر به از دست دادن پاسخ گیرنده به بوها در نورونهای ORN میشود که در غیر این صورت در این حیوانات طبیعی به نظر میرسند (شکل 15.10B). همچنین از دست دادن کامل پاسخ رفتاری به اکثر بوها وجود دارد. به عبارت دیگر، موشها آنوسمیک هستند. این نقطه پایانی مشترک پس از از دست دادن عملکرد هر مولکول نشان میدهد که هر فعالسازی پروتئین G با واسطه گیرنده مرحلهای سیگنالینگ، افزایش سطح cAMP با واسطه آدنیلیل سیکلاز و فعالسازی +Ca2 کانال دروازهای نوکلئوتید حلقوی در انتقال بوها نقش دارند. با این وجود، در موشها، تعداد کمی از ORNها ممکن است از یک مسیر انتقال با واسطه پروتئین G متفاوت استفاده کنند، که شاید برخی از عملکردهای شیمیایی-حسی باقی مانده پس از غیرفعال شدن Golf ACIII یا کانال دروازهای نوکلئوتید حلقوی را توضیح دهد. با این حال، این ORNها بخش کوچکی از کل نورونهای شیمیایی-حسی را تشکیل میدهند. علاوه بر این، در بیمهرگان (از جمله دروزوفیلا)، برخی از گیرندههای بو ممکن است به عنوان کانالهای یونی عمل کنند و مستقیماً بر دپلاریزاسیون (و در نتیجه انتقال بو) بدون فعال کردن پروتئینهای G تأثیر بگذارند. بنابراین، اگرچه ساختار مولکولی کلی پروتئینهای گیرنده بو حفظ شده است، اما این پروتئینها در گونههای مختلف به روشهای متنوعی عمل میکنند.

FIGURE 15.11 Responses of receptor neurons to selected odorants. Neuron 1 responds similarly to three different odorants. In contrast, neuron 2 responds to only one of these odorants. Neuron 3 responds to two of the three odorants. The responses of these receptor neurons were recorded by whole cell patch clamp recording (see Box 4A); downward deflections represent inward cur- rents measured at a holding potential of -55 mV. (From Firestein et al., 1992.)
شکل ۱۵.۱۱ پاسخ نورونهای گیرنده به بوهای انتخابشده. نورون ۱ به طور مشابه به سه بو مختلف پاسخ میدهد. در مقابل، نورون ۲ فقط به یکی از این بوها پاسخ میدهد. نورون ۳ به دو مورد از سه بو پاسخ میدهد. پاسخهای این نورونهای گیرنده با استفاده از ضبط گیره وصلهای تمام سلول ثبت شد (به کادر ۴A مراجعه کنید)؛ انحرافهای رو به پایین نشان دهنده جریانهای رو به داخل هستند که در پتانسیل نگهداری -۵۵ میلیولت اندازهگیری شدهاند. (از فایرستین و همکاران، ۱۹۹۲)
Like other sensory receptor cells, individual ORNs are sensitive to subsets of stimuli-that is, there is receptor specificity. Some ORNs exhibit marked selectivity to a single chemically defined odorant. Several different odorant molecules, however, may activate other ORNS (Figure 15.11). Presumably, these differences in odorant sensitivity parallel the expression of a single odorant receptor gene in each ORN. Thus, some receptor proteins must have fairly high affinity for some odorants, while others are less selective. Currently, no chemical or physiological data indicate a correspondence between high-affinity binding of an odorant to an odorant receptor molecule, electrical activation of the ORN, and perception of a specific odor in mammals. Indeed, most randomly selected single ORNs have broadly tuned responses to a variety of odorants (Figure 15.12A). Nevertheless, genetic labeling studies have demonstrated that consistent relationships exist between classes of odorants and the responses they elicit in individual cells isolated from olfactory epithelium. Response specificity reflects chemical differences in subsets of odorant mixtures (defined by differences in carbon chain length of the molecular “backbone” of an odorant). These responses can be fairly broad (for example, a single ORN responds relatively well to several different mixtures; see Figure 15.12A). If, however, an ORN that expresses a single odorant receptor protein that binds an identified ligand is isolated (for example, the M71 odorant receptor, which is known to bind acetophenone and benzaldehyde; Figure 15.12B), it responds specifically to the mixture that includes that odorants. It is not known, however, whether any of these odorant molecules represent the “best” (i.e., highest affinity) or most environmentally relevant odor- ants for any given receptor protein.
مانند سایر سلولهای گیرنده حسی، ORN های منفرد به زیرمجموعههایی از محرکها حساس هستند – یعنی اختصاصی بودن گیرنده وجود دارد. برخی از ORN ها گزینشپذیری قابل توجهی نسبت به یک ماده معطر شیمیایی مشخص نشان میدهند. با این حال، چندین مولکول معطر مختلف ممکن است ORNS های دیگر را فعال کنند (شکل 15.11). احتمالاً، این تفاوتها در حساسیت به بو، با بیان یک ژن گیرنده معطر در هر ORN موازی است. بنابراین، برخی از پروتئینهای گیرنده باید میل ترکیبی نسبتاً بالایی برای برخی از بوها داشته باشند، در حالی که برخی دیگر کمتر انتخابی هستند. در حال حاضر، هیچ داده شیمیایی یا فیزیولوژیکی نشاندهنده تطابق بین اتصال با میل ترکیبی بالا یک ماده معطر به یک مولکول گیرنده معطر، فعالسازی الکتریکی ORN و درک یک بوی خاص در پستانداران نیست. در واقع، اکثر ORN های منفرد که به صورت تصادفی انتخاب شدهاند، پاسخهای تنظیمشده گستردهای به انواع بوها دارند (شکل 15.12A). با این وجود، مطالعات برچسبگذاری ژنتیکی نشان دادهاند که روابط پایداری بین طبقات بوها و پاسخهایی که در سلولهای منفرد جدا شده از اپیتلیوم بویایی ایجاد میکنند، وجود دارد. ویژگی پاسخ، تفاوتهای شیمیایی در زیرمجموعههای مخلوطهای بودار را نشان میدهد (که با تفاوت در طول زنجیره کربنی «ستون فقرات» مولکولی یک بودار تعریف میشود). این پاسخها میتوانند نسبتاً گسترده باشند (برای مثال، یک ORN واحد به چندین مخلوط مختلف نسبتاً خوب پاسخ میدهد؛ به شکل 15.12A مراجعه کنید). با این حال، اگر یک ORN که یک پروتئین گیرنده بودار واحد را بیان میکند که به یک لیگاند مشخص متصل میشود، جدا شود (برای مثال، گیرنده بودار M71، که به استوفنون و بنزآلدئید متصل میشود؛ شکل 15.12B)، به طور خاص به مخلوطی که شامل آن بودارها است، پاسخ میدهد. با این حال، مشخص نیست که آیا هیچ یک از این مولکولهای بودار، «بهترین» (یعنی بالاترین میل ترکیبی) یا سازگارترین بودارها با محیط را برای هر پروتئین گیرنده مشخص نشان میدهند یا خیر.
FIGURE 15.12 Odorant receptor neuron selectivity. Odorant receptor neurons (ORNS) were isolated and tested for their responses to six different odorant molecule mixtures (indicated here as A-F). KCI was used as a control to demonstrate the capacity of the cell to generate an action potential. The size of the dots and magnitude of the spikes in the graphs indicate the strength of the electrical response to each odorant mixture. (A) Randomly chosen ORNs responded to several of the six mixtures. (B) The M71R-expressing cell was isolated by linking its gene to green fluorescent protein. M71-selected ORNS responded preferentially only to mixture F. (Graphs after Bozza et al., 2002; A micrograph from Bozza and Kauer, 1998; B micrograph courtesy of T. Bozza.)
شکل ۱۵.۱۲ گزینشپذیری نورون گیرنده بو. نورونهای گیرنده بو (ORNS) جدا شده و برای پاسخهایشان به شش مخلوط مولکول بو مختلف (که در اینجا با A-F نشان داده شدهاند) آزمایش شدند. از KCI به عنوان کنترل برای نشان دادن ظرفیت سلول در تولید پتانسیل عمل استفاده شد. اندازه نقاط و بزرگی پیکها در نمودارها، قدرت پاسخ الکتریکی به هر مخلوط بو را نشان میدهد. (الف) ORNهای تصادفی انتخاب شده به چندین مورد از شش مخلوط پاسخ دادند. (ب) سلول بیانکننده M71R با اتصال ژن آن به پروتئین فلورسنت سبز جدا شد. ORNSهای انتخاب شده توسط M71 ترجیحاً فقط به مخلوط F پاسخ دادند. (نمودارها از Bozza و همکاران، ۲۰۰۲؛ میکروگراف از Bozza و Kauer، ۱۹۹۸؛ میکروگراف B با حسن نیت از T. Bozza.)
The Olfactory Bulb
The transduction of odorants in the olfactory cilia and the subsequent changes in electrical activity in the ORN are only the first steps in olfactory information processing. Unlike other primary sensory receptor cells (e.g., photoreceptors in the retina or hair cells in the cochlea), ORNs have axons, and these axons relay odorant information directly to the rest of the brain via action potentials. As the axons leave the olfactory epithelium, they coalesce to form a large number of bundles that together make up the olfactory nerve (cranial nerve I). Each olfactory nerve projects ipsilaterally to the olfactory bulb, which in humans lies on the ventral anterior aspect of the ipsilateral cerebral hemisphere. The most distinctive feature of the olfactory bulb is the array of glomeruli more or less spherical accumulations of neuropil 100 to 200 μm in diameter. Glomeruli lie just beneath the surface of the bulb and are the synaptic target of the primary olfactory axons (Figure 15.13). In vertebrates, ORN axons make excitatory glutamatergic synapses within the glomeruli. Remarkably, this relation- ship between the olfactory periphery (the nose, or insect antennae that is, the structures where ORNs are found) and glomeruli in the CNS is maintained across the animal kingdom (see Figure 15.13A, inset).
پیاز بویایی
انتقال بوها در مژکهای بویایی و تغییرات بعدی در فعالیت الکتریکی در ORN تنها اولین مراحل پردازش اطلاعات بویایی هستند. برخلاف سایر سلولهای گیرنده حسی اولیه (مثلاً گیرندههای نوری در شبکیه یا سلولهای مویی در حلزون گوش)، ORNها آکسون دارند و این آکسونها اطلاعات بو را مستقیماً از طریق پتانسیلهای عمل به بقیه مغز منتقل میکنند. هنگامی که آکسونها از اپیتلیوم بویایی خارج میشوند، به هم میپیوندند و تعداد زیادی دسته تشکیل میدهند که با هم عصب بویایی (عصب جمجمهای I) را تشکیل میدهند. هر عصب بویایی به صورت همسو به پیاز بویایی، که در انسان در قسمت قدامی شکمی نیمکره مغزی همسو قرار دارد، متصل میشود. متمایزترین ویژگی پیاز بویایی، آرایهای از گلومرولها با تجمع کم و بیش کروی نوروپیل با قطر ۱۰۰ تا ۲۰۰ میکرومتر است. گلومرولها درست زیر سطح پیاز بویایی قرار دارند و هدف سیناپسی آکسونهای بویایی اولیه هستند (شکل ۱۵.۱۳). در مهرهداران، آکسونهای ORN سیناپسهای گلوتاماترژیک تحریکی را در داخل گلومرولها ایجاد میکنند. نکته قابل توجه این است که این رابطه بین حاشیه بویایی (بینی یا شاخکهای حشرات، یعنی ساختارهایی که ORNها در آنها یافت میشوند) و گلومرولها در سیستم عصبی مرکزی در سراسر قلمرو حیوانات حفظ میشود (به شکل ۱۵.۱۳A، تصویر داخل کادر مراجعه کنید).
In mammals, including humans, within each glomerulus the axons of the receptor neurons contact apical dendrites of mitral cells, which are the principal projection neurons of the olfactory bulb. The cell bodies of the mitral cells are located in a distinct layer of the olfactory bulb deep within the glomeruli. A mitral cell extends its primary dendrite into a single glomerulus, where the dendrite gives rise to an elaborate tuft of branches onto which the axons of ORNs synapse (see Figure 15.13B,D). In the mouse, in which glomerular connectivity has been studied quantitatively, each glomerulus includes the apical dendrites of approximately 25 mitral cells, which in turn receive input from approximately 25,000 olfactory receptor axons. Remarkably, most if not all 25,000 of these axons come from ORNs that express the same, single odorant receptor gene (see Figure 15.13E). This degree of convergence presumably increases the sensitivity of mitral cells to ensure maximum fidelity of odor detection. It may also maximize the signal strength from the convergent olfactory receptor neuron input by averaging out uncorrelated “background” noise. Each glomerulus also includes dendritic processes from two other classes of local circuit neurons: Approximately 50 tufted cells and 25 periglomerular cells contribute to each glomerulus (see Figure 15.13D). Although it is generally assumed that these neurons sharpen the sensitivity of individual glomeruli to specific odorants, their function is unclear.
در پستانداران، از جمله انسان، درون هر گلومرول، آکسونهای نورونهای گیرنده با دندریتهای رأسی سلولهای میترال، که نورونهای اصلی برآمدگی پیاز بویایی هستند، تماس پیدا میکنند. اجسام سلولی سلولهای میترال در یک لایه مجزا از پیاز بویایی در اعماق گلومرولها قرار دارند. یک سلول میترال، دندریت اولیه خود را به یک گلومرول واحد گسترش میدهد، جایی که دندریت به یک دسته شاخههای پیچیده تبدیل میشود که آکسونهای ORNها روی آنها سیناپس برقرار میکنند (شکل 15.13B، D را ببینید). در موش، که در آن اتصال گلومرولی به صورت کمی مورد مطالعه قرار گرفته است، هر گلومرول شامل دندریتهای رأسی تقریباً 25 سلول میترال است که به نوبه خود از تقریباً 25000 آکسون گیرنده بویایی ورودی دریافت میکنند. نکته قابل توجه این است که اگر نگوییم همه، اما بیشتر این ۲۵۰۰۰ آکسون از ORNهایی میآیند که ژن گیرنده بویایی یکسانی را بیان میکنند (شکل ۱۵.۱۳E را ببینید). این درجه از همگرایی احتمالاً حساسیت سلولهای میترال را افزایش میدهد تا حداکثر دقت در تشخیص بو را تضمین کند. همچنین ممکن است با میانگینگیری از نویز «زمینه» ناهمبسته، قدرت سیگنال ورودی نورون گیرنده بویایی همگرا را به حداکثر برساند. هر گلومرول همچنین شامل زوائد دندریتی از دو دسته دیگر از نورونهای مدار موضعی است: تقریباً ۵۰ سلول تافتدار و ۲۵ سلول پریگلومرولی در هر گلومرول نقش دارند (شکل ۱۵.۱۳D را ببینید). اگرچه عموماً فرض میشود که این نورونها حساسیت گلومرولهای منفرد را به بوهای خاص تشدید میکنند، اما عملکرد آنها مشخص نیست.

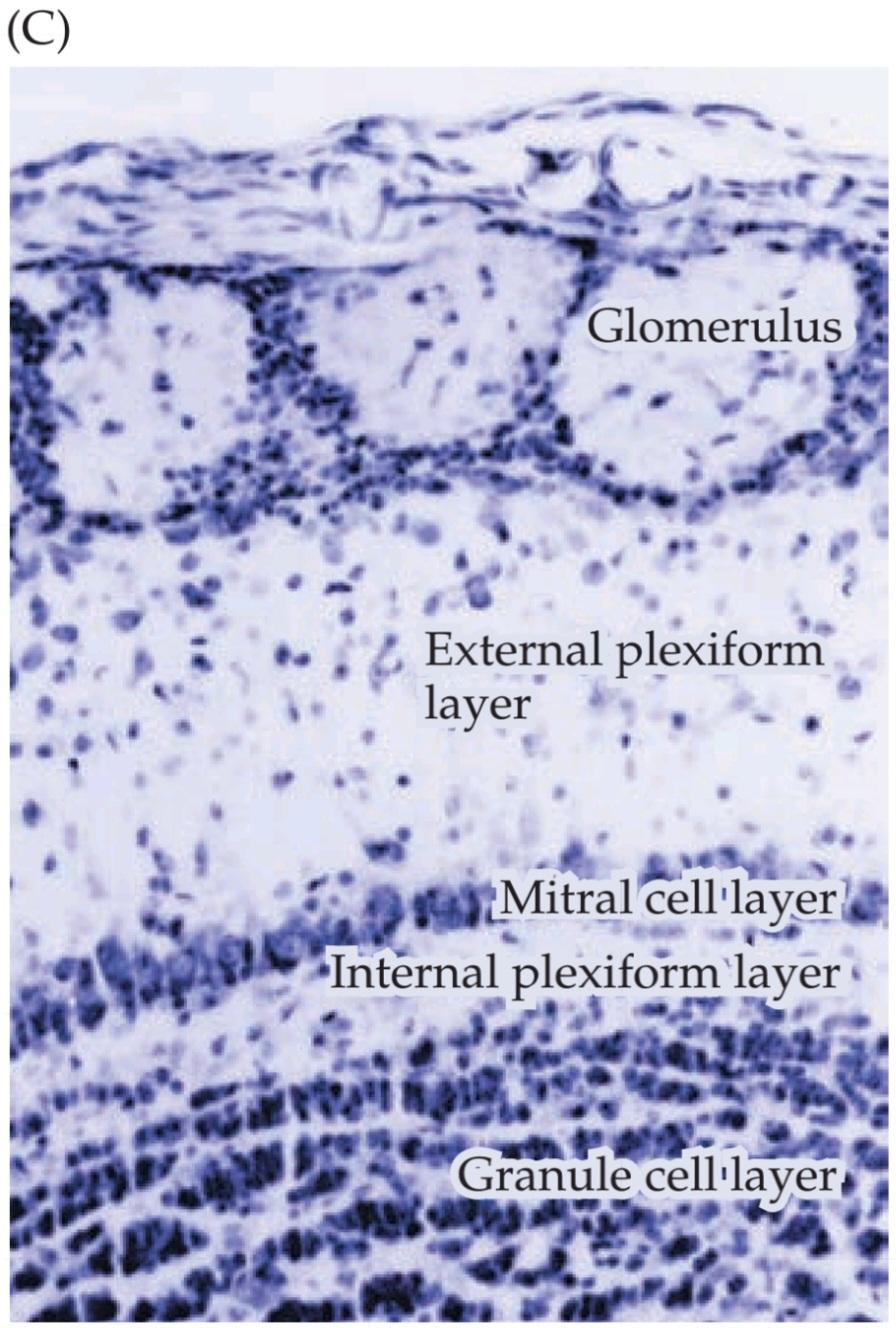

FIGURE 15.13 Organization of the mammalian olfactory ► bulb. (A) When the bulb is viewed from its dorsal surface (visualized here in a living mouse in which the overlying bone has been removed), olfactory glomeruli can be seen. The dense accumulation of dendrites and synapses that constitutes glomeruli are stained here with a vital fluorescent dye that recognizes neuronal processes. The inset shows a similar arrangement of glomeruli in the mushroom body (the equivalent of the olfactory bulb) in Drosophila. (B) Among the major neuronal components of each glomerulus are the apical tufts of mitral cells, which project to the pyriform cortex and other bulb targets (see Figure 15.1C). In this image of a coronal section through the bulb, the mitral cells have been labeled retrogradely by placing the lipophilic tracer Di-l in the lateral olfactory tract. (C) The cellular structure of the olfactory bulb, shown in a Nissl stained coronal section. The five layers of the bulb are indicated. The glomerular layer includes the tufts of mitral cells, the axon terminals of ORNs, and periglomerular cells that define the margins of each glomerulus. The external plexiform layer is made up of lateral dendrites of mitral cells, cell bodies and lateral dendrites of tufted cells, and dendrites of granule cells that make dendrodendritic synapses with the other dendritic elements. The mitral cell layer is defined by the cell bodies of mitral cells, and mitral cell axons are found in the internal plexiform layer. Finally, granule cell bodies are densely packed into the granule cell layer. (D) Laminar and circuit organization of the olfactory bulb, shown diagrammatically in a cutaway view from its medial surface. Olfactory receptor cell axons synapse with mitral cell apical dendritic tufts and periglomerular cell processes within glomeruli. Granule cells and mitral cell lateral dendrites constitute the major synaptic elements of the external plexiform layer. (E) Axons from ORNS that express a particular odorant receptor gene converge on a small subset of bilaterally symmetrical glomeruli. These glomeruli, indicated in the boxed area in the upper panel, are shown at higher magnification in the lower panel. The projections from the olfactory epithelium have been labeled by a reporter transgene inserted by homologous recombination (“knocked in”) into the genetic locus that encodes the particular receptor. (A courtesy of D. Purves and A.-S. La Mantia; inset from Wang et al., 2003; B from Blanchart et al., 2006; C from Pomeroy et al., 1990; E from Mombaerts et al., 1996; inset from Tadenev et al., 2011.)
شکل ۱۵.۱۳ سازماندهی پیاز بویایی پستانداران. (الف) وقتی پیاز از سطح پشتی آن مشاهده شود (در اینجا در یک موش زنده که استخوان روی آن برداشته شده است، تجسم شده است)، گلومرولهای بویایی قابل مشاهده هستند. تجمع متراکم دندریتها و سیناپسها که گلومرولها را تشکیل میدهند، در اینجا با یک رنگ فلورسنت حیاتی که فرآیندهای عصبی را تشخیص میدهد، رنگآمیزی شدهاند. تصویر داخل کادر، چیدمان مشابهی از گلومرولها را در بدن قارچ (معادل پیاز بویایی) در دروزوفیلا نشان میدهد. (ب) در میان اجزای اصلی عصبی هر گلومرول، دستههای رأسی سلولهای میترال وجود دارند که به قشر پیریفورم و سایر اهداف پیاز امتداد مییابند (شکل ۱۵.۱C را ببینید). در این تصویر از یک برش تاجی از پیاز، سلولهای میترال با قرار دادن ردیاب لیپوفیل Di-l در دستگاه بویایی جانبی، به صورت رتروگراد برچسبگذاری شدهاند. (ج) ساختار سلولی پیاز بویایی، که در برش تاجی رنگآمیزی شده با نیسل نشان داده شده است. پنج لایه پیاز نشان داده شده است. لایه گلومرولی شامل دستههای سلولهای میترال، پایانههای آکسون ORNها و سلولهای پریگلومرولی است که حاشیه هر گلومرول را مشخص میکنند. لایه شبکهای خارجی از دندریتهای جانبی سلولهای میترال، اجسام سلولی و دندریتهای جانبی سلولهای تافتدار و دندریتهای سلولهای گرانولی که سیناپسهای دندرودندریتیک با سایر عناصر دندریتی میسازند، تشکیل شده است. لایه سلول میترال توسط اجسام سلولی سلولهای میترال تعریف میشود و آکسونهای سلولهای میترال در لایه شبکهای داخلی یافت میشوند. در نهایت، اجسام سلولی گرانولی به طور متراکم در لایه سلول گرانولی قرار گرفتهاند. (د) سازماندهی لایهای و مداری پیاز بویایی، که به صورت نموداری در نمای برش خورده از سطح داخلی آن نشان داده شده است. آکسونهای سلول گیرنده بویایی با تافتهای دندریتیک رأسی سلول میترال و زوائد سلولی پریگلومرولی درون گلومرولها سیناپس برقرار میکنند. سلولهای گرانول و دندریتهای جانبی سلول میترال، عناصر سیناپسی اصلی لایه شبکهای خارجی را تشکیل میدهند. (E) آکسونهای ORNS که یک ژن گیرنده بویایی خاص را بیان میکنند، در زیرمجموعه کوچکی از گلومرولهای متقارن دو طرفه همگرا میشوند. این گلومرولها که در ناحیه کادربندی شده در پنل بالایی نشان داده شدهاند، در پنل پایینی با بزرگنمایی بالاتر نشان داده شدهاند. برآمدگیهای اپیتلیوم بویایی توسط یک ترانسژن گزارشگر که توسط نوترکیبی همولوگ (“knocked”) در جایگاه ژنتیکی که گیرنده خاص را رمزگذاری میکند، وارد شده است، برچسبگذاری شدهاند. (با احترام از D. Purves و A.-S. La Mantia؛ تصویر از Wang و همکاران، ۲۰۰۳؛ تصویر از Blanchart و همکاران، ۲۰۰۶؛ تصویر از Pomeroy و همکاران، ۱۹۹۰؛ تصویر از Mombaerts و همکاران، ۱۹۹۶؛ تصویر از Tadenev و همکاران، ۲۰۱۱)
Finally, granule cells, which constitute the innermost layer of the vertebrate olfactory bulb, synapse primarily on the basal dendrites of mitral cells in the external plexiform layer (see Figure 15.13C,D). Granule cells lack an identifiable axon, and instead make reciprocal dendrodendritic synapses with mitral cells. Granule cells arethought to establish local lateral inhibitory circuits with mitral cells as well as participating in synaptic plasticity in the olfactory bulb. Olfactory granule cells and periglomerular cells are among the few classes of neurons in the forebrain that can be replaced throughout life in some mammals (see Chapter 26). In humans, however, the available evidence suggests that these cells are not lost and regenerated in adulthood.
در نهایت، سلولهای گرانولی که داخلیترین لایه پیاز بویایی مهرهداران را تشکیل میدهند، عمدتاً روی دندریتهای قاعدهای سلولهای میترال در لایه شبکهای خارجی سیناپس برقرار میکنند (شکل 15.13C، D را ببینید). سلولهای گرانولی فاقد آکسون قابل شناسایی هستند و در عوض سیناپسهای دندرودندریتیک متقابل با سلولهای میترال میسازند. تصور میشود که سلولهای گرانولی مدارهای مهاری جانبی موضعی را با سلولهای میترال ایجاد میکنند و همچنین در انعطافپذیری سیناپسی در پیاز بویایی شرکت میکنند. سلولهای گرانولی بویایی و سلولهای پریگلومرولی از معدود دستههای نورونها در مغز پیشین هستند که میتوانند در طول زندگی در برخی از پستانداران جایگزین شوند (به فصل 26 مراجعه کنید). با این حال، در انسان، شواهد موجود نشان میدهد که این سلولها در بزرگسالی از بین نمیروند و بازسازی میشوند.
The relationship between ORNs expressing one odorant receptor and small subsets of glomeruli (see Figure 15.13E) suggests that individual glomeruli respond specifically (or at least selectively) to distinct odorants. The selective (but not singular) responses of subsets of glomeruli to particular odorants have been confirmed physiologically in invertebrates such as Drosophila, as well as in mice, using single and multiunit recordings, metabolic mapping, voltage sensitive dyes, genetically encoded sensors of electrical activity, or intrinsic signals that depend on blood oxygenation. Such studies show that increasing the odorant concentration increases the activity of individual glomeruli, as well as the number of glomeruli activated. In addition, different single odorants, or odorants with distinct chemical structures (e.g., length of the carbon chain in the backbone of the odorant molecule) maximally activate one or a few glomeruli (Figure 15.14A).
رابطه بین ORN های بیان کننده یک گیرنده بو و زیرمجموعه های کوچکی از گلومرول ها (به شکل 15.13E مراجعه کنید) نشان می دهد که گلومرول های منفرد به طور خاص (یا حداقل انتخابی) به بوهای متمایز پاسخ می دهند. پاسخ های انتخابی (اما نه منحصر به فرد) زیرمجموعه های گلومرول ها به بوهای خاص، از نظر فیزیولوژیکی در بی مهرگانی مانند دروزوفیلا و همچنین در موش ها، با استفاده از ثبت های تک و چند واحدی، نقشه برداری متابولیک، رنگ های حساس به ولتاژ، حسگرهای کدگذاری شده ژنتیکی فعالیت الکتریکی یا سیگنال های ذاتی که به اکسیژن رسانی خون بستگی دارند، تأیید شده است. چنین مطالعاتی نشان می دهد که افزایش غلظت بو، فعالیت گلومرول های منفرد و همچنین تعداد گلومرول های فعال شده را افزایش می دهد. علاوه بر این، بوهای منفرد مختلف یا بوهایی با ساختارهای شیمیایی متمایز (به عنوان مثال، طول زنجیره کربنی در ستون فقرات مولکول بو) حداکثر یک یا چند گلومرول را فعال می کنند (شکل 15.14A).
It is still not clear how (or whether) odor identity and concentration are mapped across the entire array, or reflect the activation of smaller subsets of glomeruli. Given the response of small numbers of glomeruli to single odorants, one might expect that complex natural odors such as those of coffee, fruits, cheeses, or spiceseach of which is composed of more than 100 compounds-would activate a very large number of olfactory glomeruli. Surprisingly, this is not the case. In mice, natural odorants presented at their normal concentrations activate a relatively small number of glomeruli (up to 20), each of which responds selectively to one or two molecules that characterize the complex odor (Figure 15.14B). Thus, to solve the problem of representing complex odorants, the olfactory system appears to employ a sparse coding mechanism that cues in on a small number of dominant chemicals within a mixture (see Figure 15.12) and represents that mixture over a relatively small subset of glomeruli. One useful metaphor is to envision the sheet of glomeruli in the olfactory bulb as an array of lights on a movie marquee; the spatial distribution of the active and inactive glomeruli (“lit and unlit lights”) produces a message that is unique for a given odorant at a particular concentration.
هنوز مشخص نیست که چگونه (یا آیا) هویت و غلظت بو در کل آرایه ترسیم شده است، یا اینکه آیا فعال شدن زیرمجموعههای کوچکتری از گلومرولها را منعکس میکند. با توجه به پاسخ تعداد کمی از گلومرولها به بوهای منفرد، میتوان انتظار داشت که بوهای طبیعی پیچیده مانند بوهای قهوه، میوهها، پنیرها یا ادویهها که هر کدام از بیش از 100 ترکیب تشکیل شدهاند، تعداد بسیار زیادی از گلومرولهای بویایی را فعال کنند. با کمال تعجب، این مورد صدق نمیکند. در موشها، بوهای طبیعی ارائه شده در غلظتهای طبیعی خود، تعداد نسبتاً کمی از گلومرولها (تا 20) را فعال میکنند که هر کدام به طور انتخابی به یک یا دو مولکول که بوی پیچیده را مشخص میکنند، پاسخ میدهند (شکل 15.14B). بنابراین، برای حل مشکل نمایش بوهای پیچیده، به نظر میرسد سیستم بویایی از یک مکانیسم کدگذاری پراکنده استفاده میکند که تعداد کمی از مواد شیمیایی غالب را در یک مخلوط نشان میدهد (شکل ۱۵.۱۲ را ببینید) و آن مخلوط را بر روی زیرمجموعه نسبتاً کوچکی از گلومرولها نمایش میدهد. یک استعاره مفید این است که صفحه گلومرولها را در پیاز بویایی به عنوان آرایهای از چراغها روی یک چادر فیلم تصور کنیم؛ توزیع فضایی گلومرولهای فعال و غیرفعال (“چراغهای روشن و خاموش”) پیامی تولید میکند که برای یک بو معین در غلظت خاص منحصر به فرد است.


FIGURE 15.14 Responses of chemically distinct odorants in individual glomeruli. (A) At left, the array of glomeruli in the Drosophila melanogaster olfactory lobe (the equivalent of the mammalian olfactory bulb) is visualized with a fluorescent protein expressed under the genetic control of an olfactory lobe specific gene. Subsequent panels (left to right) show that three distinct odorants 1 octan 3-ol, an insect attractant; hexane, which has a chemical smell to humans; and isoamyl acetate, the major molecular constituent of the aroma given off by banana sactivate different glomeruli. In each case, activation (yellow and the maximum red) is limited to one or two distinct glomeruli. (B) Surface images of glomeruli from a mouse olfactory bulb. An overlying response intensity map shows the response to odorants with different carbon backbones; red represents highintensity response. The glomerulus that responds specifically to acetophenone shows different levels of response to 1% and 10% concentrations in room air. (A from Wang et al., 2003; B from Fleischmann et al., 2008.)
شکل ۱۵.۱۴ پاسخهای بوهای شیمیایی متمایز در گلومرولهای منفرد. (الف) در سمت چپ، آرایه گلومرولها در لوب بویایی دروزوفیلا ملانوگاستر (معادل پیاز بویایی پستانداران) با یک پروتئین فلورسنت که تحت کنترل ژنتیکی یک ژن خاص لوب بویایی بیان میشود، تجسم شده است. پنلهای بعدی (از چپ به راست) نشان میدهند که سه بو متمایز – ۱-اکتان-۳-اول، یک جاذب حشرات؛ هگزان، که برای انسان بوی شیمیایی دارد؛ و ایزوآمیل استات، جزء مولکولی اصلی عطری که از موز ساطع میشود، گلومرولهای مختلفی را فعال میکنند. در هر مورد، فعالسازی (زرد و حداکثر قرمز) به یک یا دو گلومرول متمایز محدود میشود. (ب) تصاویر سطحی گلومرولها از پیاز بویایی موش. یک نقشه شدت پاسخ روی هم رفته، پاسخ به بوهایی با اسکلت کربنی متفاوت را نشان میدهد؛ قرمز نشان دهنده پاسخ با شدت بالا است. گلومرولهایی که به طور خاص به استوفنون پاسخ میدهند، سطوح مختلفی از پاسخ را به غلظتهای ۱٪ و ۱۰٪ در هوای اتاق نشان میدهند. (الف از وانگ و همکاران، ۲۰۰۳؛ ب از فلایشمن و همکاران، ۲۰۰۸.)
Pyriform Cortical Processing of Information Relayed from the Olfactory Bulb
Mitral cell axons, as well as those from tufted cells (a less frequent class of olfactory bulb projection neurons), pro- vide the only relay for olfactory information to the rest of the brain. The mitral cell axons from each olfactory bulb form a bundle the lateral olfactory tract that projects to the accessory olfactory nuclei, the olfactory tubercle, the pyriform and entorhinal cortices, as well as to portions of the amygdala (see Figure 15.1; Figure 15.15A). Most projections of the lateral olfactory tract are ipsilateral; however, a subset of mitral cell axons cross the midline, presumably initiating bilateral processing of some aspects of olfactory information. In humans, the major target of the lateral olfactory tract is the three layered pyriform cortex in the ventromedial aspect of the temporal lobe, near the optic chiasm. Mitral cell inputs from glomeruli that receive odorant receptor specific projections are distributed across the pyriform cortex. Accordingly, neurons in pyriform cortex respond to odors based upon the relay of odorant information from ORNs through the olfactory bulb via mitral cell projections.
پردازش اطلاعات منتقل شده از پیاز بویایی توسط قشر پیریفورم
آکسونهای سلولهای میترال، و همچنین آکسونهای سلولهای تافتدار (دستهای کمتر رایج از نورونهای برآمدگی پیاز بویایی)، تنها رله اطلاعات بویایی به بقیه مغز را فراهم میکنند. آکسونهای سلولهای میترال از هر پیاز بویایی، دستهای از راه بویایی جانبی را تشکیل میدهند که به هستههای بویایی فرعی، توبرکل بویایی، قشرهای پیریفورم و انتورینال و همچنین به بخشهایی از آمیگدال امتداد مییابد (شکل 15.1؛ شکل 15.15A را ببینید). اکثر برآمدگیهای راه بویایی جانبی، همسو هستند. با این حال، زیرمجموعهای از آکسونهای سلولهای میترال از خط وسط عبور میکنند و احتمالاً پردازش دو طرفه برخی از جنبههای اطلاعات بویایی را آغاز میکنند. در انسان، هدف اصلی دستگاه بویایی جانبی، قشر سه لایه پیریفورم در قسمت شکمی-میانی لوب گیجگاهی، نزدیک کیاسمای بینایی است. ورودیهای سلولهای میترال از گلومرولها که برآمدگیهای خاص گیرنده بو را دریافت میکنند، در سراسر قشر پیریفورم توزیع میشوند. بر این اساس، نورونهای قشر پیریفورم بر اساس انتقال اطلاعات بو از ORNها از طریق پیاز بویایی و از طریق برآمدگیهای سلولهای میترال، به بوها پاسخ میدهند.
Recent work suggests that the segregation of projections based upon the relationship between ORNs expressing a single odorant receptor protein and specific subsets of glomeruli in the olfactory bulb is far less constrained in the pyriform cortex (Figure 15.15A). Furthermore, pyriform cortical neurons have a variety of responses to multiple versus single odors (Figure 15.15B). In fact, some individual pyriform cortical cells seem to be more broadly tuned to different odors than are cells in the olfactory bulb, and the neurons that respond to single odors are distributed throughout extended regions of the pyriform cortex (Figure 15.16). Apparently, the segregation of information seen in the olfactory bulb is not maintained in the pyriform cortex; however, there may be some segregation of glomerular inputs to the amygdala. Thus, transformation of odorant information from the olfactory epithelium through the bulb to the pyriform cortex that may build a representation of olfactory sensation remains somewhat difficult to discern based on patterns of con- nectivity alone.
کارهای اخیر نشان میدهد که تفکیک پروجکشنها بر اساس رابطه بین ORNهایی که یک پروتئین گیرنده بویایی واحد را بیان میکنند و زیرمجموعههای خاصی از گلومرولها در پیاز بویایی، در قشر پیریفورم محدودیت بسیار کمتری دارد (شکل 15.15A). علاوه بر این، نورونهای قشر پیریفورم پاسخهای متنوعی به بوهای چندگانه در مقابل بوهای تکی دارند (شکل 15.15B). در واقع، به نظر میرسد برخی از سلولهای قشر پیریفورم منفرد، نسبت به سلولهای پیاز بویایی، به طور گستردهتری برای بوهای مختلف تنظیم شدهاند و نورونهایی که به بوهای تکی پاسخ میدهند، در سراسر مناطق گسترده قشر پیریفورم توزیع شدهاند (شکل 15.16). ظاهراً، تفکیک اطلاعات مشاهده شده در پیاز بویایی در قشر پیریفورم حفظ نمیشود. با این حال، ممکن است مقداری تفکیک ورودیهای گلومرولی به آمیگدال وجود داشته باشد. بنابراین، تشخیص تبدیل اطلاعات بویایی از اپیتلیوم بویایی از طریق پیاز به قشر پیریفورم که ممکن است نمایانگر حس بویایی باشد، تنها بر اساس الگوهای اتصال، تا حدودی دشوار است.
FIGURE 15.15 Single glomeruli exhibit divergent projections to olfactory recipient areas. (A) Anatomical tracing (using focal electroporation of TMR-dextran) of the projections of a single olfactory glomerulus via the lateral olfactory tract (LOT) to multiple olfactory bulb targets, including the pyriform cortex (PIR), entorhinal cortex (ENT), amygdala (AMG), olfactory tubercle (OT), and accessory olfactory nucleus (AON). (B) Distinct “tuning” of pyramidal neurons in the pyriform cortex to 24 distinct odorants in awake, behaving mice. The red label (far right) reflects singlecell injection into the neuron whose tuning curve is shown at the far left. The green colabel is for GABAergic interneurons in the pyriform cortex. The lack of colocalization confirms the identity of the recorded, injected cell as an excitatory pyramidal neuron. At top, a single pyramidal neuron is broadly tuned (based on changes in action potential firing frequency in response to odorant presentation: AHZ) so that it has detectable responses to all 24 odors, with some modest selectivity for a subset that elicits the highest change in firing frequency. At bottom, a pyramidal neuron from the pyriform cortex that is unresponsive to all but 3 to 5 of the 24 odorants, with a distinct peak response. (A from Sosulski et al., 2011; B from Zhan and Luo, 2010.)
شکل ۱۵.۱۵ گلومرولهای منفرد، برآمدگیهای واگرا به نواحی گیرنده بویایی نشان میدهند. (الف) ردیابی آناتومیکی (با استفاده از الکتروپوراسیون کانونی TMR-دکستران) برآمدگیهای یک گلومرول بویایی منفرد از طریق دستگاه بویایی جانبی (LOT) به چندین هدف پیاز بویایی، از جمله قشر پیریفورم (PIR)، قشر انتورینال (ENT)، آمیگدال (AMG)، توبرکل بویایی (OT) و هسته بویایی فرعی (AON). (ب) “تنظیم” متمایز نورونهای هرمی در قشر پیریفورم به ۲۴ بوکننده متمایز در موشهای بیدار و در حال رفتار. برچسب قرمز (سمت راست) نشان دهنده تزریق تک سلولی به نورونی است که منحنی تنظیم آن در سمت چپ نشان داده شده است. برچسب سبز مربوط به نورونهای رابط گاباارژیک در قشر پیریفورم است. عدم هممکانی، هویت سلول ثبتشده و تزریقشده را به عنوان یک نورون هرمی تحریکی تأیید میکند. در بالا، یک نورون هرمی واحد به طور گسترده تنظیم شده است (براساس تغییرات در فرکانس شلیک پتانسیل عمل در پاسخ به ارائه بو: AHZ) به طوری که پاسخهای قابل تشخیصی به هر 24 بو دارد، با گزینشپذیری متوسطی برای زیرمجموعهای که بالاترین تغییر در فرکانس شلیک را ایجاد میکند. در پایین، یک نورون هرمی از قشر پیریفورم که به همه به جز 3 تا 5 مورد از 24 بو پاسخ نمیدهد، با یک پاسخ اوج متمایز. (A از Sosulski و همکاران، 2011؛ B از Zhan و Luo، 2010.)

FIGURE 15.16 Differential activation of widely distributed ensembles of neurons in pyriform cortex. (A) Lateral surface of the mouse brain showing the pyriform cortex and outlining the region from which optical recordings of the electrical activity of single neurons were made. (B-E) Four distinct odors recruited different subsets of cells across the pyriform cortex. Activated cells (bright red) were recorded based on local change in fluorescence signal emitted by each cell. The fluorescence signal was due to a Ca2+ sensitive dye introduced into all cells in the pyriform cortex prior to the recording session. The arrows in each panel indicate a blood vessel, which provides a landmark to compare patterns of acti- vation of the multiple odorants in this single animal. (From Stettler and Axel, 2009.)
شکل ۱۵.۱۶ فعالسازی افتراقی گروههای گستردهی نورونها در قشر پیریفورم. (الف) سطح جانبی مغز موش که قشر پیریفورم را نشان میدهد و ناحیهای را که از آن ثبت نوری فعالیت الکتریکی نورونهای منفرد انجام شده است، مشخص میکند. (ب-ه) چهار بوی متمایز، زیرمجموعههای مختلفی از سلولها را در سراسر قشر پیریفورم به کار گرفتند. سلولهای فعالشده (قرمز روشن) بر اساس تغییر موضعی در سیگنال فلورسانس ساطعشده توسط هر سلول ثبت شدند. سیگنال فلورسانس به دلیل یک رنگ حساس به +Ca2 بود که قبل از جلسه ثبت به تمام سلولهای قشر پیریفورم وارد شده بود. فلشها در هر پنل نشاندهندهی یک رگ خونی هستند که نشانهای برای مقایسه الگوهای فعالسازی چندین بو در این حیوان واحد فراهم میکند. (از Stettler and Axel, 2009.)
The pyriform cortex has pyramidal neurons that project to a variety of forebrain targets. Thus, olfactory information is distributed broadly to forebrain regions, where it can influence a wide range of behaviors. Significant numbers of neurons in the pyriform cortex innervate directly a variety of areas in the neocortex, including the orbitofrontal cortex in humans. and other primates, where multimodal responses to complex stimuli particularly food include an olfactory component. Pyriform cortical neurons also project to the thalamus, hippocampus, hypothalamic nuclei, and amygdala. The connections between the pyriform cortex and the mediodorsal nucleus of the thalamus, which is implicated in human memory (see Chapter 30), are thought to in fluence olfactory-guided “declarative” memory (see Chapter 30) via mediodorsal connections with the frontal cortex. Projections to the hippocampus are similarly thought to play a role in olfactory guided memory, but there is very little indication of how olfaction and declarative, or conscious mnemonic information are integrated. Finally, connections between the pyriform cortex, hypothalamus, and amygdala are thought to influence visceral, appetitive, and sexual behaviors.
قشر پیریفورم دارای نورونهای هرمی است که به اهداف متنوعی در مغز پیشین متصل میشوند. بنابراین، اطلاعات بویایی به طور گسترده در نواحی مغز پیشین توزیع میشود، جایی که میتواند طیف وسیعی از رفتارها را تحت تأثیر قرار دهد. تعداد قابل توجهی از نورونها در قشر پیریفورم مستقیماً به نواحی متنوعی در نئوکورتکس، از جمله قشر اوربیتوفرونتال در انسان و سایر نخستیها، عصبرسانی میکنند، جایی که پاسخهای چندوجهی به محرکهای پیچیده به ویژه غذا شامل یک جزء بویایی است. نورونهای قشر پیریفورم همچنین به تالاموس، هیپوکامپ، هستههای هیپوتالاموس و آمیگدال متصل میشوند. تصور میشود که اتصالات بین قشر پیریفورم و هسته مدیودورسال تالاموس، که در حافظه انسان دخیل است (به فصل 30 مراجعه کنید)، از طریق اتصالات مدیودورسال با قشر پیشانی، بر حافظه “بیانی” هدایتشده توسط بویایی (به فصل 30 مراجعه کنید) تأثیر میگذارند. به طور مشابه تصور میشود که انتقال اطلاعات به هیپوکامپ در حافظه هدایتشده توسط بویایی نقش دارد، اما اطلاعات بسیار کمی در مورد چگونگی ادغام اطلاعات بویایی و اطلاعات یادآوری اخباری یا آگاهانه وجود دارد. در نهایت، تصور میشود که ارتباطات بین قشر پیریفورم، هیپوتالاموس و آمیگدال بر رفتارهای احشایی، اشتهایی و جنسی تأثیر میگذارند.
The details of central olfactory processing are unclear, in large measure because of the difficulty of studying the processing of specific olfactory stimuli experimentally. Identifying key odor stimuli, presenting them to the ORNS with consistent concentrations and without environmental “noise” from other molecules in air that can act as odorants, and quantifying receptor responses are daunting tasks that even now have not been completely solved for the olfactory system (however, see below for how these issues have been approached for vomeronasal sensation). Nevertheless, these pathways ensure that information about odors reaches a variety of forebrain regions, allowing olfactoryperception to influence cognitive, visceral, emotional, and homeostatic behaviors.
جزئیات پردازش بویایی مرکزی تا حد زیادی به دلیل دشواری مطالعه پردازش محرکهای بویایی خاص به صورت تجربی، نامشخص است. شناسایی محرکهای بویایی کلیدی، ارائه آنها به ORNS با غلظتهای ثابت و بدون “نویز” محیطی از سایر مولکولهای موجود در هوا که میتوانند به عنوان بو عمل کنند، و کمیسازی پاسخهای گیرنده، وظایف دلهرهآوری هستند که حتی اکنون برای سیستم بویایی به طور کامل حل نشدهاند (با این حال، در زیر نحوه برخورد با این مسائل برای حس وومرونازال را ببینید). با این وجود، این مسیرها تضمین میکنند که اطلاعات مربوط به بوها به مناطق مختلف مغز قدامی میرسد و به ادراک بویایی اجازه میدهد تا بر رفتارهای شناختی، احشایی، عاطفی و هموستاتیک تأثیر بگذارد.
The Vomeronasal System: Predators, Prey, and Mates
Many dog owners (and the occasional brave cat owner) have noticed the conspicuous openings in the mucus membranes above the upper gum line of their petusually while trying to pry an especially chewable household item from a recalcitrant pet’s jaws. These modest supralingual openings represent a second division of the olfactory system that is prominent in carnivores (including dogs and cats) and rodents, but less robust or absent in primates (especially humans). This vomeronasal system encompasses a distinct receptor cell population in a separate compartment of the nasal epithelium called the vomeronasal organ (VNO), as well as a separate region of the olfactory bulb called the accessory olfactory bulb (AOB) where axons from chemosensory receptor cells in the vomeronasal organ synapse (Figure 15.17).
سیستم وومرونازال: شکارچیان، طعمهها و جفتها
بسیاری از صاحبان سگ (و گاهی اوقات صاحبان گربههای شجاع) متوجه منافذ قابل توجهی در غشاهای مخاطی بالای خط لثه بالایی حیوان خانگی خود شدهاند که معمولاً هنگام تلاش برای بیرون کشیدن یک وسیله خانگی جویدنی از فک یک حیوان خانگی سرکش ایجاد میشود. این منافذ کوچک بالای زبانی نشاندهنده بخش دوم سیستم بویایی است که در گوشتخواران (از جمله سگها و گربهها) و جوندگان برجسته است، اما در نخستیها (به ویژه انسان) کمتر قوی است یا وجود ندارد. این سیستم وومرونازال شامل یک جمعیت سلولی گیرنده مجزا در یک محفظه جداگانه از اپیتلیوم بینی به نام اندام وومرونازال (VNO) و همچنین یک ناحیه جداگانه از پیاز بویایی به نام پیاز بویایی فرعی (AOB) است که در آن آکسونهای سلولهای گیرنده شیمیایی حسی در اندام وومرونازال سیناپس ایجاد میکنند (شکل 15.17).
The projections of the accessory olfactory bulb are distinct from those of the remainder of the olfactory bulb (referred to as the “main” olfactory bulb in rodents and carnivores) and include the hypothalamus and amygdala as their major target zones. This anatomical distinction provides an important clue to the primary function of the vomeronasal system: It is believed to encode and process information about odorants from conspecifics or predators and to mediate sexual, reproductive, homeostatic, and aggressive responses. The specific stimuli detected and represented by the vomeronasal system that mediate behaviors with conspecifics (i.e., mating, parental, and other social behaviors) are referred to as pheromones. The specific stimuli that mediate behaviors with other animals are referred to as kairomones (airborne molecular stimuli from a predator [e.g., an owl] or prey [e.g., a mouse]). The existence of pheromones and kairomones, distinct from consciously perceived odors, remains a focus of research for a variety of purposes, including animal population con- trol and assisted reproduction.
برآمدگیهای پیاز بویایی فرعی با برآمدگیهای بقیه پیاز بویایی (که در جوندگان و گوشتخواران به عنوان پیاز بویایی “اصلی” شناخته میشود) متمایز هستند و شامل هیپوتالاموس و آمیگدال به عنوان مناطق هدف اصلی آنها میشوند. این تمایز آناتومیکی سرنخ مهمی در مورد عملکرد اصلی سیستم وومرونازال ارائه میدهد: اعتقاد بر این است که این سیستم اطلاعات مربوط به بوها را از همنوعان یا شکارچیان رمزگذاری و پردازش میکند و پاسخهای جنسی، تولید مثلی، هموستاتیک و پرخاشگری را واسطهگری میکند. محرکهای خاصی که توسط سیستم وومرونازال شناسایی و نمایش داده میشوند و واسطه رفتارها با همنوعان (یعنی جفتگیری، والدینی و سایر رفتارهای اجتماعی) هستند، فرومون نامیده میشوند. محرکهای خاصی که واسطه رفتارها با سایر حیوانات هستند، کایرومون نامیده میشوند (محرکهای مولکولی موجود در هوا از یک شکارچی [مثلاً جغد] یا طعمه [مثلاً موش] ). وجود فرومونها و کایرومونها، متمایز از بوهای درکشدهی آگاهانه، همچنان برای اهداف مختلفی از جمله کنترل جمعیت حیوانات و تولید مثل کمکی، مورد توجه تحقیقات است.
The fate of the vomeronasal system in primates, espe- cially humans, is mysterious. The vomeronasal organ is absent in most primates, as is a region of the olfactory bulb that corresponds to the accessory olfactory bulb. There are few recognizable vomeronasal receptor genes in the human genome, and those that have some homology are pseudogenes they are not expressed and do not appear to encode functional proteins. Nevertheless, primates, including humans, have behavioral responses that can be attributed to stimuli similar to the pheromones that activate the vomeronasal system in other animals. These include control of the menstrual cycle in women exposed to either same sex or opposite sex individuals (e.g., same sex or coed dormitories these studies, however, remain controversial, see above). There are equally controversial studies of maleand female specific responses to odorants in distinct regions of the hypothalamus (presumably relayed via the olfactory bulb) as well as the reversal of these responses in the hypothalamus of individuals of different sexual orientations (Figure 15.18; see also Chapter 24). Thus, in some mammals the vomeronasal system provides a distinct chemosensory parallel pathway for detecting and processing chemosensory signals about reproduction, social interactions, predator threats and prey opportunities, For other mammals, including humans, the representa- tion of such information-if indeed it is specifically represented remains obscure.
سرنوشت سیستم ومرونازال در نخستیسانان، به ویژه انسان، مرموز است. اندام ومرونازال در اکثر نخستیسانان وجود ندارد، همانطور که ناحیهای از پیاز بویایی که با پیاز بویایی فرعی مطابقت دارد، وجود ندارد. تعداد کمی ژن گیرنده ومرونازال قابل تشخیص در ژنوم انسان وجود دارد و آنهایی که تا حدودی همولوژی دارند، شبهژن هستند، بیان نمیشوند و به نظر نمیرسد پروتئینهای عملکردی را رمزگذاری کنند. با این وجود، نخستیسانان، از جمله انسان، پاسخهای رفتاری دارند که میتوان آنها را به محرکهایی مشابه فرومونهایی که سیستم ومرونازال را در سایر حیوانات فعال میکنند، نسبت داد. این موارد شامل کنترل چرخه قاعدگی در زنانی است که در معرض افراد همجنس یا جنس مخالف قرار دارند (به عنوان مثال، خوابگاههای همجنس یا مختلط). با این حال، این مطالعات همچنان بحثبرانگیز هستند، به بالا مراجعه کنید). مطالعات به همان اندازه بحثبرانگیزی در مورد پاسخهای خاص مردان و زنان به بوها در مناطق متمایز هیپوتالاموس (که احتمالاً از طریق پیاز بویایی منتقل میشوند) و همچنین معکوس شدن این پاسخها در هیپوتالاموس افراد با گرایشهای جنسی مختلف وجود دارد (شکل ۱۵.۱۸؛ همچنین به فصل ۲۴ مراجعه کنید). بنابراین، در برخی از پستانداران، سیستم وومرونازال یک مسیر موازی شیمیایی-حسی متمایز برای تشخیص و پردازش سیگنالهای شیمیایی-حسی در مورد تولید مثل، تعاملات اجتماعی، تهدیدهای شکارچی و فرصتهای شکار فراهم میکند. برای سایر پستانداران، از جمله انسان، نمایش چنین اطلاعاتی – اگر واقعاً به طور خاص نمایش داده شود – همچنان مبهم است.

FIGURE 15.17 The vomeronasal system. (A) A midsagittal section through the head of a mouse shows the location of the vomeronasal organ in the nasal cavity, and the accessory olfactory bulb located in the dorsal posterior region of the main olfactory bulb. (B) As diagrammed here, the two divisions of the accessory olfactory bulb each have glomeruli (spherical units of neuropil where synapses take place) that receive input from only one of two classes of vomeronasal receptor neurons, VR1 or VR2 (vomeronasal receptor class 1, shown here as dark blue, or class 2, light blue). (B after Pantages and Dulac, 2000.)
شکل ۱۵.۱۷ سیستم وومرونازال. (الف) برش میانی از سر یک موش، محل اندام وومرونازال را در حفره بینی و پیاز بویایی فرعی واقع در ناحیه پشتی خلفی پیاز بویایی اصلی را نشان میدهد. (ب) همانطور که در اینجا نمودار شده است، هر دو بخش پیاز بویایی فرعی دارای گلومرول (واحدهای کروی نوروپیل که سیناپسها در آنها رخ میدهند) هستند که فقط از یکی از دو دسته نورونهای گیرنده وومرونازال، VR1 یا VR2 (گیرنده وومرونازال کلاس ۱، که در اینجا با رنگ آبی تیره یا کلاس ۲، آبی روشن نشان داده شده است) ورودی دریافت میکنند. (ب، برگرفته از Pantages and Dulac، ۲۰۰۰.)

FIGURE 15.18 Differential patterns of activation in the hypothalamus of a typical human female (left) and male (right) after exposure to an estrogen or androgen containing odor mix. (From Savic et al., 2001.)
شکل ۱۵.۱۸ الگوهای متفاوت فعالسازی در هیپوتالاموس یک زن (چپ) و یک مرد (راست) معمولی پس از قرار گرفتن در معرض ترکیبی از بوهای حاوی استروژن یا آندروژن. (از Savic و همکاران، ۲۰۰۱)
The Vomeronasal System: Molecular Mechanisms of Sensory Transduction
In the late 1990s, the separate identity of the vomeronasal system was confirmed at the molecular level with the cloning of a family of vomeronasal receptors (VRS). The genomic identity and expression of VRS is specific for the chemosensory neurons of the VNO. The VRS are therefore distinct from their counterparts found in ORNS. The VRs are a large class (as many as 250 individual receptor genes in the mouse) of 7 transmembrane G-protein coupled receptors (Figure 15.19A) expressed uniquely in vomeronasal receptor neurons (VRNS). They fall into two major classes, VIRS and V2RS. V1RS have a limited extracellular domain, whereas V2Rs have an extracellular domain that is quite extensive. V1Rs and V2Rs use different G-protein coupled cascades to activate signaling (see Figure 15.19A). Thus, although VRNs in the VNO look much like their ORN counterparts in the olfactory epithelium (and share expression of some molecules), their G-protein coupled receptors are genetically, molecularly, structurally, and functionally different. Moreover, signal transduction is accomplished via a different set of second messengers and cyclic nucleotide gated ion channels. The VIRS use the G-protein Gai2, and the V2Rs use the G-protein Gao (versus the olfactory selective Golf that is activated by odorant binding to ORS in ORNs). The activity of transient receptor potential (TRP) channels, specifically TRP2, in vomeronasal receptor neurons is regulated by phospholipase C (PLC) and diacylglycerol (DAG) in response to G-protein stimulation via VIRS and V2Rs, whereas a cyclic nucleotide gated ion channel and a Ca2+ gated Cl channel are the primary molecular mediators of excitability in ORNs via activation of adenylate cyclase and the generation cAMP (see Figure 15.10). In addition, some V2Rs are coexpressed with and may interact with major histocompatibility complex (MHC) gene families for M10 and M1. The functional significance of the V2R MHC interaction remains uncertain. The MHC protein may contribute to pheromone detection by subsets of V2Ŕs and also is thought to regulate the trafficking of the V2R to the vomeronasal receptor cell membrane.
سیستم وومرونازال: مکانیسمهای مولکولی انتقال حسی
در اواخر دهه 1990، هویت جداگانه سیستم وومرونازال در سطح مولکولی با کلونینگ خانوادهای از گیرندههای وومرونازال (VRS) تأیید شد. هویت ژنومی و بیان VRS مختص نورونهای شیمیایی-حسی VNO است. بنابراین، VRS از همتایان خود که در ORNS یافت میشوند، متمایز است. VRها دسته بزرگی (تا 250 ژن گیرنده منفرد در موش) از 7 گیرنده جفتشده با پروتئین G غشایی (شکل 15.19A) هستند که به طور منحصر به فرد در نورونهای گیرنده وومرونازال (VRNS) بیان میشوند. آنها در دو دسته اصلی VIRS و V2RS قرار میگیرند. V1RS دامنه خارج سلولی محدودی دارد، در حالی که V2Rها دامنه خارج سلولی بسیار گستردهای دارند. V1Rها و V2Rها از آبشارهای جفتشده با پروتئین G متفاوتی برای فعال کردن سیگنالینگ استفاده میکنند (شکل 15.19A را ببینید). بنابراین، اگرچه VRNها در VNO بسیار شبیه به همتایان ORN خود در اپیتلیوم بویایی هستند (و بیان برخی مولکولها را به اشتراک میگذارند)، گیرندههای جفتشده با پروتئین G آنها از نظر ژنتیکی، مولکولی، ساختاری و عملکردی متفاوت هستند. علاوه بر این، انتقال سیگنال از طریق مجموعهای متفاوت از پیامرسانهای ثانویه و کانالهای یونی دریچهدار نوکلئوتیدی حلقوی انجام میشود. VIRSها از G-پروتئین Gai2 و V2Rها از G-پروتئین Gao استفاده میکنند (در مقابل Golf که انتخابی بویایی است و با اتصال بو به ORS در ORNها فعال میشود). فعالیت کانالهای پتانسیل گیرنده گذرا (TRP)، به ویژه TRP2، در نورونهای گیرنده وومرونازال توسط فسفولیپاز C (PLC) و دیآسیلگلیسرول (DAG) در پاسخ به تحریک پروتئین G از طریق VIRS و V2Rها تنظیم میشود، در حالی که یک کانال یونی دریچهدار نوکلئوتیدی حلقوی و یک کانال Cl دریچهدار +Ca2 واسطههای مولکولی اصلی تحریکپذیری در ORNها از طریق فعالسازی آدنیلات سیکلاز و تولید cAMP هستند (شکل 15.10 را ببینید). علاوه بر این، برخی از V2Rها با خانوادههای ژنی کمپلکس سازگاری بافتی اصلی (MHC) برای M10 و M1 بیان میشوند و ممکن است با آنها تعامل داشته باشند. اهمیت عملکردی تعامل MHC V2R همچنان نامشخص است. پروتئین MHC ممکن است در تشخیص فرومون توسط زیرمجموعههایی از V2Ŕها نقش داشته باشد و همچنین تصور میشود که انتقال V2R به غشای سلولی گیرنده وومرونازال را تنظیم میکند.
The molecular map of pheromones (airborne molecu- lar stimuli from conspecifics: e.g., mouse to mouse) and kairomones (airborne molecular stimuli from predators or prey) is now fairly well understood. Based on cellular and physiological analyses, there is a fairly broad tuning of the vomeronasal receptors (Figure 15.19B), with some specificity for distinct V1RS and V2Rs. Thus, several V1Rs and V2Rs respond robustly and differentially to pheromones as sex specific or predatorprey specific cues (urine, etc.) in male versus female mice. Elimination of the TRP channels that mediate vomeronasal signal transduction (or elimination, replacement, or mutation of the receptors themselves) leads to changes in sexual or reproductive behavior, often in a dimorphic (see Chapter 24) manner (that is, males and females are differentially compromised). In contrast, several V2Rs and fewer V1RS respond robustly and differentially to predator cues, including those of snakes, owls, rats, and ferrets. This selectivity is assumed to mediate avoidance responses to these threatening species. V1Rs and V2Rs are functionally partially segregated-V1Rs apparently participate more in pheromone sensing, and V2RS in kairomone sensing.
نقشه مولکولی فرومونها (محرکهای مولکولی هوابرد از همنوعان: مثلاً موش به موش) و کایرومونها (محرکهای مولکولی هوابرد از شکارچیان یا طعمهها) اکنون به خوبی درک شده است. بر اساس تجزیه و تحلیلهای سلولی و فیزیولوژیکی، تنظیم نسبتاً گستردهای از گیرندههای وومرونازال (شکل 15.19B) وجود دارد، با برخی ویژگیهای خاص برای V1RS و V2R های متمایز. بنابراین، چندین V1R و V2R به طور قوی و متفاوت به فرومونها به عنوان نشانههای خاص جنس یا خاص طعمه شکارچی (ادرار و غیره) در موشهای نر در مقابل ماده پاسخ میدهند. حذف کانالهای TRP که واسطه انتقال سیگنال وومرونازال هستند (یا حذف، جایگزینی یا جهش خود گیرندهها) منجر به تغییراتی در رفتار جنسی یا تولید مثلی میشود، که اغلب به صورت دو شکلی (به فصل 24 مراجعه کنید) است (یعنی نرها و مادهها به طور متفاوت در معرض خطر قرار میگیرند). در مقابل، چندین V2R و تعداد کمتری V1RS به طور قوی و متفاوتی به نشانههای شکارچیان، از جمله مارها، جغدها، موشها و راسوها، پاسخ میدهند. فرض بر این است که این گزینشپذیری، واسطه پاسخهای اجتنابی به این گونههای تهدیدآمیز است. V1Rها و V2Rها از نظر عملکردی تا حدی از هم جدا هستند – V1Rها ظاهراً بیشتر در حس کردن فرومون و V2RS در حس کردن کایرومون شرکت میکنند.
The physiology of central targets of the vomeronasal system, relayed via the AOB-which has a cellular structure similar to that of the OB-is consistent with the selectivity of the V1Rs and V2Rs. Electrical recordings from single neurons in the hypothalamus and amygdala (presumed to be the targets of accessory olfactory bulb inputs) in rodents show that these cells respond specifically to chemical constituents of urine or other excreta thought to contain pheromones that elicit stereotypical reproductive or aggressive behaviors.
فیزیولوژی اهداف مرکزی سیستم وومرونازال، که از طریق AOB که ساختار سلولی مشابه OB دارد منتقل میشوند، با گزینشپذیری V1Rها و V2Rها سازگار است. ثبتهای الکتریکی از نورونهای منفرد در هیپوتالاموس و آمیگدال (که فرض میشود اهداف ورودیهای پیاز بویایی فرعی هستند) در جوندگان نشان میدهد که این سلولها به طور خاص به اجزای شیمیایی ادرار یا سایر مواد دفعی که تصور میشود حاوی فرومونهایی هستند که رفتارهای کلیشهای تولید مثلی یا پرخاشگری را ایجاد میکنند، پاسخ میدهند.
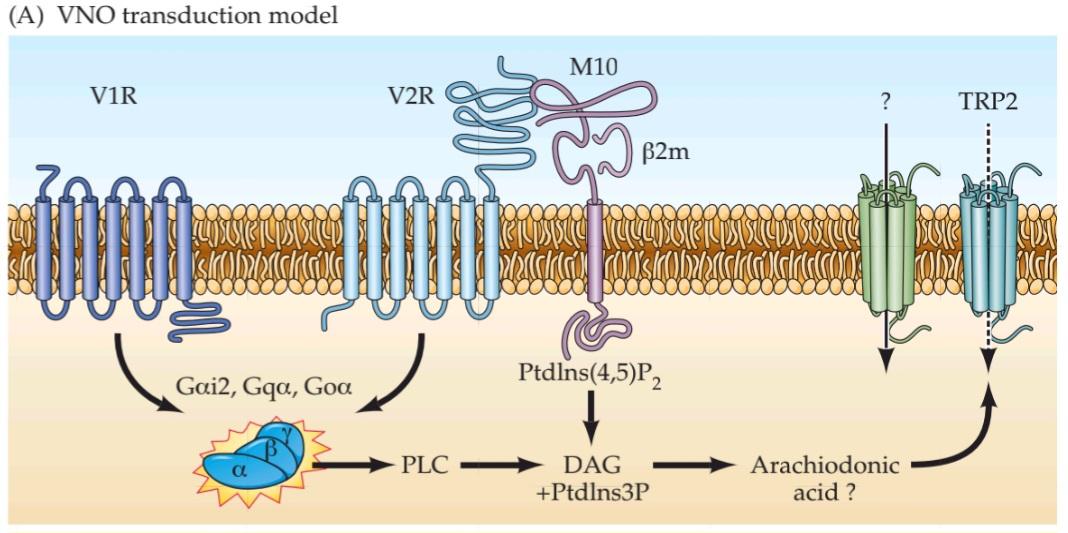
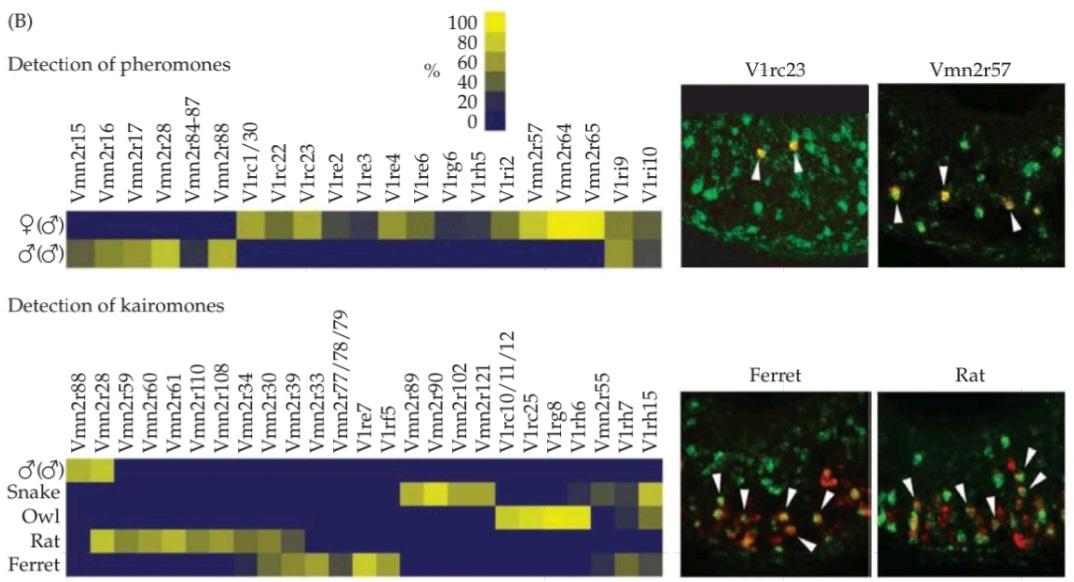
FIGURE 15.19 The two basic classes of vomeronasal receptor (VR) proteins. (A) Both VIRS and V2RS are 7-transmembrane G-protein coupled receptors; however, the signal transduction mechanisms that activate the transient receptor potential (TRP) channel in the two classes of cells are distinct. (B) Selectivity of single VR proteins for sex specific pheromonal cues (top) and species specific kairomonal cues. The selectivity is not exclusive; however, based on the heat maps, it is clear that some receptor proteins (e.g.. Vmn2r64 for sex specific pheromones and Virg8 for species specific kairomones) respond dimorphically (Vmn2r64) or selectively (Virg8), to distinct cues. These estimates of response selectivity are based on frequency of colocalization of single VRs (green) with expression of Egrl protein (red) that is rapidly expressed in response to neuronal activity. (A after Dulac and Torello, 2003; B from Isogai et al., 2011.)
شکل ۱۵.۱۹ دو دسته اصلی پروتئینهای گیرنده وومرونازال (VR). (الف) هر دو VIRS و V2RS گیرندههای جفتشده با پروتئین G غشایی ۷ هستند؛ با این حال، مکانیسمهای انتقال سیگنال که کانال پتانسیل گیرنده گذرا (TRP) را در دو دسته سلول فعال میکنند، متمایز هستند. (ب) گزینشپذیری پروتئینهای VR منفرد برای نشانههای فرومونی خاص جنس (بالا) و نشانههای کایرومونی خاص گونه. گزینشپذیری انحصاری نیست. با این حال، بر اساس نقشههای حرارتی، مشخص است که برخی از پروتئینهای گیرنده (به عنوان مثال Vmn2r64 برای فرومونهای خاص جنس و Virg8 برای کایرومونهای خاص گونه) به نشانههای متمایز به صورت دیمورفیک (Vmn2r64) یا انتخابی (Virg8) پاسخ میدهند. این تخمینها از گزینشپذیری پاسخ بر اساس فراوانی هممکانی VRهای منفرد (سبز) با بیان پروتئین Egrl (قرمز) است که به سرعت در پاسخ به فعالیت عصبی بیان میشود. (الف برگرفته از دولاک و تورلو، ۲۰۰۳؛ ب برگرفته از ایسوگای و همکاران، ۲۰۱۱)
Organization of the Taste System
The third chemosensory system, the taste system, represents the chemical as well as physical qualities of ingested substances, primarily food. In concert with the olfactory and trigeminal systems, taste reflects the aesthetic and nutritive qualities of food as well as indicating whether or not a food item is safe to be ingested. Once in the mouth, the chemical constituents of food interact with receptor proteins on taste cells, which are located in epithelial specializations called taste buds in the tongue. Taste cells transduce chemical stimuli to encode information about the identity, concentration, and qualities (pleasant, unpleasant, or potentially harmful) of the substance. This information also prepares the gastrointestinal system to receive and digest food by causing salivation and swallowing or if the substance is noxious, gagging and regurgitation. Information about the temperature and texture of food (including viscosity and fat content) is transduced and relayed from the tongue and mouth via somatosensory receptors from the trigeminal and other sensory cranial nerves to the thalamus and somatosensory cortices (see Chapters 9 and 10). Of course, food is not eaten simply fornutritional value or avoided because of unpleasant or potentially harmful qualities; “taste” also depends on cultural and psychological factors. How else can one explain why so many people enjoy consuming hot peppers or bitter-tasting liquids such as beer?
سازماندهی سیستم چشایی
سومین سیستم شیمیایی-حسی، سیستم چشایی، نشاندهنده ویژگیهای شیمیایی و همچنین فیزیکی مواد بلعیده شده، عمدتاً غذا، است. در هماهنگی با سیستمهای بویایی و سهقلو، طعم، منعکسکننده ویژگیهای زیباییشناختی و تغذیهای غذا و همچنین نشان دهنده ایمن بودن یا نبودن یک ماده غذایی برای بلع است. هنگامی که مواد شیمیایی غذا در دهان قرار میگیرند، با پروتئینهای گیرنده روی سلولهای چشایی که در تخصصهای اپیتلیال به نام جوانههای چشایی در زبان قرار دارند، تعامل میکنند. سلولهای چشایی محرکهای شیمیایی را برای رمزگذاری اطلاعات مربوط به هویت، غلظت و ویژگیهای (خوشایند، ناخوشایند یا بالقوه مضر) ماده، منتقل میکنند. این اطلاعات همچنین سیستم گوارش را با ایجاد بزاق و بلع یا در صورت مضر بودن ماده، حالت تهوع و استفراغ، برای دریافت و هضم غذا آماده میکند. اطلاعات مربوط به دما و بافت غذا (از جمله ویسکوزیته و میزان چربی) از طریق گیرندههای حسی-پیکری از اعصاب سه قلو و سایر اعصاب جمجمهای حسی به قشر تالاموس و حسی-پیکری منتقل و منتقل میشود (به فصلهای 9 و 10 مراجعه کنید). البته، غذا صرفاً به دلیل ارزش غذایی خورده نمیشود یا به دلیل ویژگیهای ناخوشایند یا بالقوه مضر از آن اجتناب نمیشود؛ «مزه» همچنین به عوامل فرهنگی و روانی بستگی دارد. چگونه میتوان توضیح داد که چرا بسیاری از مردم از مصرف فلفل تند یا مایعات تلخ مزه مانند آبجو لذت میبرند؟



FIGURE 15.20 The human taste system. (A) The drawing shows the relationship between receptors in the mouth and upper alimentary canal, and the nucleus of the solitary tract in the medulla. The coronal section shows the ventral posteri or medial (VPM) nucleus of the thalamus and its connection with gustatory regions of the cerebral cortex. (B) Basic pathways for processing taste information. (C) Functional MRI of a typical person consuming food. Note bilateral focal activation (red) in the insular cortex (arrows), with a bias for greater activation in the dominant hemisphere (left in most humans). (C from Schoenfeld et al., 2004.)
شکل ۱۵.۲۰ سیستم چشایی انسان. (الف) تصویر، رابطه بین گیرندههای دهان و دستگاه گوارش فوقانی و هسته مجرای منفرد در بصل النخاع را نشان میدهد. بخش تاجی، هسته شکمی-خلفی یا میانی (VPM) تالاموس و ارتباط آن با نواحی چشایی قشر مغز را نشان میدهد. (ب) مسیرهای اساسی برای پردازش اطلاعات چشایی. (ج) MRI عملکردی یک فرد معمولی در حال مصرف غذا. به فعالسازی کانونی دو طرفه (قرمز) در قشر جزیرهای (فلشها) توجه کنید، با این تفاوت که نیمکره غالب (سمت چپ در اکثر انسانها) بیشتر فعال است. (ج از Schoenfeld و همکاران، ۲۰۰۴.)
Like the olfactory system, the taste system is defined by its specialized peripheral receptors as well as by several central pathways that relay and process taste information (Figure 15.20). Taste cells (the peripheral receptors) are found in taste buds distributed on the dorsal surface of the tongue, soft palate, pharynx, and upper part of the esophagus. Taste cells synapse with primary sensory axons that run in the chorda tympani and greater superior petrosal branches of the facial nerve (cranial nerve VII), the lingual branch of the glossopharyngeal nerve (cranial nerve IX), and the superior laryngeal branch of the vagus nerve (cranial nerve X) to innervate the taste buds in the tongue, palate, epiglottis, and esophagus, respectively. The central axons of these primary sensory neurons in the respective cranial nerve ganglia project to rostral and lateral regions of the nucleus of the solitary tract in the medulla (see Figure 15.20A), also known as the gustatory nucleus of the solitary tract complex. (The posterior region of the solitary tract nucleus is the main target of afferent visceral sensory information related to the sympathetic and para- sympathetic divisions of the visceral motor system; see Chapter 21.)
مانند سیستم بویایی، سیستم چشایی توسط گیرندههای محیطی تخصصی خود و همچنین چندین مسیر مرکزی که اطلاعات چشایی را منتقل و پردازش میکنند، تعریف میشود (شکل 15.20). سلولهای چشایی (گیرندههای محیطی) در جوانههای چشایی که در سطح پشتی زبان، کام نرم، حلق و قسمت فوقانی مری توزیع شدهاند، یافت میشوند. سلولهای چشایی با آکسونهای حسی اولیه که در طناب صماخ و شاخههای پتروزال فوقانی عصب صورتی (عصب جمجمهای VII)، شاخه زبانی عصب زبانی-حلقی (عصب جمجمهای IX) و شاخه حنجرهای فوقانی عصب واگ (عصب جمجمهای X) قرار دارند، سیناپس برقرار میکنند تا به ترتیب جوانههای چشایی را در زبان، کام، اپیگلوت و مری عصبدهی کنند. آکسونهای مرکزی این نورونهای حسی اولیه در گانگلیونهای عصبی جمجمهای مربوطه، به نواحی جلویی و جانبی هستهی دستگاه عصبی منفرد در بصلالنخاع (شکل 15.20A را ببینید) که به عنوان هستهی چشایی کمپلکس دستگاه عصبی منفرد نیز شناخته میشود، امتداد مییابند. (ناحیهی خلفی هستهی دستگاه عصبی منفرد، هدف اصلی اطلاعات حسی احشایی آوران مربوط به بخشهای سمپاتیک و پاراسمپاتیک سیستم حرکتی احشایی است؛ به فصل 21 مراجعه کنید.)
The distribution of the cranial nerves that innervate taste buds in the oral cavity is topographically represented along the rostral-caudal axis of the rostral portion of the gustatory nucleus; the terminations from the facial nerve are rostral, those from the glossopharyngeal are in the midregion, and those from the vagus nerve are more caudal in the nucleus (see Figure 15.20A). Integration of taste and visceral sensory information is presumably facilitated by this arrangement. The caudal part of the nucleus of the solitary tract also receives innervation from subdiaphragmatic branches of the vagus nerve, which control gastric motility. Interneurons connecting the rostral and caudal regions of the nucleus represent the first interaction between visceral and gustatory stimuli, and these connections can be thought of as the sensory limb of a gustatory visceral reflex arc. This close relationship between gustatory and visceral information makes sense, since an animal must quickly recognize if it is eating something that is likely to make it sick and respond accordingly.
توزیع اعصاب جمجمهای که جوانههای چشایی را در حفره دهان عصبدهی میکنند، از نظر توپوگرافی در امتداد محور سری-دمی بخش سری هسته چشایی نشان داده شده است؛ انتهای عصب صورتی سری، انتهای زبانحلقی در ناحیه میانی و انتهای عصب واگ در هسته دمیتر است (شکل 15.20A را ببینید). ادغام اطلاعات حسی چشایی و احشایی احتمالاً با این ترتیب تسهیل میشود. بخش دمی هسته مجرای منفرد همچنین از شاخههای زیر دیافراگمی عصب واگ که حرکات معده را کنترل میکنند، عصب دریافت میکند. نورونهای رابطی که نواحی سری و دمی هسته را به هم متصل میکنند، اولین تعامل بین محرکهای احشایی و چشایی را نشان میدهند و این اتصالات را میتوان به عنوان اندام حسی یک قوس رفلکس احشایی چشایی در نظر گرفت. این رابطه نزدیک بین اطلاعات چشایی و احشایی منطقی است، زیرا یک حیوان باید به سرعت تشخیص دهد که آیا چیزی میخورد که احتمالاً او را بیمار میکند و بر این اساس پاسخ دهد.
Axons from the rostral (gustatory) part of the solitary nucleus project to the ventral posterior complex of the thalamus, where they terminate in the medial half of the ventral posterior medial nucleus. This nucleus proj- ects in turn to several regions of the neocortex, including the anterior insula in the temporal lobe (the insular taste cortex) and the operculum of the frontal lobe (see Figure 15.20B). There is also a secondary neocortical taste area in the caudolateral orbitofrontal cortex; here neurons respond to combinations of visual, somatosensory, olfactory, and gustatory stimuli. Interestingly, in the monkey, when a given food is consumed to the point of satiety, specific orbitofrontal neurons diminish their activity to that tastant, suggesting that these neurons are involved in the conscious motivation to eat (or not to eat) particular foods. Finally, reciprocal projections connect the nucleus of the solitary tract via nuclei in the pons to the hypothalamus and amygdala. These projections presumably influence affective aspects (e.g., pleasurable versus aversive experi- ence of food; food-seeking behavior) of appetite, satiety, and other homeostatic responses associated with eating (recall that the hypothalamus is the major center governing homeostasis; see Chapter 21).
آکسونهای بخش منقاری (چشایی) هسته انفرادی به مجتمع خلفی شکمی تالاموس امتداد مییابند، جایی که در نیمه میانی هسته میانی خلفی شکمی خاتمه مییابند. این هسته به نوبه خود به چندین ناحیه از نئوکورتکس، از جمله اینسولای قدامی در لوب گیجگاهی (قشر چشایی جزیرهای) و سرپوش لوب پیشانی امتداد مییابد (شکل 15.20B را ببینید). همچنین یک ناحیه چشایی نئوکورتکس ثانویه در قشر اوربیتوفرونتال خلفی جانبی وجود دارد. در اینجا نورونها به ترکیبی از محرکهای بینایی، حسی-پیکری، بویایی و چشایی پاسخ میدهند. جالب توجه است که در میمون، هنگامی که یک غذای معین تا حد سیری مصرف میشود، نورونهای خاص اوربیتوفرونتال فعالیت خود را تا آن طعم کاهش میدهند، که نشان میدهد این نورونها در انگیزه آگاهانه برای خوردن (یا نخوردن) غذاهای خاص نقش دارند. در نهایت، فرافکنیهای متقابل، هستهی دستگاه عصبی منفرد را از طریق هستههایی در پل مغزی به هیپوتالاموس و آمیگدال متصل میکنند. این فرافکنیها احتمالاً بر جنبههای عاطفی (مثلاً تجربهی لذتبخش در مقابل تجربهی ناخوشایند غذا؛ رفتار جستجوی غذا) اشتها، سیری و سایر پاسخهای هموستاتیک مرتبط با خوردن تأثیر میگذارند (به یاد داشته باشید که هیپوتالاموس مرکز اصلی کنترل هموستاز است؛ به فصل ۲۱ مراجعه کنید).
Taste Perception in Humans
The taste system encodes information about the quantity as well as the identity of stimuli. Most taste stimuli are nonvolatile, hydrophilic molecules that are soluble in saliva. In general, the perceived intensity of taste is directly proportional to the concentration of the taste stimulus. In humans, threshold concentrations for most ingested tastants are quite high. For example, the threshold concentration for citric acid is about 2 mM; for salt (NaCl) 10 mM; and for sucrose 20 mM. (In contrast, recall that the perceptual threshold for some odorants is as low as 0.01 nM.) Because the body requires substantial concentrations of salt and carbohydrates, taste cells may respond only to relatively high concentrations of these essential substances in order to promote an adequate intake. Clearly, it is advantageous for the taste system to detect potentially dangerous substances (e.g., bitter tasting plant compounds, which may be noxious or poisonous) at much lower concentrations. Thus, the threshold concentration for such tastants is relatively low: That for quinine is 0.008 mM, and for the deadly substance strychnine it is 0.0001 mM.
درک طعم در انسان
سیستم چشایی اطلاعاتی در مورد کمیت و همچنین هویت محرکها را رمزگذاری میکند. اکثر محرکهای چشایی، مولکولهای غیرفرار و آبدوست هستند که در بزاق محلول میباشند. به طور کلی، شدت درک شده طعم مستقیماً با غلظت محرک طعم متناسب است. در انسان، غلظت آستانه برای اکثر طعمدهندههای بلعیده شده بسیار بالا است. به عنوان مثال، غلظت آستانه برای اسید سیتریک حدود 2 میلیمولار؛ برای نمک (NaCl) 10 میلیمولار؛ و برای ساکارز 20 میلیمولار است. (در مقابل، به یاد داشته باشید که آستانه ادراک برای برخی از بوها به اندازه 0.01 نانومولار کم است.) از آنجا که بدن به غلظتهای قابل توجهی از نمک و کربوهیدرات نیاز دارد، سلولهای چشایی ممکن است فقط به غلظتهای نسبتاً بالایی از این مواد ضروری پاسخ دهند تا مصرف کافی را ارتقا دهند. واضح است که برای سیستم چشایی مفید است که مواد بالقوه خطرناک (به عنوان مثال، ترکیبات گیاهی تلخ مزه، که ممکن است مضر یا سمی باشند) را در غلظتهای بسیار پایینتر تشخیص دهد. بنابراین، غلظت آستانه برای چنین طعمدهندههایی نسبتاً پایین است: برای کینین 0.008 میلیمولار و برای ماده کشنده استریکنین 0.0001 میلیمولار است.
Tastants are detected over the full surface of the tongue in receptive specializations called taste papillae (Figure 15.21A). Papillae are defined by multicellular protuberances surrounded by local invaginations in the tongue epithelium. These invaginations form a trench to concentrate solubilized tastants. Taste buds are distributed along the lateral surfaces of the papillar protuberance as well as in the trench walls. They consist of specialized neuroep- ithelial receptor cells called taste cells, some supporting cells, and occasional basal cells (Figure 15.21B). In humans, approximately 4000 taste buds are distributed throughout the surface of the tongue as well as the palate, epiglottis, and esophagus. Taste cells are clustered around a 1-mm opening called a taste pore in the taste bud near the surface of the tongue (see Figure 15.21B). Solubilized tastants are further concentrated and are presented directly to the exposed taste receptor cells in the relatively small region of the taste pore. Like ORNs (and presumably for the same reason because they are exposed to infectious agents and environmental toxins), taste cells have a lifetime of about 2 weeks. Taste cells are apparently regenerated from basal cells, which constitute a local stem cell population that is retained in the mature tongue.
مزهها در تمام سطح زبان در نواحی تخصصی گیرنده به نام پاپیلای چشایی شناسایی میشوند (شکل 15.21A). پاپیلاها توسط برآمدگیهای چند سلولی احاطه شده توسط فرورفتگیهای موضعی در اپیتلیوم زبان مشخص میشوند. این فرورفتگیها یک شیار برای تمرکز مزههای محلول تشکیل میدهند. جوانههای چشایی در امتداد سطوح جانبی برآمدگی پاپیلار و همچنین در دیوارههای شیار توزیع شدهاند. آنها شامل سلولهای گیرنده نورواپیتلیال تخصصی به نام سلولهای چشایی، برخی سلولهای پشتیبان و گاهی اوقات سلولهای پایه هستند (شکل 15.21B). در انسان، تقریباً 4000 جوانه چشایی در سراسر سطح زبان و همچنین کام، اپیگلوت و مری توزیع شدهاند. سلولهای چشایی در اطراف یک منفذ 1 میلیمتری به نام منفذ چشایی در جوانه چشایی نزدیک سطح زبان جمع شدهاند (شکل 15.21B را ببینید). طعمدهندههای محلول بیشتر تغلیظ میشوند و مستقیماً به سلولهای گیرنده طعم در معرض در ناحیه نسبتاً کوچکی از منافذ چشایی ارائه میشوند. مانند ORNها (و احتمالاً به همان دلیل زیرا در معرض عوامل عفونی و سموم محیطی قرار دارند)، سلولهای چشایی حدود ۲ هفته عمر دارند. ظاهراً سلولهای چشایی از سلولهای پایه بازسازی میشوند که جمعیتی از سلولهای بنیادی موضعی را تشکیل میدهند که در زبان بالغ حفظ میشوند.


FIGURE 15.21 Taste buds and taste papillae. (A) Distribution of taste papillae on the dorsal surface of the tongue. The blowup shows the location of individual taste buds on a circumvallate papilla. (B) Diagram and light micrograph of a taste bud, showing various types of taste cells and the associated gustatory nerves. The taste cells make synapses on the gustatory afferent axons. The apical surface of the receptor cells has microvilli that are oriented toward the taste pore. (Micrograph courtesy of M. Tizzano, T. Finger and colleagues.)
شکل ۱۵.۲۱ جوانههای چشایی و پاپیلای چشایی. (الف) توزیع پاپیلای چشایی در سطح پشتی زبان. تصویر بزرگنمایی شده، محل جوانههای چشایی منفرد را روی یک پاپیلای گردابی نشان میدهد. (ب) نمودار و میکروگراف نوری از یک جوانه چشایی، که انواع مختلف سلولهای چشایی و اعصاب چشایی مرتبط را نشان میدهد. سلولهای چشایی سیناپسهایی را روی آکسونهای آوران چشایی ایجاد میکنند. سطح رأسی سلولهای گیرنده دارای میکروویلیهایی است که به سمت منفذ چشایی جهتگیری کردهاند. (میکروگراف از M. Tizzano، T. Finger و همکاران.)
There are three types of papillae: fungiform (which contain about 25% of the total number of taste buds), circumvallate (50%), and foliate (the remaining 25%). The three classes are distributed discontinuously on the surface of the tongue. Fungiform papillae are found only on the anterior two thirds of the tongue; the highest density (about 30 per square centimeter) is at the tip. Fungiform papillae have a mushroom like structure (hence their name) and typically have about three taste buds at their apical surface. Nine circumvallate papillae form a chevron at the rear of the tongue. Each consists of a circular trench containing about 250 taste buds along the trench walls (see Figure 15.21A). Two foliate papillae are present on the posterolateral tongue, each having about 20 parallel ridges with about 600 taste buds in their walls. Thus, chemical stimuli on the tongue first stimulate receptors in the fungiform papillae and then in the foliate and circumvallate papillae. Tastants subsequently stimulate scattered taste buds in the pharynx, lar- ynx, and upper esophagus.
سه نوع پاپیلا وجود دارد: قارچی شکل (که حدود ۲۵٪ از کل جوانههای چشایی را شامل میشوند)، دریچهای (۵۰٪) و برگی (۲۵٪ باقیمانده). این سه دسته به صورت ناپیوسته روی سطح زبان توزیع شدهاند. پاپیلاهای قارچی شکل فقط در دو سوم قدامی زبان یافت میشوند؛ بیشترین تراکم (حدود ۳۰ عدد در هر سانتیمتر مربع) در نوک زبان است. پاپیلاهای قارچی شکل ساختاری شبیه قارچ دارند (از این رو نام آنها) و معمولاً حدود سه جوانه چشایی در سطح رأسی خود دارند. نه پاپیلا دریچهای در عقب زبان یک شیار تشکیل میدهند. هر کدام از یک شیار دایرهای حاوی حدود ۲۵۰ جوانه چشایی در امتداد دیوارههای شیار تشکیل شدهاند (شکل ۱۵.۲۱A را ببینید). دو پاپیلا برگی شکل در زبان خلفی-جانبی وجود دارد که هر کدام حدود ۲۰ برآمدگی موازی با حدود ۶۰۰ جوانه چشایی در دیوارههای خود دارند. بنابراین، محرکهای شیمیایی روی زبان ابتدا گیرندههای موجود در پاپیلای قارچیشکل و سپس گیرندههای موجود در پاپیلای برگی و گرداگرد زبان را تحریک میکنند. طعمدهندهها متعاقباً جوانههای چشایی پراکنده در حلق، حنجره و مری فوقانی را تحریک میکنند.
Based on general agreement across cultures, the taste system detects five per- ceptually distinct categories of tastants: salt, sour, sweet, bitter, and umami. (From the Japanese word for “delicious,” umami refers to savory tastes, including monosodium glutamate and other amino acids that provide the flavor in cooked. meat and other protein rich foods.) These five perceptual categories have dietary and metabolic significance: Salt tastes include NaCl, which is needed for electrolyte balance; sour tastes, associated with acidity and thus protons (H), indicate the palatability of various foods (e.g., the citric acid in oranges); sugars such as glucose and other carbohydrates are needed for energy; bitter tasting molecules, including plant alkaloids such as atropine, quinine, and strychnine, indicate foods that may be poisonous; and essential amino. acids such as glutamate are needed for protein synthesis.
بر اساس توافق عمومی در فرهنگها، سیستم چشایی پنج دسته طعم متمایز ادراکی را تشخیص میدهد: شور، ترش، شیرین، تلخ و اومامی. (اومامی از کلمه ژاپنی به معنای “خوشمزه” به طعمهای خوش طعم، از جمله مونوسدیم گلوتامات و سایر اسیدهای آمینه که طعم گوشت پخته شده و سایر غذاهای غنی از پروتئین را فراهم میکنند، اشاره دارد.) این پنج دسته ادراکی اهمیت غذایی و متابولیکی دارند: طعمهای شور شامل NaCl است که برای تعادل الکترولیت مورد نیاز است؛ طعمهای ترش، که با اسیدیته و در نتیجه پروتونها (H) مرتبط هستند، نشاندهنده خوشمزگی غذاهای مختلف هستند (مثلاً اسید سیتریک موجود در پرتقال)؛ قندهایی مانند گلوکز و سایر کربوهیدراتها برای انرژی مورد نیاز هستند؛ مولکولهای تلخ مزه، از جمله آلکالوئیدهای گیاهی مانند آتروپین، کینین و استریکنین، نشاندهنده غذاهایی هستند که ممکن است سمی باشند؛ و اسیدهای آمینه ضروری مانند گلوتامات برای سنتز پروتئین مورد نیاز هستند.
There are obvious limitations to this classification. Peo- ple experience a variety of gustatory or ingestive sensations in addition to these five, including astringent (cranberries, tea), pungent (hot peppers, ginger), fat, starch, and various metallic tastes, to name only a few. In addition, mixtures of chemicals may elicit entirely new taste sensations. Finally, at low concentrations the protective response to aversive tastes can be overridden, leading to acquired tastes for foods having sour or bitter flavor, such as lemons (sour) and quinine (bitter).
محدودیتهای آشکاری برای این طبقهبندی وجود دارد. افراد علاوه بر این پنج مورد، انواع مختلفی از احساسات چشایی یا بلع را تجربه میکنند، از جمله گس (زغال اخته، چای)، تند (فلفل تند، زنجبیل)، چربی، نشاسته و طعمهای مختلف فلزی، که تنها چند مورد از آنها را نام بردیم. علاوه بر این، مخلوطی از مواد شیمیایی ممکن است احساسات چشایی کاملاً جدیدی را ایجاد کنند. در نهایت، در غلظتهای پایین، پاسخ محافظتی به طعمهای بد میتواند نادیده گرفته شود و منجر به طعمهای اکتسابی برای غذاهایی با طعم ترش یا تلخ، مانند لیمو (ترش) و کینین (تلخ) شود.
Although all tastes can be detected over the entire surface of the tongue, different regions of the tongue have different thresholds for various tastes (Figure 15.22A). These discontinuities in taste sensitivity may be related to the aesthetic, metabolic, and potentially toxic qualities detected by the taste receptors in the tongue. The tip of the tongue is most responsive to sweet, umami, and salty compounds, all of which produce pleasurable sensations at somewhat higher concentrations. Thus, tastes encountered by this region the initial point of contact for most ingested foods activate feeding behaviors such as mouth movements, salivary secretion, insulin release, and swallowing. The acquisition of foods high in carbohydrates and amino acids is beneficial (in moderation), and thus it is not surprising that the most exposed region of the tongue is especially sensitive to these tastes.
اگرچه میتوان همه مزهها را در تمام سطح زبان تشخیص داد، اما مناطق مختلف زبان آستانههای متفاوتی برای مزههای مختلف دارند (شکل 15.22A). این ناپیوستگیها در حساسیت به مزه ممکن است مربوط به ویژگیهای زیباییشناختی، متابولیکی و بالقوه سمی باشد که توسط گیرندههای چشایی در زبان تشخیص داده میشوند. نوک زبان بیشترین واکنش را به ترکیبات شیرین، اومامی و شور نشان میدهد که همگی در غلظتهای نسبتاً بالاتر، احساسات لذتبخشی ایجاد میکنند. بنابراین، مزههایی که این ناحیه، نقطه اولیه تماس برای اکثر غذاهای بلعیده شده، با آنها مواجه میشود، رفتارهای تغذیهای مانند حرکات دهان، ترشح بزاق، آزادسازی انسولین و بلع را فعال میکند. دریافت غذاهای سرشار از کربوهیدرات و اسیدهای آمینه (در حد اعتدال) مفید است و بنابراین جای تعجب نیست که در معرضترین ناحیه زبان به ویژه به این مزهها حساس باشد.

FIGURE 15.22 Peripheral innervation of the tongue. (A) Responses to sweet/umami, salty, sour, and bitter tastants recorded in the three cranial nerves that innervate the tongue and epiglottis. (B) Composite fMRI showing the different locations of focal activation in the insular cortex in response to each of the tastes encoded by taste receptors. (B from Schoenfeld et al., 2004.)
شکل ۱۵.۲۲ عصبدهی محیطی زبان. (الف) پاسخ به طعمهای شیرین/اومامی، شور، ترش و تلخ که در سه عصب جمجمهای که زبان و اپیگلوت را عصبدهی میکنند ثبت شده است. (ب) fMRI ترکیبی که مکانهای مختلف فعالسازی کانونی در قشر اینسولار را در پاسخ به هر یک از طعمهای کدگذاری شده توسط گیرندههای چشایی نشان میدهد. (ب از Schoenfeld و همکاران، ۲۰۰۴.)
Sour and bitter taste sensitivity is lowest toward the tip and greatest on the sides and back of the tongue. It seems reasonable that, once it has analyzed for nutrient content, the receptor surface might next evaluate aesthetic characteristics like acidity and bitterness that indicate lack of palatability (excessive sourness) or even toxicity (bitterness). Sourtasting compounds elicit grimaces, puckering, and massive salivary secretion to dilute the tastant. Activation of the rear of the tongue by bitter tasting substances elic- its protrusion of the tongue and other protective reactions (expectoration and gagging) that prevent ingestion.
حساسیت به طعم ترش و تلخ در نوک زبان کمترین و در کنارهها و پشت زبان بیشترین است. منطقی به نظر میرسد که پس از تجزیه و تحلیل محتوای مواد مغذی، سطح گیرنده ممکن است در مرحله بعد ویژگیهای زیباییشناختی مانند اسیدیته و تلخی را ارزیابی کند که نشاندهنده عدم خوشمزگی (ترشی بیش از حد) یا حتی سمیت (تلخی) است. ترکیبات ترش مزه باعث ایجاد اخم، چین و چروک و ترشح زیاد بزاق برای رقیق کردن طعم میشوند. فعال شدن قسمت عقب زبان توسط مواد تلخ مزه باعث بیرون زدگی زبان و سایر واکنشهای محافظتی (خلط و عق زدن) میشود که از بلع جلوگیری میکند.
Each of the primary tastes represented over the surface of the tongue corresponds to a distinct class of receptor molecules expressed in subsets of taste cells (see the next section). Thus, representation in taste buds of the five primary categories of taste perception is closely linked to the molecular biology of taste transduction. These taste categories are also maintained in the representation of taste information in the CNS, including in the insular taste cortex (Figure 15.22B). Mapping of responses to sweet, bitter, salty, sour, and umami in typical humans shows that each of these tastes elicits focal activity in the taste cortex, suggesting that information about each taste category re- mains somewhat segregated throughout the taste system.
هر یک از مزههای اولیه که روی سطح زبان نمایش داده میشوند، مربوط به دستهی متمایزی از مولکولهای گیرنده هستند که در زیرمجموعههایی از سلولهای چشایی بیان میشوند (به بخش بعدی مراجعه کنید). بنابراین، نمایش پنج دستهی اصلی درک مزه در جوانههای چشایی ارتباط نزدیکی با زیستشناسی مولکولی انتقال مزه دارد. این دستههای مزه همچنین در نمایش اطلاعات مزه در سیستم عصبی مرکزی، از جمله در قشر چشایی جزیرهای، حفظ میشوند (شکل 15.22B). نقشهبرداری از پاسخها به شیرینی، تلخی، شوری، ترشی و اومامی در انسانهای معمولی نشان میدهد که هر یک از این مزهها فعالیت کانونی را در قشر چشایی ایجاد میکنند، که نشان میدهد اطلاعات مربوط به هر دسته مزه تا حدودی در سراسر سیستم چشایی مجزا باقی میماند.
As with olfaction, gustatory sensitivity declines with age. An obvious index of this decline is the tendency of adults to add more salt and spices to food than children do. The decreased sensitivity to salt can be problematic for older people with hypertension as well as electrolyte and/or fluid balance problems. Unfortunately, a safe and effective substitute for table salt (NaCl) has not yet been developed.
مانند بویایی، حساسیت چشایی با افزایش سن کاهش مییابد. یک شاخص بارز این کاهش، تمایل بزرگسالان به افزودن نمک و ادویه بیشتر به غذا نسبت به کودکان است. کاهش حساسیت به نمک میتواند برای افراد مسن مبتلا به فشار خون بالا و همچنین مشکلات تعادل الکترولیت و/یا مایعات مشکلساز باشد. متأسفانه، هنوز جایگزینی ایمن و مؤثر برای نمک طعام (NaCl) توسعه نیافته است.
Taste Receptor Proteins and Transduction
Within the taste buds, only the taste cells are specialized for sensory transduction, and their basic structure and function are uniform across all classes of papillae and their constituent taste buds. Taste cells have distinct apical and basal domains, reflecting their epithelial character (Figure 15.23). Chemosensory transduction is initiated in the apical domain of the taste cells, and electrical signals are generated at the basal domain via graded receptor potentials (and corresponding secretion of neurotransmitters). The specific neurotransmitters released by taste cells remain. uncertain but are thought to include serotonin, ATP, and GABA. Taste receptor proteins and related signaling molecules, like those in ORNS, are concentrated on microvilli that emerge from the taste cell apical surface. The basal domain is specialized for synaptic activation in response to tastant binding on apical receptor proteins. There are voltage regulated ion channels as well as channels controlled by second messengers especially members of the transient receptor potential, or TRP, family. In addition, local endoplasmic reticulum acts as a store that provides Ca2+ to facilitate synaptic vesicle fusion and neurotrans mitter release at synapses made onto gustatory afferents at the basal surface. These synapses are made onto primary afferent axons from branches of three cranial nerves: the facial (VII), glossopharyngeal (IX), and vagus (X) nerves (see Figure 15.20A,B).
پروتئینهای گیرنده چشایی و انتقال حس
در جوانههای چشایی، فقط سلولهای چشایی برای انتقال حس تخصص یافتهاند و ساختار و عملکرد اساسی آنها در تمام طبقات پاپیلاها و جوانههای چشایی تشکیلدهنده آنها یکسان است. سلولهای چشایی دارای دامنههای رأسی و قاعدهای متمایزی هستند که منعکسکننده ویژگی اپیتلیالی آنها است (شکل 15.23). انتقال حس شیمیایی در دامنه رأسی سلولهای چشایی آغاز میشود و سیگنالهای الکتریکی در دامنه قاعدهای از طریق پتانسیلهای گیرنده درجهبندیشده (و ترشح مربوط به انتقالدهندههای عصبی) تولید میشوند. انتقالدهندههای عصبی خاص آزاد شده توسط سلولهای چشایی هنوز نامشخص هستند، اما تصور میشود که شامل سروتونین، ATP و GABA باشند. پروتئینهای گیرنده چشایی و مولکولهای سیگنالینگ مرتبط، مانند آنهایی که در ORNS وجود دارند، بر روی میکروویلیهایی متمرکز شدهاند که از سطح رأسی سلول چشایی خارج میشوند. دامنه قاعدهای برای فعالسازی سیناپسی در پاسخ به اتصال طعم به پروتئینهای گیرنده رأسی تخصص یافته است. کانالهای یونی تنظیمشده با ولتاژ و همچنین کانالهایی که توسط پیامرسانهای ثانویه، بهویژه اعضای خانواده پتانسیل گیرنده گذرا یا TRP، کنترل میشوند، وجود دارد. علاوه بر این، شبکه آندوپلاسمی موضعی به عنوان مخزنی عمل میکند که +Ca2 را برای تسهیل ادغام وزیکولهای سیناپسی و آزادسازی نوروترانسمیتر در سیناپسهای ساخته شده بر روی آورانهای چشایی در سطح پایه فراهم میکند. این سیناپسها بر روی آکسونهای آوران اولیه از شاخههای سه عصب جمجمهای ساخته میشوند: اعصاب صورت (VII)، زبانی-حلقی (IX) و واگ (X) (شکل 15.20A، B را ببینید).
Five distinct classes of taste receptor molecules represent tastants in the major perceptual categories salty, sour, sweet, bitter, and umami. These receptor molecules are thought to be concentrated primarily in the apical microvilli of taste cells. Salty and sour tastes are elicited by ionic stimuli such as the positively charged ions in salts (e.g., Na+ from NaCl), or the H+ in acids (e.g., acetic acid, which gives vinegar its sour taste). Thus, the ions in salty and sour tastants initiate sensory transduction via specificion channels, most likely an amiloride sensitive Na+ channel for salty tastes (Figure 15.24A) and, for sour, an H+ permeant, nonselective cation channel that is a member of the TRP family (Figure 15.24B). The sour receptor channel is related to a similar channel pro- tein that is mutated in polycystic kidney disease; thus, the channel is referred to as PKD.
پنج دسته مجزا از مولکولهای گیرنده طعم، طعمها را در دستههای اصلی ادراکی نشان میدهند شور، ترش، شیرین، تلخ و اومامی تصور میشود. که این مولکولهای گیرنده عمدتاً در میکروویلیهای رأسی سلولهای چشایی متمرکز هستند. طعمهای شور و ترش توسط محرکهای یونی مانند یونهای دارای بار مثبت در نمکها (مثلاً +Na از NaCl) یا +H در اسیدها (مثلاً اسید استیک که به سرکه طعم ترش میدهد) ایجاد میشوند. بنابراین، یونهای موجود در طعمهای شور و ترش، انتقال حسی را از طریق کانالهای اختصاصی آغاز میکنند، به احتمال زیاد یک کانال +Na حساس به آمیلورید برای طعمهای شور (شکل 15.24A) و برای طعم ترش، یک کانال کاتیونی غیرانتخابی نفوذپذیر به +H که عضوی از خانواده TRP است (شکل 15.24B). کانال گیرنده طعم ترش به یک پروتئین کانال مشابه مرتبط است که در بیماری کلیه پلی کیستیک جهش یافته است. بنابراین، این کانال به عنوان PKD شناخته میشود.

FIGURE 15.23 Sensory transduction in taste cells. Taste cells are polarized epithelial cells with an apical and a basal domain sepa- rated by tight junctions. Tastant-transducing channels (salt and sour) and G-protein coupled receptors (sweet, amino acid, and bitter) are limited to the apical domain. Intracellular signaling components that are coupled to taste receptor molecules (G-proteins and various second messenger related molecules) are also enriched in the apical domain. Voltage regulated Na+, K+, and Ca2+ channels mediate release of neurotransmitter from presynaptic specializations at the base the cell onto terminals of peripheral sensory afferents. These channels are limited to the basolateral domain, as is endoplasmic reticulum that also modulates intracellular Ca2+ concentration and contributes to the release of neurotransmitter. The neurotransmitter serotonin, among others, is found in taste cells, and serotonin receptors are found on the sensory afferents. Finally, the TRPM, channel, which facilitates G-protein coupled receptor mediated depolarization, is expressed in taste cells. Its localization to apical versus basal domains is not yet known.
شکل ۱۵.۲۳ انتقال حسی در سلولهای چشایی. سلولهای چشایی، سلولهای اپیتلیال قطبیشده با یک دامنه رأسی و یک دامنه قاعدهای هستند که توسط اتصالات محکم از هم جدا شدهاند. کانالهای انتقالدهنده طعم (شور و ترش) و گیرندههای جفتشده با پروتئین G (شیرینی، اسید آمینه و تلخی) به دامنه رأسی محدود میشوند. اجزای سیگنالدهی درون سلولی که به مولکولهای گیرنده طعم (پروتئینهای G و مولکولهای مختلف مرتبط با پیامرسان ثانویه) متصل میشوند نیز در دامنه رأسی غنی شدهاند. کانالهای +Na+، K و +Ca2 تنظیمشده با ولتاژ، آزادسازی انتقالدهنده عصبی را از تخصصهای پیشسیناپسی در پایه سلول به پایانههای آورانهای حسی محیطی واسطهگری میکنند. این کانالها به دامنه قاعدهای-جانبی محدود میشوند، همانطور که شبکه آندوپلاسمی نیز غلظت +Ca2 درون سلولی را تعدیل میکند و در آزادسازی انتقالدهنده عصبی نقش دارد. انتقالدهنده عصبی سروتونین، در میان سایر انتقالدهندههای عصبی، در سلولهای چشایی یافت میشود و گیرندههای سروتونین روی آورانهای حسی یافت میشوند. در نهایت، کانال TRPM که دپلاریزاسیون واسطهای گیرنده جفتشده با پروتئین G را تسهیل میکند، در سلولهای چشایی بیان میشود. مکانیابی آن در دامنههای رأسی در مقابل پایهای هنوز مشخص نیست.
The sour receptor is expressed in a subset of taste. cells, similar to the segregated expression of receptor proteins for sweet, umami, and bitter. The receptor potentials generated by the positive inward current carried either by Nat for salty or H+ for sour directly depolarize the relevant taste cell. The initial depolar ization leads to the activation of voltage gated Na+ channels in the basolateral aspect of the taste cell. This additional depolarization activates voltage gated Ca2+ channels, leading to the release of neurotrans mitter from the basal aspect of the taste cell and the activation of action potentials in ganglion cell axons (see Figure 15.23).
گیرنده ترشی در زیرمجموعهای از سلولهای چشایی بیان میشود، مشابه بیان جداگانه پروتئینهای گیرنده برای شیرینی، اومامی و تلخی. پتانسیلهای گیرنده تولید شده توسط جریان مثبت رو به داخل که توسط Nat برای شوری یا +H برای ترشی حمل میشود، مستقیماً سلول چشایی مربوطه را دپلاریزه میکند. دپلاریزاسیون اولیه منجر به فعال شدن کانالهای +Na وابسته به ولتاژ در سطح قاعدهای-جانبی سلول چشایی میشود. این دپلاریزاسیون اضافی، کانالهای +Ca2 وابسته به ولتاژ را فعال میکند و منجر به آزادسازی انتقالدهنده عصبی از سطح قاعدهای سلول چشایی و فعال شدن پتانسیلهای عمل در آکسونهای سلولهای گانگلیونی میشود (شکل 15.23 را ببینید).
In humans and other mammals, sweet and umami receptors are heterodimeric G-protein-coupled receptors that share a common 7-transmembrane receptor subunit called T1R3, paired with the T1R2 7-transmembrane receptor for perception of sweet, or with the T1R1 receptor for amino acids (Figure 15.24C,D). The T1R2 and T1R1 receptors are expressed in different subsets of taste cells, indicating the presence of, respectively, sweet- and amino acid-selective cells in the taste buds. Upon binding sugars or other sweet stimuli, the T1R2/T1R3 receptor heterodimer initiates a G-protein mediated signal transduction cascade that leads to activation of the phospholipase C isoform PLCẞ2, leading in turn to increased concentrations of inositol triphosphate (IP3) and to the opening of TRP channels (specifically the TRPM, channel), which depolarizes the taste cell via increased intracellular Ca2+. Similarly, the T1R1/T1R3 receptor is broadly tuned to the 20 standard L-amino acids found in proteins (but not to their D-amino acid enantiomers). Transduction of amino acid stimuli via the T1R1/T1R3 receptor also reflects G-protein coupled intracellular signaling leading to PLCẞ2-mediated activation of the TRPM5 channel and depolarization of the taste cell (see Figure 15.24D).
در انسان و سایر پستانداران، گیرندههای شیرینی و اومامی، گیرندههای هترودایمری جفتشده با پروتئین G هستند که یک زیر واحد گیرنده 7 غشایی مشترک به نام T1R3 را به اشتراک میگذارند که با گیرنده 7 غشایی T1R2 برای درک شیرینی یا با گیرنده T1R1 برای اسیدهای آمینه جفت میشود (شکل 15.24C,D). گیرندههای T1R2 و T1R1 در زیرمجموعههای مختلفی از سلولهای چشایی بیان میشوند که نشاندهنده وجود سلولهای انتخابی شیرین و اسید آمینه به ترتیب در جوانههای چشایی است. پس از اتصال قندها یا سایر محرکهای شیرینی، هترودایمرهای گیرنده T1R2/T1R3 یک آبشار انتقال سیگنال با واسطه پروتئین G را آغاز میکنند که منجر به فعال شدن C ایزوفرم فسفولیپاز PLCẞ2 میشود و به نوبه خود منجر به افزایش غلظت اینوزیتول تری فسفات (IP3) و باز شدن کانالهای TRP (به ویژه کانال TRPM) میشود که سلول چشایی را از طریق افزایش +Ca2 درون سلولی دپلاریزه میکند. به طور مشابه، گیرنده T1R1/T1R3 به طور گسترده با 20 اسید آمینه استاندارد L موجود در پروتئینها تنظیم شده است (اما نه با انانتیومرهای D-اسید آمینه آنها). انتقال محرکهای اسید آمینه از طریق گیرنده T1R1/T1R3 همچنین سیگنالینگ درون سلولی همراه با پروتئین G را نشان میدهد که منجر به فعال شدن کانال TRPM5 با واسطه PLCẞ2 و دپلاریزاسیون سلول چشایی میشود (شکل 15.24D را ببینید).
Another family of G-protein coupled receptors known as T2R receptors transduces bitter tastes. Approximately 30 genes in humans and other mammals encode 30 T2R subtypes, and single taste cells express multiple T2R subtypes. Indeed, in humans a well-known mutation for the perception of a specific bitter tastant phenothylcarbamide (PTC) was originally discovered in the early 1930s and identified as a simple Mendelian trait shortly thereafter; this has proven to be a mutation of a human T2R gene. The observation of a selective single gene mutation for bitter taste indicates that this taste category is distinct and encoded specifically in taste receptor cells. The distribution of T2R receptors among taste cells supports this view. T2Rs are not expressed in the same taste cells as T1R1, T1R2, and T1R3 receptors. Thus, the receptor cells for bitter tastants are presumably completely distinct from those for sweet and umami, which share at least one heterodimeric G-protein-coupled receptor subunit.
خانواده دیگری از گیرندههای جفتشده با پروتئین G که به عنوان گیرندههای T2R شناخته میشوند، طعمهای تلخ را منتقل میکنند. تقریباً 30 ژن در انسان و سایر پستانداران، 30 زیرگروه T2R را رمزگذاری میکنند و سلولهای چشایی منفرد، چندین زیرگروه T2R را بیان میکنند. در واقع، در انسان، یک جهش شناختهشده برای درک طعم تلخ خاص فنوتیل کاربامید (PTC) در ابتدا در اوایل دهه 1930 کشف شد و اندکی پس از آن به عنوان یک ویژگی ساده مندلی شناسایی شد. ثابت شده است که این جهش، جهشی از یک ژن T2R انسانی است. مشاهده یک جهش تک ژنی انتخابی برای طعم تلخ نشان میدهد که این دسته از طعمها متمایز هستند و به طور خاص در سلولهای گیرنده طعم کدگذاری میشوند. توزیع گیرندههای T2R در بین سلولهای چشایی از این دیدگاه پشتیبانی میکند. گیرندههای T2R در همان سلولهای چشایی گیرندههای T1R1، T1R2 و T1R3 بیان نمیشوند. بنابراین، سلولهای گیرنده طعمهای تلخ احتمالاً کاملاً از سلولهای شیرین و اومامی متمایز هستند که حداقل یک زیر واحد گیرنده جفتشده با پروتئین G هترودایمر را به اشتراک میگذارند.




FIGURE 15.24 Molecular mechanisms of taste transduction via ion channels and G-protein coupled receptors. (A) Cation selectivity of the amiloride sensitive Na+ channel versus the H+ sensitive proton channel provides the basis for specificity of salty tastes. (B) Sour tastants are transduced by a proton-permeant, nonselective cation channel that is a member of the transient receptor potential (TRP) channel family. In both cases, positive current via the cation channel leads to depolarization of the cell. (C-E) For sweet, amino acid (umami), and bitter tastants, different classes of G-protein coupled receptors mediate transduction. (C) For sweet tastants, heteromeric complexes of the T1R2 and TIR3 receptors transduce stimuli via a PLCẞ2 mediated, IP-dependent mechanism that leads to activation of the TRPM, Ca2+ channel. (D) For amino acids, heteromeric complexes of TIRI and T1R3 receptors transduce stimuli via the same PLCẞ2/IP3/TRPM, dependent mechanism. (E) Bitter tastes are transduced via a distinct set of G-protein coupled receptors, the T2R receptor subtypes. The details of T2R receptors are less well established; however, they apparently associate with the taste cell-specific G-protein gustducin, which is not found in sweet or amino acid receptor expressing taste cells. Nevertheless, stimulus-coupled depolarization for bitter tastes relies on the same PLCẞ2/IP3/TRPM5-depen- dent mechanism used for sweet and amino acid taste transduction.
شکل ۱۵.۲۴ مکانیسمهای مولکولی انتقال طعم از طریق کانالهای یونی و گیرندههای جفتشده با پروتئین G. (الف) گزینشپذیری کاتیونی کانال +Na حساس به آمیلورید در مقابل کانال پروتون حساس به +H، مبنای اختصاصی بودن طعمهای شور را فراهم میکند. (ب) طعمهای ترش توسط یک کانال کاتیونی غیرانتخابی و نفوذکننده به پروتون که عضوی از خانواده کانالهای پتانسیل گیرنده گذرا (TRP) است، انتقال مییابند. در هر دو مورد، جریان مثبت از طریق کانال کاتیونی منجر به دپلاریزاسیون سلول میشود. (ج-ه) برای طعمهای شیرین، اسید آمینه (اومامی) و تلخ، دستههای مختلف گیرندههای جفتشده با پروتئین G واسطه انتقال طعم هستند. (ج) برای طعمهای شیرین، کمپلکسهای هترومریک گیرندههای T1R2 و TIR3 محرکها را از طریق یک مکانیسم وابسته به IP و با واسطه PLCẞ2 انتقال میدهند که منجر به فعال شدن کانال +TRPM، Ca2+ میشود. (د) برای اسیدهای آمینه، کمپلکسهای هترومریک گیرندههای TIRI و T1R3 محرکها را از طریق همان مکانیسم وابسته به PLCẞ2/IP3/TRPM منتقل میکنند. (ه) طعمهای تلخ از طریق مجموعهای متمایز از گیرندههای جفتشده با پروتئین G، یعنی زیرگروههای گیرنده T2R، منتقل میشوند. جزئیات گیرندههای T2R کمتر مشخص شده است. با این حال، ظاهراً آنها با گاستوکین پروتئین G مخصوص سلول چشایی مرتبط هستند که در سلولهای چشایی بیانکننده گیرندههای شیرین یا اسید آمینه یافت نمیشود. با این وجود، دپلاریزاسیون جفتشده با محرک برای طعمهای تلخ به همان مکانیسم وابسته به PLCẞ2/IP3/TRPM5 متکی است که برای انتقال طعم شیرین و اسید آمینه استفاده میشود.
Although the transduction of bitter stimuli relies on a mechanism similar to that for sweet and amino acid tastes, the taste cell specific G-protein gustducin, found primarily in T2R expressing taste cells, apparently contributes to the transduction of bitter tastes (Figure 15.24E). The role of gustducin versus that of the other G-proteins for transduction of sweet and umami/amino acid tastes remains unclear. The remaining steps in bitter transduction are similar to those for sweet and amino acids: PLCẞ2 mediated activation of TRPM, channels depolarizes the taste cell, resulting in the release of neurotransmitter at the synapse between the taste cell and sensory ganglion cell axon.
اگرچه انتقال محرکهای تلخی به مکانیسمی مشابه مکانیسم طعمهای شیرین و اسیدهای آمینه متکی است، اما گاستوکین، پروتئین G مخصوص سلول چشایی، که عمدتاً در سلولهای چشایی بیانکننده T2R یافت میشود، ظاهراً در انتقال طعمهای تلخ نقش دارد (شکل 15.24E). نقش گاستوکین در مقایسه با سایر پروتئینهای G برای انتقال طعمهای شیرین و اومامی/اسید آمینه هنوز مشخص نیست. مراحل باقیمانده در انتقال تلخی مشابه مراحل شیرین و اسیدهای آمینه است: فعالسازی TRPM با واسطه PLCẞ2، کانالها سلول چشایی را دپلاریزه میکند و منجر به آزاد شدن انتقالدهنده عصبی در سیناپس بین سلول چشایی و آکسون سلول گانگلیونی حسی میشود.
Neural Coding in the Taste System
In the taste system, neural coding refers to the way that the identity, concentration, and “hedonic” (pleasurable or aversive) value of tastants is represented in the pattern of action potentials relayed to the brain from the taste buds. Neurons in the taste system might be specifically “tuned” to respond with a maximum change in electrical activity to a single taste stimulus. Such tuning might rely on specificity at the level of the receptor cells, as well as on the maintenance of separate channels for the relay of this information from the periphery to the brain. This sort of coding scheme is often referred to as a labeled line code, since responses in specific cells at multiple points in the pathway presumably correspond to distinct stimuli. The segregated expression of sour, sweet, amino acid, and bitter receptors in different taste cells (Figure 15.25A-C) and the maintenance of focal activation for each class of taste in the insular taste cortex (see Figure 15.20C) are consistent with labeled line coding.
کدگذاری عصبی در سیستم چشایی
در سیستم چشایی، کدگذاری عصبی به نحوه نمایش هویت، غلظت و ارزش “لذتبخش یا آزاردهنده” طعمها در الگوی پتانسیلهای عمل منتقل شده به مغز از جوانههای چشایی اشاره دارد. نورونهای سیستم چشایی ممکن است به طور خاص “تنظیم” شوند تا با حداکثر تغییر در فعالیت الکتریکی به یک محرک چشایی واحد پاسخ دهند. چنین تنظیمی ممکن است به ویژگی در سطح سلولهای گیرنده و همچنین به حفظ کانالهای جداگانه برای انتقال این اطلاعات از حاشیه به مغز متکی باشد. این نوع طرح کدگذاری اغلب به عنوان یک کد خط برچسبگذاری شده شناخته میشود، زیرا پاسخها در سلولهای خاص در نقاط مختلف مسیر احتمالاً با محرکهای متمایز مطابقت دارند. بیان جداگانه گیرندههای ترش، شیرین، اسید آمینه و تلخ در سلولهای چشایی مختلف (شکل 15.25A-C) و حفظ فعالسازی کانونی برای هر دسته از طعم در قشر چشایی جزیرهای (به شکل 15.20C مراجعه کنید) با کدگذاری خط برچسبگذاری شده سازگار است.
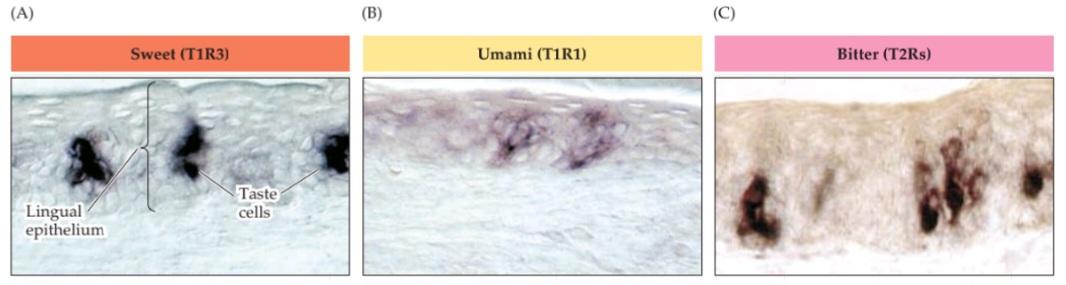

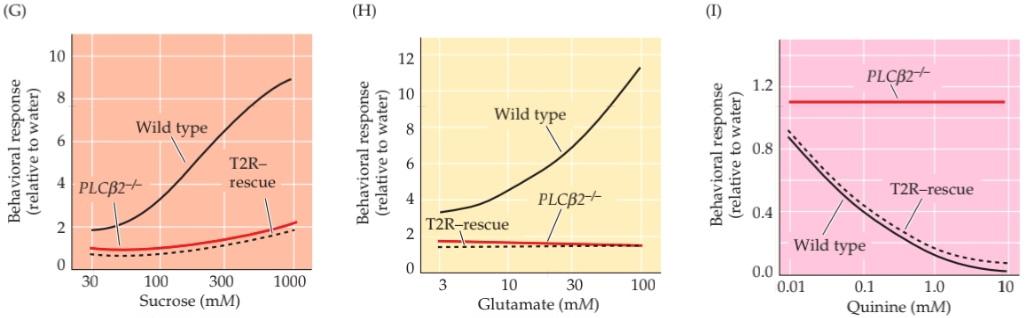
FIGURE 15.25 Specificity in peripheral taste coding supports the labeled line hypothesis. (A-C) Sweet (A), amino acid (B), and bitter (C) receptors are expressed in different subsets of taste cells. (D-E) The gene for the TRPM, channel can be inactivated, or “knocked out,” in mice (TRPM) and behavioral responses measured with a taste preference test. The mouse is presented with two drinking spouts, one with water and the other with a tastant; behavioral responses are measured as the frequency of licking of the two spouts. For pleasant tastes such as sweet (sucrose; D) or umami (glutamate; E), control (i.e., wild type) mice lick the spout with the tastant more frequently, and higher concentrations of tastant lead to increased response (black lines). In TRPM5/- mice, this behavioral response (i.e., a preference for the tastant versus water) is eliminated at all concentrations (red lines). (F) For an aversive tastant like bitter quinine, control mice prefer water. This behavioral response which is initially low is further diminished with higher quinine concentrations (black line). Inactivation of TRPM, also eliminates this behavioral response, regardless of tastant concentration (red line). (G-I) When the PLCB2 gene is knocked out, the behavioral response to sucrose (G), glutamate (H), and quinine (1) is eliminated (red lines). When PLCẞ2 is reexpressed only in T2R-expressing taste cells, behavioral responses to sucrose and glutamate are not rescued (dashed black lines in G and H); however, the behav- ioral response to quinine is restored to normal levels (compare the solid and dashed black lines in I). (A,B from Nelson et al., 2001; C from Adler et al., 2000; D-I after Zhang et al., 2003.)
شکل ۱۵.۲۵ اختصاصی بودن در کدگذاری طعم محیطی، فرضیه خط برچسبگذاری شده را تأیید میکند. (A-C) گیرندههای شیرینی (A)، اسید آمینه (B) و تلخ (C) در زیرمجموعههای مختلفی از سلولهای چشایی بیان میشوند. (D-E) ژن مربوط به کانال TRPM میتواند در موشها غیرفعال یا “خاموش” شود (TRPM) و پاسخهای رفتاری با آزمایش ترجیح طعم اندازهگیری شوند. به موش دو دهانه نوشیدنی، یکی با آب و دیگری با یک مزه داده میشود؛ پاسخهای رفتاری به صورت دفعات لیسیدن دو دهانه اندازهگیری میشوند. برای طعمهای دلپذیر مانند شیرینی (ساکارز؛ D) یا اومامی (گلوتامات؛ E)، موشهای کنترل (یعنی نوع وحشی) دهانه حاوی مزه را بیشتر لیس میزنند و غلظتهای بالاتر مزه منجر به افزایش پاسخ میشود (خطوط سیاه). در موشهای TRPM5/-، این پاسخ رفتاری (یعنی ترجیح مزه در مقابل آب) در تمام غلظتها (خطوط قرمز) حذف میشود. (و) برای یک طعم بد مانند کینین تلخ، موشهای گروه کنترل آب را ترجیح میدهند. این پاسخ رفتاری که در ابتدا کم است، با غلظتهای بالاتر کینین بیشتر کاهش مییابد (خط سیاه). غیرفعال شدن TRPM نیز این پاسخ رفتاری را صرف نظر از غلظت طعم حذف میکند (خط قرمز). (G-I) هنگامی که ژن PLCB2 غیرفعال میشود، پاسخ رفتاری به ساکارز (G)، گلوتامات (H) و کینین (1) حذف میشود (خطوط قرمز). هنگامی که PLCẞ2 فقط در سلولهای چشایی بیانکننده T2R دوباره بیان میشود، پاسخهای رفتاری به ساکارز و گلوتامات حفظ نمیشوند (خطوط سیاه خطچین در G و H)؛ با این حال، پاسخ رفتاری به کینین به سطوح طبیعی بازگردانده میشود (خطوط سیاه ممتد و خطچین را در I مقایسه کنید). (A،B از نلسون و همکاران، 2001؛ C از آدلر و همکاران، 2000؛ D-I پس از ژانگ و همکاران، 2003.)
Molecular genetic experiments in mice indicate that some perceptual taste categories are established based on the identity of T1Rs and T2Rs that are expressed in individual taste cells. Initial support came from studies in which the genes that specify the sweet and amino acid heteromeric receptors (T1R2 and T1R1) were inactivated in mice. Such mice lack behavioral responses to a broad range of sweet or amino acid stimuli, depending on the gene that has been inactivated. Moreover, recordings of electrical activity in the relevant branches of cranial nerves VII, IX, or X showed that action potentials in response to sweet or amino acid stimuli were lost in parallel with the genetic mutation and behavioral change. Finally, these deficits in transduction and perception were unchanged at a broad range of concentrations, indicating that the molecular specificity of each receptor is quite rigid the remaining receptors could not respond, even at high concentrations of sweet or amino acid stimuli (Figure 15.25D-H).
آزمایشهای ژنتیکی مولکولی در موشها نشان میدهد که برخی از دستههای چشایی ادراکی بر اساس هویت گیرندههای T1R و T2R که در سلولهای چشایی منفرد بیان میشوند، ایجاد میشوند. پشتیبانی اولیه از مطالعاتی حاصل شد که در آنها ژنهای مشخصکننده گیرندههای هترومریک شیرین و اسید آمینه (T1R2 و T1R1) در موشها غیرفعال شدند. چنین موشهایی بسته به ژن غیرفعال شده، فاقد پاسخهای رفتاری به طیف وسیعی از محرکهای شیرین یا اسید آمینه هستند. علاوه بر این، ثبت فعالیت الکتریکی در شاخههای مربوط به اعصاب جمجمهای VII، IX یا X نشان داد که پتانسیلهای عمل در پاسخ به محرکهای شیرین یا اسید آمینه به موازات جهش ژنتیکی و تغییر رفتاری از بین رفتهاند. در نهایت، این نقصها در انتقال و ادراک در طیف وسیعی از غلظتها بدون تغییر بودند، که نشان میدهد ویژگی مولکولی هر گیرنده کاملاً ثابت است و گیرندههای باقی مانده حتی در غلظتهای بالای محرکهای شیرین یا اسید آمینه نمیتوانند پاسخ دهند (شکل 15.25D-H).
These observations suggest that sweet and amino acid transduction and perception depend on labeled lines from the periphery. Bitter taste proved harder to analyze because of the larger number of T2R bitter receptors. To circumvent this challenge, Charles Zuker, Nicholas Ryba, and colleagues took advantage of the shared aspects of intracellular signaling for sweet, amino acid, and bitter tastes. If the genes for either the TRPM channel or PLCẞ2 are inactivated, behavioral and physiological responses to sweet, amino acid, and bitter stimuli are all abolished (see Figure 15.25), while salty and sour perceptions which do not rely on the G-protein coupled, PLCẞ2 mediated transduction mechanism remain. To evaluate whether taste cells expressing the T2R family of receptors provide a labeled line for bitter tastes, PLCB2 was selectively reexpressed in T2R-expressing taste cells in a PLCB2 mutant mouse. Thus, in these mice only the taste cells that normally express the T2R subset of receptor genes could tranduce taste signals. If these receptors specifically and uniquely encode bitter tastes, the “rescued” mice (i.e., those expressing PLCẞ2 in T2R cells) should regain their perceptual and physiological responses to bitter, but not sweet or amino acid, tastes. This was indeed the result of the experiment: Behavioral and physiological responses to bitter tastes, but not sweet or amino acid tastes, were restored to normal levels (Figure 15.251). Evidently, receptor proteins uniquely expressed in subsets of taste cells encode sweet, amino acid, and bitter, as judged by taste perception, action potential activity in peripheral nerves, and behavioral responses. This specificity and segregation of receptor cells at the periphery can be considered to establish labeled lines that relay the information to the CNS, where information about the identity of the five primary taste categories remains segregated. Given the clear distinctions one makes between sweet, salty, sour, bitter, and umami tastes, it seems likely that this perceptual clarity established by peripheral receptors is maintained by central representations and is used to guide specific ingestive (sweet, salty, umami) or aversive (sour, bitter) behaviors.
این مشاهدات نشان میدهد که انتقال و درک شیرینی و اسید آمینه به خطوط برچسبگذاری شده از محیط بستگی دارد. تجزیه و تحلیل طعم تلخ به دلیل تعداد بیشتر گیرندههای تلخ T2R دشوارتر بود. برای غلبه بر این چالش، چارلز زوکر، نیکلاس ریبا و همکارانشان از جنبههای مشترک سیگنالینگ درون سلولی برای طعمهای شیرین، اسید آمینه و تلخ استفاده کردند. اگر ژنهای مربوط به کانال TRPM یا PLCẞ2 غیرفعال شوند، پاسخهای رفتاری و فیزیولوژیکی به محرکهای شیرین، اسید آمینه و تلخ همگی از بین میروند (شکل 15.25 را ببینید)، در حالی که درک شوری و ترشی که به مکانیسم انتقال با واسطه PLCẞ2 متصل به G-پروتئین متکی نیستند، باقی میمانند. برای ارزیابی اینکه آیا سلولهای چشایی که خانواده گیرندههای T2R را بیان میکنند، یک خط برچسبگذاری شده برای طعمهای تلخ ارائه میدهند، PLCB2 به طور انتخابی در سلولهای چشایی بیانکننده T2R در یک موش جهشیافته PLCB2 دوباره بیان شد. بنابراین، در این موشها فقط سلولهای چشایی که به طور معمول زیرمجموعه ژنهای گیرنده T2R را بیان میکنند، میتوانند سیگنالهای چشایی را منتقل کنند. اگر این گیرندهها به طور خاص و منحصر به فرد طعمهای تلخ را رمزگذاری کنند، موشهای “نجات یافته” (یعنی آنهایی که PLCẞ2 را در سلولهای T2R بیان میکنند) باید پاسخهای ادراکی و فیزیولوژیکی خود را به طعمهای تلخ، اما نه شیرین یا اسید آمینه، بازیابی کنند. این در واقع نتیجه آزمایش بود: پاسخهای رفتاری و فیزیولوژیکی به طعمهای تلخ، اما نه شیرین یا اسید آمینه، به سطوح طبیعی بازگردانده شدند (شکل 15.251). بدیهی است که پروتئینهای گیرنده که به طور منحصر به فرد در زیرمجموعههای سلولهای چشایی بیان میشوند، شیرینی، اسید آمینه و تلخی را رمزگذاری میکنند، همانطور که با درک طعم، فعالیت پتانسیل عمل در اعصاب محیطی و پاسخهای رفتاری قضاوت میشود. این ویژگی و تفکیک سلولهای گیرنده در حاشیه را میتوان برای ایجاد خطوط برچسبگذاری شدهای در نظر گرفت که اطلاعات را به CNS منتقل میکنند، جایی که اطلاعات مربوط به هویت پنج دسته طعم اصلی جدا از هم باقی میماند. با توجه به تمایزات واضحی که بین طعمهای شیرین، شور، ترش، تلخ و اومامی قائل میشویم، به نظر میرسد که این وضوح ادراکی که توسط گیرندههای محیطی ایجاد میشود، توسط بازنماییهای مرکزی حفظ میشود و برای هدایت رفتارهای خاص خوردن (شیرین، شور، اومامی) یا بدخوری (ترش، تلخ) استفاده میشود.
Summary
The chemical senses-olfaction, vomeronasal sensation, and taste all contribute to sensing airborne or soluble mol- ecules from a variety of sources. Humans and other mammals rely on this information for behaviors as diverse as attraction, reproduction, feeding, and avoiding potentially dangerous circumstances. Receptor neurons in the olfactory epithelium transduce chemical stimuli into neuronal activity by stimulation of a large family of G-protein-coupled receptors that elicit second messenger mediated regulation of Na+, Ca2+, and Cl ion channels. These events generate olfactory receptor potentials, and ultimately action potentials, in the afferent axons of these cells. The large number of odorant receptor molecules in most species is believed to establish sensitivity to the myriad odors that animals can discriminate. In most vertebrates except humans, the vomeronasal pathway provides a parallel pathway for the detection of pheromones from conspecifics (attractive cues) and kairomones from predators or prey (aversive or attractive cues). The peripheral vomeronasal receptor neurons appear similar to ORNs, but they express a different family of G-protein coupled receptors and the intercellular trans duction mechanisms for generating action potentials is distinct from that in ORNs. Taste receptor cells, in contrast, use a variety of mechanisms for transducing a more limited range of chemical stimuli. Each of the five perceptual categories of taste salty, sour, sweet, amino acids (also known as umami), and bitter-are encoded by receptor cells that express distinct receptor proteins. Salts and protons (acids, which elicit a sour taste) directly activate two different ion channels, and for sweet, amino acid, and bitter tastes there are specific sets of G-protein coupled receptors. Olfaction, vomeronasal sensation, and taste are all relayed via specific pathways in the CNS. ORNs project directly from the periphery to the olfactory bulb, and the olfactory bulb projects primarily to the pyriform cortex. Vomeronasal receptor neurons project directly to the accessory olfactory bulb, which in turn projects to targets in the hypothalamus and amygdala. In the taste system, cranial sensory ganglion neurons relay information from taste cells to the solitary nucleus in the brainstem. The solitary nucleus projects, via the thalamus, to the taste area of the cerebral cortex, where each of the five taste categories is represented in a distinct, nonoverlapping domain. Each of these systems ultimately processes chemo sensory information in ways that give rise to some of the most sublime pleasures humans can experience.
خلاصه
حسهای شیمیایی – بویایی، حس وومرونازال و چشایی – همگی در حس کردن مولکولهای موجود در هوا یا محلول از منابع مختلف نقش دارند. انسانها و سایر پستانداران برای رفتارهای متنوعی مانند جذب، تولید مثل، تغذیه و اجتناب از شرایط بالقوه خطرناک به این اطلاعات متکی هستند. نورونهای گیرنده در اپیتلیوم بویایی، محرکهای شیمیایی را با تحریک خانواده بزرگی از گیرندههای جفتشده با پروتئین G که تنظیم کانالهای یونی Na+، Ca2+ و Cl را با واسطه پیامرسان ثانویه انجام میدهند، به فعالیت عصبی تبدیل میکنند. این رویدادها پتانسیلهای گیرنده بویایی و در نهایت پتانسیلهای عمل را در آکسونهای آوران این سلولها ایجاد میکنند. اعتقاد بر این است که تعداد زیاد مولکولهای گیرنده بو در اکثر گونهها، حساسیت به بوهای بیشماری را که حیوانات میتوانند تشخیص دهند، ایجاد میکند. در اکثر مهرهداران به جز انسان، مسیر وومرونازال مسیری موازی برای تشخیص فرومونها از همنوعان (نشانههای جذاب) و کایرومونها از شکارچیان یا طعمهها (نشانههای بد یا جذاب) فراهم میکند. نورونهای گیرنده وومرونازال محیطی شبیه به ORNها به نظر میرسند، اما آنها خانواده متفاوتی از گیرندههای جفتشده با پروتئین G را بیان میکنند و مکانیسمهای انتقال بین سلولی برای تولید پتانسیلهای عمل با ORNها متفاوت است. در مقابل، سلولهای گیرنده چشایی از مکانیسمهای متنوعی برای انتقال طیف محدودتری از محرکهای شیمیایی استفاده میکنند. هر یک از پنج دسته ادراکی طعم شور، ترش، شیرین، اسیدهای آمینه (که به عنوان اومامی نیز شناخته میشوند) و تلخ توسط سلولهای گیرندهای رمزگذاری میشوند که پروتئینهای گیرنده متمایزی را بیان میکنند. نمکها و پروتونها (اسیدها، که طعم ترش را ایجاد میکنند) مستقیماً دو کانال یونی مختلف را فعال میکنند و برای طعمهای شیرین، اسید آمینه و تلخ، مجموعههای خاصی از گیرندههای جفتشده با پروتئین G وجود دارد. بویایی، حس وومرونازال و طعم، همگی از طریق مسیرهای خاصی در CNS منتقل میشوند. ORNها مستقیماً از محیط به پیاز بویایی منتقل میشوند و پیاز بویایی در درجه اول به قشر پیریفورم منتقل میشود. نورونهای گیرندهی وومرونازال مستقیماً به پیاز بویایی فرعی میروند که به نوبهی خود به اهدافی در هیپوتالاموس و آمیگدال میپیوندد. در سیستم چشایی، نورونهای گانگلیون حسی جمجمهای اطلاعات را از سلولهای چشایی به هستهی منفرد در ساقهی مغز منتقل میکنند. هستهی منفرد، از طریق تالاموس، به ناحیهی چشایی قشر مغز منتقل میشود، جایی که هر یک از پنج دستهی چشایی در یک دامنهی متمایز و غیر همپوشان نمایش داده میشوند. هر یک از این سیستمها در نهایت اطلاعات شیمیایی-حسی را به روشهایی پردازش میکنند که منجر به برخی از والاترین لذتهایی میشود که انسانها میتوانند تجربه کنند.
ADDITIONAL READING
کلیک کنید «Reviews»
Axel, R. (2005) Scents and sensibility: A molecular logic of olfactory perception (Nobel lecture). Angew Chem., Int. Ed. (English) 44 (38): 6110-6127.
Buck, L. B. (2000) The molecular architecture of odor and pheromone sensing in mammals. Cell 100: 611-618.
Chandreshekar, J., M. A. Hoon, N. J. Ryba and C. S. Zuker (2006) The receptors and cells for mammalian taste. Nature 444: 288-294.
Hildebrand, J. G. and G. M. Shepherd (1997) Mechanisms of olfactory discrimination: Converging evidence for common principles across phyla. Annu. Rev. Neurosci. 20: 595-631.
Lindemann, B. (1996) Taste reception. Physiol. Rev. 76: 719-766. Mombaerts, P. (2004) Genes and ligands for odorant, vomero- nasal and taste receptors Nat. Rev. Neurosci. 5: 263–278.
Scott, K. (2004) The sweet and the bitter of mammalian taste. Curr. Opin. Neurobiol. 14: 423-427.
Zufall, F. and T. Leinders-Zufall (2000) The cellular and molec- ular basis of odor adaptation. Chem. Senses 25: 473-481.
کلیک کنید «Important original papers»
Adler, E. and 5 others (2000) A novel family of mammalian taste receptors. Cell 100: 693-702.
Astic, L. and D. Saucier (1986) Analysis of the topographical organization of olfactory epithelium projections in the rat. Brain Res. Bull. 16: 455-462.
Avanet, P. and B. Lindemann (1988) Amiloride-blockable sodium currents in isolated taste receptor cells. J. Memb. Biol. 105: 245-255.
Bozza, T., P. Feinstein, C. Zheng and P. Mombaerts (2002) Odorant receptor expression defines functional units in the mouse olfactory system. J. Neurosci. 22: 3033-3043.
Buck, L. and R. Axel (1991) A novel multigene family may encode odorant receptors: A molecular basis for odor recognition. Cell 65: 175-187.
Caterina, M. J. and 8 others (2000) Impaired nociception and pain sensation in mice lacking the capsaicin receptor. Science 288: 306–313.
Chaudhari, N., A. M. Landin and S. D. Roper (2000) A metabotropic glutamate receptor variant functions as a taste receptor. Nature Neurosci. 3: 113-119.
DuLac, C. and A. T. Torello (2003) Molecular detection of pheromone signals in mammals: from genes to behaviour. Nat. Rev. Neurosci. 4: 551-562.
Fleischmann, A. and 10 others (2008) Mice with a “monoclonal nose”: Perturbations in an olfactory map impair odor discrimi- nation. Neuron 60: 1068-1081.
Graziadei, P. P. C. and G. A. Monti-Graziadei (1980) Neuro- genesis and neuron regeneration in the olfactory system of mammals. III. Deafferentation and reinnervation of the olfactory bulb following section of the fila olfactoria in rat. J. Neurocytol. 9: 145-162.
Isogai, Y. and 5 others (2011) Molecular organization of vomeronasal chemoreception Nature 478: 241–245.
Kay, L. M. and G. Laurent (2000) Odor and context dependent modulation of mitral cell activity in behaving rats. Nat. Neurosci. 2: 1003-1009.
Lin, D. Y., S. D. Shea and L. D. Katz (2006) Representation of natural stimuli in the rodent main olfactory bulb. Neuron 50: 937-949.
Malnic, B., J. Hirono, T. Sato and L. B. Buck (1999) Combinato- rial receptor codes for odors. Cell 96: 713-723.
Mombaerts, P. and 7 others (1996) Visualizing an olfactory sensory map. Cell 87: 675-686.
Nelson, G. and 5 others (2001) Mammalian sweet taste receptors. Cell 106: 381-390.
Nelson, G. and 6 others (2002) An amino-acid taste receptor. Nature 416: 199–202.
Sosulski, D. L., M. L. Bloom, T. Cutforth, R. Axel and S. R. Datta (2011) Distinct representations of olfactory information in different cortical centers. Nature 472: 213-216.
Stettler, D. D. and R. Axel (2009) Representations of odor in the piriform cortex. Neuron 63: 854-864.
Vassar, R. and 5 others (1994) Topographic organization of sensory projections to the olfactory bulb. Cell 79: 981-991.
Wong, G. T., K. S. Gannon and R. F. Margolskee (1996) Transduction of bitter and sweet taste by gustducin. Nature 381: 796-800.
Zhan, C. and M. Luo (2010) Diverse patterns of odor representation by neurons in the anterior piriform cortex of awake mice. J. Neurosci. 30: 16662-16672.
Zhang, Y. and 7 others (2003) Coding of sweet, bitter, and umami tastes: Different receptor cells sharing similar signaling pathways. Cell 112: 293-301.
Zhao, G. Q. and 6 others (2003) The receptors for mammalian sweet and umami taste. Cell 115: 255-266.
کلیک کنید «Books»
Barlow, H. B. and J. D. Mollon (1989) The Senses. Cambridge, UK: Cambridge University Press, chapters 17-19.
Doty, R. L. (ed.) (1995) Handbook of Olfaction and Gustation. New York: Marcel Dekker.
Farbman, A. I. (1992) Cell Biology of Olfaction. New York: Cambridge University Press.
Getchell, T. V., L. M. Bartoshuk, R. L. Doty and J. B. Snow, Jr. (1991) Smell and Taste in Health and Disease. New York: Raven Press.
Shier, D., J. Butler, and R. Lewis (2004) Hole’s Human Anatomy and Physiology. Boston: McGraw-Hill.
Go to the NEUROSCIENCE 6e Companion Website at oup-arc.com/access/purves-6e for Web Topics, Animations, Flashcards, and more. Go to DASHBOARD for additional resources and assessments.
»
»
🚀 با ما همراه شوید!
تازهترین مطالب و آموزشهای مغز و اعصاب را از دست ندهید. با فالو کردن کانال تلگرام، از ما حمایت کنید!

