فیزیولوژی پزشکی گانونگ؛ مروری بر فیزیولوژی سلول

دعای مطالعه [ نمایش ]
بِسْمِ الله الرَّحْمنِ الرَّحیمِ
اَللّهُمَّ اَخْرِجْنى مِنْ ظُلُماتِ الْوَهْمِ
خدايا مرا بيرون آور از تاريكىهاى وهم،
وَ اَكْرِمْنى بِنُورِ الْفَهْمِ
و به نور فهم گرامى ام بدار،
اَللّهُمَّ افْتَحْ عَلَيْنا اَبْوابَ رَحْمَتِكَ
خدايا درهاى رحمتت را به روى ما بگشا،
وَانْشُرْ عَلَيْنا خَزائِنَ عُلُومِكَ بِرَحْمَتِكَ يا اَرْحَمَ الرّاحِمينَ
و خزانههاى علومت را بر ما باز كن به امید رحمتت اى مهربانترين مهربانان.
کتاب «فیزیولوژی پزشکی گانونگ» بهعنوان یکی از جامعترین و معتبرترین منابع در حوزه علوم پزشکی، همچنان مرجع کلیدی برای درک عملکرد پیچیده بدن انسان است. این اثر با تکیه بر تازهترین پژوهشها و توضیحات دقیق از سازوکارهای فیزیولوژیک، پلی میان علوم پایه پزشکی و کاربردهای بالینی ایجاد میکند و نقشی بیبدیل در آموزش، پژوهش و ارتقای دانش سلامت ایفا مینماید.
ترجمه دقیق و علمیاین شاهکار توسط برند علمیآیندهنگاران مغز به مدیریت داریوش طاهری، دسترسی فارسیزبانان به مرزهای نوین دانش فیزیولوژی را ممکن ساخته و رسالتی علمیبرای ارتقای آموزش پزشکی، فهم عمیقتر سازوکارهای بدن و توسعه روشهای نوین در حوزه سلامت فراهم آورده است.
» کتاب فیزیولوژی پزشکی گانونگ
» » فصل ۲: مروری بر فیزیولوژی سلول
در حال ویرایش
» Ganong’s Review of Medical Physiology
»» CHAPTER 2: Overview of Cellular Physiology
OBJECTIVES
After studying this hapte, you should be able to:
• Name the prominent cellular organelles and state their functions in cells.
• Name the building blocks of the cellular cytoskeleton and state their contributions to cell structure and function.
• Name the intercellular connections and intracellular to extracellular connections.
• Define the processes of exocytosis and endocytosis, and describe the contribution of each to normal cell function.
• Define proteins that contribute to membrane permeability and transport.
• Recognize various forms of intercellular communication and describe ways in which chemical messengers (including second messengers) affect cellular functions.
اهداف
پس از مطالعه فصل باید بتوانید:
• اندامکهای برجسته سلولی را نام ببرید و عملکرد آنها را در سلولها بیان کنید.
• بلوکهای سازنده اسکلت سلولی را نام ببرید و سهم آنها را در ساختار و عملکرد سلول بیان کنید.
• اتصالات بین سلولی و اتصالات درون سلولی به خارج سلولی را نام ببرید.
• فرآیندهای اگزوسیتوز و اندوسیتوز را تعریف کنید و سهم هر یک را در عملکرد طبیعی سلول شرح دهید.
• پروتئینهایی را تعریف کنید که به نفوذپذیری و انتقال غشا کمک میکنند.
• اشکال مختلف ارتباط بین سلولی را بشناسید و راههایی را که پیام رسانهای شیمیایی (از جمله پیام رسانهای دوم) بر عملکرد سلولی تأثیر میگذارند، توصیف کنید.

INTRODUCTION
The cell is the fundamental working unit of all organisms. In humans, cells can be highly specialized in both structure and function; alternatively, cells from different organs can share features and function. In the previous chapter, some basic principles of biophysics and the catabolism and metabolism of building blocks found in the cell were examined. In some of those discussions, how the building blocks could contribute to basic cell function (eg, DNA replication, transcription, and translation) were discussed. In this chapter, more of the fundamental aspects of cellular and molecular physiology will be reviewed. Additional aspects that concern specialization of cellular and molecular function are considered in the next chapters concerning immune function and excitable cells and within the sections that highlight each physiological system.
مقدمه
سلول واحد کار اساسی همه موجودات است. در انسان، سلولها میتوانند هم در ساختار و هم در عملکرد بسیار تخصصی باشند. در عوض، سلولهای اندامهای مختلف میتوانند ویژگیها و عملکردهای مشترکی داشته باشند. در فصل قبل، برخی از اصول اولیه بیوفیزیک و کاتابولیسم و متابولیسم بلوکهای سازنده موجود در سلول مورد بررسی قرار گرفت. در برخی از آن بحثها، چگونگی مشارکت بلوکهای سازنده در عملکرد سلولی (به عنوان مثال، همانندسازی DNA، رونویسی و ترجمه) مورد بحث قرار گرفت. در این فصل بیشتر جنبههای بنیادی فیزیولوژی سلولی و مولکولی بررسی خواهد شد. جنبههای اضافی که مربوط به تخصصی شدن عملکرد سلولی و مولکولی است در فصلهای بعدی مربوط به عملکرد ایمنی و سلولهای تحریک پذیر و در بخشهایی که هر سیستم فیزیولوژیکی را برجسته میکند در نظر گرفته شده است.
FUNCTIONAL MORPHOLOGY OF THE CELL AND HOMEOSTASIS
The actual environment of the cells of the body is the interstitial component of the extracellular fluid (ECF). Because normal cell function depends on the constancy of this fluid, it is not surprising that in multicellular animals, an immense number of regulatory mechanisms have evolved to maintain it. To describe “the various physiologic arrangements which serve to restore the normal state, once it has been disturbed,” W.B. Cannon coined the term homeostasis. The buffering properties of the body fluids and the renal and respiratory adjustments to the presence of excess acid or alkali are examples of homeostatic mechanisms. There are countless other examples, and a large part of physiology is concerned with regulatory mechanisms that act to maintain the constancy of the internal environment. Many of these regulatory mechanisms operate on the principle of negative feedback; deviations from a given normal set point are detected by a sensor, and signals from the sensor trigger compensatory changes that continue until the set point is again reached.
مورفولوژی عملکردی سلول و هموستاز
محیط واقعی سلولهای بدن جزء بینابینی مایع خارج سلولی (ECF) است. از آنجایی که عملکرد طبیعی سلول به پایداری این مایع بستگی دارد، جای تعجب نیست که در حیوانات چند سلولی، مکانیسمهای تنظیمیبسیار زیادی برای حفظ آن تکامل یافته است. W.B. کانن اصطلاح هموستاز را ابداع کرد. خواص بافری مایعات بدن و تنظیمات کلیوی و تنفسی برای حضور اسید یا قلیایی اضافی نمونههایی از مکانیسمهای هموستاتیک هستند. مثالهای بیشماری دیگر وجود دارد، و بخش بزرگی از فیزیولوژی به مکانیسمهای تنظیمیمربوط میشود که برای حفظ ثبات محیط داخلی عمل میکنند. بسیاری از این مکانیسمهای نظارتی بر اساس اصل بازخورد منفی عمل میکنند. انحراف از یک نقطه تنظیم نرمال معین توسط یک سنسور تشخیص داده میشود و سیگنالهای حسگر باعث ایجاد تغییرات جبرانی میشود که تا رسیدن دوباره به نقطه تنظیم ادامه مییابد.
A basic knowledge of cell function and structure is essential to an understanding of the homeostasis, the organ systems and the way they function in the body. A key tool for examining cellular constituents is the microscope. A light microscope can resolve structures as close as 0.2 μm, while an electron microscope can resolve structures as close as 0.002 μm. Although cell dimensions are quite variable, this resolution can provide a good look at the inner workings of the cell. The advent of common access to phase contrast, fluorescent, confocal, and many other microscopy techniques along with specialized probes for both static and dynamic cellular structures further expanded the examination of cell structure and function. Equally revolutionary advances in modern biophysical, biochemical, and molecular biological techniques have also greatly contributed to our knowledge of the cell.
دانش اولیه از عملکرد و ساختار سلول برای درک هموستاز، سیستمهای اندام و نحوه عملکرد آنها در بدن ضروری است. یک ابزار کلیدی برای بررسی اجزای سلولی میکروسکوپ است. یک میکروسکوپ نوری میتواند ساختارهای نزدیک به 0.2 میکرومتر را تشخیص دهد، در حالی که یک میکروسکوپ الکترونی میتواند ساختارهای نزدیک به 0.002 میکرومتر را تشخیص دهد. اگرچه ابعاد سلول کاملاً متغیر است، اما این وضوح میتواند نگاه خوبی به عملکرد داخلی سلول ارائه دهد. ظهور دسترسی رایج به کنتراست فاز، فلورسنت، کانفوکال و بسیاری از تکنیکهای میکروسکوپی دیگر همراه با پروبهای تخصصی برای ساختارهای سلولی استاتیک و پویا، بررسی ساختار و عملکرد سلول را بیشتر گسترش داد. پیشرفتهای به همان اندازه انقلابی در تکنیکهای بیوفیزیکی، بیوشیمیایی و بیولوژیکی مولکولی مدرن نیز به دانش ما از سلول کمک زیادی کرده است.
The specialization of the cells in the various organs is considerable, and no cell can be called “typical” of all cells in the body. However, a number of cell structures (organelles) are common to most cells. These structures are shown in Figure 2-1. Many of them can be isolated by ultracentrifugation combined with other techniques. When cells are homogenized and the resulting suspension is centrifuged, the nuclei sediment first, followed by the mitochondria. High-speed centrifugation that generates forces of 100,000 times gravity or more causes a fraction made up of granules called the microsomes to sediment. This fraction includes organelles such as the ribosomes and peroxisomes.
تخصص سلولها در اندامهای مختلف قابل توجه است و هیچ سلولی را نمیتوان «معمولی» همه سلولهای بدن نامید. با این حال، تعدادی از ساختارهای سلولی (ارگانلها) در اکثر سلولها مشترک هستند. این ساختارها در شکل 2-1 نشان داده شده است. بسیاری از آنها را میتوان با اولتراسانتریفیوژ همراه با تکنیکهای دیگر جدا کرد. وقتی سلولها همگن میشوند و سوسپانسیون حاصل سانتریفیوژ میشود، ابتدا هستهها و سپس میتوکندریها رسوب میکنند. سانتریفیوژ با سرعت بالا که نیروهایی معادل 100000 برابر گرانش یا بیشتر ایجاد میکند، باعث رسوب کسری متشکل از دانههایی به نام میکروزوم میشود. این کسر شامل اندامکهایی مانند ریبوزومها و پراکسی زومها است.

FIGURE 2-1 Cross-sectional diagram of a hypothetical cell as seen with the light microscope. Individual organelles are expanded for closer examination. (Adapted with permission from Bloom and Fawcett. Reproduced with permission from Junqueira LC, Carneiro J, Kelley RO: Basic Histology, 9th ed. New York, NY: McGraw-Hill; 1998.)
شکل 2-1 نمودار مقطعی یک سلول فرضی همانطور که با میکروسکوپ نوری دیده میشود. اندامکهای منفرد برای بررسی دقیق تر منبسط میشوند. (اقتباس شده با اجازه بلوم و فاوست. تکثیر شده با اجازه Junqueira LC, Carneiro J, Kelley RO: Basic Histology, 9th ed. New York, NY: McGraw-Hill; 1998.)
CELL MEMBRANES
The membrane that surrounds the cell is a remarkable structure. It is made up of lipids and proteins and is semipermeable, allowing some substances to pass through it and excluding others. However, its permeability can also be varied because it contains numerous regulated ion channels and other transport proteins that can change the amounts of substances moving across it. It is generally referred to as the plasma membrane. The nucleus and other organelles in the cell are bound by similar membranous structures.
غشای سلولی
غشایی که سلول را احاطه کرده است ساختار قابل توجهی است. این ماده از لیپیدها و پروتئینها ساخته شده و نیمه تراوا است و به برخی از مواد اجازه میدهد از آن عبور کنند و برخی دیگر را حذف میکند. با این حال، نفوذپذیری آن نیز میتواند متفاوت باشد، زیرا حاوی کانالهای یونی تنظیمشده متعدد و سایر پروتئینهای حملونقل است که میتوانند مقدار مواد در حال حرکت در آن را تغییر دهند. به طور کلی به آن غشای پلاسما میگویند. هسته و سایر اندامکهای سلول توسط ساختارهای غشایی مشابهی محدود شده اند.
Although the chemical structures of membranes and their properties vary considerably from one location to another, they have certain common features. They are generally about 7.5 nm (75 angstroms [Å]) thick. The major lipids are phospholipids such as phosphatidylcholine, phosphatidylserine, and phosphatidylethanolamine. The shape of the phospholipid molecule reflects its solubility properties: the “head” end of the molecule contains the phosphate portion and is relatively soluble in water (polar, hydrophilic) and the “tail” ends are relatively insoluble (nonpolar, hydrophobic). The possession of both hydrophilic and hydrophobic properties makes the lipid an amphipathic molecule. In the membrane, the hydrophilic ends of the molecules are exposed to the aqueous environment that bathes the exterior of the cells and the aqueous cytoplasm; the hydrophobic ends meet in the water-poor interior of the membrane (Figure 2-2). In prokaryotes (ie, bacteria in which there is no nucleus), the membranes are relatively simple, but in eukaryotes (ie, cells containing nuclei), cell membranes contain various glycosphingolipids, sphingomyelin, and cholesterol in addition to phospholipids and phosphatidylcholine.
اگرچه ساختار شیمیایی غشاها و خواص آنها به طور قابل توجهی از مکانی به مکان دیگر متفاوت است، اما ویژگیهای مشترک خاصی دارند. ضخامت آنها معمولاً 7.5 نانومتر (75 آنگستروم [Å]) است. لیپیدهای اصلی فسفولیپیدهایی مانند فسفاتیدیل کولین، فسفاتیدیل سرین و فسفاتیدیل اتانول آمین هستند. شکل مولکول فسفولیپید خاصیت حلالیت آن را منعکس میکند: انتهای “سر” مولکول حاوی بخش فسفات است و نسبتاً در آب محلول است (قطبی، آب دوست) و انتهای “دم” نسبتا نامحلول (غیر قطبی، آبگریز) است. داشتن هر دو ویژگی آب دوست و آبگریز باعث میشود لیپید به یک مولکول آمفی پاتیک تبدیل شود. در غشاء، انتهای آبدوست مولکولها در معرض محیط آبی قرار میگیرند که قسمت بیرونی سلولها و سیتوپلاسم آبی را میپوشاند. انتهای آبگریز در قسمت داخلی غشاء فقیر از آب به هم میرسند (شکل 2-2). در پروکاریوتها (یعنی باکتریهایی که در آنها هسته وجود ندارد)، غشاها نسبتاً ساده هستند، اما در یوکاریوتها (یعنی سلولهای حاوی هسته)، غشاهای سلولی علاوه بر فسفولیپیدها و فسفاتیدیل کولین، حاوی گلیکوسفنگولیپیدهای مختلف، اسفنگومیلین و کلسترول هستند.

FIGURE 2–2 Organization of the phospholipid bilayer and associated proteins in a biologic membrane. The phospholipid molecules that make up the membrane each have two hydrophobic fatty acid chains attached to a hydrophilic phosphate head. Individual proteins take on different shapes and positions in the cell. Many are integral proteins, extending into the membrane or peripheral proteins that are attached to the inside or outside (not shown) of the membrane. Proteins can be modified (eg, with carbohydrate chains). Many specific protein attachments and cholesterol that are commonly found in the bilayer are omitted for clarity.
شکل 2-2 سازمان دولایه فسفولیپیدی و پروتئینهای مرتبط در یک غشای بیولوژیکی. مولکولهای فسفولیپیدی که غشاء را تشکیل میدهند، هر کدام دو زنجیره اسید چرب آبگریز دارند که به یک سر فسفات آبدوست متصل هستند. تک تک پروتئینها شکلها و موقعیتهای متفاوتی در سلول به خود میگیرند. بسیاری از آنها پروتئینهای یکپارچه هستند که به داخل غشاء یا پروتئینهای محیطی که به داخل یا خارج (نشان داده نشده) غشاء متصل هستند گسترش مییابند. پروتئینها را میتوان اصلاح کرد (به عنوان مثال، با زنجیرههای کربوهیدرات). بسیاری از پیوستهای پروتئینی خاص و کلسترول که معمولاً در دولایه یافت میشوند، برای وضوح حذف شدهاند.
Many different proteins are embedded in the membrane. The membrane proteins are classified into two categories: integral proteins or intrinsic membrane proteins and peripheral proteins or extrinsic membrane proteins. They exist as separate globular units and many pass through or are embedded in one leaflet of the membrane (eg, integral proteins), whereas peripheral proteins are associated with the inside or outside of the membrane (Figure 2-2). The amount of protein varies significantly with the function of the cell but makes up on average 50% of the mass of the membrane; that is, there is about one protein molecule per 50 of the much smaller phospholipid molecules. The proteins in the membrane carry out many functions. Some are cell adhesion molecules (CAMs) that anchor cells to their neighbors or to basal laminas. Some proteins function as pumps, actively transporting ions across the membrane. Other proteins function as carriers, transporting substances down electrochemical gradients by facilitated diffusion. Still others are ion channels, which, when activated, permit the passage of ions into or out of the cell. The role of the pumps, carriers, and ion channels in transport across the cell membrane is discussed below. Proteins in another group function as receptors that bind ligands or messenger molecules, initiating physiological changes inside the cell. Proteins also function as enzymes, catalyzing reactions at the surfaces of the membrane. Examples from each of these groups are discussed later in this chapter.
بسیاری از پروتئینهای مختلف در غشاء تعبیه شده اند. پروتئینهای غشایی به دو دسته تقسیم میشوند: پروتئینهای انتگرال یا پروتئینهای غشایی ذاتی و پروتئینهای محیطی یا پروتئینهای غشایی بیرونی. آنها به عنوان واحدهای کروی جداگانه وجود دارند و بسیاری از آنها از یک برگچه غشاء عبور میکنند یا در یک برگچه قرار میگیرند (به عنوان مثال، پروتئینهای انتگرال)، در حالی که پروتئینهای محیطی با داخل یا خارج غشاء مرتبط هستند (شکل 2-2). مقدار پروتئین به طور قابل توجهی با عملکرد سلول متفاوت است، اما به طور متوسط 50٪ از جرم غشاء را تشکیل میدهد. یعنی در هر 50 مولکول فسفولیپید بسیار کوچکتر، حدود یک مولکول پروتئین وجود دارد. پروتئینهای موجود در غشاء وظایف بسیاری را انجام میدهند. برخی از آنها مولکولهای چسبنده سلولی (CAM) هستند که سلولها را به همسایگان خود یا به لایههای پایه متصل میکنند. برخی از پروتئینها به عنوان پمپ عمل میکنند و به طور فعال یونها را در سراسر غشاء حمل میکنند. پروتئینهای دیگر به عنوان حامل عمل میکنند و مواد را با انتشار تسهیل شده به پایین شیبهای الکتروشیمیایی منتقل میکنند. برخی دیگر کانالهای یونی هستند که وقتی فعال میشوند اجازه عبور یونها به داخل یا خارج از سلول را میدهند. نقش پمپها، حاملها و کانالهای یونی در انتقال از طریق غشای سلولی در زیر مورد بحث قرار میگیرد. پروتئینها در گروهی دیگر بهعنوان گیرندههایی عمل میکنند که لیگاندها یا مولکولهای پیامرسان را به هم متصل میکنند و تغییرات فیزیولوژیکی را در داخل سلول آغاز میکنند. پروتئینها همچنین به عنوان آنزیم عمل میکنند و واکنشها را در سطوح غشاء کاتالیز میکنند. نمونههایی از هر یک از این گروهها در ادامه این فصل مورد بحث قرار میگیرد.
The hydrophobic portions of the proteins are usually located in the interior of the membrane, whereas the charged, hydrophilic portions are located on the surfaces. Peripheral proteins are attached to the surfaces of the membrane in various ways. One common way is attachment to glycosylated forms of phosphatidylinositol. Proteins held by these glycosylphosphatidylinositol (GPI) anchors (Figure 2-3) include enzymes such as alkaline phosphatase, various antigens, a number of CAMs, and proteins that combat cell lysis by complement. Over 250 GPI-linked cell surface proteins have now been described in humans. Other proteins are lipidated, that is, they have specific lipids attached to them (Figure 2-3). Proteins may be myristoylated, palmitoylated, or prenylated (ie, attached to geranylgeranyl or farnesyl groups).
بخشهای آبگریز پروتئینها معمولاً در داخل غشاء قرار دارند، در حالی که بخشهای باردار و آبدوست روی سطوح قرار دارند. پروتئینهای محیطی به روشهای مختلف به سطوح غشاء متصل میشوند. یکی از راههای رایج اتصال به اشکال گلیکوزیله فسفاتیدیلینوزیتول است. پروتئینهایی که توسط این لنگرهای گلیکوزیل فسفاتیدیل (GPI) نگهداری میشوند (شکل 2-3) شامل آنزیمهایی مانند آلکالین فسفاتاز، آنتی ژنهای مختلف، تعدادی CAM و پروتئینهایی هستند که با لیز سلولی توسط مکمل مبارزه میکنند. اکنون بیش از 250 پروتئین سطح سلولی مرتبط با GPI در انسان توصیف شده است. سایر پروتئینها لیپید شده اند، یعنی لیپیدهای خاصی به آنها متصل شده اند (شکل 2-3). پروتئینها ممکن است میریستویله، پالمیتویله یا پرنیله شوند (یعنی به گروههای ژرانیل ژرانیل یا فارنسیل متصل شوند).

FIGURE 2-3 Protein linkages to membrane lipids. A variety of lipid modifications can occur at amino or carboxy terminals of proteins attached to cytosolic side of the plasma membrane. Many proteins associated with the external side of the plasma membrane can be attached via glycosylated forms of phosphatidylinositol (eg, GPI anchors).
شکل 2-3 پیوندهای پروتئین با لیپیدهای غشایی. انواع تغییرات چربی میتواند در پایانههای آمینو یا کربوکسی پروتئینهای متصل به سمت سیتوزولی غشای پلاسما رخ دهد. بسیاری از پروتئینهای مرتبط با قسمت خارجی غشای پلاسما را میتوان از طریق اشکال گلیکوزیله فسفاتیدیلینوزیتول (مانند لنگرهای GPI) متصل کرد.
The protein structure and particularly the enzyme content of biologic membranes varies not only from cell to cell, but also within the same cell. For example, some of the enzymes embedded in cell membranes are different from those in mitochondrial membranes. In epithelial cells, the enzymes in the cell membrane on the mucosal surface differ from those in the cell membrane on the basal and lateral margins of the cells; that is, the cells are polarized. Such polarization makes directional transport across epithelia possible. The membranes are dynamic structures, and their constituents are being constantly renewed at different rates. Some proteins are anchored to the cytoskeleton, but others move laterally in the membrane.
ساختار پروتئین و به ویژه محتوای آنزیم غشاهای بیولوژیکی نه تنها از سلولی به سلول دیگر، بلکه در همان سلول نیز متفاوت است. به عنوان مثال، برخی از آنزیمهای موجود در غشای سلولی با آنزیمهای موجود در غشای میتوکندری متفاوت است. در سلولهای اپیتلیال، آنزیمهای غشای سلولی در سطح مخاطی با غشای سلولی در حاشیههای پایه و جانبی سلولها متفاوت است. یعنی سلولها پلاریزه میشوند. چنین پلاریزاسیونی حمل و نقل جهت دار در سراسر اپیتلیوم را ممکن میسازد. غشاها ساختارهای دینامیکی هستند و اجزای تشکیل دهنده آنها دائماً با سرعتهای مختلف تجدید میشوند. برخی از پروتئینها به اسکلت سلولی متصل میشوند، اما برخی دیگر به صورت جانبی در غشاء حرکت میکنند.
Underlying most cells is a thin, “fuzzy” layer plus some fibrils that collectively make up the basement membrane or, more properly, the basal lamina. The basal lamina and, more generally, the extracellular matrix are made up of many proteins that hold cells together, regulate their development, and determine their growth. These include collagens, laminins, fibronectin, tenascin, and various proteoglycans.
در زیر اکثر سلولها یک لایه نازک و “فازی” به اضافه برخی فیبریلها وجود دارد که در مجموع غشای پایه یا به عبارت دقیق تر، لایه بازال را میسازند. لایه بازال و به طور کلی ماتریکس خارج سلولی از پروتئینهای زیادی تشکیل شده است که سلولها را کنار هم نگه میدارد، رشد آنها را تنظیم میکند و رشد آنها را تعیین میکند. اینها شامل کلاژنها، لامینینها، فیبرونکتین، تناسین و پروتئوگلیکانهای مختلف است.
MITOCHONDRIA
Over a billion years ago, aerobic bacteria were engulfed by eukaryotic cells and evolved into mitochondria, providing the eukaryotic cells with the ability to form the energy-rich compound ATP by oxidative phosphorylation. Mitochondria perform other functions, including a role in the regulation of apoptosis (programmed cell death), but oxidative phosphorylation is the most crucial. Each eukaryotic cell can have hundreds to thousands of mitochondria. In mammals, they are generally depicted as sausage-shaped organelles (Figure 2- 1), but their shape can be quite dynamic. Each has an outer membrane, an intermembrane space, an inner membrane, which is folded to form shelves (cristae), and a central matrix space. The enzyme complexes responsible for oxidative phosphorylation are lined up on the cristae (Figure 2-4).
میتوکندری
بیش از یک میلیارد سال پیش، باکتریهای هوازی توسط سلولهای یوکاریوتی غرق شدند و به میتوکندری تکامل یافتند و سلولهای یوکاریوتی توانایی تشکیل ترکیب غنی از انرژی ATP را با فسفوریلاسیون اکسیداتیو فراهم کردند. میتوکندری عملکردهای دیگری از جمله نقشی در تنظیم آپوپتوز (مرگ برنامه ریزی شده سلولی) انجام میدهد، اما فسفوریلاسیون اکسیداتیو بسیار مهم است. هر سلول یوکاریوتی میتواند صدها تا هزاران میتوکندری داشته باشد. در پستانداران، آنها به طور کلی به صورت اندامکهای سوسیس شکل نشان داده میشوند (شکل 2-1)، اما شکل آنها میتواند کاملاً پویا باشد. هر کدام دارای یک غشای بیرونی، یک فضای بین غشایی، یک غشای داخلی است که برای تشکیل قفسهها (cristae) تا میشود و یک فضای ماتریس مرکزی. کمپلکسهای آنزیمیمسئول فسفوریلاسیون اکسیداتیو روی کریستاها قرار گرفتهاند (شکل 2-4).

FIGURE 2-4 Components involved in oxidative phosphorylation in mitochondria and their origins. As enzyme complexes I through IV convert 2- carbon metabolic fragments to CO2 and H2O, protons (H+) are pumped into the intermembrane space. The protons diffuse back to the matrix space via complex V, ATP synthase (AS), in which ADP is converted to ATP. The enzyme complexes are made up of subunits coded by mitochondrial DNA (mDNA) and nuclear DNA (nDNA), and the figures document the contribution of each DNA to the complexes.
شکل 2-4 اجزای دخیل در فسفوریلاسیون اکسیداتیو در میتوکندری و منشا آنها. همانطور که کمپلکسهای آنزیمیI تا IV قطعات متابولیک 2- کربن را به CO2 و H2O تبدیل میکنند، پروتونها (+H) به فضای بین غشایی پمپ میشوند. پروتونها از طریق پیچیده V، سنتاز ATP (AS) به فضای ماتریس باز میگردند، که در آن ADP به ATP تبدیل میشود. کمپلکسهای آنزیمیاز زیر واحدهایی تشکیل شدهاند که توسط DNA میتوکندری (mDNA) و DNA هستهای (nDNA) کدگذاری شدهاند، و شکلها سهم هر DNA را در کمپلکسها نشان میدهند.
Consistent with their origin from aerobic bacteria, the mitochondria have their own genome. There is much less DNA in the mitochondrial genome than in the nuclear genome, and 99% of the proteins in the mitochondria are the products of nuclear genes, but mitochondrial DNA is responsible for certain key components of the pathway for oxidative phosphorylation. Specifically, human mitochondrial DNA is a double-stranded circular molecule containing approximately 16,500 base pairs (compared with over a billion in nuclear DNA). It codes for 13 protein subunits that are associated with proteins encoded by nuclear genes to form four enzyme complexes plus two ribosomal and 22 transfer RNAs that are needed for protein production by the intramitochondrial ribosomes.
مطابق با منشا آنها از باکتریهای هوازی، میتوکندریها ژنوم خاص خود را دارند. DNA بسیار کمتری در ژنوم میتوکندری نسبت به ژنوم هسته ای وجود دارد و 99 درصد پروتئینهای موجود در میتوکندری محصولات ژنهای هسته ای هستند، اما DNA میتوکندری مسئول اجزای کلیدی خاصی از مسیر فسفوریلاسیون اکسیداتیو است. به طور خاص، DNA میتوکندری انسان یک مولکول دایره ای دو رشته ای است که حاوی تقریباً 16500 جفت باز است (در مقایسه با بیش از یک میلیارد DNA هسته ای). این 13 زیرواحد پروتئینی را کد میکند که با پروتئینهای کدگذاری شده توسط ژنهای هسته ای برای تشکیل چهار کمپلکس آنزیمیبه اضافه دو RNA ریبوزومیو 22 انتقالی که برای تولید پروتئین توسط ریبوزومهای داخل میتوکندری مورد نیاز هستند، کد میکند.
The enzyme complexes responsible for oxidative phosphorylation illustrate the interactions between the products of the mitochondrial genome and the nuclear genome. For example, complex I, reduced nicotinamide adenine dinucleotide dehydrogenase (NADH), is made up of seven protein subunits coded by mitochondrial DNA and 39 subunits coded by nuclear DNA. The origin of the subunits in the other complexes is shown in Figure 2-4. Complex II, succinate dehydrogenase- ubiquinone oxidoreductase; complex III, ubiquinonecytochrome c oxidoreductase; and complex IV, cytochrome c oxidase, act with complex I, coenzyme Q, and cytochrome c to convert metabolites to CO2 and H2O. Complexes I, III, and IV pump protons (H*) into the intermembrane space during this electron transfer. The protons then flow down their electrochemical gradient through complex V, ATP synthase, which harnesses this energy to generate ATP.
کمپلکسهای آنزیمیمسئول فسفوریلاسیون اکسیداتیو، برهمکنشهای بین محصولات ژنوم میتوکندری و ژنوم هستهای را نشان میدهند. به عنوان مثال، کمپلکس I، نیکوتین آمید آدنین دی نوکلئوتید دهیدروژناز احیا شده (NADH)، از هفت زیرواحد پروتئینی کدگذاری شده توسط DNA میتوکندری و 39 زیر واحد کدگذاری شده توسط DNA هسته ای تشکیل شده است. منشا زیر واحدها در سایر کمپلکسها در شکل 2-4 نشان داده شده است. کمپلکس II، سوکسینات دهیدروژناز- یوبی کینون اکسیدوردوکتاز. کمپلکس III، ubiquinonecytochrome c oxidoreductase. و کمپلکس IV، سیتوکروم c اکسیداز، با کمپلکس I، کوآنزیم Q و سیتوکروم c برای تبدیل متابولیتها به CO2 و H2O عمل میکنند. مجتمعهای I، III و IV پروتونها (+H) را در طی این انتقال الکترون به فضای بین غشایی پمپ میکنند. سپس پروتونها از طریق شیب الکتروشیمیایی خود از طریق V، سنتاز ATP که این انرژی را برای تولید ATP مهار میکند، به پایین جریان مییابند.
As zygote mitochondria are derived from the ovum, their inheritance is maternal. This maternal inheritance has been used as a tool to track evolutionary descent. Mitochondria have an ineffective DNA repair system, and the mutation rate for mitochondrial DNA is over 10 times the rate for nuclear DNA. A large number of relatively rare diseases have been traced to mutations in mitochondrial DNA. These include disorders of tissues with high metabolic rates in which energy production is defective as a result of abnormalities in the production of ATP, as well as other disorders (Clinical Box 2-1).
از آنجایی که میتوکندری زیگوت از تخمک مشتق میشود، وراثت آنها مادری است. این ارث مادری به عنوان ابزاری برای ردیابی تبار تکاملی استفاده شده است. میتوکندریها دارای یک سیستم ترمیم DNA ناکارآمد هستند و نرخ جهش برای DNA میتوکندری بیش از 10 برابر نرخ DNA هسته ای است. تعداد زیادی از بیماریهای نسبتاً نادر به جهش در DNA میتوکندری ردیابی شده اند. اینها شامل اختلالات بافتی با نرخ متابولیک بالا است که در آن تولید انرژی در نتیجه ناهنجاری در تولید ATP و همچنین سایر اختلالات معیوب است (باکس بالینی 2-1).
CLINICAL BOX 2. 1
Mitochondrial Diseases
Mitochondrial diseases encompass at least 40 diverse disorders that are grouped because of their links to mitochondrial failure. These diseases can occur following inheritance or spontaneous mutations in mitochondrial or nuclear DNA that lead to altered functions of the mitochondrial proteins (or RNA). Depending on the target cell and/or tissues affected, symptoms resulting from mitochondrial diseases may include altered motor control; altered muscle output; gastrointestinal dysfunction; altered growth; diabetes; seizures; visual/hearing problems; lactic acidosis; developmental delays; and susceptibility to infection or cardiac, liver, and respiratory disease. Although there is evidence for tissue-specific isoforms of mitochondrial proteins, mutations in these proteins do not fully explain the highly variable patterns or targeted organ systems observed with mitochondrial diseases.
کادر بالینی 2 .1
بیماریهای میتوکندری
بیماریهای میتوکندری حداقل 40 اختلال متنوع را در بر میگیرد که به دلیل ارتباط آنها با نارسایی میتوکندری دسته بندی میشوند. این بیماریها میتوانند به دنبال توارث یا جهشهای خود به خودی در DNA میتوکندری یا هسته ای رخ دهند که منجر به تغییر عملکرد پروتئینهای میتوکندری (یا RNA) میشود. بسته به سلول هدف و/یا بافت آسیب دیده، علائم ناشی از بیماریهای میتوکندری ممکن است شامل تغییر در کنترل حرکتی باشد. خروجی عضلانی تغییر یافته؛ اختلال در عملکرد دستگاه گوارش؛ رشد تغییر یافته؛ دیابت؛ تشنج؛ مشکلات بینایی / شنوایی؛ اسیدوز لاکتیک؛ تأخیر در رشد؛ و حساسیت به عفونت یا بیماریهای قلبی، کبدی و تنفسی. اگرچه شواهدی برای ایزوفرمهای بافتی خاص پروتئینهای میتوکندری وجود دارد، جهش در این پروتئینها به طور کامل الگوهای بسیار متغیر یا سیستمهای اندام هدفمند مشاهده شده با بیماریهای میتوکندری را توضیح نمیدهد.
THERAPEUTIC HIGHLIGHTS
With the diversity of disease types and the overall importance of mitochondria in energy production, it is not surprising that there is no single cure for mitochondrial diseases and focus remains on treating the symptoms when possible. For example, in some mitochondrial myopathies (ie, mitochondrial diseases associated with neuromuscular function), physical therapy may help extend the range of movement of muscles and improve dexterity.
نکات برجسته درمانی
با توجه به تنوع انواع بیماریها و اهمیت کلی میتوکندری در تولید انرژی، تعجب آور نیست که هیچ درمان واحدی برای بیماریهای میتوکندری وجود ندارد و تمرکز بر روی درمان علائم در صورت امکان باقی میماند. برای مثال، در برخی از میوپاتیهای میتوکندریایی (یعنی بیماریهای میتوکندریایی مرتبط با عملکرد عصبی عضلانی)، فیزیوتراپی ممکن است به گسترش دامنه حرکت عضلات و بهبود مهارت کمک کند.
LYSOSOMES
In the cytoplasm of the cell there are large, somewhat irregular structures surrounded by membranes (Figure 2-1). The interior of these structures, which are called lysosomes, is more acidic than the rest of the cytoplasm, and external material such as endocytosed bacteria, as well as worn-out cell components, are digested in them. The interior is kept acidic by the action of a proton pump, or H+ ATPase. This integral membrane protein uses the energy of ATP to move protons from the cytosol up their electrochemical gradient and keep the lysosome relatively acidic, near pH 5.0. Lysosomes can contain over 40 types of hydrolytic enzymes, some of which are listed in Table 2-1. Not surprisingly,these enzymes are all acid hydrolases, in that they function best at the acidic pH of the lysosomal compartment. This can be a safety feature for the cell; if the lysosomes were to break open and release their contents, the enzymes would not be efficient at the near neutral cytosolic pH 7.2, and thus would be unable to digest cytosolic targets they may encounter. Diseases associated with lysosomal dysfunction are discussed in Clinical Box 2-2.
لیزوزومها
در سیتوپلاسم سلول ساختارهای بزرگ و تا حدی نامنظم وجود دارد که توسط غشاء احاطه شده اند (شکل 2-1). درون این ساختارها که لیزوزوم نامیده میشوند نسبت به بقیه سیتوپلاسم اسیدی تر هستند و مواد خارجی مانند باکتریهای اندوسیتوز شده و همچنین اجزای سلولی فرسوده در آنها هضم میشوند. داخل آن با عمل یک پمپ پروتون یا H+ATPase اسیدی نگه داشته میشود. این پروتئین غشایی یکپارچه از انرژی ATP استفاده میکند تا پروتونها را از سیتوزول به سمت گرادیان الکتروشیمیایی حرکت دهد و لیزوزوم را نسبتاً اسیدی و نزدیک به pH 5.0 نگه دارد. لیزوزومها میتوانند حاوی بیش از 40 نوع آنزیم هیدرولیتیک باشند که برخی از آنها در جدول 2-1 ذکر شده است. جای تعجب نیست که این آنزیمها همه هیدرولازهای اسیدی هستند، زیرا در pH اسیدی بخش لیزوزومیبهترین عملکرد را دارند. این میتواند یک ویژگی ایمنی برای سلول باشد. اگر لیزوزومها باز شوند و محتویات خود را آزاد کنند، آنزیمها در pH سیتوزولی تقریباً خنثی 7.2 کارآمد نخواهند بود و بنابراین قادر به هضم اهداف سیتوزولی که ممکن است با آنها مواجه شوند نخواهند بود. بیماریهای مرتبط با اختلال عملکرد لیزوزومیدر کادر بالینی 2-2 مورد بحث قرار گرفته است.
TABLE 2-1 Some of the enzymes found in lysosomes and the cell components that are their substrates.
جدول 2-1 برخی از آنزیمهای موجود در لیزوزومها و اجزای سلولی که بستر آنها هستند.

CLINICAL BOX 2.2L
ysosomal Diseases
When a lysosomal enzyme is congenitally absent, the lysosomes become engorged with the material the enzyme normally degrades. This eventually leads to one of the lysosomal diseases (also called lysosomal storage diseases). There are over 50 such diseases currently recognized. For example, Fabry disease is caused by a deficiency in a-galactosidase; Gaucher disease is caused by a deficiency in ẞ-galactocerebrosidase; and Tay-Sachs disease, which causes mental retardation and blindness, is caused by the loss of hexosaminidase A, a lysosomal enzyme that catalyzes the biodegradation of gangliosides (fatty acid derivatives). Such individual lysosomal diseases are rare, but they are serious and can be fatal.
کادر بالینی 2.2 لیتر
بیماریهای ایزوزومی
هنگامیکه یک آنزیم لیزوزومیبه طور مادرزادی وجود نداشته باشد، لیزوزومها با موادی که آنزیم به طور معمول تجزیه میشود، آغشته میشوند. این در نهایت منجر به یکی از بیماریهای لیزوزومی(که بیماریهای ذخیره لیزوزومینیز نامیده میشود) میشود. در حال حاضر بیش از 50 بیماری از این دست شناخته شده است. به عنوان مثال، بیماری فابری به دلیل کمبود a-galactosidase ایجاد میشود. بیماری گوچر ناشی از کمبود ẞ-galactocerebrosidase است. و بیماری Tay-Sachs که باعث عقب ماندگی ذهنی و نابینایی میشود، به دلیل از دست دادن هگزوزامینیداز A، آنزیم لیزوزومیکه تجزیه زیستی گانگلیوزیدها (مشتقات اسیدهای چرب) را کاتالیز میکند، ایجاد میشود. چنین بیماریهای لیزوزومیفردی نادر هستند، اما جدی هستند و میتوانند کشنده باشند.
THERAPEUTIC HIGHLIGHTS
Since there are many different lysosomal disorders, treatments vary considerably and “cures” remain elusive for most of these diseases. Much of the care is focused on managing symptoms of each specific disorder. Enzyme replacement therapy has shown to be effective for certain lysosomal diseases, including Gaucher disease and Fabry disease. However, the long-term effectiveness and the tissue-specific effects of many of the enzyme replacement treatments have not yet been established. Recent alternative approaches include bone marrow or stem cell transplantation. Again, medical advances are still necessary to fully combat this group of diseases.
نکات برجسته درمانی
از آنجایی که اختلالات لیزوزومیبسیاری وجود دارد، درمانها به طور قابل توجهی متفاوت است و “درمان” برای اکثر این بیماریها گریزان باقی میماند. بیشتر مراقبتها بر مدیریت علائم هر اختلال خاص متمرکز است. درمان جایگزینی آنزیم نشان داده است که برای برخی از بیماریهای لیزوزومیاز جمله بیماری گوچر و بیماری فابری موثر است. با این حال، اثربخشی طولانی مدت و اثرات خاص بافت بسیاری از درمانهای جایگزین آنزیم هنوز ثابت نشده است. رویکردهای جایگزین اخیر شامل پیوند مغز استخوان یا سلولهای بنیادی است. باز هم، پیشرفتهای پزشکی هنوز برای مبارزه کامل با این گروه از بیماریها ضروری است.
PEROXISOMES
Peroxisomes are 0.5 μm in diameter (Figure 2-1), are surrounded by a membrane, and contain enzymes that can either produce H2O2 (oxidases) or break it down (catalases). Proteins are directed to the peroxisome by a unique signal sequence with the help of protein chaperones, peroxins. The peroxisome membrane contains a number of peroxisome-specific proteins that are concerned with transport of substances into and out of the matrix of the peroxisome. The matrix contains more than 40 enzymes, which operate in concert with enzymes outside the peroxisome to catalyze a variety of anabolic and catabolic reactions (eg, breakdown of lipids). Peroxisomes can form by budding of the endoplasmic reticulum, or by division. A number of synthetic compounds were found to cause proliferation of peroxisomes by acting on receptors in the nuclei of cells. These peroxisome proliferator-activated receptors (PPARs) are members of the nuclear receptor superfamily. When activated, they bind to DNA, producing changes in the production of mRNAs. The known effects for PPARs are extensive and can affect most tissues and organs.
پراکسیزومها
پراکسی زومها 0.5 میکرومتر قطر دارند (شکل 2-1)، توسط یک غشاء احاطه شده اند و حاوی آنزیمهایی هستند که میتوانند H2O2 (اکسیدازها) تولید کنند یا آن را تجزیه کنند (کاتالاز). پروتئینها توسط یک توالی سیگنال منحصر به فرد با کمک چپرونهای پروتئینی، پراکسینها به پراکسی زوم هدایت میشوند. غشای پراکسی زوم حاوی تعدادی پروتئین خاص پراکسی زوم است که مربوط به انتقال مواد به داخل و خارج از ماتریکس پراکسی زوم است. ماتریکس حاوی بیش از 40 آنزیم است که در هماهنگی با آنزیمهای خارج از پراکسی زوم عمل میکنند تا انواع واکنشهای آنابولیک و کاتابولیک (مانند تجزیه لیپیدها) را کاتالیز کنند. پراکسی زومها میتوانند با جوانه زدن شبکه آندوپلاسمییا با تقسیم تشکیل شوند. تعدادی از ترکیبات مصنوعی با اثر بر گیرندههای هسته سلولها باعث تکثیر پراکسی زومها میشوند. این گیرندههای فعال شده با تکثیر پراکسی زوم (PPARs) اعضایی از خانواده گیرندههای هسته ای هستند. هنگامیکه فعال میشوند، به DNA متصل میشوند و تغییراتی در تولید mRNAها ایجاد میکنند. اثرات شناخته شده برای PPARها گسترده است و میتواند بر اکثر بافتها و اندامها تأثیر بگذارد.
CYTOSKELETON
All cells have a cytoskeleton, a system of fibers that not only maintains the structure of the cell but also permits it to change shape and move. The cytoskeleton is made up primarily of microtubules, intermediate filaments, and microfilaments (Figure 2-5), along with proteins that anchor them and tie them together. In addition, proteins and organelles move along microtubules and microfilaments from one part of the cell to another, propelled by molecular motors.
اسکلت سلولی
همه سلولها دارای اسکلت سلولی هستند، سیستمیاز الیاف که نه تنها ساختار سلول را حفظ میکند، بلکه به آن اجازه تغییر شکل و حرکت را نیز میدهد. اسکلت سلولی عمدتاً از ریز لولهها، رشتههای میانی و میکروفیلامنتها (شکل 2-5) به همراه پروتئینهایی که آنها را لنگر میاندازند و به هم میپیوندند، تشکیل شده است. علاوه بر این، پروتئینها و اندامکها در امتداد ریز لولهها و ریز رشتهها از بخشی از سلول به قسمت دیگر حرکت میکنند که توسط موتورهای مولکولی به پیش میروند.
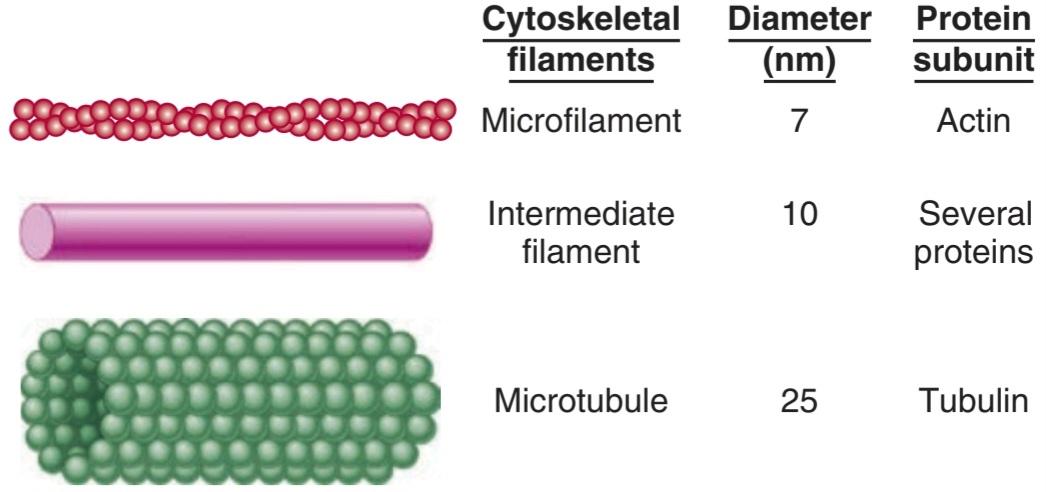
FIGURE 2-5 Cytoskeletal elements of the cell. Artistic impressions that depict the major cytoskeletal elements are shown on the left, with approximate diameters and protein subunits of these elements are listed for comparison. (Reproduced with permission from Widmaier EP, Raff H, Strang KT: Vander’s Human Physiology: The Mechanisms of Body Function, 11th ed. New York, NY: McGraw-Hill; 2008.)
شکل 2-5 عناصر سیتواسکلتی سلول. آثار هنری که عناصر اصلی اسکلت سلولی را به تصویر میکشند در سمت چپ نشان داده شدهاند، با قطرهای تقریبی و زیر واحدهای پروتئینی این عناصر برای مقایسه فهرست شدهاند. (تکثیر شده با اجازه Widmaier EP, Raff H, Strang KT: Vander’s Human Physiology: The Mechanisms of Body Function, ed. 11 New York, NY: McGraw-Hill; 2008.)
Microtubules (Figure 2-5 and Figure 2-6) are long, hollow structures with 5 nm walls surrounding a cavity 15 nm in diameter. They are made up of two globular protein subunits: a- and ẞ-tubulin. A third subunit, y-tubulin, is associated with the production of microtubules by the centrosomes. The a and B subunits form heterodimers, which aggregate to form long tubes made up of stacked rings, with each ring usually containing 13 subunits. The tubules interact with guanosine triphosphate (GTP) to facilitate their formation. Although microtubule subunits can be added to either end, microtubules are polar with assembly predominating at the plus (“+”) end and disassembly predominating at the minus (“-“) end. Both processes occur simultaneously in vitro. The growth of microtubules is temperature sensitive (disassembly is favored under cold conditions) as well as under the control of a variety of cellular factors that can directly interact with microtubules in the cell.
میکروتوبولها (شکل 2-5 و شکل 2-6) ساختارهای توخالی و طولانی با دیوارههای 5 نانومتری هستند که حفره ای به قطر 15 نانومتر را احاطه کرده اند. آنها از دو زیر واحد پروتئین کروی تشکیل شده اند: a- و ẞ-tubulin. سومین زیرواحد، y-tubulin، با تولید میکروتوبولها توسط سانتروزومها مرتبط است. زیرواحدهای a و B هترودیمرهایی را تشکیل میدهند، که با تجمع لولههای بلندی که از حلقههای انباشته تشکیل شدهاند، هر حلقه معمولاً شامل 13 زیر واحد است. لولهها با گوانوزین تری فسفات (GTP) برای تسهیل تشکیل آنها تعامل دارند. اگرچه میتوان زیر واحدهای میکروتوبولی را به هر دو انتها اضافه کرد، ریزلولهها قطبی هستند که مونتاژ در انتهای مثبت (“+”) و جداسازی در انتهای منهای (“-“) غالب است. هر دو فرآیند به طور همزمان در شرایط آزمایشگاهی رخ میدهند. رشد میکروتوبولها به دما حساس است (جداسازی در شرایط سرد مطلوب است) و همچنین تحت کنترل انواع فاکتورهای سلولی است که میتوانند مستقیماً با میکروتوبولهای موجود در سلول تعامل داشته باشند.

FIGURE 2-6 Microfilaments and microtubules. Electron micrograph (Left) of the cytoplasm of a fibroblast, displaying actin microfilaments (MF) and microtubules (MT). Fluorescent micrographs of airway epithelial cells displaying actin microfilaments stained with phalloidin (Middle) and microtubules visualized with an antibody to ẞ-tubulin (Right). Both fluorescent micrographs are counterstained with Hoechst dye (blue) to visualize nuclei. Note the distinct differences in cytoskeletal structure. (Electron 70 micrograph used with permission of E Katchburian; fluorescent micrographs used with permission of Stephanie Manberg.)
شکل 2-6 میکروفیلامنتها و میکروتوبولها. میکروگراف الکترونی (سمت چپ) سیتوپلاسم فیبروبلاست، ریز رشتههای اکتین (MF) و میکروتوبولها (MT) را نشان میدهد. میکروگرافهای فلورسنت سلولهای اپیتلیال راه هوایی که میکروفیلامنتهای اکتین رنگآمیزی شده با فالویدین (میانی) و میکروتوبولهایی را که با آنتیبادی به ẞ-توبولین (راست) مشاهده میشوند، نشان میدهند. هر دو میکروگراف فلورسنت با رنگ هوخست (آبی) رنگ آمیزی میشوند تا هستهها را تجسم کنند. به تفاوتهای متمایز در ساختار اسکلت سلولی توجه کنید. (میکروگراف الکترون 70 با اجازه E Katchburian استفاده میشود؛ میکروگرافهای فلورسنت با اجازه استفانی منبرگ استفاده میشود.)
Because of their constant assembly and disassembly, microtubules are a dynamic portion of the cytoskeleton. They provide the tracks along which several different molecular motors move transport vesicles, organelles such as secretory granules, and mitochondria from one part of the cell to another. They also form the spindle, which moves the chromosomes in mitosis. Cargo can be transported in either direction on microtubules.
میکروتوبولها به دلیل مونتاژ و جداسازی مداومشان، بخش دینامیکی از اسکلت سلولی هستند. آنها مسیرهایی را فراهم میکنند که در طول آن چندین موتور مولکولی مختلف، وزیکولهای حمل و نقل، اندامکها مانند دانههای ترشحی و میتوکندری را از یک قسمت سلول به قسمت دیگر حرکت میدهند. آنها همچنین دوک را تشکیل میدهند که کروموزومها را در میتوز حرکت میدهد. محموله را میتوان در هر دو جهت بر روی میکروتوبولها حمل کرد.
There are several drugs available that disrupt cellular function through interaction with microtubules. Microtubule assembly is prevented by colchicine and vinblastine. The anticancer drug paclitaxel (Taxol) binds to microtubules and makes them so stable that organelles cannot move. Mitotic spindles cannot form, and the cells die.
چندین دارو در دسترس هستند که عملکرد سلولی را از طریق تعامل با میکروتوبولها مختل میکنند. کلشی سین و وینبلاستین از مونتاژ میکروتوبول جلوگیری میکند. داروی ضد سرطان پاکلیتاکسل (تاکسول) به میکروتوبولها متصل میشود و آنها را چنان پایدار میکند که اندامکها نمیتوانند حرکت کنند. دوکهای میتوزی نمیتوانند تشکیل شوند و سلولها میمیرند.
Intermediate filaments (Figure 2-5) are 8-14 nm in diameter and are made up of various subunits. Some of these filaments connect the nuclear membrane to the cell membrane. They form a flexible scaffolding for the cell and help it resist external pressure. In their absence, cells rupture more easily, and when they are abnormal in humans, blistering of the skin is common. The proteins that make up intermediate filaments are cell-type specific, and are thus frequently used as cellular markers. For example, vimentin is a major intermediate filament in fibroblasts, whereas cytokeratin is expressed in epithelial cells.
رشتههای میانی (شکل 2-5) 8-14 نانومتر قطر دارند و از زیر واحدهای مختلفی تشکیل شده اند. برخی از این رشتهها غشای هسته را به غشای سلولی متصل میکنند. آنها یک داربست انعطاف پذیر برای سلول تشکیل میدهند و به آن کمک میکنند تا در برابر فشار خارجی مقاومت کند. در غیاب آنها، سلولها راحتتر پاره میشوند و زمانی که در انسان غیرطبیعی باشند، ایجاد تاول در پوست شایع است. پروتئینهایی که رشتههای میانی را میسازند، خاص نوع سلول هستند، و بنابراین اغلب به عنوان نشانگر سلولی استفاده میشوند. به عنوان مثال، ویمنتین یک رشته میانی اصلی در فیبروبلاستها است، در حالی که سیتوکراتین در سلولهای اپیتلیال بیان میشود.
Microfilaments (Figures 2-5 and 2-6) are long solid fibers with a 5-9 nm diameter that are made up of actin. Although actin is most often associated with muscle contraction, it is present in all types of cells. It is the most abundant protein in mammalian cells, sometimes accounting for as much as 15% of the total protein in the cell. Its structure is highly conserved; for example, 88% of the amino acid sequences in yeast and rabbit actin are identical. Actin filaments polymerize and depolymerize in vivo, and it is not uncommon to find polymerization occurring at one end of the filament while depolymerization is occurring at the other end. Filamentous (F) actin refers to intact microfilaments and globular (G) actin refers to the unpolymerized protein actin subunits. F- actin fibers attach to various parts of the cytoskeleton and can interact directly or indirectly with membrane-bound proteins. They reach to the tips of the microvilli on the epithelial cells of the intestinal mucosa. They are also abundant in the lamellipodia that cells put out when they crawl along surfaces. The actin filaments interact with integrin receptors and form focal adhesion complexes, which serve as points of traction with the surface over which the cell pulls itself. In addition, some molecular motors use microfilaments as tracks.
ریز رشتهها (شکلهای 2-5 و 2-6) الیاف جامد بلند با قطر 5-9 نانومتر هستند که از اکتین ساخته شده اند. اگرچه اکتین اغلب با انقباض عضلانی مرتبط است، اما در همه انواع سلولها وجود دارد. این پروتئین فراوانترین پروتئین در سلولهای پستانداران است که گاهی تا 15 درصد از کل پروتئین موجود در سلول را تشکیل میدهد. ساختار آن به شدت حفظ شده است. به عنوان مثال، 88 درصد از توالی اسیدهای آمینه در اکتین مخمر و خرگوش یکسان هستند. رشتههای اکتین در داخل بدن پلیمریزه و دپلیمریزه میشوند و غیر معمول نیست که پلیمریزاسیون در یک انتهای رشته رخ دهد در حالی که پلیمریزاسیون در انتهای دیگر رخ میدهد. اکتین رشته ای (F) به ریز رشتههای دست نخورده و اکتین کروی (G) به زیرواحدهای اکتین پروتئین پلیمریزه نشده اشاره دارد. فیبرهای F-اکتین به بخشهای مختلف اسکلت سلولی متصل میشوند و میتوانند به طور مستقیم یا غیرمستقیم با پروتئینهای متصل به غشاء تعامل کنند. آنها به نوک میکروویلیهای روی سلولهای اپیتلیال مخاط روده میرسند. آنها همچنین در لاملیپودیایی که سلولها هنگام خزیدن در امتداد سطوح بیرون میآورند، فراوان هستند. رشتههای اکتین با گیرندههای اینتگرین تعامل میکنند و کمپلکسهای چسبندگی کانونی را تشکیل میدهند، که به عنوان نقاط کشش با سطحی که سلول خود را روی آن میکشد، عمل میکند. علاوه بر این، برخی از موتورهای مولکولی از ریز رشتهها به عنوان مسیر استفاده میکنند.
MOLECULAR MOTORS
The molecular motors that move proteins, organelles, and other cell parts (collectively referred to as “cargo”) to all parts of the cell are 100-500 kDa ATPases. They attach to their cargo at one end of the molecule and to microtubules or actin polymers with the other end, sometimes referred to as the “head.” They convert the energy of ATP into movement along the cytoskeleton, taking their cargo with them. There are three super families of molecular motors: kinesin, dynein, and myosin. Examples of individual proteins from each superfamily are shown in Figure 2-7. It is important to note that there is extensive variation among superfamily members, allowing for the specialization of function (eg, choice of cargo, cytoskeletal filament type, and/or direction of movement).
موتورهای مولکولی
موتورهای مولکولی که پروتئینها، اندامکها و سایر بخشهای سلولی (که در مجموع به آنها “محموله” گفته میشود) را به تمام قسمتهای سلول منتقل میکنند، 100-500 کیلو دالتون ATPases هستند. آنها به محموله خود در یک انتهای مولکول و به میکروتوبولها یا پلیمرهای اکتین با سر دیگر متصل میشوند که گاهی اوقات به عنوان “سر” نامیده میشود. آنها انرژی ATP را به حرکت در امتداد اسکلت سلولی تبدیل میکنند و محموله خود را با خود میبرند. سه سوپر خانواده موتورهای مولکولی وجود دارد: کینزین، داینئین و میوزین. نمونههایی از پروتئینهای مجزا از هر خانواده در شکل 2-7 نشان داده شده است. توجه به این نکته مهم است که تنوع گسترده ای در بین اعضای ابرخانواده وجود دارد که امکان تخصصی شدن عملکرد را فراهم میکند (به عنوان مثال، انتخاب محموله، نوع رشته اسکلت سلولی و/یا جهت حرکت).

FIGURE 2-7 Examples of molecular motors. Conventional kinesin is shown attached to cargo, in this case a membrane-bound organelle (light blue). Cytoplasmic dynein is shown in isolation. Myosin V and its ability to “walk” along a microfilament are displayed in a two-part sequence. Note that the “heads” of each of the motors hydrolyze ATP and use the energy to produce motion.
شکل 2-7 نمونههایی از موتورهای مولکولی. کینزین معمولی متصل به محموله، در این مورد یک اندامک متصل به غشاء (آبی روشن) نشان داده شده است. داینئین سیتوپلاسمیبه صورت مجزا نشان داده میشود. میوزین V و توانایی آن برای “راه رفتن” در امتداد یک میکروفیلامنت در یک توالی دو قسمتی نمایش داده میشود. توجه داشته باشید که “سر” هر یک از موتورها ATP را هیدرولیز میکند و از انرژی برای تولید حرکت استفاده میکند.
The conventional form of kinesin is a double-headed molecule that tends to move its cargo toward the plus (“+”) ends of microtubules. One head binds to the microtubule and then bends its neck while the other head swings forward and binds, producing almost continuous movement. Some kinesins are associated with mitosis and meiosis. Other kinesins perform different functions, including, in some instances, moving cargo to the minus (“-“) end of microtubules. Dyneins have two heads, with their neck pieces embedded in a complex of proteins. Cytoplasmic dyneins have a function like that of conventional kinesin, except they tend to move particles and membranes to the minus (-) end of the microtubules. The multiple forms of myosin in the body are divided into 18 classes. The heads of myosin molecules bind to actin and produce motion by bending their neck regions (myosin II) or walking along microfilaments, one head after the other (myosin V). In these ways, they perform functions as diverse as contraction of muscle and cell migration.
شکل معمولی کینزین یک مولکول دو سر است که تمایل دارد محموله خود را به سمت انتهای مثبت (“+”) میکروتوبولها حرکت دهد. یک سر به میکروتوبول متصل میشود و سپس گردن خود را خم میکند در حالی که سر دیگر به سمت جلو حرکت میکند و متصل میشود و حرکت تقریباً مداومیایجاد میکند. برخی از کینزینها با میتوز و میوز مرتبط هستند. سایر کینزینها عملکردهای مختلفی را انجام میدهند، از جمله، در برخی موارد، انتقال محموله به انتهای منهای (“-“) میکروتوبولها. داینینها دو سر دارند که تکههای گردن آنها در مجموعه ای از پروتئینها جاسازی شده است. داینینهای سیتوپلاسمیعملکردی مانند کینزین معمولی دارند، با این تفاوت که تمایل دارند ذرات و غشاها را به سمت منهای (-) انتهای میکروتوبولها حرکت دهند. اشکال متعدد میوزین در بدن به 18 کلاس تقسیم میشود. سر مولکولهای میوزین به اکتین متصل میشود و با خم کردن نواحی گردن (میوزین II) یا راه رفتن در امتداد ریز رشتهها، یکی پس از دیگری (میوزین V) حرکت ایجاد میکند. به این ترتیب، آنها عملکردهای متنوعی مانند انقباض ماهیچهها و مهاجرت سلولی را انجام میدهند.
CENTROSOMES
Near the nucleus in the cytoplasm of eukaryotic animal cells is a centrosome. The centrosome is made up of two centrioles and surrounding amorphous pericentriolar material. The centrioles are short cylinders arranged so that they are at right angles to each other. Microtubules in groups of three run longitudinally in the walls of each centriole (Figure 2-1). Nine of these triplets are spaced at regular intervals around the circumference.
سانتروزومها
در نزدیکی هسته در سیتوپلاسم سلولهای جانوری یوکاریوتی یک سانتروزوم قرار دارد. سانتروزوم از دو سانتریول و مواد بی شکل اطراف مرکز تشکیل شده است. سانتریولها استوانههای کوتاهی هستند که طوری چیده شده اند که با هم زاویه قائمه دارند. میکروتوبولها در گروههای سه تایی به صورت طولی در دیوارههای هر سانتریول اجرا میشوند (شکل 2-1). 9 تا از این سه قلوها در فواصل منظم در اطراف محیط قرار دارند.
The centrosomes are microtubule-organizing centers (MTOCs) that contain y-tubulin. The microtubules grow out of this y-tubulin in the pericentriolar material. When a cell divides, the centrosomes duplicate themselves, and the pairs move apart to the poles of the mitotic spindle, where they monitor the steps in cell division. In multinucleate cells, a centrosome is near each nucleus.
سانتروزومها مراکز سازماندهی میکروتوبول (MTOCs) هستند که حاوی y-tubulin هستند. میکروتوبولها از این y-توبولین در ماده pericentriolar رشد میکنند. هنگامیکه یک سلول تقسیم میشود، سانتروزومها خود را تکثیر میکنند و جفتها از هم جدا میشوند و به قطبهای دوک میتوزی میروند، جایی که مراحل تقسیم سلولی را زیر نظر میگیرند. در سلولهای چند هسته ای، یک سانتروزوم در نزدیکی هر هسته قرار دارد.
CILIA
Cilia are specialized cellular projections that are used by unicellular organisms to propel themselves through liquid and by multicellular organisms to propel mucus and other substances over the surface of various epithelia. Additionally, virtually all cells in the human body contain a primary cilium that emanates from the surface. The primary cilium serves as a sensory organelle that receives both mechanical and chemical signals from other cells and the environment. Cilia are functionally indistinct from the eukaryotic flagella of sperm cells. Within the cilium there is an axoneme that comprises a unique arrangement of nine outer microtubule doublets and two inner microtubules (“9+2” arrangement). Along this cytoskeleton is axonemal dynein. Coordinated dynein- microtubule interactions within the axoneme are the basis of ciliary and sperm movement. At the base of the axoneme and just inside lies the basal body. It has nine circumferential triplet microtubules, like a centriole, and there is evidence that basal bodies and centrioles are interconvertible. A wide variety of diseases and disorders arise from dysfunctional cilia (Clinical Box 2-3).
سیلیا
جلیقهها برآمدگیهای سلولی تخصصی هستند که توسط ارگانیسمهای تک سلولی برای به حرکت درآوردن خود از طریق مایع و توسط ارگانیسمهای چند سلولی برای به حرکت درآوردن موکوس و سایر مواد بر روی سطح اپیتلیالهای مختلف استفاده میشود. علاوه بر این، تقریباً تمام سلولهای بدن انسان حاوی یک مژک اولیه هستند که از سطح بیرون میآید. مژک اولیه به عنوان اندامک حسی عمل میکند که سیگنالهای مکانیکی و شیمیایی را از سایر سلولها و محیط دریافت میکند. سلیومها از نظر عملکردی از تاژکهای یوکاریوتی سلولهای اسپرم متمایز نیستند. درون مژک یک آکسونم وجود دارد که از آرایش منحصر به فردی از نه دوتایی میکروتوبول بیرونی و دو میکروتوبول داخلی (آرایش “9+2”) تشکیل شده است. در امتداد این اسکلت سلولی آکسونمال داینئین قرار دارد. فعل و انفعالات هماهنگ داینین- میکروتوبول در آکسونم اساس حرکت مژگانی و اسپرم است. در قاعده آکسونم و درست در داخل بدن بازال قرار دارد. این 9 میکرولوله سه گانه محیطی دارد، مانند یک سانتریول، و شواهدی وجود دارد که اجسام پایه و سانتریولها قابل تبدیل هستند. طیف گسترده ای از بیماریها و اختلالات از گل مژههای ناکارآمد ناشی میشوند (باکس بالینی 2-3).
CLINICAL BOX 2.3
Ciliary Diseases
Primary ciliary dyskinesia refers to a set of inherited disorders that limit ciliary structure and/or function. Disorders associated with ciliary dysfunction have long been recognized in the conducting airway. Altered ciliary function in the conducting airway can slow the mucociliary escalator and result in airway obstruction and increased infection. Dysregulation of ciliary function in sperm cells has also been well characterized to result in loss of motility and infertility. Ciliary defects in the function or structure of primary cilia have been shown to have effects on a variety of tissues/organs. As would be expected, such diseases are quite varied in their presentation, largely due to the affected tissue, and include mental retardation, retinal blindness, obesity, polycystic kidney disease, liver fibrosis, ataxia, and some forms of cancer.
کادر بالینی 2.3
بیماریهای مژگانی
دیسکینزی مژگانی اولیه به مجموعه ای از اختلالات ارثی اشاره دارد که ساختار و/یا عملکرد مژگانی را محدود میکند. اختلالات مرتبط با اختلال عملکرد مژگانی مدتهاست که در راه هوایی رسانا شناخته شده است. تغییر عملکرد مژگانی در راه هوایی رسانا میتواند پله برقی موکوسیلیاری را کند کرده و منجر به انسداد راه هوایی و افزایش عفونت شود. اختلال در عملکرد مژگانی در سلولهای اسپرم نیز به خوبی مشخص شده است که منجر به از دست دادن تحرک و ناباروری میشود. نقایص مژگانی در عملکرد یا ساختار مژکهای اولیه نشان داده شده است که بر روی انواع بافتها / اندامها تأثیر میگذارد. همانطور که انتظار میرود، چنین بیماریهایی از نظر تظاهرات کاملاً متفاوت هستند که عمدتاً به دلیل بافت آسیب دیده است و شامل عقب ماندگی ذهنی، کوری شبکیه، چاقی، بیماری کلیه پلی کیستیک، فیبروز کبدی، آتاکسی و برخی از انواع سرطان میشود.
THERAPEUTIQ HIGHLIGHTS
The severity in ciliary disorders can vary widely, and treatments targeted to individual organs also vary. Treatment of ciliary dyskinesia in the conducting airway is focused on keeping the airways clear and free of infection. Strategies include routine washing and suctioning of the sinus cavities and ear canals and liberal use of antibiotics. Other treatments that keep the airway from being obstructed (eg, bronchodilators, mucolytics, and corticosteroids) are also commonly used.
نکات برجسته درمانی
شدت اختلالات مژگانی میتواند به طور گسترده ای متفاوت باشد، و درمانهای هدفمند برای اندامهای فردی نیز متفاوت است. درمان دیسکینزی مژگانی در راه هوایی رسانا بر پاک نگه داشتن راههای هوایی و عاری از عفونت متمرکز است. استراتژیها شامل شستن و ساکشن روتین حفرههای سینوسی و کانالهای گوش و استفاده آزادانه از آنتی بیوتیکها است. درمانهای دیگری که از انسداد راه هوایی جلوگیری میکنند (مثلاً برونکودیلاتورها، موکولیتیکها و کورتیکواستروئیدها) نیز معمولاً استفاده میشوند.
CELL ADHESION MOLECULES
Cells are attached to the basal lamina and to each other by CAMs that are prominent parts of the intercellular connections described below. The unique structural and signaling functions of these adhesion proteins have been found to be important in embryonic development and formation of the nervous system and other tissues, in holding tissues together in adults, in inflammation and wound healing, and in the metastasis of tumors. Many CAMs pass through the cell membrane and are anchored to the cytoskeleton inside the cell. Some bind to like molecules on other cells (homophilic binding), whereas others bind to nonself molecules (heterophilic binding). Many bind to laminins, a family of large cross-shaped molecules with multiple receptor domains in the extracellular matrix.
مولکولهای چسبندگی سلولی
سلولها توسط CAM که بخشهای برجسته ای از اتصالات بین سلولی هستند که در زیر توضیح داده شده است به لایه پایه و به یکدیگر متصل میشوند. مشخص شده است که عملکردهای ساختاری و سیگنالی منحصر به فرد این پروتئینهای چسبنده در رشد جنینی و تشکیل سیستم عصبی و سایر بافتها، در کنار هم نگه داشتن بافتها در بزرگسالان، در التهاب و بهبود زخم و متاستاز تومورها مهم است. بسیاری از CAMها از غشای سلولی عبور میکنند و به اسکلت سلولی داخل سلول متصل میشوند. برخی به مولکولهای مشابه روی سلولهای دیگر متصل میشوند (اتصال هموفیلیک)، در حالی که برخی دیگر به مولکولهای غیرخودی (پیوند هتروفیلیک) متصل میشوند. بسیاری از آنها به لامینینها، خانواده ای از مولکولهای متقاطع شکل بزرگ با دامنههای گیرنده متعدد در ماتریکس خارج سلولی متصل میشوند.
Nomenclature in the CAM field is somewhat chaotic, partly because the field is growing so rapidly and partly because of the extensive use of acronyms, as in other areas of modern biology. However, the CAMs can be divided into four broad families: (1) integrins, heterodimers that bind to various receptors; (2) adhesion molecules of the IgG superfamily of immunoglobulins; (3) cadherins, Ca2+-dependent molecules that mediate cell-to-cell adhesion by homophilic reactions; and (4) selectins, which have lectin-like domains that bind carbohydrates.
نامگذاری در زمینه CAM تا حدودی آشفته است، تا حدی به این دلیل که این رشته به سرعت در حال رشد است و تا حدی به دلیل استفاده گسترده از کلمات اختصاری، مانند سایر حوزههای زیست شناسی مدرن. با این حال، CAMها را میتوان به چهار خانواده بزرگ تقسیم کرد: (1) اینتگرینها، هترودیمرهایی که به گیرندههای مختلف متصل میشوند. (2) مولکولهای چسبندگی از خانواده فوق العاده IgG ایمونوگلوبولینها. (3) کادرینها، مولکولهای وابسته به Ca2 که واسطه چسبندگی سلول به سلول توسط واکنشهای هموفیل هستند. و (4) سلکتینها که دارای حوزههای لکتین مانند هستند که کربوهیدراتها را متصل میکنند.
The CAMS not only fasten cells to their neighbors, but they also transmit signals into and out of the cell. For example, cells that lose their contact with the extracellular matrix via integrins have a higher rate of apoptosis than anchored cells, and interactions between integrins and the cytoskeleton are involved in cell movement.
دوربینهای مداربسته نه تنها سلولها را به همسایگان خود میبندند، بلکه سیگنالها را به داخل و خارج سلول نیز ارسال میکنند. به عنوان مثال، سلولهایی که تماس خود را با ماتریکس خارج سلولی از طریق اینتگرین از دست میدهند، نسبت به سلولهای لنگردار، سرعت آپوپتوز بیشتری دارند و برهمکنشهای بین اینتگرین و اسکلت سلولی در حرکت سلولی نقش دارند.
INTERCELLULAR CONNECTIONS
Intercellular junctions that form between the cells in tissues can be broadly split into two groups: junctions that fasten the cells to one another and to surrounding tissues, and junctions that permit transfer of ions and other molecules from one cell to another. The types of junctions that tie cells together and endow tissues with strength and stability include tight junctions, which are also known as the zonula occludens (Figure 2-8). The desmosome and zonula adherens also help hold cells together, and the hemidesmosome and focal adhesions attach cells to their basal laminas. The gap junction forms a cytoplasmic “tunnel” for diffusion of small molecules (< 1000 Da) between two neighboring cells.
اتصالات بین سلولی
اتصالات بین سلولی که بین سلولهای بافت ایجاد میشود را میتوان به طور کلی به دو گروه تقسیم کرد: اتصالات که سلولها را به یکدیگر و به بافتهای اطراف متصل میکنند و اتصالاتی که امکان انتقال یونها و سایر مولکولها را از یک سلول به سلول دیگر فراهم میکنند. انواع اتصالاتی که سلولها را به هم میبندند و به بافتها استحکام و پایداری میبخشند شامل اتصالات محکم هستند که به نام zonula occludens نیز شناخته میشوند (شکل 2-8). دسموزوم و چسبنده زونولا همچنین به نگه داشتن سلولها در کنار هم کمک میکنند و چسبندگیهای همیدزموزوم و کانونی سلولها را به لایههای پایه آنها متصل میکنند. اتصال شکاف یک “تونل” سیتوپلاسمیرا برای انتشار مولکولهای کوچک (< 1000 Da) بین دو سلول همسایه تشکیل میدهد.

FIGURE 2–8 Intercellular junctions in the mucosa of the small intestine. Tight junctions (zonula occludens), adherens junctions (zonula adherens), desmosomes, gap junctions, and hemidesmosomes are all shown in relative positions in a polarized epithelial cell.
شکل 2-8 اتصالات بین سلولی در مخاط روده کوچک. اتصالات محکم (zonula occludens)، اتصالات چسبنده (zonula adherens)، دسموزومها، اتصالات شکافی، و hemidesmosomes همگی در موقعیتهای نسبی در یک سلول اپیتلیال پلاریزه نشان داده شده اند.
Tight junctions characteristically surround the apical margins of the cells in epithelia such as the intestinal mucosa, the walls of the renal tubules, and the choroid plexus. They are also important to endothelial barrier function and endothelium-dependent vasodilation. They are made up of ridges—half from one cell and half from the other-which adhere so strongly at cell junctions that they almost obliterate the space between the cells. There are three main families of transmembrane proteins that contribute to tight junctions: occludin, junctional adhesion molecules, and claudins; there are several more proteins that interact from the cytosolic side. Tight junctions permit the passage of ions, solute and intracellular signaling molecules in between adjacent cells (paracellular pathway) and the degree of this “leakiness” varies, depending in part on the protein makeup of the tight junction. Extracellular fluxes of ions and solute across epithelia at these junctions are a significant part of overall ion and solute flux. In addition, tight junctions prevent the movement of proteins in the plane of the membrane, helping maintain the different distribution of transporters and channels in the apical and basolateral cell membranes that make transport across epithelia possible.
اتصالات محکم به طور مشخص حاشیههای آپیکال سلولهای اپیتلیوم مانند مخاط روده، دیوارههای لولههای کلیوی و شبکه مشیمیه را احاطه میکند. آنها همچنین برای عملکرد سد اندوتلیال و اتساع عروق وابسته به اندوتلیوم مهم هستند. آنها از برجستگیهایی تشکیل شده اند – نیمیاز یک سلول و نیمیاز سلول دیگر – که به قدری در محل اتصال سلولها به هم میچسبند که تقریباً فضای بین سلولها را محو میکنند. سه خانواده اصلی از پروتئینهای گذرنده وجود دارد که به اتصالات محکم کمک میکنند: اکلودین، مولکولهای چسبنده پیوندی، و کلودین. چندین پروتئین دیگر وجود دارد که از سمت سیتوزولی برهم کنش دارند. اتصالات محکم اجازه عبور یونها، املاح و مولکولهای سیگنالدهنده درون سلولی را در بین سلولهای مجاور (مسیر پاراسلولی) میدهند و میزان این “نشت” متفاوت است، که تا حدی به ترکیب پروتئین پیوند محکم بستگی دارد. شار خارج سلولی یونها و املاح در سراسر اپیتلیوم در این اتصالات بخش قابل توجهی از شار کلی یون و املاح است. علاوه بر این، اتصالات محکم از حرکت پروتئینها در صفحه غشاء جلوگیری میکند، و به حفظ توزیع متفاوت ناقلها و کانالها در غشای سلولی آپیکال و قاعده جانبی کمک میکند که انتقال در سراسر اپیتلیوم را ممکن میکند.
In epithelial cells, each zonula adherens is usually a continuous structure on the basal side of the zonula occludens, and it is a major site of attachment for intracellular microfilaments. It contains cadherins.
در سلولهای اپیتلیال، هر زونولای چسبنده معمولاً یک ساختار پیوسته در سمت قاعدهای زونولا مسدود است و محل اصلی اتصال میکروفیلامنتهای داخل سلولی است. حاوی کادرین است.
Desmosomes are patches characterized by apposed thickenings of the membranes of two adjacent cells. Attached to the thickened area in each cell are intermediate filaments, some running parallel to the membrane and others radiating away from it. Between the two membrane thickenings, the intercellular space contains filamentous material that includes cadherins and the extracellular portions of several other transmembrane proteins.
دسموزومها لکههایی هستند که با ضخیم شدن احتمالی غشاهای دو سلول مجاور مشخص میشوند. به ناحیه ضخیم شده در هر سلول، رشتههای میانی متصل میشوند که برخی به موازات غشاء هستند و برخی دیگر از آن دور میشوند. بین دو ضخیم شدن غشاء، فضای بین سلولی حاوی مواد رشته ای است که شامل کادرینها و بخشهای خارج سلولی چندین پروتئین ترانس غشایی دیگر است.
Hemidesmosomes look like half-desmosomes that attach cells to the underlying basal lamina and are connected intracellularly to intermediate filaments. However, they contain integrins rather than cadherins. Focal adhesions also attach cells to their basal laminas. As noted previously, they are labile structures associated with actin filaments inside the cell, and they play an important role in cell movement.
همیدزموزومها شبیه نیمه دسموزومهایی هستند که سلولها را به لایه بازال زیرین متصل میکنند و به صورت درون سلولی به رشتههای میانی متصل میشوند. با این حال، آنها حاوی اینتگرین هستند تا کادرین. چسبندگیهای کانونی نیز سلولها را به لایههای پایه آنها متصل میکند. همانطور که قبلا ذکر شد، آنها ساختارهای ناپایداری مرتبط با رشتههای اکتین در داخل سلول هستند و نقش مهمیدر حرکت سلول دارند.
GAP JUNCTIONS
The intercellular space is up to 4 nm at gap junctions. Here, units called connexons in the membrane of each cell are lined up with one another to form the dodecameric gap junction (Figure 2-9). Each connexon is made up of six protein subunits called connexins. They surround a channel that, when lined up with the channel in the corresponding connexon in the adjacent cell, permits substances to pass between the cells without entering the ECF. The pore diameter in the channel is estimated between 0.8 and 1.4 nm, which permits the passage of ions, sugars, amino acids, and other solutes with molecular weights up to about 1000 Da. Gap junctions thus permit the rapid propagation of electrical activity from cell to cell, as well as the exchange of various chemical messengers and intracellular signaling molecules. However, the gap junction channels are not simply passive, nonspecific conduits. At least 20 different genes code for connexins in humans, and mutations in these genes can lead to diseases that are highly selective in terms of the tissues involved and the type of communication between cells produced (Clinical Box 2-4). Experiments in which particular connexins are deleted by gene manipulation or replaced with different connexins confirm that the particular connexin subunits that make up connexons determine their permeability and selectivity. It should be noted that connexons can also provide a conduit (ie, connexin semichannels) for regulated passage of small molecules between the cytoplasm and the ECF. Such movement can allow additional signaling pathways between and among cells in a tissue.
اتصالات شکاف
فضای بین سلولی در اتصالات شکاف تا 4 نانومتر است. در اینجا، واحدهایی به نام کانکسون در غشای هر سلول با یکدیگر ردیف میشوند تا اتصال شکاف دوازدهه را تشکیل دهند (شکل 2-9). هر کانکسون از شش زیر واحد پروتئینی به نام کانکسین تشکیل شده است. آنها کانالی را احاطه کرده اند که وقتی با کانال در کانکسون مربوطه در سلول مجاور ردیف میشود، به مواد اجازه میدهد بدون ورود به ECF از بین سلولها عبور کنند. قطر منافذ در کانال بین 0.8 تا 1.4 نانومتر تخمین زده میشود که اجازه عبور یونها، قندها، اسیدهای آمینه و سایر املاح با وزن مولکولی تا حدود 1000 Da را میدهد. بنابراین، اتصالات شکاف انتشار سریع فعالیت الکتریکی از سلولی به سلول دیگر و همچنین تبادل پیامرسانهای شیمیایی مختلف و مولکولهای سیگنال درون سلولی را ممکن میسازد. با این حال، کانالهای اتصال شکاف صرفاً مجرای غیرفعال و غیر اختصاصی نیستند. حداقل 20 ژن مختلف برای کانکسینها در انسان کد میکنند و جهش در این ژنها میتواند منجر به بیماریهایی شود که از نظر بافتهای درگیر و نوع ارتباط بین سلولهای تولید شده بسیار انتخابی هستند (باکس بالینی 2-4). آزمایشهایی که در آن کانکسهای خاص با دستکاری ژن حذف میشوند یا با کانکسینهای مختلف جایگزین میشوند، تأیید میکنند که زیرواحدهای کانکسین خاصی که کانکسها را تشکیل میدهند، نفوذپذیری و انتخابپذیری آنها را تعیین میکنند. لازم به ذکر است که کانکسها همچنین میتوانند مجرای (به عنوان مثال، نیمه کانالهای کانکسین) برای عبور تنظیم شده مولکولهای کوچک بین سیتوپلاسم و ECF فراهم کنند. چنین حرکتی میتواند مسیرهای سیگنالی اضافی را بین سلولها و بین سلولهای یک بافت ایجاد کند.

FIGURE 2-9 Gap junction connecting the cytoplasm of two cells. A) A gap junction plaque, or collection of individual gap junctions, is shown to form multiple pores between cells that allow for the transfer of small molecules. Inset is an electron micrograph from rat liver. B) Topographic depiction of individual connexon and corresponding six connexin proteins that traverse the membrane. Note that each connexin traverses the membrane four times. (Reproduced with permission from Kandel ER, Schwartz JH, Jessell TM, Siegelbaum SA, Hudspeth AJ (editors): Principles of Neural Science, 5th ed. New York, NY: McGraw-Hill; 2013.)
شکل 2-9 اتصال شکافی که سیتوپلاسم دو سلول را به هم متصل میکند. الف) یک پلاک اتصال شکاف، یا مجموعه ای از اتصالات شکاف جداگانه، نشان داده شده است که منافذ متعددی را بین سلولها تشکیل میدهد که امکان انتقال مولکولهای کوچک را فراهم میکند. Inset یک میکروگراف الکترونی از کبد موش است. ب) تصویر توپوگرافی کانکسون منفرد و شش پروتئین کانکسین مربوطه که از غشاء عبور میکنند. توجه داشته باشید که هر کانکسین چهار بار از غشا عبور میکند. (تکثیر شده با اجازه از Kandel ER، Schwartz JH، Jessell TM، Siegelbaum SA، Hudspeth AJ (ویراستاران): Principles of Neural Science، ویرایش پنجم نیویورک، نیویورک: McGraw-Hill؛ 2013.)
CLINICAL BOX 2:4
Connexins in Disease
There is extensive information related to the in vivo functions of connexins, growing out of work on connexin knockouts in mice and the analysis of mutations in human connexins. The mouse knockouts demonstrated that connexin deletions lead to electrophysiological defects in the heart and predisposition to sudden cardiac death, female sterility, abnormal bone development, abnormal growth in the liver, cataracts, hearing loss, and a host of other abnormalities. Information from these and other studies has allowed for the identification of several connexin mutations known to be responsible for almost 20 different human diseases. These diseases include several skin disorders such as Clouston syndrome (a connexin 30 (Cx30) defect) and erythrokeratoderma variabilis (Cx30.3 and Cx31); inherited deafness (Cx26, Cx30, and Cx31); predisposition to myoclonic epilepsy (Cx36); predisposition to arteriosclerosis (Cx37); cataract (Cx46 and Cx50); idiopathic atrial fibrillation (Cx40); and X-linked Charcot-Marie-Tooth disease (Cx32). It is interesting to note that each of these target tissues for disease contains other connexins that do not fully compensate for loss of the crucial connexins in disease development. Understanding how loss of individual connexins alters cell physiology to contribute to these and other human diseases is an area of intense research.
کادر بالینی2. 4
کانکسینها در بیماری
اطلاعات گستردهای در رابطه با عملکردهای in vivo کانکسینها، رشد بدون کار بر روی ناک اوت کانکسین در موشها و تجزیه و تحلیل جهشها در کانکسینها وجود دارد. ناک اوت موش نشان داد که حذف کانکسین منجر به نقایص الکتروفیزیولوژیک در قلب و مستعد مرگ ناگهانی قلبی، عقیمیزنان، رشد غیرطبیعی استخوان، رشد غیرطبیعی در کبد، آب مروارید، کاهش شنوایی و بسیاری از ناهنجاریهای دیگر میشود. اطلاعات به دست آمده از این مطالعات و مطالعات دیگر امکان شناسایی چندین جهش کانکسین را فراهم کرده است که مسئول تقریباً 20 بیماری مختلف انسانی هستند. این بیماریها شامل چندین اختلال پوستی مانند سندرم Clouston (یک نقص کانکسین 30 (Cx30)) و erythrokeratoderma variabilis (Cx30.3 و Cx31) است. ناشنوایی ارثی (Cx26، Cx30، و Cx31)؛ مستعد ابتلا به صرع میوکلونیک (Cx36)؛ استعداد ابتلا به تصلب شرایین (Cx37)؛ آب مروارید (Cx46 و Cx50)؛ فیبریلاسیون دهلیزی ایدیوپاتیک (Cx40)؛ و بیماری Charcot-Marie-Tooth مرتبط با X (Cx32). جالب است بدانید که هر یک از این بافتهای هدف برای بیماری حاوی کانکسینهای دیگری هستند که به طور کامل از دست دادن کانکسینهای حیاتی در توسعه بیماری را جبران نمیکنند. درک اینکه چگونه از دست دادن کانکسینهای منفرد فیزیولوژی سلولی را برای کمک به این بیماریها و سایر بیماریهای انسانی تغییر میدهد، منطقه ای از تحقیقات فشرده است.
NUCLEUS & RELATED STRUCTURES
A nucleus is present in all eukaryotic cells that divide (Figure 2-1). The nucleus is made up in large part of the chromosomes, the structures in the nucleus that carry a complete blueprint for all the heritable species and individual characteristics of the animal. Except in germ cells, the chromosomes occur in pairs, one originally from each parent. Each chromosome is made up of a giant molecule of DNA. The DNA strand is about 2 m long, but it can fit in the nucleus because at intervals it is wrapped around a core of histone proteins to form a nucleosome. There are about 25 million nucleosomes in each nucleus. Thus, the structure of the chromosomes has been likened to a string of beads. The beads are the nucleosomes, and the linker DNA between them is the string. The whole complex of DNA and proteins is called chromatin. During cell division, the coiling around histones is loosened, probably by acetylation of the histones, and pairs of chromosomes become visible, but between cell divisions only clumps of chromatin can be discerned in the nucleus. The ultimate units of heredity are the genes on the chromosomes. As discussed in Chapter 1, each gene is a portion of the DNA molecule.
هسته و ساختارهای مرتبط
یک هسته در تمام سلولهای یوکاریوتی که تقسیم میشوند وجود دارد (شکل 2-1). هسته در بخش بزرگی از کروموزومها تشکیل شده است، ساختارهایی در هسته که نقشه کاملی برای تمام گونههای ارثی و ویژگیهای فردی حیوان دارند. به جز در سلولهای زاینده، کروموزومها به صورت جفت، یکی از هر والدین، وجود دارند. هر کروموزوم از یک مولکول غول پیکر DNA تشکیل شده است. رشته DNA حدود 2 متر طول دارد، اما میتواند در هسته قرار گیرد زیرا در فواصل زمانی دور هسته ای از پروتئینهای هیستون پیچیده میشود تا یک نوکلئوزوم تشکیل دهد. در هر هسته حدود 25 میلیون نوکلئوزوم وجود دارد. بنابراین، ساختار کروموزومها به رشته ای از مهرهها تشبیه شده است. مهرهها نوکلئوزوم هستند و DNA پیوند دهنده بین آنها رشته است. کل مجموعه DNA و پروتئینها کروماتین نامیده میشود. در طی تقسیم سلولی، احتمالاً در اثر استیلاسیون هیستونها، سیم پیچ اطراف هیستونها شل میشود و جفتهای کروموزوم قابل مشاهده میشوند، اما بین تقسیمهای سلولی تنها تودههای کروماتین را میتوان در هسته تشخیص داد. واحدهای نهایی وراثت، ژنهای روی کروموزومها هستند. همانطور که در فصل 1 بحث شد، هر ژن بخشی از مولکول DNA است.
The nucleus of most cells contains a nucleolus (Figure 2-1), a patchwork of granules rich in RNA. In some cells, the nucleus contains several of these structures. Nucleoli are most prominent and numerous in growing cells. They are the site of synthesis of ribosomes, the structures in the cytoplasm in which proteins are synthesized.
هسته اکثر سلولها حاوی یک هسته است (شکل 2-1)، مجموعه ای از گرانولهای غنی از RNA. در برخی سلولها، هسته حاوی چندین مورد از این ساختارها است. هستهها در سلولهای در حال رشد برجستهترین و متعدد هستند. آنها محل سنتز ریبوزومها هستند، ساختارهایی در سیتوپلاسم که در آن پروتئینها سنتز میشوند.
The interior of the nucleus has a skeleton of fine filaments that are attached to the nuclear membrane, or envelope (Figure 2-1), which surrounds the nucleus. This membrane is a double membrane, and spaces between the twofolds are called perinuclear cisterns. The membrane is permeable only to small molecules. However, it contains nuclear pore complexes. Each complex has eightfold symmetry and is made up of about 100 proteins organized to form a tunnel through which transport of proteins and mRNA occurs. There are many transport pathways; many proteins that participate in these pathways, including importins and exportins, have been isolated and characterized. Much current research is focused on transport into and out of the nucleus, and a more detailed understanding of these processes should emerge in the near future.
داخل هسته دارای اسکلتی از رشتههای ظریف است که به غشای هسته یا پوشش (شکل 2-1) که هسته را احاطه کرده است، متصل شده است. این غشاء یک غشای دوتایی است و فضاهای بین دو لایه را مخازن دور هسته ای مینامند. غشاء فقط برای مولکولهای کوچک نفوذ پذیر است. با این حال، حاوی مجتمعهای منافذ هسته ای است. هر مجتمع دارای تقارن هشت برابری است و از حدود 100 پروتئین تشکیل شده است که برای تشکیل یک تونل سازماندهی شده اند که از طریق آن انتقال پروتئین و mRNA صورت میگیرد. مسیرهای حمل و نقل زیادی وجود دارد. بسیاری از پروتئینهایی که در این مسیرها شرکت میکنند، از جمله واردات و صادرات، جدا شده و مشخص شدهاند. بسیاری از تحقیقات کنونی بر انتقال به داخل و خارج از هسته متمرکز شدهاند و درک دقیقتری از این فرآیندها باید در آینده نزدیک پدیدار شود.
ENDOPLASMIC RETICULUM
The endoplasmic reticulum is a complex series of tubules in the cytoplasm of the cell (Figure 2-1; Figure 2-10; and Figure 2-11). The inner limb of its membrane is continuous with a segment of the nuclear membrane, so in effect this part of the nuclear membrane is a cistern of the endoplasmic reticulum. The tubule walls are made up of membrane. In rough (granular) endoplasmic reticulum, ribosomes are attached to the cytoplasmic side of the membrane, whereas in smooth (agranular) endoplasmic reticulum, ribosomes are absent. Free ribosomes are also found in the cytoplasm. The rough endoplasmic reticulum is concerned with protein synthesis and the initial folding of polypeptide chains with the formation of disulfide bonds. The smooth endoplasmic reticulum is the site of steroid synthesis in steroid-secreting cells and the site of detoxification processes in other cells. A modified endoplasmic reticulum, the sarcoplasmic reticulum, plays an important role in skeletal muscle, cardiac muscle, and smooth muscle cells. In particular, the endoplasmic or sarcoplasmic reticulum can sequester cytosolic Ca2+ ions and function as an intracellular Ca2+ store, which then allow for Ca2+ release into the cytosol as signaling molecules to stimulate cell contraction, proliferation, and migration.
شبکه آندوپلاسمیک
شبکه آندوپلاسمیمجموعه پیچیده ای از لولهها در سیتوپلاسم سلول است (شکل 2-1؛ شکل 2-10؛ و شکل 2-11). اندام داخلی غشای آن با بخشی از غشای هسته پیوسته است، بنابراین در واقع این قسمت از غشای هسته مخزن شبکه آندوپلاسمیاست. دیوارههای لوله از غشاء تشکیل شده است. در شبکه آندوپلاسمیناهموار (دانه ای)، ریبوزومها به سمت سیتوپلاسمیغشاء متصل میشوند، در حالی که در شبکه آندوپلاسمیصاف (دانه ای)، ریبوزومها وجود ندارند. ریبوزومهای آزاد نیز در سیتوپلاسم یافت میشوند. شبکه آندوپلاسمیناهموار با سنتز پروتئین و چینخوردگی اولیه زنجیرههای پلی پپتیدی با تشکیل پیوندهای دی سولفیدی مرتبط است. شبکه آندوپلاسمیصاف محل سنتز استروئید در سلولهای ترشح کننده استروئید و محل فرآیندهای سم زدایی در سلولهای دیگر است. شبکه آندوپلاسمیاصلاح شده، شبکه سارکوپلاسمی، نقش مهمیدر عضلات اسکلتی، عضله قلبی و سلولهای ماهیچه صاف ایفا میکند. به طور خاص، شبکه آندوپلاسمییا سارکوپلاسمیمیتواند یونهای +Ca2 سیتوزولی را جدا کرده و به عنوان یک ذخیره +Ca2 درون سلولی عمل کند، که سپس اجازه میدهد تا +Ca2 در سیتوزول به عنوان مولکولهای سیگنال برای تحریک انقباض، تکثیر و مهاجرت سلولی آزاد شود.

FIGURE 2-10 Rough endoplasmic reticulum and protein translation.
Messenger RNA and ribosomes meet up in the cytosol for translation. Proteins that have appropriate signal peptides begin translation, and then associate with the endoplasmic reticulum (ER) to complete translation. The association of ribosomes is what gives the ER its “rough” appearance. (Reproduced with permission from Widmaier EP, Raff H, Strang KT: Vander’s Human Physiology: The Mechanisms of Body Function, 11th ed. New York, NY: McGraw-Hill; 2008.)
شکل 2-10 شبکه آندوپلاسمیخشن و ترجمه پروتئین. پیام رسان RNA و ریبوزومها برای ترجمه در سیتوزول به هم میرسند. پروتئینهایی که دارای پپتیدهای سیگنال مناسب هستند، ترجمه را آغاز میکنند و سپس با شبکه آندوپلاسمی(ER) برای تکمیل ترجمه مرتبط میشوند. ارتباط ریبوزومها همان چیزی است که به ER ظاهر “خشن” میدهد. (تکثیر شده با اجازه Widmaier EP, Raff H, Strang KT: Vander’s Human Physiology: The Mechanisms of Body Function, ed. 11 New York, NY: McGraw-Hill; 2008.)

FIGURE 2-11 Cellular structures involved in protein processing. Structures involved in protein processing, from transcription to secretion, are shown. See text for details.
شکل 2-11 ساختارهای سلولی درگیر در پردازش پروتئین. ساختارهای درگیر در پردازش پروتئین، از رونویسی تا ترشح، نشان داده شده است. برای جزئیات به متن مراجعه کنید
RIBOSOMES
The ribosomes in eukaryotes measure approximately 22 × 32 nm. Each is made up of a large and a small subunit called, on the basis of their rates of sedimentation in the ultracentrifuge, the 60S and 40S subunits. The ribosomes are complex structures, containing many different proteins and at least three ribosomal RNAs. They are the sites of protein synthesis. The ribosomes that become attached to the endoplasmic reticulum synthesize all transmembrane proteins, most secreted proteins, and most proteins that are stored in the Golgi apparatus, lysosomes, and endosomes. These proteins typically have a hydrophobic signal peptide at one end (Figure 2-10). The polypeptide chains that form these proteins are extruded into the endoplasmic reticulum. The free ribosomes synthesize cytoplasmic proteins such as hemoglobin and the proteins found in peroxisomes and mitochondria.
ریبوزومها
اندازه ریبوزوم در یوکاریوتها تقریباً 22×32 نانومتر است. هر کدام از یک زیر واحد بزرگ و کوچک تشکیل شده اند که بر اساس میزان رسوب آنها در اولتراسانتریفیوژ، زیر واحدهای 60S و 40S نامیده میشوند. ریبوزومها ساختارهای پیچیده ای هستند که حاوی پروتئینهای مختلف و حداقل سه RNA ریبوزومیهستند. آنها محل سنتز پروتئین هستند. ریبوزومهایی که به شبکه آندوپلاسمیمتصل میشوند، تمام پروتئینهای گذرنده، بیشتر پروتئینهای ترشح شده و بیشتر پروتئینهایی را که در دستگاه گلژی، لیزوزومها و اندوزومها ذخیره میشوند، سنتز میکنند. این پروتئینها معمولاً یک پپتید سیگنال آبگریز در یک انتها دارند (شکل 2-10). زنجیرههای پلی پپتیدی که این پروتئینها را تشکیل میدهند به داخل شبکه آندوپلاسمیاکسترود میشوند. ریبوزومهای آزاد پروتئینهای سیتوپلاسمیمانند هموگلوبین و پروتئینهای موجود در پراکسی زومها و میتوکندریها را سنتز میکنند.
GOLGI APPARATUS & VESICULAR TRAFFIC
The Golgi apparatus is a collection of membrane-enclosed sacs (cisternae) that are stacked like dinner plates (Figure 2-1). One or more Golgi apparati are present in all eukaryotic cells, usually near the nucleus. Much of the organization of the Golgi is directed at proper glycosylation of proteins and lipids. There are more than 200 enzymes that function to add, remove, or modify sugars from proteins and lipids in the Golgi apparatus.
آپارات و وزیکولار GOLGI
دستگاه گلژی مجموعه ای از کیسههای محصور در غشاء (cisternae) است که مانند بشقابهای شام روی هم چیده شده اند (شکل 2-1). یک یا چند دستگاه گلژی در تمام سلولهای یوکاریوتی، معمولاً در نزدیکی هسته وجود دارد. بیشتر سازماندهی گلژی به سمت گلیکوزیلاسیون مناسب پروتئینها و لیپیدها است. بیش از 200 آنزیم وجود دارد که برای افزودن، حذف یا اصلاح قندها از پروتئینها و لیپیدها در دستگاه گلژی عمل میکنند.
The Golgi apparatus is a polarized structure with two distinct sides or faces, cis and trans sides (Figures 2-1, 2-10, 2-11). The cis face is near the endoplasmic reticulum, while the opposite trans face is near the plasma membrane (Figure 2-11). Membranous vesicles containing newly synthesized proteins bud off from the rouph endoplasmic reticulum and fuse with the cistern on the cis side of the Golgi apparatus. The proteins are then passed via other vesicles to the middle cisterns and finally to the cistern on the trans side, from which vesicles branch off into the cytoplasm. From the trans side of Golgi, vesicles shuttle to the lysosomes and to the cell exterior via constitutive and nonconstitutive pathways, both involving exocytosis. Conversely, vesicles are pinched off from the cell membrane by endocytosis and pass to endosomes. From there, they are recycled.
دستگاه گلژی یک ساختار قطبی شده با دو ضلع یا وجه مجزا، سیس و ترانس است (شکلهای 2-1، 2-10، 2-11). صورت سیس نزدیک شبکه آندوپلاسمیاست، در حالی که وجه ترانس مقابل نزدیک غشای پلاسمایی است (شکل 2-11). وزیکولهای غشایی حاوی پروتئینهای تازه سنتز شده از شبکه آندوپلاسمیروف بیرون زده و با مخزن سمت سیس دستگاه گلژی ترکیب میشوند. سپس پروتئینها از طریق وزیکولهای دیگر به مخزنهای میانی و در نهایت به مخزن در سمت ترانس منتقل میشوند که از آن وزیکولها به سیتوپلاسم منشعب میشوند. از سمت ترانس گلژی، وزیکولها از طریق مسیرهای سازنده و غیر سازنده به لیزوزومها و به سمت بیرون سلول حرکت میکنند که هر دو شامل اگزوسیتوز هستند. برعکس، وزیکولها توسط اندوسیتوز از غشای سلولی جدا شده و به اندوزومها منتقل میشوند. از آنجا، آنها بازیافت میشوند.
Vesicular traffic in the Golgi, and between other membranous compartments in the cell, is regulated by a combination of common mechanisms along with special mechanisms that determine where inside the cell they will go. One prominent feature is the involvement of a series of regulatory proteins controlled by GTP or guanosine diphosphate (GDP) binding (small G-proteins) associated with vesicle assembly and delivery. A second prominent feature is the presence of proteins called SNAREs (for soluble N-ethylmaleimide-sensitive factor attachment receptor). The v- (for vesicle) SNAREs on vesicle membranes interact in a lock-and-key fashion with t- (for target) SNAREs. Individual vesicles also contain structural protein or lipids in their membrane that help target them for specific membrane compartments (eg, Golgi sacs, cell membranes).
تردد وزیکولی در گلژی و بین سایر بخشهای غشایی سلول، با ترکیبی از مکانیسمهای رایج همراه با مکانیسمهای ویژه ای تنظیم میشود که تعیین میکند در داخل سلول کجا خواهند رفت. یکی از ویژگیهای برجسته درگیر شدن یک سری از پروتئینهای تنظیمیاست که توسط اتصال GTP یا گوانوزین دی فسفات (GDP) (پروتئینهای G کوچک) مرتبط با مونتاژ و تحویل وزیکول کنترل میشوند. دومین ویژگی برجسته، وجود پروتئینهایی به نام SNAREs (برای گیرنده چسبندگی فاکتور حساس به N-ethylmaleimide محلول) است. SNAREهای v- (برای وزیکول) روی غشاهای وزیکول به صورت قفل و کلید با SNAREهای t- (برای هدف) تعامل دارند. وزیکولهای منفرد همچنین حاوی پروتئین یا لیپیدهای ساختاری در غشای خود هستند که به هدف قرار دادن آنها برای بخشهای غشایی خاص (مانند کیسههای گلژی، غشای سلولی) کمک میکنند.
QUALITY CONTROL
The processes involved in protein synthesis, folding, and migration to the various parts of the cell are so complex that it is remarkable that more errors and abnormalities do not occur. The fact that these processes work as well as they do is because of mechanisms at each level that are responsible for “quality control.” Damaged DNA is detected and repaired or bypassed. The various RNAs are also checked during the translation process. Finally, when the protein chains are in the endoplasmic reticulum and Golgi apparatus, defective structures are detected and the abnormal proteins are degraded in lysosomes and proteasomes. The net result is a remarkable accuracy in the production of the proteins needed for normal cell function.
کنترل کیفیت
فرآیندهای درگیر در سنتز پروتئین، چین خوردگی و مهاجرت به قسمتهای مختلف سلول به قدری پیچیده است که قابل توجه است که خطاها و ناهنجاریهای بیشتری رخ نمیدهد. این واقعیت که این فرآیندها به خوبی کار میکنند به دلیل مکانیسمهایی در هر سطح است که مسئول “کنترل کیفیت” هستند. DNA آسیب دیده شناسایی و ترمیم یا دور زده میشود. RNAهای مختلف نیز در طول فرآیند ترجمه بررسی میشوند. در نهایت، هنگامیکه زنجیرههای پروتئینی در شبکه آندوپلاسمیو دستگاه گلژی قرار دارند، ساختارهای معیوب شناسایی میشوند و پروتئینهای غیر طبیعی در لیزوزومها و پروتئازومها تجزیه میشوند. نتیجه خالص دقت قابل توجه در تولید پروتئینهای مورد نیاز برای عملکرد طبیعی سلول است.
APOPTOSIS
In addition to dividing and growing under genetic control, cells can die and be absorbed under genetic control. This process is called programmed cell death, or apoptosis (Gr. apo “away” + ptosis “fall”). It can be called “cell suicide” in the sense that the cell’s own genes play an active role in its demise. It should be distinguished from necrosis (“cell murder”), in which healthy cells are destroyed by external processes such as inflammation.
آپوپتوزیس
علاوه بر تقسیم و رشد تحت کنترل ژنتیکی، سلولها میتوانند بمیرند و تحت کنترل ژنتیکی جذب شوند. این فرآیند مرگ سلولی برنامه ریزی شده یا آپوپتوز نامیده میشود. میتوان آن را «خودکشی سلولی» نامید، به این معنا که ژنهای خود سلول نقش فعالی در نابودی آن دارند. باید از نکروز (“قتل سلولی”)، که در آن سلولهای سالم توسط فرآیندهای خارجی مانند التهاب از بین میروند، متمایز شود.
Apoptosis is a very common process during development and in adulthood. In the central nervous system (CNS), large numbers of neurons are produced and then die during the remodeling that occurs during development and synapse formation. In the immune system, apoptosis gets rid of inappropriate clones of immunocytes and is responsible for the lytic effects of glucocorticoids on lymphocytes. Apoptosis is also an important factor in processes such as removal of the webs between the fingers in fetal life and regression of duct systems in the course of sexual development in the fetus. In adults, it participates in the cyclic breakdown of the endometrium that leads to menstruation. In epithelia, cells that lose their connections to the basal lamina and neighboring cells undergo apoptosis. This is responsible for the death of the enterocytes sloughed off the tips of intestinal villi. Abnormal apoptosis probably occurs in autoimmune diseases, neurodegenerative diseases, and cancer. It is interesting that apoptosis occurs in invertebrates, including nematodes and insects. However, its molecular mechanism is much more complex than that in vertebrates.
آپوپتوز یک فرآیند بسیار رایج در طول رشد و در بزرگسالی است. در سیستم عصبی مرکزی (CNS)، تعداد زیادی نورون تولید میشوند و سپس در طی بازسازی و شکلگیری سیناپس میمیرند. در سیستم ایمنی، آپوپتوز از شر کلونهای نامناسب ایمونوسیتها خلاص میشود و مسئول اثرات لیتیک گلوکوکورتیکوئیدها بر لنفوسیتها است. آپوپتوز همچنین عامل مهمیدر فرآیندهایی مانند برداشتن تارهای بین انگشتان در زندگی جنینی و پسرفت سیستم مجاری در روند رشد جنسی در جنین است. در بزرگسالان، در تجزیه چرخه ای آندومتر که منجر به قاعدگی میشود، شرکت میکند. در اپیتلیوم، سلولهایی که اتصالات خود را با لایه بازال و سلولهای مجاور از دست میدهند، دچار آپوپتوز میشوند. این عامل مرگ انتروسیتهایی است که از نوک پرزهای روده جدا شدهاند. آپوپتوز غیرطبیعی احتمالاً در بیماریهای خودایمنی، بیماریهای نورودژنراتیو و سرطان رخ میدهد. جالب است که آپوپتوز در بی مهرگان از جمله نماتدها و حشرات رخ میدهد. با این حال، مکانیسم مولکولی آن بسیار پیچیده تر از مهره داران است.
One final common pathway bringing about apoptosis is activation of caspases, a group of cysteine proteases. Many of these have been characterized to date in mammals; 14 have been found in humans. They exist in cells as inactive proenzymes (procaspases) until activated by the cellular machinery. The net result is DNA fragmentation, cytoplasmic and chromatin condensation, and eventually membrane bleb formation, with cell breakup and removal of the debris by phagocytes (Clinical Box 2-5).
یکی از آخرین مسیرهای متداول که باعث آپوپتوز میشود، فعال شدن کاسپازها، گروهی از سیستئین پروتئازها است. بسیاری از اینها تا به امروز در پستانداران مشخص شده است. 14 مورد در انسان یافت شده است. آنها در سلولها به عنوان پروآنزیمهای غیر فعال (پروکاسپازها) وجود دارند تا زمانی که توسط ماشین سلولی فعال شوند. نتیجه خالص قطعه قطعه شدن DNA، تراکم سیتوپلاسمیو کروماتین، و در نهایت تشکیل حباب غشایی، با شکسته شدن سلول و حذف بقایای توسط فاگوسیتها است (باکس بالینی 2-5).
CLINICAL BOX 2.5
Cellular and Molecular Medicine
Fundamental research on molecular aspects of genetics, regulation of gene expression, and protein synthesis has been paying off in clinical medicine at a rapidly accelerating rate.
کادر بالینی 2.5
پزشکی سلولی و مولکولی
تحقیقات بنیادی بر روی جنبههای مولکولی ژنتیک، تنظیم بیان ژن و سنتز پروتئین در پزشکی بالینی با سرعتی سریع در حال افزایش است.
One early dividend was an understanding of the mechanisms by which antibiotics exert their effects. Almost all act by inhibiting protein synthesis at one or another of the steps described previously. Antiviral drugs act in a similar way; for example, acyclovir and ganciclovir act by inhibiting DNA polymerase. Some of these drugs have this effect primarily in bacteria, but others inhibit protein synthesis in the cells of other animals, including mammals. This fact makes antibiotics of great value for research as well as for treatment of infections. Single genetic abnormalities that cause over 600 human diseases have been identified. Many of the diseases are rare, but others are more common and some cause conditions that are severe and eventually fatal. Examples include the defectively regulated Cl- channel in cystic fibrosis and the unstable trinucleotide repeats in various parts of the genome that cause Huntington disease, the fragile X syndrome, and several other neurologic diseases. Abnormalities in mitochondrial DNA can also cause human diseases such as Leber hereditary optic neuropathy and some forms of cardiomyopathy. Not surprisingly, genetic aspects of cancer are probably receiving the greatest current attention. Some cancers are caused by oncogenes, genes that are carried in the genomes of cancer cells and are responsible for producing their malignant properties. These genes are derived by somatic mutation from closely related proto-oncogenes, which are normal genes that control growth. Over 100 oncogenes have been described. Another group of genes produce proteins that suppress tumors, and more than 10 of these tumor suppressor genes have been described. The most studied of these is the p53 gene on human chromosome 17. The p53 protein produced by this gene triggers apoptosis. It is also a nuclear transcription factor that appears to increase production of a 21-kDa protein that blocks two cell cycle enzymes, slowing the cycle and permitting repair of mutations and other defects in DNA. The p53 gene is mutated in up to 50% of human cancers, with the production of p53 proteins that fail to slow the cell cycle and permit other mutations in DNA to persist. The accumulated mutations eventually cause cancer.
یکی از مزیتهای اولیه، درک مکانیسمهایی بود که آنتی بیوتیکها از طریق آن اثرات خود را اعمال میکنند. تقریباً همه با مهار سنتز پروتئین در یکی از مراحلی که قبلاً توضیح داده شد عمل میکنند. داروهای ضد ویروسی نیز به روشی مشابه عمل میکنند. به عنوان مثال، آسیکلوویر و گانسیکلوویر با مهار DNA پلیمراز عمل میکنند. برخی از این داروها عمدتاً در باکتریها این اثر را دارند، اما برخی دیگر از سنتز پروتئین در سلولهای حیوانات دیگر از جمله پستانداران جلوگیری میکنند. این واقعیت باعث میشود که آنتی بیوتیکها برای تحقیقات و همچنین برای درمان عفونتها ارزش زیادی داشته باشند. ناهنجاریهای ژنتیکی منفرد که باعث بیش از 600 بیماری انسانی میشود، شناسایی شده است. بسیاری از بیماریها نادر هستند، اما برخی دیگر شایع تر هستند و برخی باعث ایجاد شرایطی میشوند که شدید و در نهایت کشنده هستند. به عنوان مثال میتوان به کانال کلر معیوب تنظیم شده در فیبروز کیستیک و تکرارهای ناپایدار تری نوکلئوتید در قسمتهای مختلف ژنوم اشاره کرد که باعث بیماریهانتینگتون، سندرم X شکننده و چندین بیماری عصبی دیگر میشود. ناهنجاری در DNA میتوکندری همچنین میتواند باعث بیماریهای انسانی مانند نوروپاتی ارثی بینایی Leber و برخی از اشکال کاردیومیوپاتی شود. جای تعجب نیست که جنبههای ژنتیکی سرطان احتمالاً در حال حاضر بیشترین توجه را به خود جلب کرده است. برخی از سرطانها توسط انکوژنها ایجاد میشوند، ژنهایی که در ژنوم سلولهای سرطانی حمل میشوند و مسئول تولید خواص بدخیم آنها هستند. این ژنها توسط جهش سوماتیک از پروتوآنکوژنهای نزدیک به هم که ژنهای طبیعی هستند که رشد را کنترل میکنند، به دست میآیند. بیش از 100 انکوژن توصیف شده است. گروه دیگری از ژنها پروتئینهایی تولید میکنند که تومورها را سرکوب میکنند و بیش از 10 مورد از این ژنهای سرکوب کننده تومور شرح داده شده است. بیشترین مطالعه شده از این ژن، ژن p53 در کروموزوم 17 انسان است. پروتئین p53 تولید شده توسط این ژن باعث آپوپتوز میشود. همچنین یک فاکتور رونویسی هسته ای است که به نظر میرسد تولید یک پروتئین 21 کیلو دالتونی را افزایش میدهد که دو آنزیم چرخه سلولی را مسدود میکند، چرخه را کند میکند و امکان ترمیم جهشها و سایر نقصهای DNA را فراهم میکند. ژن p53 تا 50 درصد از سرطانهای انسان جهش یافته است، با تولید پروتئینهای p53 که نمیتوانند چرخه سلولی را کند کنند و به سایر جهشهای DNA اجازه تداوم پیدا کنند. جهشهای انباشته شده در نهایت باعث سرطان میشوند.
TRANSPORT ACROSS CELL MEMBRANES
There are several mechanisms of transport across cellular membranes. Primary pathways include exocytosis, endocytosis, membrane permeability and ion channels, and primary and secondary active transport. Each of these is discussed below.
حمل و نقل از طریق غشای سلولی
مکانیسمهای مختلفی برای انتقال از طریق غشاهای سلولی وجود دارد. مسیرهای اولیه شامل اگزوسیتوز، اندوسیتوز، نفوذپذیری غشاء و کانالهای یونی و انتقال فعال اولیه و ثانویه است. در زیر به هر یک از این موارد پرداخته شده است.
EXOCYTOSIS
Vesicles containing material for export, such as secretory granules, are targeted to the cell membrane (Figure 2-11), where they bond in a similar manner to that discussed in vesicular traffic between Golgi stacks, via the v-SNARE/t-SNARE arrangement. The area of fusion then breaks down, leaving the contents of the vesicle outside and the cell membrane intact. This is the Ca2+-dependent process of exocytosis (Figure 2-12).
اگزوسیتوز
وزیکولهای حاوی مواد برای صادرات، مانند گرانولهای ترشحی، به غشای سلولی هدف قرار میگیرند (شکل 2-11)، جایی که به روشی مشابه با آنچه در ترافیک تاولی بین پشتههای گلژی بحث شد، از طریق آرایش v-SNARE/t-SNARE پیوند میخورند. سپس ناحیه همجوشی تجزیه میشود و محتویات وزیکول در خارج و غشای سلولی دست نخورده باقی میماند. این فرآیند اگزوسیتوز وابسته به +Ca2 است (شکل 2-12).

FIGURE 2-12 Exocytosis and endocytosis. Note that in exocytosis the cytoplasmic sides of two membranes fuse, whereas in endocytosis two extracellular sides fuse.
شکل 2-12 اگزوسیتوز و اندوسیتوز. توجه داشته باشید که در اگزوسیتوز، طرفهای سیتوپلاسمیدو غشاء با هم ترکیب میشوند، در حالی که در اندوسیتوز دو طرف خارج سلولی با هم ترکیب میشوند.
Note that secretion from the cell occurs via two pathways (Figure 2-11). In the nonconstitutive (or regulated) pathway, proteins from the Golgi apparatus initially enter secretory granules, where processing of prohormones to the mature hormones occurs before exocytosis. The other pathway, the constitutive pathway, involves the prompt transport of proteins to the cell membrane in vesicles, with little or no processing or storage. The nonconstitutive pathway is sometimes called the regulated pathway, but this term is misleading because the output of proteins by the constitutive pathway is also regulated.
توجه داشته باشید که ترشح از سلول از طریق دو مسیر انجام میشود (شکل 2-11). در مسیر غیر سازنده (یا تنظیمشده)، پروتئینهای دستگاه گلژی در ابتدا وارد گرانولهای ترشحی میشوند، جایی که پردازش پروهورمونها به هورمونهای بالغ قبل از اگزوسیتوز اتفاق میافتد. مسیر دیگر، مسیر سازنده، شامل حمل و نقل سریع پروتئینها به غشای سلولی در وزیکولها، بدون پردازش یا ذخیره سازی کم است. مسیر غیر سازنده گاهی اوقات مسیر تنظیم شده نامیده میشود، اما این اصطلاح گمراه کننده است زیرا خروجی پروتئینها توسط مسیر سازنده نیز تنظیم میشود.
ENDOCYTOSIS
Endocytosis is the reverse of exocytosis. There are various types of endocytosis named for the size of particles being ingested as well as the regulatory requirements for the particular process. These include phagocytosis,pinocytosis, clathrin-mediated endocytosis, caveolae-dependent uptake, and nonclathrin/noncaveolae endocytosis.
اندوسیتوزیس
اندوسیتوز معکوس اگزوسیتوز است. انواع مختلفی از اندوسیتوز وجود دارد که به دلیل اندازه ذرات در حال بلعیده شدن و همچنین الزامات نظارتی برای فرآیند خاص نامگذاری شده اند. اینها شامل فاگوسیتوز، پینوسیتوز، اندوسیتوز با واسطه کلاترین، جذب وابسته به caveolae و اندوسیتوز nonclathrin/noncaveolae است.
Phagocytosis (“cell eating”) is the process by which bacteria, dead cells, or other bits of microscopic material are engulfed by cells such as the polymorphonuclear leukocytes of the blood. The material makes contact with the cell membrane, which then invaginates. The invagination is pinched off, leaving the engulfed material in the membrane-enclosed vacuole and the cell membrane intact. Pinocytosis (“cell drinking”) is a similar process with the vesicles much smaller in size and the substances ingested are in solution. The small size membrane that is ingested with each event should not be misconstrued; cells undergoing active pinocytosis (eg, macrophages) can ingest the equivalent of their entire cell membrane in just 1 h.
فاگوسیتوز (“سلول خوردن”) فرآیندی است که طی آن باکتریها، سلولهای مرده یا سایر قطعات میکروسکوپی توسط سلولهایی مانند لکوسیتهای پلی مورفونوکلئر خون غرق میشوند. این ماده با غشای سلولی تماس پیدا میکند و سپس غشای سلولی داخل میشود. انواژیناسیون قطع میشود و مواد غرق شده در واکوئل محصور در غشاء و غشای سلولی دست نخورده باقی میماند. پینوسیتوز (“نوشیدن سلول”) فرآیند مشابهی است که اندازه وزیکولها بسیار کوچکتر است و مواد بلعیده شده در محلول هستند. غشای کوچکی که با هر رویداد بلعیده میشود نباید اشتباه تعبیر شود. سلولهایی که تحت پینوسیتوز فعال قرار میگیرند (مثلاً ماکروفاژها) میتوانند معادل کل غشای سلولی خود را تنها در 1 ساعت بخورند.
Clathrin-mediated endocytosis occurs at membrane indentations where the protein clathrin accumulates. Clathrin molecules have the shape of triskelions, with three “legs” radiating from a central hub (Figure 2-13). As endocytosis progresses, the clathrin molecules form a geometric array that surrounds the endocytotic vesicle. At the neck of the vesicle, the GTP-binding protein dynamin is involved, either directly or indirectly, in pinching off the vesicle. Once the complete vesicle is formed, the clathrin falls off and the three-legged proteins recycle to form another vesicle. The vesicle fuses with and dumps its contents into an early endosome (Figure 2-11). From the early endosome, a new vesicle can bud off and return to the cell membrane. Alternatively, the early endosome can become a late endosome and fuse with a lysosome (Figure 2-11) in which the contents are digested by the lysosomal proteases. Clathrin-mediated endocytosis is responsible for the internalization of many receptors and the ligands bound to them—including, for example, nerve growth factor (NGF) and low-density lipoproteins. It also plays a major role in synaptic function.
اندوسیتوز با واسطه کلاترین در فرورفتگیهای غشایی که در آن پروتئین کلاترین تجمع مییابد رخ میدهد. مولکولهای کلاترین شکل تریسکولیونها را دارند که سه پا از یکهاب مرکزی تابش میکنند (شکل 2-13). با پیشرفت اندوسیتوز، مولکولهای کلاترین یک آرایه هندسی تشکیل میدهند که وزیکول اندوسیتوز را احاطه کرده است. در گردن وزیکول، دینامین پروتئین متصل شونده به GTP به طور مستقیم یا غیرمستقیم درگیر کردن وزیکول نقش دارد. هنگامیکه وزیکول کامل تشکیل شد، کلاترین میافتد و پروتئینهای سه پا بازیافت میشوند و وزیکول دیگری تشکیل میدهند. وزیکول با محتویات خود ترکیب میشود و درون یک اندوزوم اولیه میریزد (شکل 2-11). از اندوزوم اولیه، یک وزیکول جدید میتواند جوانه بزند و به غشای سلولی بازگردد. متناوباً، اندوزوم اولیه میتواند به یک آندوزوم دیررس تبدیل شود و با یک لیزوزوم ترکیب شود (شکل 2-11) که در آن محتویات توسط پروتئازهای لیزوزومیهضم میشوند. اندوسیتوز با واسطه کلاترین مسئول درونی سازی بسیاری از گیرندهها و لیگاندهای متصل به آنها است – از جمله، برای مثال، فاکتور رشد عصبی (NGF) و لیپوپروتئینهای با چگالی کم. همچنین نقش مهمیدر عملکرد سیناپسی دارد.

FIGURE 2-13 Clathrin molecule on the surface of an endocytotic vesicle.
شکل 2-13 مولکول کلاترین روی سطح یک وزیکول اندوسیتوز.
Note the characteristic triskelion shape and the fact that with other clathrin molecules it forms a net supporting the vesicle.
به شکل مشخصه تری اسکلیون و این واقعیت که با سایر مولکولهای کلاترین شبکه ای تشکیل میدهد که از وزیکول حمایت میکند توجه کنید.
It is apparent that exocytosis adds to the total amount of membrane surrounding the cell, and if membrane were not removed elsewhere at an equivalent rate, the cell would enlarge. However, removal of cell membrane occurs by endocytosis, and such exocytosis-endocytosis coupling maintains the surface area of the cell at its normal size.
واضح است که اگزوسیتوز به کل غشای اطراف سلول اضافه میشود و اگر غشاء در جای دیگری با سرعتی معادل برداشته نمیشد، سلول بزرگ میشد. با این حال، حذف غشای سلولی توسط اندوسیتوز اتفاق میافتد و چنین جفتشدگی اگزوسیتوز-اندوسیتوز سطح سلول را در اندازه طبیعی آن حفظ میکند.
RAFTS & CAVEOLAE
Some areas of the cell membrane are especially rich in cholesterol and sphingolipids and have been called rafts. These rafts are probably the precursors of flask-shaped membrane depressions called caveolae (little caves) when their walls become infiltrated with a protein called caveolin that resembles clathrin (Figure 2-14). There is considerable debate about the functions of rafts and caveolae, with evidence that they are involved in cholesterol regulation and transcytosis. It is clear, however, that cholesterol can interact directly with caveolin, effectively limiting the protein’s ability to move around in the membrane. Internalization via caveolae involves binding of cargo to caveolin and regulation by dynamin. Caveolae are prominent in endothelial cells, where they help in the uptake of nutrients from the blood.
قایقها & بچهها
برخی از نواحی غشای سلولی به ویژه سرشار از کلسترول و اسفنگولیپید هستند و به آنها رافت گفته میشود. این قایقها احتمالاً پیش ساز فرورفتگیهای غشایی فلاسکی شکل به نام caveolae (غارهای کوچک) هستند، زمانی که دیوارههای آنها با پروتئینی به نام caveolin که شبیه کلاترین است نفوذ میکند (شکل 2-14). بحثهای قابل توجهی در مورد عملکرد قایقها و کاوئولها وجود دارد، با شواهدی مبنی بر اینکه آنها در تنظیم کلسترول و ترانس سیتوز نقش دارند. با این حال، واضح است که کلسترول میتواند به طور مستقیم با کائولین تعامل داشته باشد و به طور موثر توانایی پروتئین را برای حرکت در غشاء محدود کند. درونی سازی از طریق caveolae شامل اتصال محموله به caveolin و تنظیم توسط دینامین است. Caveolae در سلولهای اندوتلیال برجسته هستند، جایی که به جذب مواد مغذی از خون کمک میکنند.
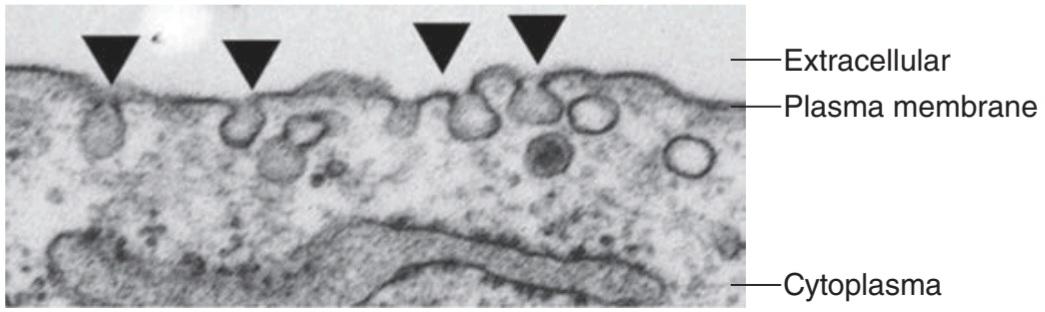
FIGURE 2-14 Caveolae in vascular smooth muscle cell. Ultrastructure of the plasma membrane of a human pulmonary arterial smooth muscle cell is assessed by electron microscopy. Arrow heads indicate individual caveolae.
شکل 2-14 Caveolae در سلول ماهیچه صاف عروقی. فراساختار غشای پلاسمایی یک سلول عضله صاف شریان ریوی انسان با میکروسکوپ الکترونی ارزیابی میشود. سر پیکانها نشان دهنده کائولاهای منفرد است.
COATS & VESICLE TRANSPORT
It now appears that all vesicles involved in transport have protein coats. In humans, over 50 coat complex subunits have been identified. Vesicles that transport proteins from the trans Golgi to lysosomes have assembly protein 1 (AP-1) clathrin coats, and endocytotic vesicles that transport to endosomes have AP-2 clathrin coats. Vesicles that transport between the endoplasmic reticulum and the Golgi have coat proteins I and II (COPI and COPII). Certain amino acid sequences or attached groups on the transported proteins target the proteins for particular locations. For example, the amino acid sequence Asn-Pro-any amino acid-Tyr targets transport from the cell surface to the endosomes, and mannose- 6-phosphate groups target transfer from the Golgi to mannose-6-phosphate receptors (MPR) on the lysosomes.
مانتو و وزیکول حمل و نقل
اکنون به نظر میرسد که تمام وزیکولهای درگیر در حمل و نقل دارای پوشش پروتئینی هستند. در انسان، بیش از 50 زیر واحد پیچیده پوششی شناسایی شده است. وزیکولهایی که پروتئینها را از گلژی ترانس به لیزوزومها منتقل میکنند دارای پوشش کلاترین پروتئین مونتاژ 1 (AP-1) هستند و وزیکولهای اندوسیتوز که به اندوزومها منتقل میشوند دارای پوششهای کلاترین AP-2 هستند. وزیکولهایی که بین شبکه آندوپلاسمیو گلژی حمل میشوند دارای پروتئینهای پوششی I و II (COPI و COPII) هستند. توالیهای اسید آمینه خاصی یا گروههای متصل به پروتئینهای انتقالیافته، پروتئینها را برای مکانهای خاص هدف قرار میدهند. به عنوان مثال، توالی اسید آمینه Asn-Pro-any amino acid-Tyr انتقال از سطح سلول به اندوزومها را هدف قرار میدهد و گروههای مانوز-6-فسفات انتقال از گلژی به گیرندههای مانوز-6-فسفات (MPR) روی لیزوزومها را هدف قرار میدهند.
Various small G-proteins of the Rab family are especially important in vesicular traffic. They appear to guide and facilitate orderly attachments of these vesicles. To illustrate the complexity of directing vesicular traffic, humans have 60 Rab proteins and 35 SNARE proteins.
پروتئینهای G کوچک مختلف از خانواده Rab به ویژه در ترافیک تاولی مهم هستند. به نظر میرسد که آنها اتصال منظم این وزیکولها را هدایت و تسهیل میکنند. برای نشان دادن پیچیدگی هدایت ترافیک تاولی، انسان 60 پروتئین Rab و 35 پروتئین SNARE دارد.
MEMBRANE PERMEABILITY & MEMBRANE TRANSPORT PROTEINS
Small, nonpolar molecules (including O2 and N2) and small uncharged polar molecules such as CO2 diffuse across the lipid membranes of cells. However, the membranes have very limited permeability to other substances. Instead, they cross the membranes by endocytosis and exocytosis and by passage through highly specific transport proteins, transmembrane proteins that form channels for ions or transport substances such as glucose, urea, and amino acids. The limited permeability applies even to water, with simple diffusion being supplemented throughout the body with various water channels (aquaporins). For reference, the sizes of ions and other biologically important substances are summarized in Table 2-2.
نفوذپذیری غشاء و پروتئینهای انتقال غشاء
مولکولهای کوچک و غیرقطبی (از جمله O2 و N2) و مولکولهای قطبی کوچک بدون بار مانند CO2 در سراسر غشای لیپیدی سلولها پخش میشوند. با این حال، غشاها نفوذپذیری بسیار محدودی نسبت به سایر مواد دارند. در عوض، آنها از طریق اندوسیتوز و اگزوسیتوز و با عبور از پروتئینهای حمل و نقل بسیار خاص، پروتئینهای گذرنده که کانالهایی را برای یونها یا مواد انتقال دهنده مانند گلوکز، اوره و اسیدهای آمینه تشکیل میدهند، عبور میکنند. نفوذپذیری محدود حتی در مورد آب نیز صدق میکند، با انتشار ساده که در سراسر بدن با کانالهای مختلف آب (آکواپورینها) تکمیل میشود. برای مرجع، اندازه یونها و سایر مواد مهم بیولوژیکی در جدول 2-2 خلاصه شده است.
TABLE 2-2 Size of hydrated ions and other substances of biologic interest.
جدول 2-2 اندازه یونهای هیدراته و سایر مواد مورد علاقه بیولوژیکی.

Data from Moore EW: Physiology of Intestinal Water and Electrolyte Absorption. American Gastroenterological Association, 1976.
دادهها از Moore EW: فیزیولوژی روده آب و جذب الکترولیت. انجمن گوارش آمریکا، 1976.
Some transport proteins are simple aqueous ion channels, though many of these have special features that make them selective for a given substance such as Ca2+ or, in the case of aquaporins, for water. These membrane-spanning proteins (or collections of proteins) have tightly regulated pores that can be gated opened or closed in response to local changes (Figure 2-15). Some are gated by alterations in membrane potential (voltage-gated), whereas others are opened or closed in response to a ligand (ligand-gated). The ligand is often external (eg, a neurotransmitter, a hormone, or an agonist). However, it can also be internal; intracellular Ca2+, cyclic adenosine 3′,5′-monophosphate (cAMP), lipids, or one of the G-proteins produced in cells can all bind directly to channels and activate them. Some channels are also opened by mechanical stretch, and these mechanosensitive channels play an important role in cell movement.
برخی از پروتئینهای انتقال، کانالهای یونی آبی ساده هستند، اگرچه بسیاری از آنها دارای ویژگیهای خاصی هستند که آنها را برای یک ماده معین مانند +Ca2 یا در مورد آکواپورینها برای آب انتخاب میکند. این پروتئینهای پوشاننده غشاء (یا مجموعه ای از پروتئینها) دارای منافذ کاملاً تنظیم شده ای هستند که میتوانند در پاسخ به تغییرات موضعی باز یا بسته شوند (شکل 2-15). برخی از آنها با تغییرات در پتانسیل غشا (دردار ولتاژ) بسته میشوند، در حالی که برخی دیگر در پاسخ به یک لیگاند باز یا بسته میشوند (دریچه لیگاند). لیگاند اغلب خارجی است (به عنوان مثال، یک انتقال دهنده عصبی، یک هورمون، یا یک آگونیست). با این حال، میتواند داخلی نیز باشد. +Ca2 داخل سلولی، آدنوزین حلقوی 3’،5′-مونوفسفات (cAMP)، لیپیدها یا یکی از پروتئینهای G تولید شده در سلولها میتوانند مستقیماً به کانالها متصل شده و آنها را فعال کنند. برخی از کانالها نیز با کشش مکانیکی باز میشوند و این کانالهای حساس مکانیکی نقش مهمیدر حرکت سلول ایفا میکنند.

FIGURE 2-15 Regulation of gating in ion channels. Ion channels can gate open or closed in response to several environmental signals. Some typical examples are shown in an idealized channel. A) Ligand gating: Channel opens in response to ligand binding. B) Voltage gating: Channel opens in response to a change in membrane potential. C) Posttranslational modification: Channel gates in response to modification such as phosphorylation.
شکل 2-15 تنظیم دروازه در کانالهای یونی. کانالهای یونی میتوانند در پاسخ به چندین سیگنال محیطی باز یا بسته شوند. برخی از نمونههای معمولی در یک کانال ایده آل نشان داده شده است. الف) دروازه لیگاند: کانال در پاسخ به اتصال لیگاند باز میشود. ب) دروازه ولتاژ: کانال در پاسخ به تغییر پتانسیل غشا باز میشود. ج) اصلاح پس از ترجمه: دروازههای کانال در پاسخ به اصلاحاتی مانند فسفوریلاسیون.
Other transport proteins are carriers that bind ions and other molecules and then change their configuration, moving the bound molecule from one side of the cell membrane to the other. Molecules move from areas of high concentration to areas of low concentration (down their chemical gradient), and cations move to negatively charged areas whereas anions move to positively charged areas (“down” their electrical gradient). When carrier proteins move substances in the direction of their chemical or electrical gradients, no energy input is required and the process is called facilitated diffusion. A typical example is glucose transport by the glucose transporter, which moves glucose down its concentration gradient from the ECF to the cytoplasm of the cell. Other carriers transport substances against their electrical and chemical gradients. This form of transport requires energy and is called active transport. In animal cells, the energy is provided almost exclusively by hydrolysis of ATP. Not surprisingly, therefore, many carrier molecules are ATPases, enzymes that catalyze the hydrolysis of ATP. One of these ATPases is sodium-potassium adenosine triphosphatase (Na, K ATPase), which is also known as the Na, K pump.
سایر پروتئینهای ناقل حاملهایی هستند که یونها و مولکولهای دیگر را به هم متصل میکنند و سپس پیکربندی آنها را تغییر میدهند و مولکول متصلشده را از یک طرف غشای سلولی به سمت دیگر حرکت میدهند. مولکولها از مناطق با غلظت بالا به مناطق با غلظت کم (به سمت پایین شیب شیمیایی خود) حرکت میکنند، و کاتیونها به مناطق دارای بار منفی حرکت میکنند در حالی که آنیونها به مناطق دارای بار مثبت (“پایین” گرادیان الکتریکی خود) حرکت میکنند. هنگامیکه پروتئینهای حامل مواد را در جهت شیبهای شیمیایی یا الکتریکی خود حرکت میدهند، نیازی به انرژی ورودی نیست و این فرآیند انتشار تسهیل شده نامیده میشود. یک مثال معمولی انتقال گلوکز توسط ناقل گلوکز است که گلوکز را به سمت پایین گرادیان غلظت از ECF به سیتوپلاسم سلول حرکت میدهد. سایر حاملها مواد را در مقابل شیبهای الکتریکی و شیمیایی خود حمل میکنند. این نوع حمل و نقل به انرژی نیاز دارد و به آن حمل و نقل فعال میگویند. در سلولهای حیوانی، انرژی تقریباً منحصراً از طریق هیدرولیز ATP تأمین میشود. بنابراین جای تعجب نیست که بسیاری از مولکولهای حامل ATPases هستند، آنزیمهایی که هیدرولیز ATP را کاتالیز میکنند. یکی از این ATPازها سدیم پتاسیم آدنوزین تری فسفاتاز (Na, K ATPase) است که به پمپ Na, K نیز معروف است.
There are also H, K ATPases in the gastric mucosa and the renal tubules. Ca2+ ATPase pumps Ca2+ out of cells. Proton ATPases acidify many intracellular organelles, including parts of the Golgi complex and lysosomes.
در مخاط معده و لولههای کلیوی نیز H، K ATPases وجود دارد. +Ca2+ ATPase Ca2 را از سلولها پمپ میکند. پروتونهای ATPase بسیاری از اندامکهای درون سلولی از جمله قسمتهایی از کمپلکس گلژی و لیزوزومها را اسیدی میکنند.
Some of the transport proteins are called uniports because they transport only one substance. Others are called symports because transport requires the binding of more than one substance to the transport protein and the substances are transported across the membrane together. An example is the symport in the intestinal mucosa that is responsible for the cotransport of Na+ and glucose from the intestinal lumen into mucosal cells. Other transporters are called antiports because they exchange one substance for another.
برخی از پروتئینهای حمل و نقل، یونی پورت نامیده میشوند زیرا فقط یک ماده را انتقال میدهند. برخی دیگر سمپورت نامیده میشوند زیرا حمل و نقل مستلزم اتصال بیش از یک ماده به پروتئین حمل و نقل است و مواد با هم در سراسر غشاء منتقل میشوند. به عنوان مثال، سمپرت در مخاط روده است که مسئول انتقال همزمان +Na و گلوکز از لومن روده به سلولهای مخاطی است. سایر حمل و نقلها را آنتی پورت مینامند زیرا یک ماده را با ماده دیگر مبادله میکنند.
ION CHANNELS
There are ion channels specific for K+, Na+, Ca2+, and Cl-, as well as channels that are nonselective for cations or anions. Each type of channel exists in multiple forms with diverse properties. Most are made up of identical or very similar subunits. Figure 2-16 shows the multiunit structure of various channels in diagrammatic cross-section.
کانالهای یونی
کانالهای یونی مخصوص +K+، Na+، Ca2 و –Cl و همچنین کانالهایی هستند که برای کاتیونها یا آنیونها غیرانتخابی هستند. هر نوع کانال به اشکال مختلف با خواص متنوع وجود دارد. اکثر آنها از زیر واحدهای یکسان یا بسیار مشابه تشکیل شده اند. شکل 2-16 ساختار چند واحدی کانالهای مختلف را در مقطع نموداری نشان میدهد.

FIGURE 2-16 Different ways in which ion channels form pores. A) Four subunits form a central pore in typical K+ channels. B) Some ligand-gated channels such as the acetylcholine receptor contain five similar subunits that form a central pore in the channel. C) Aquaporin, or water channels, contain four subunits that each contain a pore that can allow for water movement. Additionally, these subunits form a central pore that can allow for ion movement. It should be noted that other formations also occur.
شکل 2-16 روشهای مختلف که در آن کانالهای یونی منافذ را تشکیل میدهند. الف) چهار زیرواحد یک منفذ مرکزی را در کانالهای +K معمولی تشکیل میدهند. ب) برخی از کانالهای دریچه لیگاند مانند گیرنده استیل کولین حاوی پنج زیر واحد مشابه هستند که یک منفذ مرکزی را در کانال تشکیل میدهند. ج) آکواپورین یا کانالهای آب شامل چهار زیرواحد است که هر کدام حاوی منافذی است که امکان حرکت آب را فراهم میکند. علاوه بر این، این زیر واحدها یک منفذ مرکزی را تشکیل میدهند که میتواند حرکت یون را امکان پذیر کند. لازم به ذکر است که تشکیلات دیگری نیز رخ میدهد.
Most K+ channels are tetramers, with each of the four subunits forming part of the pore through which K+ ions pass. Structural analysis of a bacterial voltage-gated K+ channel indicates that each of the four subunits has a paddle- like extension containing four charges. When the channel is closed, these extensions are near the negatively charged interior of the cell. When the membrane potential is reduced, the paddles containing the charges bend through the membrane to its exterior surface, causing the channel to open. The bacterial K+ channel is very similar to the voltage-gated K+ channels in a wide variety of species, including mammals and humans. In the acetylcholine ion channel and other ligand-gated cation or anion channels, five subunits make up the pore. Members of the CIC family of Cl- channels are dimers, but they have two pores, one in each subunit. Finally, aquaporins are tetramers with a water pore in each of the subunits. Recently, a number of ion channels with intrinsic enzyme activity have been cloned. More than 30 different voltage-gated or cyclic nucleotide-gated Na* and Ca2+ channels of this type have been described. Representative Na+, Ca2+, and K+ channels are shown in extended diagrammatic form in Figure 2-17.
بیشتر کانالهای +K تترامر هستند و هر یک از چهار زیرواحد بخشی از منافذی را تشکیل میدهند که یونهای +K از آن عبور میکنند. تجزیه و تحلیل ساختاری یک کانال +K با ولتاژ باکتریایی نشان میدهد که هر یک از چهار زیرواحد دارای یک پسوند پارویی مانند شامل چهار بار است. هنگامیکه کانال بسته میشود، این پسوندها در نزدیکی داخلی سلول با بار منفی قرار دارند. هنگامیکه پتانسیل غشا کاهش مییابد، پدلهای حاوی بارها از طریق غشاء به سطح بیرونی آن خم میشوند و باعث باز شدن کانال میشوند. کانال +K باکتریایی بسیار شبیه به کانالهای +K دارای ولتاژ در گونههای مختلف از جمله پستانداران و انسان است. در کانال یونی استیل کولین و سایر کانالهای کاتیونی یا آنیونی دارای لیگاند، پنج زیرواحد منافذ را تشکیل میدهند. اعضای خانواده CIC کانالهای Cl- دایمر هستند، اما دارای دو منفذ هستند، یکی در هر زیر واحد. در نهایت، آکواپورینها تترامرهایی هستند که در هر یک از زیر واحدها یک منفذ آب دارند. اخیراً تعدادی از کانالهای یونی با فعالیت آنزیمیذاتی شبیهسازی شدهاند. بیش از 30 کانال +Na و +Ca2 دارای ولتاژ یا نوکلئوتید حلقوی مختلف از این نوع توصیف شده است. نماینده کانالهای +Na+، Ca2 و +K به شکل نموداری توسعه یافته در شکل 2-17 نشان داده شده است.

FIGURE 2-17 Diagrammatic representation of the pore-forming subunits of three ion channels. The a subunit of the Na+ and Ca2+ channels traverses the membrane 24 times in four repeats of six membrane-spanning units. Each repeat has a “P” loop between membrane spans 5 and 6 that does not traverse the membrane. These P loops are thought to form the pore. Note that span 4 of each repeat is colored in red, representing its net “+” charge. The K+ channel has only a single repeat of the six spanning regions and P loop. Four K+ subunits are assembled for a functional K+ channel. (Reproduced with permission from Kandel ER, Schwartz JH, Jessell TM, Siegelbaum SA, Hudspeth AJ (editors): Principles of Neural Science, 5th ed. New York, NY: McGraw-Hill; 2013.)
شکل 2-17 نمایش نموداری زیر واحدهای تشکیل دهنده منافذ سه کانال یونی. زیرواحد کانالهای +Na و +Ca2 غشاء را 24 بار در چهار تکرار از شش واحد پوشاننده غشاء طی میکند. هر تکرار دارای یک حلقه “P” بین دهانه غشاء 5 و 6 است که از غشاء عبور نمیکند. تصور میشود که این حلقههای P منافذ را تشکیل میدهند. توجه داشته باشید که دهانه 4 هر تکرار به رنگ قرمز است که نشان دهنده شارژ خالص “+” آن است. کانال +K تنها یک تکرار از شش ناحیه پوشا و حلقه P دارد. چهار زیرواحد +K برای یک کانال +K کاربردی مونتاژ شدهاند. (تکثیر شده با اجازه از Kandel ER، Schwartz JH، Jessell TM، Siegelbaum SA، Hudspeth AJ (ویراستاران): Principles of Neural Science، ویرایش پنجم نیویورک، نیویورک: McGraw-Hill؛ 2013.)
Another family of Na+ channels with a different structure has been found in the apical membranes of epithelial cells in the kidneys, colon, lungs, and brain. The epithelial sodium channels (ENaCs) are made up of three subunits encoded by three different genes. Each of the subunits probably spans the membrane twice, and the amino terminal and carboxyl terminal are located inside the cell. The a subunit transports Na+, whereas the ẞ and y subunits do not. However, the addition of the ẞ and y subunits increases Na* transport through the a subunit. ENaCs are inhibited by the diuretic amiloride, which binds to the a subunit, and they used to be called amiloride inhibitable Na* channels. The ENaCs in the kidney play an important role in the regulation of ECF volume by aldosterone. ENaC knockout mice are born alive but promptly die because they cannot move Na*, and hence water, out of their lungs.
خانواده دیگری از کانالهای +Na با ساختار متفاوت در غشای آپیکال سلولهای اپیتلیال در کلیهها، روده بزرگ، ریهها و مغز یافت شده است. کانالهای سدیم اپیتلیال (ENaCs) از سه زیر واحد تشکیل شدهاند که توسط سه ژن مختلف کدگذاری میشوند. هر یک از زیر واحدها احتمالاً دو بار غشاء را میپوشاند و پایانه آمینه و پایانه کربوکسیل در داخل سلول قرار دارند. زیر واحد +a Na را منتقل میکند، در حالی که زیر واحدهای ẞ و y این کار را نمیکنند. با این حال، افزودن زیر واحدهای ẞ و y باعث افزایش انتقال +Na از طریق زیر واحد a میشود. ENaCs توسط آمیلورید دیورتیک که به زیرواحد a متصل میشود، مهار میشوند و قبلاً به آنها کانالهای سدیم قابل مهار آمیلورید میگفتند. ENaCs موجود در کلیه نقش مهمیدر تنظیم حجم ECF توسط آلدوسترون ایفا میکند. موشهای حذفی ENaC زنده به دنیا میآیند اما به سرعت میمیرند زیرا نمیتوانند +Na و در نتیجه آب را از ریههای خود خارج کنند.
Humans have several types of Cl channels. The CIC dimeric channels are found in plants, bacteria, and animals, and there are nine different CIC genes in humans. Other Cl channels have the same pentameric form as the acetylcholine receptor; examples include the y-aminobutyric acid A (GABA) and glycine receptors in the CNS. The cystic fibrosis transmembrane conductance regulator (CFTR) that is mutated in patients with cystic fibrosis is also a Cl- channel. Ion channel mutations cause a variety of channelopathies diseases that mostly affect muscle and brain tissue and produce episodic paralyses or convulsions, but are also observed in nonexcitable tissues (Clinical Box 2-6).
انسانها چندین نوع کانال کلر دارند. کانالهای دایمر CIC در گیاهان، باکتریها و حیوانات یافت میشوند و ۹ ژن مختلف CIC در انسان وجود دارد. سایر کانالهای کلر همان شکل پنتامری گیرنده استیل کولین را دارند. نمونهها شامل y-aminobutyric acid A (GABA) و گیرندههای گلیسین در CNS است. تنظیم کننده هدایت غشایی گذرنده فیبروز کیستیک (CFTR) که در بیماران مبتلا به فیبروز کیستیک جهش یافته است نیز یک کانال -Cl است. جهشهای کانال یونی باعث ایجاد انواع بیماریهای کانالوپاتی میشوند که عمدتاً بر بافت عضلانی و مغز تأثیر میگذارند و فلج یا تشنج اپیزودیک ایجاد میکنند، اما در بافتهای غیر قابل تحریک نیز مشاهده میشوند (باکس بالینی 2-6).
CLINICAL BOX 2:6
Channelopathies
Channelopathies include a wide range of diseases that can affect both excitable (eg, neurons and muscle) and nonexcitable cells. Using molecular genetic tools, many of the pathologic defects in channelopathies have been traced to mutations in single ion channels. Examples of channelopathies in excitable cells include periodic paralysis (eg, Kir2.6/KCNJ18, a K+ channel, Cay1.1/CACNA1S, a Ca2+ channel, or Nay 1.4/SCN4A, a Na* channel), myasthenia (eg, nicotinic acetyl choline receptor, a ligand-gated nonspecific cation channel), myotonia (eg, Kir1.1/KCNJ1, a K+ channel), malignant hyperthermia (ryanodine receptor/RYR1, a Ca2+ channel), long QT syndrome (both Na* and K+ channels, such as Ky7.1/KCNQ1, Ky11.1/KCNH2/hHERG, Kir2.1/KCNJ2 and Nay1.5/SCN5A) and several other disorders. Examples of channelopathies in nonexcitable cells include the underlying cause for cystic fibrosis (CFTR/ABCC7, a Cl channel) and a form of Bartter syndrome (Kir1.1/KCNJ1, a K+ channel). Importantly, advances in treatment of these disorders can come from the understanding of the basic defect and tailoring drugs that act to alter the mutated properties of the affected channel.
کادر بالینی 2. 6
کانالوپاتیها
کانالوپاتی شامل طیف گسترده ای از بیماریها است که میتواند سلولهای تحریک پذیر (مثلاً نورونها و ماهیچهها) و غیر تحریک پذیر را تحت تأثیر قرار دهد. با استفاده از ابزارهای ژنتیکی مولکولی، بسیاری از نقایص پاتولوژیک در کانالوپاتیها به جهش در کانالهای تک یونی ردیابی شده اند. نمونههایی از کانالوپاتی در سلولهای تحریک پذیر شامل فلج دوره ای (به عنوان مثال، Kir2.6/KCNJ18، یک کانال +K، یک کانال Cay1.1/CACNA1S، یک کانال +Ca2، یا Nay 1.4/SCN4A، یک کانال +Na)، میاستنی (به عنوان مثال، استیل نیکوتین استیل کولین، کانال غیر اختصاصی گیرنده من، a Kir1.1/KCNJ1، یک کانال +K)، هیپرترمیبدخیم (گیرنده رایانودین/RYR1، یک کانال +Ca2)، سندرم QT طولانی (هر دو کانال +Na و +K، مانند Ky7.1/KCNQ1، Ky11.1/KCNH2/hHERG، Kir2.12/KyN5 و چندین اختلال دیگر). نمونههایی از کانالوپاتیها در سلولهای غیرقابل تحریک عبارتند از علت زمینهای برای فیبروز کیستیک (CFTR/ABCC7، یک کانال کلر) و نوعی از سندرم بارتر (Kir1.1/KCNJ1، یک کانال +K). مهمتر از همه، پیشرفت در درمان این اختلالات میتواند از درک نقص اساسی و داروهایی که برای تغییر خواص جهش یافته کانال آسیب دیده عمل میکنند، حاصل شود.
PATCH CLAMP TECHNIQUE
Activity of ion channels and transporters in the plasma membrane plays an important role in the regulation of cell excitability and muscle contraction, as well as cell proliferation, migration, and apoptosis. An important technique that has permitted major advances in our knowledge about ion transport proteins (channels and transporters) is patch clamp technique. The technique is used to measure and study ionic currents through membrane ion channels and via electrogenic membrane transporters in isolated living cells and tissue sections. Depending on the research interest, there are four recording configurations using patch clamp technique. A micropipette or glass pipette is placed on the membrane of a cell and forms a tight seal to the membrane. The patch of membrane under the pipette tip usually contains only a few transport or channel proteins or a single channel protein (eg, a K* channel). The cell can be left intact to record single-channel activity using the cell-attached patch mode (Figure 2- 18). Alternatively, the membrane patch sealed to the pipette can be pulled loose from the cell, forming an inside-out patch to record single-channel currents. If the membrane patch is then disrupted by briefly applying a strong suction, the interior of the pipette becomes continuous with the cytoplasm. This whole-cell recording configuration is used to record the whole-cell currents from the entire cell (Figure 2-18) and to record electrical potentials (eg, the resting membrane potential and action potentials) in the whole cell. The pipette can be retracted during the whole-cell recording to cause a rupture and reformation of the membrane to form an outside-out patch to study the effect of extracellular agonists on the single-channel currents.
تکنیک گیره پچ
فعالیت کانالهای یونی و ناقلها در غشای پلاسمایی نقش مهمیدر تنظیم تحریکپذیری سلولی و انقباض عضلانی و همچنین تکثیر سلولی، مهاجرت و آپوپتوز دارد. یک تکنیک مهم که باعث پیشرفتهای عمده در دانش ما در مورد پروتئینهای انتقال یون (کانالها و ناقلها) شده است، تکنیک پچ گیره است. این تکنیک برای اندازهگیری و مطالعه جریانهای یونی از طریق کانالهای یونی غشایی و از طریق انتقالدهندههای غشایی الکتروژنی در سلولهای زنده جدا شده و بخشهای بافتی استفاده میشود. بسته به علاقه پژوهشی، چهار پیکربندی ضبط با استفاده از تکنیک پچ گیره وجود دارد. یک میکروپیپت یا پیپت شیشه ای روی غشای یک سلول قرار میگیرد و یک مهر و موم محکم به غشاء میدهد. لکه غشاء زیر نوک پیپت معمولاً فقط حاوی چند پروتئین انتقال یا کانال یا یک پروتئین تک کانالی است (مثلاً یک کانال +K). سلول را میتوان دست نخورده رها کرد تا فعالیت تک کانالی را با استفاده از حالت پچ متصل به سلول ثبت کند (شکل 2-18). متناوباً، وصله غشایی مهر و موم شده به پیپت را میتوان از سلول جدا کرد و یک وصله داخل به بیرون برای ثبت جریانهای تک کانالی تشکیل داد. اگر وصله غشایی با اعمال یک مکش قوی به طور مختصر مختل شود، داخل پیپت با سیتوپلاسم پیوسته میشود. این پیکربندی ضبط کل سلول برای ثبت جریانهای کل سلول از کل سلول (شکل 2-18) و برای ثبت پتانسیلهای الکتریکی (به عنوان مثال، پتانسیل غشاء استراحت و پتانسیلهای عمل) در کل سلول استفاده میشود. پیپت را میتوان در طول ضبط کل سلول جمع کرد تا باعث پارگی و اصلاح غشاء شود تا یک پچ بیرونی برای مطالعه تأثیر آگونیستهای خارج سلولی بر جریانهای تک کانالی ایجاد کند.

FIGURE 2-18 Patch clamp technique for studying ion transport. In a patch clamp experiment, a small glass pipette filled with extracellular (or intracellular) solution is carefully maneuvered to seal off a portion of a cell membrane (cell- attached patch, A). The pipette filled with an appropriate solution has an electrode that allows for recording of electrical changes through any pore or channel in the membrane patch. A typical single-channel recording of the Ca2+- activated K+ currents in cell-attached patch is shown below in panel A. The inside-out patch configuration is achieved by rapidly pulling up the pipette from the attached cell, without breaking the seal (B). The patch sealed to the pipette can also be ruptured off by a brief suction to form the whole-cell recording mode (C). This mode allows to record ionic currents in the entire cell. A typical whole- cell recording of the superimposed voltage-gated K+ currents is shown in panel C.
شکل 2-18 تکنیک پچ گیره برای مطالعه انتقال یون. در آزمایش پچ گیره، یک پیپت شیشه ای کوچک پر از محلول خارج سلولی (یا داخل سلولی) با دقت مانور داده میشود تا بخشی از غشای سلولی را ببندد (پچ متصل به سلول، A). پیپت پر شده با محلول مناسب دارای یک الکترود است که امکان ثبت تغییرات الکتریکی را از طریق هر منافذ یا کانال در وصله غشایی فراهم میکند. یک ضبط معمولی تک کانالی جریانهای +K فعال شده +Ca2– در پچ متصل به سلول در زیر در پانل A نشان داده شده است. پیکربندی پچ داخل به بیرون با بالا کشیدن سریع پیپت از سلول متصل، بدون شکستن مهر و موم (B) به دست میآید. وصله مهر و موم شده به پیپت همچنین میتواند با یک مکش کوتاه پاره شود تا حالت ضبط کل سلولی (C) ایجاد شود. این حالت اجازه میدهد تا جریانهای یونی را در کل سلول ضبط کنید. یک ضبط معمولی کل سلولی از جریانهای +K دریچه ولتاژ روی هم در پانل C نشان داده شده است.
Na, K ATPase
As noted previously, Na, K ATPase catalyzes the hydrolysis of ATP to adenosine diphosphate (ADP) and uses the energy to extrude three Na+ from the cell and take two K+ into the cell for each molecule of ATP hydrolyzed. It is an electrogenic pump in that it moves three positive charges (3Na*) out of the cell for each two (2K) that it moves in, and it is therefore said to have a coupling ratio of 3:2. It is found in all parts of the body. Its activity is inhibited by ouabain and related digitalis glycosides used in the treatment of heart failure. It is a heterodimer made up of an a subunit with a molecular weight of approximately 100,000 and a ẞ subunit with a molecular weight of approximately 55,000. Both extend through the cell membrane (Figure 2-19). Separation of the subunits eliminates activity. The ẞ subunit is a glycoprotein, whereas Nat and K+ transport occur through the a subunit. The ẞ subunit has a single membrane-spanning domain and three extracellular glycosylation sites, all of which appear to have attached carbohydrate residues. These residues account for one-third of its molecular weight. The a subunit probably spans the cell membrane 10 times, with the amino and carboxyl terminals both located intracellularly. This subunit has intracellular Na*- and ATP-binding sites and a phosphorylation site; it also has extracellular binding sites for K+ and ouabain. The endogenous ligand of the ouabain-binding site, or endogenous ouabain, is identified in blood plasma and various organs and tissues of humans, especially in patients with essential hypertension. When Na+ binds to the a subunit, ATP also binds and is converted to ADP, with a phosphate being transferred to Asp 376, the phosphorylation site. This causes a change in the configuration of the protein, extruding Na* into the ECF. K* then binds extracellularly, dephosphorylating the a subunit, which returns to its previous conformation, releasing K+ into the cytoplasm.
Na، K ATPase
همانطور که قبلا ذکر شد، Na، K ATPase هیدرولیز ATP به آدنوزین دی فسفات (ADP) را کاتالیز میکند و از انرژی برای بیرون راندن سه Na+ از سلول استفاده میکند و برای هر مولکول ATP هیدرولیز شده دو +K را به داخل سلول میبرد. این یک پمپ الکتروژنیک است که سه بار مثبت (+3Na) را به ازای هر دو (2K) که به داخل سلول حرکت میکند، به خارج از سلول منتقل میکند و بنابراین گفته میشود که نسبت جفت شدن آن 3:2 است. در تمام قسمتهای بدن یافت میشود. فعالیت آن توسط ouabain و گلیکوزیدهای دیجیتالی مرتبط که در درمان نارسایی قلبی استفاده میشوند، مهار میشود. این یک هترودایمر است که از یک زیر واحد با وزن مولکولی تقریباً 100000 و یک زیر واحد ẞ با وزن مولکولی تقریباً 55000 تشکیل شده است. هر دو از طریق غشای سلولی گسترش مییابند (شکل 2-19). جداسازی زیر واحدها فعالیت را از بین میبرد. زیرواحد ẞ یک گلیکوپروتئین است، در حالی که انتقال +Na و +K از طریق زیر واحد a انجام میشود. زیرواحد ẞ دارای یک حوزه غشایی واحد و سه محل گلیکوزیلاسیون خارج سلولی است که به نظر میرسد همه آنها دارای بقایای کربوهیدرات متصل هستند. این باقیماندهها یک سوم وزن مولکولی آن را تشکیل میدهند. زیرواحد a احتمالاً 10 بار غشای سلولی را میپوشاند و پایانههای آمینو و کربوکسیل هر دو در داخل سلول قرار دارند. این زیر واحد دارای محلهای اتصال Na*- و ATP داخل سلولی و محل فسفوریلاسیون است. همچنین دارای مکانهای اتصال خارج سلولی برای +K و ouabain است. لیگاند درون زا محل اتصال اوابائین یا اواباین درون زا در پلاسمای خون و اندامها و بافتهای مختلف انسان به ویژه در بیماران مبتلا به فشار خون ضروری شناسایی میشود. هنگامیکه +Na به زیر واحد a متصل میشود، ATP نیز متصل میشود و به ADP تبدیل میشود و یک فسفات به Asp 376، محل فسفوریلاسیون منتقل میشود. این باعث تغییر در پیکربندی پروتئین میشود و +Na را به داخل ECF اکسترود میکند. سپس +K به صورت خارج سلولی متصل میشود و زیرواحد a را دفسفریله میکند که به ترکیب قبلی خود باز میگردد و +K را در سیتوپلاسم آزاد میکند.
FIGURE 2-19 Na, K ATPase. The intracellular portion of the a subunit has a Na+-binding site (1), a phosphorylation site (4), and an ATP-binding site (5). The extracellular portion has a K*-binding site (2) and an ouabain-binding site (3). (Reproduced with permission from Horisberger JD, Lemas V, Kraehenbühl JP et al: Structure-function relationship of Na,K-ATPase. Annu Rev Physiol 1991;53:565-584.)
شکل 2-19 Na، K ATPase. بخش درون سلولی زیرواحد a دارای محل اتصال Na+ (1)، محل فسفوریلاسیون (4) و محل اتصال ATP (5) است. بخش خارج سلولی دارای یک محل اتصال K+ (2) و یک محل اتصال به اوابین (3) است. (بازتولید شده با اجازه Horisberger JD، Lemas V، Kraehenbühl JP و همکاران: رابطه ساختار-عملکرد Na,K-ATPase. Annu Rev Physiol 1991;53:565-584.)
The a and B subunits are heterogeneous, with α1, A2, and аз subunits and ẞ1, B2, and ẞ3 subunits described so far. The a1 isoform is found in the membranes of most cells, whereas α2 is present in muscle, heart, adipose tissue, and brain, and a3 is present in heart and brain. The ẞ1 subunit is widely distributed but is absent in certain astrocytes, vestibular cells of the inner ear, and glycolytic fast- twitch muscles. The fast-twitch muscles contain only ẞ2 subunits. The different a and B subunit structures of Na, K ATPase in various tissues probably represent specialization for specific tissue functions.
زیرواحدهای a و B ناهمگن هستند، با زیرواحدهای α1، A2، و аз و زیرواحدهای ẞ1، B2 و ẞ3 تاکنون شرح داده شدهاند. ایزوفرم a1 در غشای بیشتر سلولها یافت میشود، در حالی که α2 در ماهیچه، قلب، بافت چربی و مغز و a3 در قلب و مغز وجود دارد. زیرواحد ẞ1 به طور گسترده توزیع شده است اما در برخی از آستروسیتها، سلولهای دهلیزی گوش داخلی و عضلات تند انقباض گلیکولیتیک وجود ندارد. عضلات تند انقباض فقط شامل 2 زیر واحد هستند. ساختارهای مختلف زیرواحد a و B Na، K ATPase در بافتهای مختلف احتمالاً نشان دهنده تخصص برای عملکردهای بافتی خاص است.
REGULATION OF Na, K ATPase
The amount of Na* normally found in cells is not enough to saturate the pump, so if the Na+ increases, more is pumped out. Pump activity is affected by second messenger molecules (eg, cAMP and diacylglycerol [DAG]). The magnitude and direction of the altered pump effects vary with the experimental conditions. Thyroid hormones increase pump activity by a genomic action to increase the formation of Na, K ATPase molecules. Aldosterone also increases the number of pumps, although this effect is probably secondary. Dopamine in the kidney inhibits the pump by phosphorylating it, causing a natriuresis. Insulin increases pump activity, probably by a variety of different mechanisms.
تنظیم Na، K ATPase
مقدار +Na که معمولاً در سلولها یافت میشود برای اشباع پمپ کافی نیست، بنابراین اگر +Na افزایش یابد، مقدار بیشتری از آن خارج میشود. فعالیت پمپ تحت تأثیر مولکولهای پیام رسان دوم (مانند cAMP و دی اسیل گلیسرول [DAG]) قرار میگیرد. مقدار و جهت اثرات پمپ تغییر یافته با شرایط تجربی متفاوت است. هورمونهای تیروئید با یک عمل ژنومیفعالیت پمپ را افزایش میدهند تا تشکیل مولکولهای Na، K ATPase را افزایش دهند. آلدوسترون همچنین تعداد پمپها را افزایش میدهد، اگرچه این اثر احتمالاً ثانویه است. دوپامین موجود در کلیه با فسفریله کردن پمپ، پمپ را مهار میکند و باعث ناتریورز میشود. انسولین، احتمالاً با مکانیسمهای مختلف، فعالیت پمپ را افزایش میدهد.
SECONDARY ACTIVE TRANSPORT
In many situations, the active transport of Na+ is coupled to the transport of other substances (secondary active transport). For example, the luminal membranes of mucosal cells in the small intestine contain a symport that transports glucose into the cell only if Nat binds to the protein and is transported into the cell at the same time. From the cells, the glucose enters the blood. The electrochemical gradient for Na+ is maintained by the active transport of Na+ out of the mucosal cell into ECF. Other examples are shown in Figure 2-20. In the heart, Na, K ATPase indirectly affects Ca2+ transport. An antiport in the membranes of cardiac muscle cells normally exchanges intracellular Ca2+ for extracellular Na*.
حمل و نقل فعال ثانویه
در بسیاری از موقعیتها، انتقال فعال +Na با انتقال مواد دیگر همراه است (انتقال فعال ثانویه). به عنوان مثال، غشای مجرای سلولهای مخاطی در روده کوچک حاوی علامتی است که گلوکز را تنها در صورتی به داخل سلول منتقل میکند که +Na به پروتئین متصل شود و همزمان به سلول منتقل شود. از سلولها، گلوکز وارد خون میشود. گرادیان الکتروشیمیایی برای +Na با انتقال فعال +Na به خارج از سلول مخاطی به ECF حفظ میشود. نمونههای دیگر در شکل 2-20 نشان داده شده است. در قلب، Na، K ATPase به طور غیر مستقیم بر انتقال +Ca2 تأثیر میگذارد. یک آنتی پورت در غشای سلولهای عضله قلب معمولاً +Ca2 داخل سلولی را با +Na خارج سلولی مبادله میکند.

FIGURE 2-20 Composite diagram of main secondary effects of active transport of Na* and K. Na, K ATPase converts the chemical energy of ATP hydrolysis into maintenance of an inward gradient for Na+ and an outward gradient for K+. The energy of the gradients is used for countertransport, cotransport, and maintenance of the membrane potential. Some examples of cotransport and countertransport that use these gradients are shown.
شکل 2-20 نمودار ترکیبی اثرات ثانویه اصلی انتقال فعال +Na و K. Na، K ATPase انرژی شیمیایی هیدرولیز ATP را به حفظ یک گرادیان درونی برای +Na و یک گرادیان بیرونی برای +K تبدیل میکند. انرژی گرادیانها برای انتقال متقابل، هم انتقال و حفظ پتانسیل غشا استفاده میشود. برخی از نمونههای همترانسپورت و انتقال متقابل که از این شیبها استفاده میکنند نشان داده شدهاند.
Active transport of Na* and K* is one of the major energy-using processes in the body. On the average, it accounts for about 24% of the energy utilized by cells, and in neurons it accounts for 70%. Thus, it accounts for a large part of the basal metabolism. A major payoff for this energy use is the establishment of the electrochemical gradient in cells.
انتقال فعال +Na و +K یکی از فرآیندهای اصلی مصرف انرژی در بدن است. به طور متوسط، حدود 24٪ از انرژی مورد استفاده توسط سلولها را تشکیل میدهد و در نورونها 70٪ را تشکیل میدهد. بنابراین، بخش بزرگی از متابولیسم پایه را تشکیل میدهد. یک بازده اصلی برای این مصرف انرژی ایجاد گرادیان الکتروشیمیایی در سلولها است.
TRANSPORT ACROSS EPITHELIA
In the gastrointestinal tract, the pulmonary airways, the renal tubules, and other structures lined with polarized epithelial cells, substances enter one side of a cell and exit another, producing movement of the substance from one side of the epithelium to the other (Figure 2-8). For transepithelial transport to occur, the cells need to be bound by tight junctions and, obviously, have different ion channels and transport proteins in different parts of their membranes. Most of the instances of secondary active transport cited in the preceding paragraph involve transepithelial movement of ions and other molecules.
حمل و نقل در سراسر اپیتلیا
در دستگاه گوارش، راههای هوایی ریوی، لولههای کلیوی و سایر ساختارهای پوشیده از سلولهای اپیتلیال پلاریزه، مواد وارد یک طرف سلول شده و از سمت دیگر خارج میشوند و حرکت ماده را از یک طرف اپیتلیوم به سمت دیگر ایجاد میکنند (شکل 2-8). برای اینکه انتقال از طریق اپیتلیال اتفاق بیفتد، سلولها باید با اتصالات محکم متصل شوند و بدیهی است که کانالهای یونی و پروتئینهای انتقال متفاوتی در قسمتهای مختلف غشاء دارند. بیشتر نمونههای انتقال فعال ثانویه ذکر شده در پاراگراف قبل شامل حرکت ترانس اپیتلیال یونها و سایر مولکولها است.
SPECIALIZED TRANSPORT ACROSS THE CAPILLARY WALL
The capillary wall separating plasma from interstitial fluid is different from the cell membranes separating interstitial fluid from intracellular fluid because the pressure difference across it makes filtration a significant factor in producing movement of water and solute. By definition, filtration is the process by which fluid is forced through a membrane or other barrier because of a difference in pressure on the two sides.
حمل و نقل تخصصی از طریق دیواره مویرگ
دیواره مویرگی جداکننده پلاسما از مایع بین بافتی با غشای سلولی جداکننده مایع بین بافتی از مایع درون سلولی متفاوت است زیرا اختلاف فشار در آن باعث میشود فیلتراسیون عامل مهمیدر تولید حرکت آب و املاح باشد. طبق تعریف، فیلتراسیون فرآیندی است که طی آن سیال به دلیل اختلاف فشار در دو طرف، از یک غشاء یا مانع دیگر عبور میکند.
The structure of the capillary wall varies from one vascular bed to another. However, near skeletal muscle and many other organs, water and relatively small solutes are the only substances that cross the wall with ease. The apertures in the junctions between the endothelial cells are too small to permit plasma proteins and other colloids to pass through in significant quantities. The colloids have a high molecular weight but are present in large amounts. Small amounts cross the capillary wall by vesicular transport, but their effect is slight. Therefore, the capillary wall behaves like a membrane impermeable to colloids, and these exert an osmotic pressure of about 25 mmHg. The colloid osmotic pressure due to the plasma colloids is called the oncotic pressure. Filtration across the capillary membrane as a result of the hydrostatic pressure head in the vascular system is opposed by the oncotic pressure. The way the balance between the hydrostatic and oncotic pressures controls exchanges across the capillary wall is considered in detail in Chapter 31.
ساختار دیواره مویرگی از یک بستر عروقی به تخت دیگر متفاوت است. با این حال، نزدیک ماهیچههای اسکلتی و بسیاری از اندامهای دیگر، آب و املاح نسبتا کوچک تنها موادی هستند که به راحتی از دیواره عبور میکنند. روزنهها در اتصالات بین سلولهای اندوتلیال بسیار کوچک هستند تا به پروتئینهای پلاسما و سایر کلوئیدها اجازه عبور در مقادیر قابل توجهی را بدهند. کلوئیدها وزن مولکولی بالایی دارند اما در مقادیر زیادی وجود دارند. مقادیر کمیاز دیواره مویرگی با انتقال تاولی عبور میکند، اما اثر آنها ناچیز است. بنابراین، دیواره مویرگی مانند غشایی غیرقابل نفوذ در برابر کلوئیدها رفتار میکند و فشار اسمزی حدود 25 میلی متر جیوه اعمال میکند. فشار اسمزی کلوئیدی ناشی از کلوئیدهای پلاسما را فشار انکوتیک میگویند. فیلتراسیون در سراسر غشای مویرگی در نتیجه فشار هیدرواستاتیکی در سیستم عروقی با فشار انکوتیک مخالف است. روشی که تعادل بین فشارهای هیدرواستاتیک و انکوتیک تبادلات در سراسر دیواره مویرگی را کنترل میکند در فصل 31 به تفصیل در نظر گرفته شده است.
TRANSCYTOSIS
Vesicles are present in the cytoplasm of endothelial cells, and tagged protein molecules injected into the bloodstream have been found in the vesicles and in the interstitium. This indicates that small amounts of protein are transported out of capillaries across endothelial cells by endocytosis on the capillary side followed by exocytosis on the interstitial side of the cells. The transport mechanism makes use of coated vesicles that appear to be coated with caveolin and is called transcytosis, vesicular transport, or cytopempsis.
ترانس سیتوز
وزیکولها در سیتوپلاسم سلولهای اندوتلیال وجود دارند و مولکولهای پروتئین برچسبدار تزریق شده به جریان خون در وزیکولها و بینابینی یافت شدهاند. این نشان میدهد که مقادیر کمیپروتئین از مویرگها در سلولهای اندوتلیال توسط اندوسیتوز در سمت مویرگی و سپس اگزوسیتوز در سمت بینابینی سلولها به بیرون منتقل میشود. مکانیسم انتقال از وزیکولهای پوشیده شده ای استفاده میکند که به نظر میرسد با کائولین پوشیده شده اند و ترانس سیتوز، انتقال تاولی یا سیتوپپسیس نامیده میشوند.
INTERCELLULAR COMMUNICATION
Cells communicate with one another via chemical messengers. Within a given tissue, some messengers move from cell to cell via gap junctions without entering the ECF. In addition, cells are affected by chemical messengers secreted into the ECF, or by direct cell-cell contacts. Chemical messengers typically bind to protein receptors on the surface of the cell or, in some instances, in the cytoplasm or the nucleus, triggering sequences of intracellular changes that produce their physiologic effects. Three general types of intercellular communication are mediated by messengers in the ECF: (1) neural communication, in which neurotransmitters are released at synaptic junctions from nerve cells and act across a narrow synaptic cleft on a postsynaptic cell; (2) endocrine communication, in which hormones and growth factors reach cells via the circulating blood or the lymph; and (3) paracrine communication, in which the products of cells diffuse in the ECF to affect neighboring cells that may be some distance away (Figure 2-21). In addition, cells secrete chemical messengers that in some situations bind to receptors on the same cell, that is, the cell that secreted the messenger (autocrine communication). The chemical messengers include amines, amino acids, steroids, polypeptides, and in some instances, lipids, purine nucleotides, and pyrimidine nucleotides. It is worth noting that in various parts of the body, the same chemical messenger can function as a neurotransmitter, a paracrine mediator, a hormone secreted by neurons into the blood (neural hormone), and a hormone secreted by gland cells into the blood.
ارتباط بین سلولی
سلولها از طریق پیام رسانهای شیمیایی با یکدیگر ارتباط برقرار میکنند. در داخل یک بافت معین، برخی از پیام رسانها از طریق اتصالات شکاف بدون ورود به ECF از سلولی به سلول دیگر حرکت میکنند. علاوه بر این، سلولها توسط پیام رسانهای شیمیایی ترشح شده در ECF یا تماس مستقیم سلول-سلول تحت تأثیر قرار میگیرند. پیامرسانهای شیمیایی معمولاً به گیرندههای پروتئینی روی سطح سلول یا در برخی موارد در سیتوپلاسم یا هسته متصل میشوند و توالیهایی از تغییرات درون سلولی را تحریک میکنند که اثرات فیزیولوژیکی آنها را ایجاد میکنند. سه نوع کلی ارتباط بین سلولی توسط پیام رسانها در ECF انجام میشود: (1) ارتباط عصبی، که در آن انتقال دهندههای عصبی در اتصالات سیناپسی از سلولهای عصبی آزاد میشوند و در یک شکاف سیناپسی باریک روی یک سلول پس سیناپسی عمل میکنند. (2) ارتباط غدد درون ریز، که در آن هورمونها و عوامل رشد از طریق خون در گردش یا لنف به سلولها میرسند. و (3) ارتباط پاراکرین، که در آن محصولات سلولها در ECF منتشر میشوند تا سلولهای همسایه را که ممکن است مقداری دورتر باشند، تحت تاثیر قرار دهند (شکل 2-21). علاوه بر این، سلولها پیامرسانهای شیمیایی ترشح میکنند که در برخی شرایط به گیرندههای همان سلول، یعنی سلولی که پیامرسان را ترشح میکند، متصل میشوند (ارتباطات خودکار). پیام رسانهای شیمیایی عبارتند از آمینها، اسیدهای آمینه، استروئیدها، پلی پپتیدها و در برخی موارد، لیپیدها، نوکلئوتیدهای پورین و نوکلئوتیدهای پیریمیدین. شایان ذکر است که در قسمتهای مختلف بدن، همان پیام رسان شیمیایی میتواند به عنوان یک انتقال دهنده عصبی، یک واسطه پاراکرین، هورمونی که توسط نورونها به خون ترشح میشود (هورمون عصبی) و هورمونی که از سلولهای غدد به خون ترشح میشود، عمل کند.

FIGURE 2-21 Intercellular communication by chemical mediators. Several common forms of cellular communication are illustrated. A, autocrine; P, paracrine.
شکل 2-21 ارتباط بین سلولی توسط واسطههای شیمیایی. چندین شکل رایج ارتباط سلولی نشان داده شده است. الف، اتوکرین؛ P، پاراکرین.
An additional form of intercellular communication is called juxtacrine communication. Some cells express multiple repeats of growth factors such as transforming growth factor alpha (TGF-a) extracellularly on transmembrane proteins that provide an anchor to the cell. Other cells have TGF-a receptors. Consequently, TGF-a anchored to a cell can bind to a TGF-a receptor on another cell, linking the two. This could be important in producing local foci of growth in tissues. Notch-mediated juxtacrine signaling between adjacent cells is another good example of juxtacrine communication. Notch ligands, such as Jagged (Jag1/2) and Delta-like (DLL1/3/4), in signal sending cells first bind to Notch receptors, such as Notch1-4, in signal receiving cells, through cell-to-cell contact. The activated Notch receptors mediate a series of signal transduction cascades involved in regulating cell fate decisions, cell proliferation and differentiation, and tissue and organ development.
شکل اضافی ارتباط بین سلولی، ارتباط juxtacrine نامیده میشود. برخی از سلولها تکرارهای متعددی از فاکتورهای رشد مانند تبدیل فاکتور رشد آلفا (TGF-a) را به صورت خارج سلولی بر روی پروتئینهای غشایی که یک لنگر برای سلول ایجاد میکنند، بیان میکنند. سلولهای دیگر گیرندههای TGF-a دارند. در نتیجه، TGF-a متصل به یک سلول میتواند به گیرنده TGF-a در سلول دیگر متصل شود و این دو را به هم پیوند دهد. این میتواند در تولید کانونهای رشد موضعی در بافتها مهم باشد. سیگنال دهی ژوکستاکرین با واسطه بریدگی بین سلولهای مجاور نمونه خوبی دیگر از ارتباطات ژوکستاکرین است. لیگاندهای Notch، مانند Jagged (Jag1/2) و Delta-like (DLL1/3/4)، در سلولهای ارسال سیگنال ابتدا به گیرندههای Notch، مانند Notch1-4، در سلولهای دریافت سیگنال، از طریق تماس سلول به سلول متصل میشوند. گیرندههای Notch فعال شده یک سری از آبشارهای انتقال سیگنال را انجام میدهند که در تنظیم تصمیمهای سرنوشت سلول، تکثیر و تمایز سلولی و توسعه بافت و اندام نقش دارند.
RECEPTORS FOR CHEMICAL MESSENGERS
The recognition of chemical messengers by cells typically begins by interaction with a receptor at that cell. There have been over 20 families of receptors for chemical messengers characterized. These proteins are not static components of the cell, but their numbers increase and decrease in response to various stimuli, and their properties change with changes in physiologic conditions. When a hormone or neurotransmitter is present in excess, the number of active receptors generally decreases (downregulation), whereas in the presence of a deficiency of the chemical messenger, there is an increase in the number of active receptors (upregulation). In its actions on the adrenal cortex, angiotensin II is an exception; it increases rather than decreases the number of its receptors in the adrenal. In the case of receptors in the membrane, receptor-mediated endocytosis is responsible for downregulation in some instances; ligands bind to their receptors, and the ligand-receptor complexes move laterally in the membrane to coated pits, where they are taken into the cell by endocytosis (internalization). This decreases the number of receptors in the membrane. Some receptors are recycled after internalization, whereas others are replaced by de novo synthesis in the cell. Another type of downregulation is desensitization, in which receptors are chemically modified in ways that make them less responsive.
گیرندههای پیام رسانهای شیمیایی
تشخیص پیامرسانهای شیمیایی توسط سلولها معمولاً با تعامل با گیرندهای در آن سلول آغاز میشود. بیش از 20 خانواده از گیرندهها برای پیام رسانهای شیمیایی مشخص شده اند. این پروتئینها اجزای ساکن سلول نیستند، اما تعداد آنها در پاسخ به محرکهای مختلف کم و زیاد میشود و با تغییر شرایط فیزیولوژیکی، خواص آنها تغییر میکند. هنگامیکه یک هورمون یا انتقال دهنده عصبی بیش از حد وجود داشته باشد، تعداد گیرندههای فعال به طور کلی کاهش مییابد (تنظیم پایین)، در حالی که در حضور کمبود پیام رسان شیمیایی، تعداد گیرندههای فعال افزایش مییابد (تنظیم بالا). آنژیوتانسین II در اعمال خود بر روی قشر آدرنال یک استثنا است. به جای کاهش تعداد گیرندههای آن در غده فوق کلیوی افزایش مییابد. در مورد گیرندههای غشاء، اندوسیتوز با واسطه گیرنده مسئول کاهش در برخی موارد است. لیگاندها به گیرندههای خود متصل میشوند و کمپلکسهای لیگاند-گیرنده به صورت جانبی در غشاء به حفرههای پوشیده شده حرکت میکنند، جایی که توسط اندوسیتوز (داخلیسازی) به داخل سلول منتقل میشوند. این باعث کاهش تعداد گیرندههای غشاء میشود. برخی از گیرندهها پس از درونی سازی بازیافت میشوند، در حالی که برخی دیگر با سنتز de novo در سلول جایگزین میشوند. نوع دیگری از کاهش حساسیت، حساسیت زدایی است که در آن گیرندهها از نظر شیمیایی به گونهای اصلاح میشوند که کمتر پاسخگو باشند.
MECHANISMS BY WHICH CHEMICAL MESSENGERS ACT
Receptor-ligand interaction is usually just the beginning of the cell response. This event is transduced into secondary responses within the cell that can be divided into four broad categories: (1) ion channel activation, (2) G-protein activation, (3) activation of enzyme activity within the cell, or (4) direct activation of transcription. Within each of these groups, responses can be quite varied. Some of the common mechanisms by which chemical messengers exert their intracellular effects are summarized in Table 2-3. Ligands such as acetylcholine bind directly to ion channels in the cell membrane, changing their conductance. Thyroid and steroid hormones, 1,25-dihydroxycholecalciferol, and retinoids enter cells and act on one or another member of a family of structurally related cytoplasmic or nuclear receptors. The activated receptor binds to DNA and increases transcription of selected mRNAs. Many other ligands in the ECF bind to receptors on the surface of cells and trigger the release of intracellular mediators such as cAMP, inositol trisphosphate (IP3), and DAG that initiate changes in cell function. Consequently, the extracellular ligands are called “first messengers” and the intracellular mediators are called “second messengers.” Second messengers bring about many short-term changes in cell function by altering enzyme function, triggering exocytosis, and so on, but they also can lead to the alteration of transcription of various genes. A variety of enzymatic changes, protein-protein interactions, or second messenger changes can be activated within a cell in an orderly fashion following receptor recognition of the primary messenger. The resulting cell signaling pathway provides amplification of the primary signal and distribution of the signal to appropriate targets within the cell. Extensive cell signaling pathways also provide opportunities for feedback and regulation that can fine-tune the signal for the correct physiologic response by the cell.
مکانیسمهایی که توسط آنها پیام رسانهای شیمیایی عمل میکنند
برهمکنش گیرنده-لیگاند معمولاً فقط آغاز پاسخ سلول است. این رویداد به پاسخهای ثانویه درون سلول تبدیل میشود که میتوانند به چهار دسته کلی تقسیم شوند: (1) فعال شدن کانال یونی، (2) فعالسازی پروتئین G، (3) فعالسازی فعالیت آنزیم در سلول، یا (4) فعالسازی مستقیم رونویسی. در هر یک از این گروهها، پاسخها میتواند کاملاً متفاوت باشد. برخی از مکانیسمهای رایجی که پیامرسانهای شیمیایی توسط آنها اثرات درون سلولی خود را اعمال میکنند در جدول 2-3 خلاصه شدهاند. لیگاندهایی مانند استیل کولین مستقیماً به کانالهای یونی در غشای سلولی متصل میشوند و هدایت آنها را تغییر میدهند. هورمونهای تیروئید و استروئید، 1،25-دی هیدروکسی کوله کلسیفرول و رتینوئیدها وارد سلولها میشوند و بر روی یکی از اعضای خانواده ای از گیرندههای سیتوپلاسمییا هسته ای مرتبط با ساختاری اثر میگذارند. گیرنده فعال شده به DNA متصل میشود و رونویسی mRNAهای انتخابی را افزایش میدهد. بسیاری از لیگاندهای دیگر در ECF به گیرندههای روی سطح سلولها متصل میشوند و باعث آزاد شدن واسطههای درون سلولی مانند cAMP، اینوزیتول تری فسفات (IP3) و DAG میشوند که باعث تغییرات در عملکرد سلول میشوند. در نتیجه، لیگاندهای خارج سلولی «پیامرسان اول» و واسطههای درون سلولی «پیامرسان دوم» نامیده میشوند. پیام رسانهای دوم با تغییر عملکرد آنزیم، تحریک اگزوسیتوز و غیره، تغییرات کوتاه مدت زیادی در عملکرد سلول ایجاد میکنند، اما همچنین میتوانند به تغییر رونویسی ژنهای مختلف منجر شوند. انواع تغییرات آنزیمی، فعل و انفعالات پروتئین-پروتئین، یا تغییرات پیام رسان ثانویه را میتوان به دنبال شناسایی گیرنده پیام رسان اولیه به روشی منظم در یک سلول فعال کرد. مسیر سیگنال دهی سلولی حاصل، تقویت سیگنال اولیه و توزیع سیگنال را به اهداف مناسب در داخل سلول فراهم میکند. مسیرهای سیگنال دهی گسترده سلولی همچنین فرصتهایی را برای بازخورد و تنظیم فراهم میکند که میتواند سیگنال را برای پاسخ فیزیولوژیکی صحیح سلول تنظیم کند.
TABLE 2-3 Common mechanisms by which chemical messengers in the ECF bring about changes in cell function.
جدول 2-3 مکانیسمهای رایجی که توسط آن پیام رسانهای شیمیایی در ECF تغییراتی در عملکرد سلول ایجاد میکنند.

CAMP, cyclic adenosine 3′,5′-monophosphate; cGMP, cyclic guanosine
monophosphate; DAG, diacylglycerol; ECF, extracellular fluid; EGF, epidermal growth factor; IP,, inositol triphosphate; M-CSF, monocyte colony-stimulating factor;
PDGF, platelet-derived growth factor: TGF-B, transforming growth factor B.
CAMP، آدنوزین حلقوی 3’،5′-مونوفسفات. cGMP، گوانوزین حلقوی
مونوفسفات؛ DAG، دی اسیل گلیسرول؛ ECF، مایع خارج سلولی؛ EGF، فاکتور رشد اپیدرمی؛ IP،، اینوزیتول تری فسفات؛ M-CSF، فاکتور محرک کلنی مونوسیت.
PDGF، فاکتور رشد مشتق از پلاکت: TGF-B، فاکتور رشد تبدیل کننده B.
The most predominant posttranslation modification of proteins, phosphorylation, is a common theme in cell signaling pathways. Cellular phosphorylation is under the control of two groups of proteins: kinases, enzymes that catalyze the phosphorylation of tyrosine or serine and threonine residues in proteins (or in some cases, in lipids); and phosphatases, proteins that remove phosphates from proteins (or lipids). Some of the larger receptor families are themselves kinases. Tyrosine kinase receptors initiate phosphorylation on tyrosine residues on complementary receptors following ligand binding. Serine/threonine kinase receptors initiate phosphorylation on serines or threonines in complementary receptors following ligand binding. Cytokine receptors are directly associated with a group of protein kinases that are activated following cytokine binding. Alternatively, second messenger changes can lead to phosphorylation further downstream in the signaling pathway. More than 500 protein kinases have been described. Some of the principal ones that are important in mammalian cell signaling are summarized in Table 2-4. In general, addition of phosphate groups changes the conformation of the proteins, altering their functions and consequently the functions of the cell. The close relationship between phosphorylation and dephosphorylation of cellular proteins allows for a temporal control of activation of cell signaling pathways. This is sometimes referred to as a “phosphate timer.” The dysregulation of the phosphate timer and subsequent cellular signaling in a cell can lead to disease (Clinical Box 2-7).
غالبترین تغییر پس از ترجمه پروتئینها، فسفوریلاسیون، موضوعی رایج در مسیرهای سیگنالدهی سلولی است. فسفوریلاسیون سلولی تحت کنترل دو گروه پروتئین است: کینازها، آنزیمهایی که فسفوریلاسیون تیروزین یا باقی ماندههای سرین و ترئونین را در پروتئینها (یا در برخی موارد، در لیپیدها) کاتالیز میکنند. و فسفاتازها، پروتئینهایی که فسفاتها را از پروتئینها (یا لیپیدها) حذف میکنند. برخی از خانوادههای گیرنده بزرگتر خود کیناز هستند. گیرندههای تیروزین کیناز فسفوریلاسیون بر روی باقی ماندههای تیروزین روی گیرندههای مکمل را به دنبال اتصال لیگاند آغاز میکنند. گیرندههای سرین/ترئونین کیناز فسفوریلاسیون را روی سرینها یا ترئونینها در گیرندههای مکمل به دنبال اتصال لیگاند آغاز میکنند. گیرندههای سیتوکین مستقیماً با گروهی از پروتئین کینازها مرتبط هستند که به دنبال اتصال به سیتوکین فعال میشوند. از طرف دیگر، تغییرات پیام رسان دوم میتواند منجر به فسفوریلاسیون بیشتر در پایین دست در مسیر سیگنالینگ شود. بیش از 500 پروتئین کیناز توصیف شده است. برخی از موارد اصلی که در سیگنال دهی سلولی پستانداران مهم هستند در جدول 2-4 خلاصه شده است. به طور کلی افزودن گروههای فسفات باعث تغییر ساختار پروتئینها و تغییر عملکرد آنها و در نتیجه عملکرد سلول میشود. رابطه نزدیک بین فسفوریلاسیون و دفسفوریلاسیون پروتئینهای سلولی امکان کنترل موقت فعال شدن مسیرهای سیگنال دهی سلولی را فراهم میکند. گاهی اوقات از آن به عنوان “تایمر فسفات” یاد میشود. اختلال در تنظیم تایمر فسفات و متعاقب آن سیگنال دهی سلولی در یک سلول میتواند منجر به بیماری شود (باکس بالینی 2-7).
TABLE 2-4 Sample protein kinases.
جدول 2-4 نمونه پروتئین کیناز.

CAMP, cyclic adenosine 3′,5′-monophosphate; cGMP, cyclic guanosine
monophosphate; EGF, epidermal growth factor; M-CSF, monocyte colony-stimulating factor; PDGF, platelet-derived growth factor.
CAMP، آدنوزین حلقوی 3’،5′-مونوفسفات. cGMP، گوانوزین حلقوی
مونوفسفات؛ EGF، فاکتور رشد اپیدرمی؛ M-CSF، فاکتور محرک کلنی مونوسیت. PDGF، فاکتور رشد مشتق از پلاکت.
CLINICAL BOX 2.7
Kinases in Cancer: Chronic Myeloid Leukemia
Kinases frequently play important roles in regulating cellular physiology outcomes, including cell growth and cell death. Dysregulation of cell proliferation or cell death is a hallmark of cancer. Although cancer can have many causes, a role for kinase dysregulation is exemplified in chronic myeloid leukemia (CML). CML is a pluripotent hematopoietic stem cell disorder characterized by the Philadelphia (Ph) chromosome translocation. The Ph chromosome is formed following a translocation of chromosomes 9 and 22, resulting in a shortened chromosome 22 (Ph chromosome). At the point of fusion, a novel gene (bcr-abl) encoding the active tyrosine kinase domain from a gene on chromosome 9 (Abelson tyrosine kinase; c-Abl) is fused to novel regulatory region of a separate gene on chromosome 22 (breakpoint cluster region; bcr). The bcr-abl fusion gene encodes a cytoplasmic protein with constitutively active tyrosine kinase. The dysregulated kinase activity in bcr-abl protein effectively limits white blood cell death signaling pathways while promoting cell proliferation and genetic instability. Experimental models have shown that translocation to produce the fusion bcr-abl protein is sufficient to produce CML in animal models.
کادر بالینی 2.7
کینازها در سرطان: لوسمیمیلوئید مزمن
کینازها اغلب نقش مهمیدر تنظیم نتایج فیزیولوژی سلولی از جمله رشد سلولی و مرگ سلولی دارند. اختلال در تکثیر سلولی یا مرگ سلولی از علائم سرطان است. اگرچه سرطان میتواند دلایل زیادی داشته باشد، نقش اختلال تنظیم کیناز در لوسمیمیلوئیدی مزمن (CML) به عنوان مثال است. CML یک اختلال سلولهای بنیادی خونساز پرتوان است که با جابجایی کروموزوم فیلادلفیا (Ph) مشخص میشود. کروموزوم Ph به دنبال جابجایی کروموزومهای 9 و 22 تشکیل میشود و در نتیجه کروموزوم 22 کوتاه میشود (کروموزوم Ph). در نقطه همجوشی، یک ژن جدید (bcr-abl) که دامنه تیروزین کیناز فعال را از یک ژن روی کروموزوم 9 (آبلسون تیروزین کیناز؛ c-Abl) کد میکند، به ناحیه تنظیمکننده جدیدی از یک ژن جداگانه در کروموزوم 22 (منطقه خوشه نقطه شکست) ترکیب میشود. ژن همجوشی bcr-abl یک پروتئین سیتوپلاسمیبا تیروزین کیناز فعال را کد میکند. فعالیت کیناز نامنظم در پروتئین bcr-abl به طور موثر مسیرهای پیام رسانی مرگ گلبولهای سفید را محدود میکند و در عین حال تکثیر سلولی و بی ثباتی ژنتیکی را تقویت میکند. مدلهای تجربی نشان دادهاند که انتقال برای تولید پروتئین bcr-abl همجوشی برای تولید CML در مدلهای حیوانی کافی است.
THERAPEUTIC HIGHLIGHTS
The identification of bcr-abl as the initial transforming event in CML provided an ideal target for drug discovery. The drug imatinib was developed to specifically block the tyrosine kinase activity of the bcr-abl protein. Imatinib has proven to be an effective agent for treating chronic phase CML.
نکات برجسته درمانی
شناسایی bcr-abl به عنوان رویداد تبدیل اولیه در CML یک هدف ایده آل برای کشف دارو فراهم کرد. داروی ایماتینیب برای جلوگیری از فعالیت تیروزین کیناز پروتئین bcr-abl ساخته شد. ثابت شده است که ایماتینیب یک عامل موثر برای درمان فاز مزمن CML است.
STIMULATION OF TRANSCRIPTION
The activation of transcription, and subsequent translation, is a common outcome of cellular signaling. There are three distinct pathways for primary messengers to alter transcription of cells. First, as is the case with steroid or thyroid hormones, the primary messenger is able to cross the cell membrane and bind to a nuclear receptor, which then can directly interact with DNA to alter gene expression. A second pathway to gene transcription is the activation of cytoplasmic protein kinases that can move to the nucleus to phosphorylate a latent transcription factor for activation. This pathway is a common end point of signals that go through the mitogen-activated protein (MAP) kinase cascade. MAP kinases can be activated following a variety of receptor-ligand interactions through second messenger signaling. They comprise a series of three kinases that coordinate a stepwise phosphorylation to activate each protein in series in the cytosol. Phosphorylation of the last MAP kinase in series allows it to migrate to the nucleus where it phosphorylates a latent transcription factor. A third common pathway is the activation of a latent transcription factor in the cytosol, which then migrates to the nucleus and alters transcription. This pathway is shared by a diverse set of transcription factors that include nuclear factor kappa B (NF-κB; activated following tumor necrosis family receptor binding and others) and signal transducers of activated transcription (STATs; activated following cytokine receptor binding). In all cases, the binding of the activated transcription factor to DNA increases (or in some cases, decreases) the transcription of mRNAs encoded by the gene to which it binds. The mRNAs are translated in the ribosomes, with the production of increased quantities of proteins that alter cell function.
تحریک رونویسی
فعالسازی رونویسی و ترجمه بعدی، یک نتیجه رایج سیگنالدهی سلولی است. سه مسیر مجزا برای پیام رسانهای اولیه برای تغییر رونویسی سلولها وجود دارد. اول، مانند هورمونهای استروئیدی یا تیروئیدی، پیام رسان اولیه قادر است از غشای سلولی عبور کند و به گیرنده هسته ای متصل شود، که سپس میتواند مستقیماً با DNA تعامل کند و بیان ژن را تغییر دهد. مسیر دوم برای رونویسی ژن، فعال شدن پروتئین کینازهای سیتوپلاسمیاست که میتوانند به سمت هسته حرکت کنند تا یک فاکتور رونویسی پنهان را برای فعال شدن فسفریله کنند. این مسیر نقطه پایانی مشترک سیگنالهایی است که از طریق آبشار کیناز پروتئین فعال شده با میتوژن (MAP) میگذرد. MAP کینازها را میتوان به دنبال انواع برهمکنشهای گیرنده-لیگاند از طریق سیگنال دهی پیام رسان دوم فعال کرد. آنها شامل یک سری از سه کیناز هستند که فسفوریلاسیون گام به گام را برای فعال کردن هر پروتئین به صورت سری در سیتوزول هماهنگ میکنند. فسفوریلاسیون آخرین MAP کیناز سری به آن اجازه میدهد تا به هسته مهاجرت کند، جایی که یک فاکتور رونویسی نهفته را فسفریله میکند. سومین مسیر رایج، فعال شدن یک فاکتور رونویسی نهفته در سیتوزول است که سپس به هسته مهاجرت میکند و رونویسی را تغییر میدهد. این مسیر توسط مجموعه متنوعی از فاکتورهای رونویسی مشترک است که شامل فاکتور هستهای کاپا B (NF-kB؛ فعال شده به دنبال اتصال گیرنده خانواده نکروز تومور و موارد دیگر) و مبدلهای سیگنال رونویسی فعال (STATs؛ فعال شده به دنبال اتصال گیرنده سیتوکین) است. در همه موارد، اتصال فاکتور رونویسی فعال شده به DNA، رونویسی mRNAهای کدگذاری شده توسط ژنی را که به آن متصل میشود، افزایش میدهد (یا در برخی موارد کاهش میدهد). mRNAها در ریبوزومها ترجمه میشوند و مقادیر بیشتری از پروتئینها تولید میشوند که عملکرد سلول را تغییر میدهند.
INTRACELLULAR CA2+ AS A SECOND MESSENGER
Ca2+ regulates a very large number of physiological processes that are as diverse as proliferation, neural signaling, learning, contraction, secretion, and fertilization, so regulation of intracellular Ca2+ is of great importance. The free Ca2+ concentration in the cytoplasm at rest is maintained at about 100 nmol/L. The Ca2+ concentration in the interstitial fluid is about 12,000 to 18,000 times the cytoplasmic concentration (ie, 1,200,000 to 1,8,00,000 nmol/L), so there is a marked inwardly directed concentration gradient as well as an inwardly directed electrical gradient. Much of the intracellular Ca2+ is stored at relatively high concentrations in the endoplasmic reticulum (approximately 100,000 to 1,200,000 nmol/L) and other organelles (Figure 2-22), and these organelles provide a store from which Ca2+ can be mobilized via ligand-gated channels in the endoplasmic reticulum (eg, ryanodine receptors and inositol trisphosphate receptors) to increase the concentration of free Ca2+ in the cytoplasm. Increased cytoplasmic Ca2+ binds to and activates calcium-binding proteins. These proteins can have direct effects in cellular physiology, or can activate other proteins, commonly protein kinases, to further cell signaling pathways.
+Ca2 داخل سلولی به عنوان پیام رسان دوم
+Ca2 تعداد بسیار زیادی از فرآیندهای فیزیولوژیکی را تنظیم میکند که به اندازه تکثیر، سیگنال دهی عصبی، یادگیری، انقباض، ترشح و لقاح متنوع هستند، بنابراین تنظیم +Ca2 داخل سلولی از اهمیت بالایی برخوردار است. غلظت +Ca2 آزاد در سیتوپلاسم در حالت استراحت در حدود 100 نانومول در لیتر حفظ میشود. غلظت +Ca2 در مایع بینابینی حدود 12000 تا 18000 برابر غلظت سیتوپلاسمیاست (یعنی 1200000 تا 1800000 nmol/L)، بنابراین یک گرادیان غلظت مستقیم به داخل و همچنین یک گرادیان الکتریکی مستقیم وجود دارد. بیشتر +Ca2 داخل سلولی در غلظتهای نسبتاً بالا در شبکه آندوپلاسمی(تقریباً 100000 تا 1200000 نانومول بر لیتر) و سایر اندامکها (شکل 2-22) ذخیره میشود و این اندامکها ذخیرهای را فراهم میکنند که از آن میتوان +Ca2 را در کانالهای داخل پلاسمیک از طریق کانالهای داخلی پلاسمیک متحرک کرد. گیرندههای رایانودین و گیرندههای اینوزیتول تری فسفات) برای افزایش غلظت+Ca2 آزاد در سیتوپلاسم. افزایش +Ca2 سیتوپلاسمیبه پروتئینهای متصل شونده به کلسیم متصل میشود و آنها را فعال میکند. این پروتئینها میتوانند اثرات مستقیمیدر فیزیولوژی سلولی داشته باشند یا میتوانند پروتئینهای دیگر، معمولاً پروتئین کینازها را برای ادامه مسیرهای سیگنالدهی سلولی فعال کنند.

FIGURE 2-22 Ca2+ handling in mammalian cells. Ca2+ can enter the cell via a variety of channel types. In addition, Ca2+ is stored in the endoplasmic reticulum (and, to a lesser extent in the mitochondrion) where it can be released to alter free Ca2+ concentration in the cytoplasm. Free Ca2+ can be bound by proteins that then have a variety of downstream physiologic effects. Ca2+ can be removed from the cytoplasm by ATPases in the endoplasmic reticulum or at the plasma membrane, or via Na, Ca exchangers (not shown).
شکل 2-22 جابجایی Ca2+ در سلولهای پستانداران. +Ca2 میتواند از طریق انواع کانال وارد سلول شود. علاوه بر این، +Ca2 در شبکه آندوپلاسمی(و به میزان کمتری در میتوکندری) ذخیره میشود، جایی که میتواند برای تغییر غلظت +Ca2 آزاد در سیتوپلاسم آزاد شود. +Ca2 آزاد میتواند توسط پروتئینهایی متصل شود که سپس اثرات فیزیولوژیکی پایین دستی دارند. +Ca2 را میتوان توسط ATPaseها در شبکه آندوپلاسمییا غشای پلاسمایی یا از طریق مبدلهای Na و Ca (که نشان داده نشده است) از سیتوپلاسم خارج کرد.
Ca2+ can enter the cell from the ECF, down its electrochemical gradient, through many different Ca2+ channels. Some of these are ligand-gated and others are voltage-gated. Stretch-activated channels exist in some cells as well.
+Ca2 میتواند از طریق بسیاری از کانالهای +Ca2 از ECF، پایین گرادیان الکتروشیمیایی آن، وارد سلول شود. برخی از اینها دارای دروازه لیگاند و برخی دیگر دارای ولتاژ هستند. کانالهای فعال شده با کشش در برخی سلولها نیز وجود دارد.
Many second messengers act by increasing the cytoplasmic Ca2+ concentration. The increase is produced by releasing Ca2+ from intracellular stores—primarily the endoplasmic reticulum—or by increasing the entry of Ca2+into cells, or by both mechanisms. IP3 is the major second messenger that causes Ca2+ release from the endoplasmic reticulum through the direct activation of a ligand-gated channel, the IP3 receptor. In effect, the generation of one second messenger (IP3) can lead to the release of another second messenger (Ca2+). In many tissues, transient release of Ca2+ from internal stores into the cytoplasm triggers opening of a population of Ca2+ channels in the cell membrane (store- operated Ca2+ channels; SOCCs). The resulting Ca2+ influx replenishes the total intracellular Ca2+ supply and refills the endoplasmic reticulum. Recent research has identified the physical relationships between SOCCS (eg, Orai channels) and regulatory interactions of proteins (eg, stromal interaction molecules 1 and 2) from the endoplasmic reticulum that facilitate the recruitment of Orai to form SOCCS.
بسیاری از پیام رسانهای دوم با افزایش غلظت +Ca2 سیتوپلاسمیعمل میکنند. این افزایش با آزادسازی +Ca2 از ذخایر درون سلولی – عمدتاً شبکه آندوپلاسمی- یا با افزایش ورود +Ca2 به داخل سلولها یا هر دو مکانیسم ایجاد میشود. IP3 دومین پیام رسان اصلی است که از طریق فعال سازی مستقیم یک کانال دردار لیگاند، گیرنده IP3، باعث آزاد شدن +Ca2 از شبکه آندوپلاسمیمیشود. در واقع، تولید یک پیام رسان دوم (IP3) میتواند منجر به انتشار پیام رسان دوم دیگر (+Ca2) شود. در بسیاری از بافتها، انتشار گذرای +Ca2 از ذخایر داخلی به داخل سیتوپلاسم باعث باز شدن جمعیتی از کانالهای +Ca2 در غشای سلولی میشود (کانالهای +Ca2 ذخیرهسازی شده؛ SOCCs). هجوم +Ca2 حاصل، کل منبع +Ca2 داخل سلولی را دوباره پر میکند و شبکه آندوپلاسمیرا دوباره پر میکند. تحقیقات اخیر روابط فیزیکی بین SOCCS (به عنوان مثال، کانالهای Orai) و برهمکنشهای تنظیمیپروتئینها (به عنوان مثال، مولکولهای برهمکنش استرومایی 1 و 2) از شبکه آندوپلاسمیرا شناسایی کردهاند که بهکارگیری Orai برای تشکیل SOCCS را تسهیل میکند.
As with other second messenger molecules, the increase in Ca2+ within the cytosol is rapid, and is followed by a rapid decrease. Because the movement of Ca2+ outside of the cytosol (ie, across the plasma membrane or the membrane of the internal store) requires that it move up its electrochemical gradient, it requires energy. Ca2+ movement out of the cell is facilitated by the plasma membrane Ca2+ ATPase. Alternatively, it can be transported by an antiport (ie, Na+/Ca2+ exchanger) that exchanges three Na+ for each Ca2+ driven by the energy stored in the Na* electrochemical gradient. Ca2+ movement into the internal stores is through the action of the sarcoplasmic or endoplasmic reticulum Ca2+ ATPase, also known as the SERCA pump.
مانند سایر مولکولهای پیام رسان دوم، افزایش +Ca2 در سیتوزول سریع است و به دنبال آن کاهش سریعی دارد. از آنجایی که حرکت +Ca2 در خارج از سیتوزول (یعنی در سراسر غشای پلاسمایی یا غشای ذخیره داخلی) مستلزم حرکت آن به سمت گرادیان الکتروشیمیایی خود است، به انرژی نیاز دارد. حرکت +Ca2 به خارج از سلول توسط غشای پلاسمایی +Ca2 ATPase تسهیل میشود. از طرف دیگر، میتوان آن را توسط یک ضد پورت (یعنی مبدل +Na+/Ca2) که سه +Na برای هر +Ca2 رانده شده توسط انرژی ذخیرهشده در گرادیان الکتروشیمیایی +Na تبادل میکند. حرکت +Ca2 به ذخایر داخلی از طریق عمل شبکه سارکوپلاسمییا آندوپلاسمیCa2+ ATPase که به پمپ SERCA نیز معروف است، انجام میشود.
CALCIUM-BINDING PROTEINS
Many different Ca2+-binding proteins have been described, including troponin, calmodulin, and calbindin. Troponin is the Ca2+-binding protein involved in contraction of skeletal muscle (Chapter 5). Calmodulin contains 148 amino acid residues (Figure 2-23) and has four Ca2+-binding domains. It is unique in that amino acid residue 115 is trimethylated, and it is extensively conserved, being found in plants as well as animals. When calmodulin binds Ca2+, it is capable of activating five different calmodulin-dependent kinases (CaMKs; Table 2—4), among other proteins. One of the kinases is myosin light-chain kinase, which phosphorylates myosin. This brings about contraction in smooth muscle. CaMKI and CaMKII are concerned with synaptic function, and CaMKIII is concerned with protein synthesis. Another calmodulin-activated protein is calcineurin, a phosphatase that inactivates Ca2+ channels by dephosphorylating them. It also plays a prominent role in activating T cells and is inhibited by some immunosuppressants.
پروتئینهای اتصال دهنده کلسیم
بسیاری از پروتئینهای متصل شونده +Ca2 توصیف شده اند، از جمله تروپونین، کالمودولین و کالبیندین. تروپونین پروتئین متصل شونده به +Ca2 است که در انقباض ماهیچههای اسکلتی نقش دارد (فصل 5). کالمودولین حاوی 148 باقیمانده اسید آمینه است (شکل 2-23) و دارای چهار حوزه اتصال Ca2+ است. این منحصر به فرد است که باقی مانده اسید آمینه 115 تری متیله است و به طور گسترده ای حفظ میشود و در گیاهان و همچنین حیوانات یافت میشود. هنگامیکه کالمودولین به +Ca2 متصل میشود، میتواند پنج کیناز مختلف وابسته به کالمودولین (CaMKs؛ جدول 2-4) را در میان سایر پروتئینها فعال کند. یکی از کینازها میوزین کیناز زنجیره سبک است که میوزین را فسفریله میکند. این باعث انقباض عضلات صاف میشود. CaMKI و CaMKII با عملکرد سیناپسی و CaMKIII مربوط به سنتز پروتئین است. یکی دیگر از پروتئینهای فعال شده با کالمودولین، کلسینورین است، یک فسفاتاز که کانالهای +Ca2 را با فسفریله کردن آنها غیرفعال میکند. همچنین نقش برجسته ای در فعال کردن سلولهای T ایفا میکند و توسط برخی از سرکوب کنندههای ایمنی مهار میشود.

FIGURE 2-23 Secondary structure of calmodulin from bovine brain. Single-letter abbreviations are used for the amino acid residues. Note the four calcium domains (purple residues) flanked on either side by stretches of amino acids that form a-helices in tertiary structure. (Reproduced with permission from Cheung WY: Calmodulin: An overview. Fed Proc 1982;May;41(7):2253-2257.)
شکل 2-23 ساختار ثانویه کالمودولین از مغز گاو. اختصارات تک حرفی برای باقی مانده اسید آمینه استفاده میشود. به چهار حوزه کلسیمی(بقایای ارغوانی) توجه کنید که در دو طرف با امتدادی از اسیدهای آمینه قرار دارند که مارپیچهای a را در ساختار سوم تشکیل میدهند. (تکثیر شده با اجازه Cheung WY: Calmodulin: An Overview. Fed Proc 1982; May; 41(7):2253-2257.)
MECHANISMS OF DIVERSITY OF Ca2+ ACTIONS
It may seem difficult to understand how intracellular Ca2+ can have so many varied effects as a second messenger. Part of the explanation is that Ca2+ may have different effects at low and at high concentrations. The ion may be at high concentration at the site of its release from an organelle or a channel (Ca2+ sparks) and at a subsequent lower concentration after it diffuses throughout the cell. Some of the changes it produces can outlast the rise in intracellular Ca2+ concentration because of the way it binds to some of the Ca2+-binding proteins. In addition, once released, intracellular Ca2+ concentrations frequently oscillate at regular intervals, and there is evidence that the frequency and, to a lesser extent, the amplitude of those oscillations codes information for effector mechanisms. Finally, increases in intracellular Ca2+ concentration can spread from cell to cell in waves, producing coordinated events such as the rhythmic beating of cilia in airway epithelial cells.
مکانیسمهای تنوع فعالیتهای +Ca2
ممکن است درک این که چگونه +Ca2 درون سلولی میتواند اثرات متنوعی به عنوان پیام رسان دوم داشته باشد دشوار به نظر برسد. بخشی از توضیح این است که +Ca2 ممکن است اثرات متفاوتی در غلظتهای کم و بالا داشته باشد. یون ممکن است در محل رها شدن از اندامک یا کانال (جرقههای +Ca2) غلظت بالایی داشته باشد و پس از انتشار در سراسر سلول، غلظت آن کمتر باشد. برخی از تغییراتی که تولید میکند میتواند از افزایش غلظت +Ca2 داخل سلولی بهدلیل نحوه اتصال آن به برخی از پروتئینهای متصلشونده +Ca2، دوام بیشتری داشته باشد. علاوه بر این، پس از آزاد شدن، غلظتهای +Ca2 درون سلولی اغلب در فواصل منظم نوسان میکنند، و شواهدی وجود دارد که فرکانس و، تا حدی کمتر، دامنه این نوسانات، اطلاعات مکانیسمهای اثرگذار را کد میکند. در نهایت، افزایش غلظت +Ca2 داخل سلولی میتواند از سلولی به سلول دیگر در امواج پخش شود و رویدادهای هماهنگی مانند ضربان ریتمیک مژکها در سلولهای اپیتلیال راه هوایی ایجاد کند.
G-PROTEINS
A common way to translate a signal to a biological effect inside cells is by way of nucleotide regulatory proteins that are activated after binding GTP (G- proteins). When an activating signal reaches a G-protein, the protein exchanges GDP for GTP. The GTP-protein complex brings about the activating effect of the G-protein. The inherent GTPase activity of the protein then converts GTP to GDP, restoring the G-protein to an inactive resting state. G-proteins can be divided into two principal groups involved in cell signaling: small G-proteins and heterotrimeric G-proteins. Other groups that have similar regulation and are also important to cell physiology include elongation factors, dynamin, and translocation GTPases.
G-پروتئینها
یک راه رایج برای ترجمه سیگنال به یک اثر بیولوژیکی در داخل سلولها از طریق پروتئینهای تنظیم کننده نوکلئوتیدی است که پس از اتصال GTP (پروتئینهای G-) فعال میشوند. هنگامیکه یک سیگنال فعال کننده به یک پروتئین G میرسد، پروتئین GDP را با GTP مبادله میکند. کمپلکس GTP-protein اثر فعال کننده G-protein را به همراه دارد. فعالیت ذاتی GTPase پروتئین سپس GTP را به GDP تبدیل میکند و پروتئین G را به حالت استراحت غیرفعال باز میگرداند. پروتئینهای G را میتوان به دو گروه اصلی درگیر در سیگنالدهی سلولی تقسیم کرد: پروتئینهای G کوچک و پروتئینهای G هتروتریمر. گروههای دیگری که تنظیم مشابهی دارند و همچنین برای فیزیولوژی سلولی مهم هستند عبارتند از عوامل افزایش طول، دینامین و GTPases انتقال.
There are several different families of small G-proteins (or small GTPases) that are all highly regulated. GTPase activating proteins (GAPs) tend to inactivate small G-proteins by encouraging hydrolysis of GTP to GDP in the central binding site. Guanine exchange factors (GEFs) tend to activate small G-proteins by encouraging exchange of GDP for GTP in the active site. Some of the small G-proteins contain lipid modifications that help anchor them to membranes, while others are free to diffuse throughout the cytosol. Small G- proteins are involved in many cellular functions. Members of the Rab family regulate the rate of vesicle traffic between the endoplasmic reticulum, the Golgi apparatus, lysosomes, endosomes, and the cell membrane. Another family of small GTP-binding proteins, the Rho/Rac family, mediates interactions between the cytoskeleton and cell membrane. The Ras family regulates growth by transmitting signals from the cell membrane to the nucleus.
چندین خانواده مختلف از پروتئینهای G کوچک (یا GTPaseهای کوچک) وجود دارد که همگی به شدت تنظیم شده اند. پروتئینهای فعال کننده GTPase (GAPs) با تشویق هیدرولیز GTP به GDP در محل اتصال مرکزی، پروتئینهای کوچک G را غیرفعال میکنند. فاکتورهای تبادل گوانین (GEFs) تمایل به فعال کردن پروتئینهای G کوچک با تشویق تبادل GDP برای GTP در سایت فعال دارند. برخی از پروتئینهای G کوچک حاوی تغییرات چربی هستند که به لنگر انداختن آنها به غشاها کمک میکند، در حالی که برخی دیگر آزادانه در سراسر سیتوزول پخش میشوند. پروتئینهای کوچک G در بسیاری از عملکردهای سلولی نقش دارند. اعضای خانواده Rab میزان ترافیک وزیکول بین شبکه آندوپلاسمی، دستگاه گلژی، لیزوزومها، اندوزومها و غشای سلولی را تنظیم میکنند. خانواده دیگری از پروتئینهای کوچک متصل شونده به GTP، خانواده Rho/Rac، واسطه برهمکنش بین اسکلت سلولی و غشای سلولی است. خانواده Ras با انتقال سیگنال از غشای سلولی به هسته، رشد را تنظیم میکند.
Another family of G-proteins, the larger heterotrimeric G-proteins, couple cell surface receptors to catalytic units that catalyze the intracellular formation of second messengers or couple the receptors directly to ion channels. Despite the knowledge of the small G-proteins described above, the heteromeric G-proteins are frequently referred to in the shortened “G-protein” form because they were the first to be identified. Heterotrimeric G-proteins are made up of three subunits designated a, ẞ, and y (Figure 2-24). Both the a and the y subunits have lipid modifications that anchor these proteins to the plasma membrane. The a subunit is bound to GDP. When a ligand binds to a G-protein-coupled receptor (GPCR, discussed below), this GDP is exchanged for GTP and the a subunit separates from the combined ẞ and y subunits. The separated a subunit brings about many biologic effects. The ẞ and y subunits are tightly bound in the cell and together form a signaling molecule that can also activate a variety of effectors. The intrinsic GTPase activity of the a subunit then converts GTP to GDP, and this leads to reassociation of the a with the ẞy subunit and termination of effector activation. The GTPase activity of the a subunit can be accelerated by a family of regulators of G-protein signaling (RGS).
خانواده دیگری از پروتئینهای G، پروتئینهای G هتروتریمری بزرگتر، گیرندههای سطح سلولی را به واحدهای کاتالیزوری جفت میکنند که تشکیل پیامرسان دوم درون سلولی را کاتالیز میکنند یا گیرندهها را مستقیماً به کانالهای یونی متصل میکنند. علیرغم آگاهی از پروتئینهای G کوچک که در بالا توضیح داده شد، پروتئینهای G هترومریک اغلب به شکل کوتاه شده «پروتئین G» نامیده میشوند، زیرا اولین کسانی بودند که شناسایی شدند. پروتئینهای G هتروتریمر از سه زیر واحد به نامهای a، ẞ و y تشکیل شده اند (شکل 2-24). هر دو زیر واحد a و y دارای تغییرات چربی هستند که این پروتئینها را به غشای پلاسما متصل میکند. زیر واحد a به تولید ناخالص داخلی محدود میشود. هنگامیکه یک لیگاند به یک گیرنده جفت شده با پروتئین G (GPCR که در زیر مورد بحث قرار گرفته است) متصل میشود، این تولید ناخالص داخلی با GTP مبادله میشود و زیرواحد a از زیر واحدهای ترکیبی ẞ و y جدا میشود. زیرواحد جدا شده اثرات بیولوژیکی زیادی به همراه دارد. زیرواحدهای ẞ و y به شدت در سلول متصل هستند و با هم یک مولکول سیگنالی را تشکیل میدهند که میتواند انواع مختلفی از عوامل را نیز فعال کند. فعالیت ذاتی GTPase زیر واحد a سپس GTP را به GDP تبدیل میکند و این منجر به ارتباط مجدد a با زیرواحد ẞy و خاتمه فعال سازی اثرگذار میشود. فعالیت GTPase زیرواحد a را میتوان توسط خانواده ای از تنظیم کنندههای سیگنالینگ پروتئین G (RGS) تسریع کرد.

FIGURE 2–24 Heterotrimeric G-proteins. Top: Summary of overall reaction that occurs in the Ga subunit. Bottom: When the ligand (red oval) binds to the G-protein-coupled receptor in the cell membrane, GTP replaces GDP on the a subunit. GTP-a separates from the ẞy subunit and GTP-a and ẞy both activate various effectors, producing physiologic effects. The intrinsic GTPase activity of GTP-a then converts GTP to GDP, and the a, ẞ, and y subunits reassociate.
شکل 2-24 پروتئینهای G هتروتریمری. بالا: خلاصه ای از واکنش کلی که در زیر واحد Ga رخ میدهد. پایین: وقتی لیگاند (بیضی قرمز) به گیرنده جفت شده با پروتئین G در غشای سلولی متصل میشود، GTP جایگزین GDP در زیر واحد a میشود. GTP-a از زیر واحد ẞy جدا میشود و GTP-a و ẞy هر دو عوامل مختلف را فعال میکنند و اثرات فیزیولوژیکی ایجاد میکنند. فعالیت ذاتی GTPase GTP-a سپس GTP را به GDP تبدیل میکند و زیرواحدهای a، ẞ و y دوباره مرتبط میشوند.
Heterotrimeric G-proteins relay signals from over 1000 GPCRs, and their effectors in the cells include ion channels and enzymes. There are 20 a, 6 ẞ, and 12 y genes, which allow for over 1400 a, ẞ, and y combinations. Not all combinations occur in the cell, but over 20 different heterotrimeric G-proteins have been well documented in cell signaling. They can be divided into five families, each with a relatively characteristic set of effectors.
پروتئینهای G هتروتریمر سیگنالهای بیش از 1000 GPCR را رله میکنند و عوامل مؤثر آنها در سلولها شامل کانالهای یونی و آنزیمها هستند. 20 ژن a، 6 و 12 y وجود دارد که بیش از 1400 ترکیب a، ẞ و y را امکان پذیر میکند. همه ترکیبات در سلول رخ نمیدهند، اما بیش از 20 پروتئین G هتروتریمری مختلف به خوبی در سیگنالدهی سلولی ثبت شدهاند. آنها را میتوان به پنج خانواده تقسیم کرد که هر کدام دارای مجموعه نسبتاً مشخصی از عوامل مؤثر هستند.
G-PROTEIN-COUPLED RECEPTORS
All the GPCRs that have been characterized to date are proteins that span the cell membrane seven times. Because of this structure they are alternatively referred to as seven-helix receptors or serpentine receptors. A very large number have been cloned, and their functions are multiple and diverse. This is emphasized by the extensive variety of ligands that target GPCRs (Table 2-5). The structures of four GPCRs are shown in Figure 2-25. These receptors assemble into a barrel-like structure. Upon ligand binding, a conformational change activates a resting heterotrimeric G-protein associated with the cytoplasmic leaf of the plasma membrane. Activation of a single receptor can result in 1, 10, or more active heterotrimeric G-proteins, providing amplification as well as transduction of the first messenger. Bound receptors can be inactivated to limit the amount of cellular signaling. This frequently occurs through phosphorylation of the cytoplasmic side of the receptor. Because of their diversity and importance in cellular signaling pathways, GPCRs are prime targets for drug discovery (Clinical Box 2-8).
گیرندههای جفت شده با پروتئین G
تمام GPCRهایی که تا به امروز مشخص شده اند، پروتئینهایی هستند که هفت بار غشای سلولی را پوشش میدهند. به دلیل این ساختار، آنها را به عنوان گیرندههای هفت مارپیچ یا گیرندههای سرپانتین مینامند. تعداد بسیار زیادی شبیه سازی شده اند و عملکردهای آنها متعدد و متنوع است. این مورد توسط انواع گسترده لیگاندهایی که GPCRs را هدف قرار میدهند (جدول 2-5) تاکید میشود. ساختار چهار GPCR در شکل 2-25 نشان داده شده است. این گیرندهها در یک ساختار بشکه مانند جمع میشوند. پس از اتصال لیگاند، یک تغییر ساختاری یک پروتئین G هتروتریمری در حال استراحت مرتبط با برگ سیتوپلاسمیغشای پلاسمایی را فعال میکند. فعال شدن یک گیرنده منفرد میتواند منجر به 1، 10 یا بیشتر پروتئین G هتروتریمری فعال شود که باعث تقویت و همچنین انتقال اولین پیام رسان میشود. گیرندههای محدود را میتوان غیرفعال کرد تا میزان سیگنال دهی سلولی را محدود کند. این اغلب از طریق فسفوریلاسیون سمت سیتوپلاسمیگیرنده رخ میدهد. به دلیل تنوع و اهمیت آنها در مسیرهای سیگنالینگ سلولی، GPCRها اهداف اصلی برای کشف دارو هستند (باکس بالینی 2-8).
TABLE 2-5 Examples of ligands for G-protein-coupled receptors.
جدول 2-5 نمونههایی از لیگاندهای گیرندههای جفت شده با پروتئین G.

FSH, follicle-stimulating hormone; GRP, gastrin-releasing hormone; hCG, human chorionic gonadotropin; LH, luteinizing hormone; PTH, parathyroid hormone; TRH, thyrotropin-releasing hormone; TSH, thyroid-stimulating hormone; VIP, vasoactive intestinal peptide.
FSH، هورمون محرک فولیکول؛ GRP، هورمون آزاد کننده گاسترین؛ hCG، گنادوتروپین جفتی انسانی؛ LH، هورمون لوتئینه کننده؛ PTH، هورمون پاراتیروئید؛ TRH، هورمون آزاد کننده تیروتروپین؛ TSH، هورمون محرک تیروئید؛ VIP، پپتید وازواکتیو روده ای.

FIGURE 2-25 Representative structures of four G-protein-coupled receptors from solved crystal structures. Each group of receptors is represented by one structure, all rendered with the same orientation and color scheme: transmembrane helices are colored light blue, intracellular regions are colored darker blue, and extracellular regions are brown. Each ligand is colored orange and rendered as sticks, bound lipids are colored yellow, and the conserved tryptophan residue is rendered as spheres and colored green. This figure highlights the observed differences seen in the extracellular and intracellular domains as well as the small differences seen in the ligand binding orientations among the four GPCRs various ligands. (Reproduced with permission from Hanson MA, Stevens RC: Discovery of new GPCR biology: one receptor structure at a time. Structure 1988;Jan 14;17(1):8-14.)
شکل 2-25 ساختارهای معرف چهار گیرنده جفت شده با پروتئین G از ساختارهای کریستالی حل شده. هر گروه از گیرندهها با یک ساختار نشان داده میشوند که همگی با جهتگیری و طرح رنگ یکسان ارائه میشوند: مارپیچهای گذرنده به رنگ آبی روشن، مناطق درون سلولی به رنگ آبی تیرهتر و مناطق خارج سلولی قهوهای هستند. هر لیگاند نارنجی رنگ میشود و به صورت چوب در میآید، لیپیدهای محدود شده زرد رنگ میشوند و باقی مانده تریپتوفان حفظ شده به صورت کروی و سبز رنگ میشود. این شکل، تفاوتهای مشاهدهشده در حوزههای خارج سلولی و درون سلولی و همچنین تفاوتهای کوچکی را که در جهتگیری اتصال لیگاند در میان چهار لیگاند مختلف GPCR مشاهده میشود، نشان میدهد. (تکثیر شده با اجازه Hanson MA، Stevens RC: کشف بیولوژی جدید GPCR: یک ساختار گیرنده در یک زمان. ساختار 1988؛ ژانویه 14؛ 17 (1): 8-14.)
CLINICAL BOX 2-8
Drug Development: Targeting the G-Protein-Coupled Receptors (GPCRs)
GPCRs are among the most heavily investigated drug targets in the pharmaceutical industry, representing approximately 40% of all the drugs in the marketplace today. These proteins are active in just about every organ system and present a wide range of opportunities as therapeutic targets in areas including cancer, cardiac dysfunction, diabetes, central nervous system disorders, obesity, inflammation, and pain. Features of GPCRs that allow them to be drug targets are their specificity in recognizing extracellular ligands to initiate cellular response, the cell surface location of GPCRs that make them accessible to novel ligands or drugs, and their prevalence in leading to human pathology and disease.
کادر بالینی 2-8
توسعه دارو: هدف قرار دادن گیرندههای جفت شده با پروتئین G (GPCR)
GPCRها یکی از مهمترین اهداف دارویی هستند که در صنعت داروسازی مورد بررسی قرار گرفته اند و تقریباً 40٪ از کل داروهای موجود در بازار امروز را تشکیل میدهند. این پروتئینها تقریباً در هر سیستم اندامیفعال هستند و طیف وسیعی از فرصتها را به عنوان اهداف درمانی در زمینههایی از جمله سرطان، اختلال عملکرد قلبی، دیابت، اختلالات سیستم عصبی مرکزی، چاقی، التهاب و درد ارائه میدهند. ویژگیهای GPCR که به آنها اجازه میدهد تا اهداف دارویی باشند، ویژگی آنها در تشخیص لیگاندهای خارج سلولی برای شروع پاسخ سلولی، محل سطح سلولی GPCRها است که آنها را برای لیگاندها یا داروهای جدید در دسترس قرار میدهد، و شیوع آنها در منجر به آسیبشناسی و بیماریهای انسانی.
Specific examples of successful GPCR drug targets are noted with two types of histamine receptors.
نمونههای خاصی از اهداف دارویی موفق GPCR با دو نوع گیرنده هیستامین ذکر شده است.
Histamine-1 receptor (H1-receptor) antagonists: allergy therapy. Allergens can trigger local mast cells or basophils to release histamine in the airway. A primary target for histamine is the H1-receptor in several airway cell types and this can lead to transient itching, sneezing, rhinorrhea, and nasal congestion. There are a variety of medications with improved peripheral H1-receptor selectivity that are currently used to block histamine activation of the H1-receptor and thus limit allergen effects in the upper airway. H1- receptor antagonists on the market include loratadine, fexofenadine, cetirizine, and desloratadine. These “second” and “third” generation medications have improved specificity and reduced adverse side effects (eg, drowsiness and central nervous system dysfunction) associated with some of the “first” generation drugs first introduced in the late 1930s and widely developed over the next 40 years.
آنتاگونیستهای گیرنده هیستامین-1 (گیرنده H1): درمان آلرژی. آلرژنها میتوانند ماست سلهای موضعی یا بازوفیلها را تحریک کنند تا هیستامین را در راه هوایی آزاد کنند. هدف اولیه برای هیستامین، گیرنده H1 در چندین نوع سلول راه هوایی است و این میتواند منجر به خارش گذرا، عطسه، رینوره و احتقان بینی شود. انواع مختلفی از داروها با انتخاب پذیری گیرنده H1 محیطی بهبود یافته وجود دارد که در حال حاضر برای جلوگیری از فعال شدن گیرنده H1 توسط هیستامین و در نتیجه محدود کردن اثرات آلرژن در راه هوایی فوقانی استفاده میشود. آنتاگونیستهای گیرنده H1 موجود در بازار عبارتند از: لوراتادین، فکسوفنادین، ستیریزین و دسلوراتادین. این داروهای نسل دوم و “سوم” ویژگی را بهبود بخشیده و عوارض جانبی جانبی (مانند خواب آلودگی و اختلال در عملکرد سیستم عصبی مرکزی) مرتبط با برخی از داروهای نسل اول را که برای اولین بار در اواخر دهه 1930 معرفی شدند و به طور گسترده در 40 سال آینده توسعه یافتند، بهبود بخشیده اند.
Histamine-2 receptor (H2-receptor) antagonists: treating excess stomach acid. Excess stomach acid can result in gastroesophageal reflux disease or even peptic ulcer symptoms. The parietal cell in the stomach can be stimulated to produce acid via histamine action at the H2-receptor. Excess stomach acid results in heartburn. Antagonists or H2-receptor blockers, reduce acid production by preventing H2-receptor signaling that leads to production of stomach acid. There are several drugs (eg, ranitidine, famotidine, cimetidine, and nizatidine) that specifically block the H2-receptor and thus reduce excess acid production.
آنتاگونیستهای گیرنده هیستامین-2 (گیرنده H2): درمان اسید اضافی معده. اسید معده اضافی میتواند منجر به بیماری ریفلاکس معده یا حتی علائم زخم معده شود. سلول جداری معده را میتوان از طریق عملکرد هیستامین در گیرنده H2 برای تولید اسید تحریک کرد. اسید زیاد معده باعث سوزش سر دل میشود. آنتاگونیستها یا مسدود کنندههای گیرنده H2، با جلوگیری از سیگنال دهی گیرنده H2 که منجر به تولید اسید معده میشود، تولید اسید را کاهش میدهند. چندین دارو وجود دارد (مانند رانیتیدین، فاموتیدین، سایمتیدین و نیزاتیدین) که به طور خاص گیرنده H2 را مسدود میکنند و بنابراین تولید اسید اضافی را کاهش میدهند.
INOSITOL TRISPHOSPHATE & DIACYLGLYCEROL AS SECOND MESSENGERS
The link between membrane binding of a ligand that acts via Ca2+ and the prompt increase in the cytoplasmic Ca2+ concentration is often IP3. When one of these ligands binds to its receptor, activation of the receptor produces activation of phospholipase C (PLC) on the inner surface of the membrane. Ligands bound to GPCR can do this through the G, heterotrimeric G-proteins, while ligands bound to tyrosine kinase receptors can do this through other cell signaling pathways. PLC has at least eight isoforms; PLC is activated by heterotrimeric G-proteins, while PLCy forms are activated through tyrosine kinase receptors. PLC isoforms can catalyze the hydrolysis of the membrane lipid phosphatidylinositol 4,5-diphosphate (PIP2) to form IP3 and DAG (Figure 2– 26). The IP3 diffuses to the endoplasmic reticulum where it triggers the release of Ca2+ into the cytoplasm by binding the IP3 receptor, a ligand-gated Ca2+ channel (Figure 2-27). DAG is also a second messenger; it stays in the cell membrane where it activates one of several isoforms of protein kinase C and activates receptor-operated Ca2+ channels (ROCCs) in the plasma membrane to further increase intracellular Ca2+ concentration.
اینوسیتول تری فسفات و دی اسیل گلیسرول به عنوان پیام رسان دوم
پیوند بین اتصال غشایی لیگاندی که از طریق +Ca2 عمل میکند و افزایش سریع غلظت +Ca2 سیتوپلاسمیاغلب IP3 است. هنگامیکه یکی از این لیگاندها به گیرنده خود متصل میشود، فعال شدن گیرنده باعث فعال شدن فسفولیپاز C (PLC) در سطح داخلی غشاء میشود. لیگاندهای متصل به GPCR میتوانند این کار را از طریق G-پروتئینهای هتروتریمری G انجام دهند، در حالی که لیگاندهای متصل به گیرندههای تیروزین کیناز میتوانند این کار را از طریق سایر مسیرهای سیگنالینگ سلولی انجام دهند. PLC حداقل هشت ایزوفرم دارد. PLC توسط پروتئینهای G هتروتریمر فعال میشود، در حالی که اشکال PLCy از طریق گیرندههای تیروزین کیناز فعال میشوند. ایزوفرمهای PLC میتوانند هیدرولیز لیپیدی فسفاتیدیل 4،5-دی فسفات (PIP2) را برای تشکیل IP3 و DAG کاتالیز کنند (شکل 2-26). IP3 به شبکه آندوپلاسمیمنتشر میشود، جایی که با اتصال گیرنده IP3، یک کانال+Ca2 دردار با لیگاند، باعث آزاد شدن +Ca2 در سیتوپلاسم میشود (شکل 2-27). DAG نیز یک پیام رسان دوم است. در غشای سلولی باقی میماند، جایی که یکی از چندین ایزوفرم پروتئین کیناز C را فعال میکند و کانالهای +Ca2 گیرنده (ROCCs) را در غشای پلاسمایی فعال میکند تا غلظت +Ca2 داخل سلولی را افزایش دهد.

FIGURE 2-26 Metabolism of phosphatidylinositol in cell membranes. Phosphatidylinositol is successively phosphorylated to form phosphatidylinositol 4-phosphate (PIP), then phosphatidylinositol 4,5-bisphosphate (PIP2). Phospholipase C and phospholipase Cy catalyze the breakdown of PIP2 to inositol 1,4,5-trisphosphate (IP3) and diacylglycerol. Other inositol phosphates and phosphatidylinositol derivatives can also be formed. IP3 is dephosphorylated to inositol, and diacylglycerol is metabolized to cytosine diphosphate (CDP)- diacylglycerol. CDP-diacylglycerol and inositol then combine to form phosphatidylinositol, completing the cycle. (Modified with permission from Berridge MJ: Inositol triphosphate and diacylglycerol as second messengers.
شکل 2-26 متابولیسم فسفاتیدیلینوزیتول در غشای سلولی. فسفاتیدیلینوزیتول به طور متوالی فسفریله میشود تا فسفاتیدیل 4-فسفات (PIP) و سپس فسفاتیدیل 4،5-بیس فسفات (PIP2) را تشکیل دهد. فسفولیپاز C و فسفولیپاز Cy تجزیه PIP2 به اینوزیتول 1،4،5-تری فسفات (IP3) و دی آسیل گلیسرول را کاتالیز میکنند. سایر فسفاتهای اینوزیتول و مشتقات فسفاتیدیللینوزیتول نیز میتوانند تشکیل شوند. IP3 به اینوزیتول دفسفریله میشود و دی آسیل گلیسرول به سیتوزین دی فسفات (CDP) – دی آسیل گلیسرول متابولیزه میشود. سپس CDP-دیآسیلگلیسرول و اینوزیتول با هم ترکیب میشوند و فسفاتیدیللینوزیتول را تشکیل میدهند و چرخه را کامل میکنند. (با مجوز Berridge MJ اصلاح شده: اینوزیتول تری فسفات و دی اسیل گلیسرول به عنوان پیام رسان دوم.

FIGURE 2-27 Diagrammatic representation of release of inositol trisphosphate (IP3) and diacylglycerol (DAG) as second messengers. Binding of ligand to G-protein-coupled receptor activates phospholipase C (PLC). Alternatively, activation of receptors with intracellular tyrosine kinase domains can activate PLCy. The resulting hydrolysis of phosphatidylinositol 4,5- diphosphate (PIP2) produces IP3, which releases Ca2+ from the endoplasmic reticulum (ER), and DAG, which activates protein kinase C (PKC).
شکل 2-27 نمایش نموداری انتشار اینوزیتول تری فسفات (IP3) و دی اسیل گلیسرول (DAG) به عنوان پیام رسان دوم. اتصال لیگاند به گیرنده جفت شده با پروتئین G فسفولیپاز C (PLC) را فعال میکند. از طرف دیگر، فعال شدن گیرندهها با دامنههای تیروزین کیناز داخل سلولی میتواند PLCy را فعال کند. هیدرولیز حاصل از فسفاتیدیلینوزیتول 4،5- دی فسفات (PIP2) IP3 را تولید میکند که Ca2+ را از شبکه آندوپلاسمی(ER) آزاد میکند و DAG که پروتئین کیناز C (PKC) را فعال میکند.
CYCLIC AMP
Another important second messenger is cAMP (Figure 2-28). CAMP is formed from ATP by the action of the enzyme adenylyl cyclase and converted to physiologically inactive 5′ AMP by the action of the enzyme phosphodiesterase. Some of the phosphodiesterase isoforms that break down CAMP are inhibited by methylxanthines such as caffeine and theophylline. Consequently, these compounds can augment hormonal and transmitter effects mediated via cAMP. cAMP activates one of the cyclic nucleotide-dependent protein kinases (protein kinase A, PKA) that, like protein kinase C, catalyzes the phosphorylation of proteins, changing their conformation and altering their activity. In addition, the active catalytic subunit of PKA moves to the nucleus and phosphorylates the cAMP-responsive element-binding protein (CREB). This transcription factor then binds to DNA and alters transcription of a number of genes.
آمپر چرخه ای
پیام رسان دوم مهم دیگر cAMP است (شکل 2-28). CAMP از ATP با عمل آنزیم آدنیلیل سیکلاز تشکیل شده و با عمل آنزیم به AMP 5′ فیزیولوژیکی غیر فعال تبدیل میشود. فسفودی استراز برخی از ایزوفرمهای فسفودی استراز که CAMP را تجزیه میکنند توسط متیل گزانتینها مانند کافئین و تئوفیلین مهار میشوند. در نتیجه، این ترکیبات میتوانند اثرات هورمونی و فرستنده را با واسطه cAMP افزایش دهند. cAMP یکی از پروتئین کینازهای حلقوی وابسته به نوکلئوتید (پروتئین کیناز A، PKA) را فعال میکند که مانند پروتئین کیناز C، فسفوریلاسیون پروتئینها را کاتالیز میکند و ترکیب آنها را تغییر میدهد و فعالیت آنها را تغییر میدهد. علاوه بر این، زیرواحد کاتالیزوری فعال PKA به سمت هسته حرکت میکند و پروتئین متصل شونده به عنصر cAMP (CREB) را فسفریله میکند. این فاکتور رونویسی سپس به DNA متصل میشود و رونویسی تعدادی از ژنها را تغییر میدهد.

FIGURE 2-28 Formation and metabolism of CAMP. The second messenger CAMP is made from ATP by adenylyl cyclase and broken down into AMP by phosphodiesterase.
شکل 2-28 تشکیل و متابولیسم CAMP. دومین CAMP پیام رسان از ATP توسط آدنیلیل سیکلاز ساخته شده و توسط فسفودی استراز به AMP تجزیه میشود.
PRODUCTION OF CAMP BY ADENLYL CYCLASE
Adenylyl cyclase is a membrane bound protein with 12 transmembrane regions. Ten isoforms of this enzyme have been described and each can have distinct regulatory properties, permitting the cAMP pathway to be customized to specific tissue needs. Notably, stimulatory heterotrimeric G-proteins (G) activate, while inhibitory heterotrimeric G-proteins (G;) inactivate adenylyl cyclase (Figure 2- 29). When the appropriate ligand binds to a stimulatory receptor, a G, a subunit activates one of the adenylyl cyclases. Conversely, when the appropriate ligand binds to an inhibitory receptor, a G; a subunit inhibits adenylyl cyclase. The receptors are specific, responding at low threshold to only one or a select group of related ligands. However, heterotrimeric G-proteins mediate the stimulatory and inhibitory effects produced by many different ligands. In addition, cross-talk occurs between the phospholipase C system and the adenylyl cyclase system, as several of the isoforms of adenylyl cyclase are stimulated by calmodulin. Finally, the effects of protein kinase A and protein kinase C are very widespread and can also affect directly, or indirectly, the activity at adenylyl cyclase. The close relationship between activation of G-proteins and adenylyl cyclases also allows for spatial regulation of cAMP production. All of these events, and others, allow for fine-tuning the cAMP response for a particular physiologic outcome in the cell.
تولید کمپ توسط ADENLYL CYCLASE
آدنیلیل سیکلاز یک پروتئین متصل به غشا با 12 ناحیه گذرنده است. ده ایزوفرم از این آنزیم شرح داده شده است و هر کدام میتوانند خواص تنظیمیمتمایزی داشته باشند، که اجازه میدهد مسیر cAMP برای نیازهای بافتی خاص سفارشی شود. به طور قابلتوجهی، پروتئینهای G هتروتریمری تحریککننده (G) فعال میشوند، در حالی که پروتئینهای G هتروتریمری مهاری (G؛) آدنیلیل سیکلاز را غیرفعال میکنند (شکل 2-29). هنگامیکه لیگاند مناسب به یک گیرنده تحریک کننده، یک G، متصل میشود، یک زیرواحد یکی از آدنیلیل سیکلازها را فعال میکند. برعکس، وقتی لیگاند مناسب به یک گیرنده بازدارنده متصل میشود، یک G. یک زیر واحد آدنیلیل سیکلاز را مهار میکند. گیرندهها خاص هستند و در آستانه پایین تنها به یک یا گروهی از لیگاندهای مرتبط پاسخ میدهند. با این حال، پروتئینهای G هتروتریمر اثرات تحریکی و مهاری تولید شده توسط لیگاندهای مختلف را واسطه میکنند. علاوه بر این، گفتگوی متقابل بین سیستم فسفولیپاز C و سیستم آدنیلیل سیکلاز رخ میدهد، زیرا چندین ایزوفرم آدنیلیل سیکلاز توسط کالمودولین تحریک میشوند. در نهایت، اثرات پروتئین کیناز A و پروتئین کیناز C بسیار گسترده است و همچنین میتواند به طور مستقیم یا غیر مستقیم بر فعالیت آدنیلیل سیکلاز تأثیر بگذارد. رابطه نزدیک بین فعالسازی پروتئینهای G و آدنیلیل سیکلازها همچنین امکان تنظیم فضایی تولید cAMP را فراهم میکند. همه این رویدادها و موارد دیگر، امکان تنظیم دقیق پاسخ cAMP را برای یک نتیجه فیزیولوژیکی خاص در سلول فراهم میکنند.
FIGURE 2-29 The cAMP system. Activation of adenylyl cyclase catalyzes the conversion of ATP to cAMP. Cyclic AMP activates protein kinase A, which phosphorylates proteins, producing physiologic effects. Stimulatory ligands bind to stimulatory receptors and activate adenylyl cyclase via G. Inhibitory ligands inhibit adenylyl cyclase via inhibitory receptors and G1.
شکل 2-29 سیستم cAMP. فعال شدن آدنیلیل سیکلاز تبدیل ATP به cAMP را کاتالیز میکند. AMP حلقوی پروتئین کیناز A را فعال میکند که پروتئینها را فسفریله میکند و اثرات فیزیولوژیکی ایجاد میکند. لیگاندهای محرک به گیرندههای محرک متصل میشوند و آدنیلیل سیکلاز را از طریق G فعال میکنند. لیگاندهای مهاری از طریق گیرندههای بازدارنده و G1 آدنیلیل سیکلاز را مهار میکنند.
Two bacterial toxins have important effects on adenylyl cyclase that are mediated by G-proteins. The A subunit of cholera toxin catalyzes the transfer of ADP ribose to an arginine residue in the middle of the a subunit of G,. This inhibits its GTPase activity, producing prolonged stimulation of adenylyl cyclase. Pertussis toxin catalyzes ADP-ribosylation of a cysteine residue near the carboxyl terminal of the a subunit of G1. This inhibits the function of G1. In addition to the implications of these alterations in disease, both toxins are used for fundamental research on G-protein function. The compound forskolin also stimulates adenylyl cyclase activity by a direct action on the enzyme, and is commonly used in research studies to evaluate adenylyl cyclase/cAMP contributions to cellular physiology.
دو سم باکتریایی اثرات مهمیبر روی آدنیلیل سیکلاز دارند که توسط پروتئینهای G واسطه میشوند. زیرواحد A سم وبا انتقال ADP ریبوز را به باقیمانده آرژنین در وسط زیرواحد a از G، کاتالیز میکند. این فعالیت GTPase آن را مهار میکند و باعث تحریک طولانی مدت آدنیلیل سیکلاز میشود. سم سیاه سرفه باعث کاتالیز ADP-ریبوزیلاسیون باقیمانده سیستئین در نزدیکی پایانه کربوکسیل زیر واحد a از G1 میشود. این کار عملکرد G1 را مهار میکند. علاوه بر پیامدهای این تغییرات در بیماری، هر دو سم برای تحقیقات اساسی در مورد عملکرد پروتئین G استفاده میشوند. ترکیب فورسکولین همچنین فعالیت آدنیلیل سیکلاز را با یک اثر مستقیم بر روی آنزیم تحریک میکند و معمولاً در مطالعات تحقیقاتی برای ارزیابی سهم آدنیلیل سیکلاز/cAMP در فیزیولوژی سلولی استفاده میشود.
GUANYLYL CYCLASE
Another cyclic nucleotide of physiologic importance is cyclic guanosine monophosphate (cyclic GMP or cGMP). cGMP is important in vision in both rod and cone cells. In addition, there are cGMP-regulated ion channels, and cGMP activates cGMP-dependent kinase, producing a number of physiologic effects.
گانیلیل سیکلاس
نوکلئوتید حلقوی دیگری که اهمیت فیزیولوژیکی دارد گوانوزین مونوفسفات حلقوی (GMP یا cGMP حلقوی) است. cGMP در بینایی در سلولهای میله ای و مخروطی مهم است. علاوه بر این، کانالهای یونی تنظیمشده با cGMP وجود دارد و cGMP کیناز وابسته به cGMP را فعال میکند و تعدادی از اثرات فیزیولوژیکی ایجاد میکند.
Guanylyl cyclases are a family of enzymes that catalyze the formation of cGMP. They exist in two forms (Figure 2-30). One form has an extracellular amino terminal domain that is a receptor, a single transmembrane domain, and a cytoplasmic portion with guanylyl cyclase catalytic activity. Several such guanylyl cyclases have been characterized. Two are receptors for atrial natriuretic peptide (ANP; also known as atrial natriuretic factor), and a third binds an Escherichia coli enterotoxin and the gastrointestinal polypeptide guanylin. The other form of guanylyl cyclase is soluble (SGC), contains heme, and is not bound to the membrane. There appear to be several isoforms of the intracellular enzyme. They are activated by nitric oxide (NO) and NO-containing compounds.
گوانیلیل سیکلازها خانواده ای از آنزیمها هستند که تشکیل cGMP را کاتالیز میکنند. آنها به دو شکل وجود دارند (شکل 2-30). یک فرم دارای یک دامنه انتهایی آمینو خارج سلولی است که یک گیرنده، یک دامنه گذر غشایی منفرد و یک بخش سیتوپلاسمیبا فعالیت کاتالیزوری گوانیلیل سیکلاز است. چندین چنین گوانیلیل سیکلاز مشخص شده است. دو گیرنده برای پپتید ناتریورتیک دهلیزی (ANP؛ همچنین به عنوان فاکتور ناتریورتیک دهلیزی شناخته میشود)، و سومیبه انتروتوکسین اشریشیا کلی و پلی پپتید گوارشی گوانیلین متصل میشود. شکل دیگر گوانیلیل سیکلاز محلول (SGC) است، حاوی هم است و به غشاء متصل نیست. به نظر میرسد چندین ایزوفرم از آنزیم داخل سلولی وجود دارد. آنها توسط اکسید نیتریک (NO) و ترکیبات حاوی NO فعال میشوند.

FIGURE 2-30 Diagrammatic representation of guanylyl cyclases, tyrosine kinases, and tyrosine phosphatases. NT refers to the amino (NH2) terminus and CT to the carboxyl terminus of each protein. Individual molecules are as follows: ANP, atrial natriuretic peptide; GC, guanylyl cyclase domain; EGFR, epidermal growth factor receptor; PDGFR, platelet-derived growth factor receptor; PTK, protein tyrosine kinase domain (PTK is inactive in guanylyl cyclase); PTP, tyrosine phosphatase domain.
شکل 2-30 نمایش نموداری گوانیلیل سیکلازها، تیروزین کینازها و تیروزین فسفاتازها. NT به انتهای آمینو (NH2) و CT به انتهای کربوکسیل هر پروتئین اشاره دارد. مولکولهای منفرد به شرح زیر هستند: ANP، پپتید ناتریورتیک دهلیزی. GC، دامنه گوانیلیل سیکلاز. EGFR، گیرنده فاکتور رشد اپیدرمی؛ PDGFR، گیرنده فاکتور رشد مشتق از پلاکت. PTK، دامنه پروتئین تیروزین کیناز (PTK در گوانیلیل سیکلاز غیر فعال است). PTP، دامنه تیروزین فسفاتاز.
GROWTH FACTORS
Growth factors have become increasingly important in many different aspects of physiology. They are polypeptides and proteins that are conveniently divided into three groups. One group is made up of agents that foster the multiplication or development of various types of cells; NGF, insulin-like growth factor I (IGF- I), activins and inhibins, and epidermal growth factor (EGF) are examples. More than 20 have been described. The cytokines are a second group. These factors are produced by macrophages and lymphocytes, as well as other cells, and are important in regulation of the immune system (see Chapter 3). Again, more than 20 have been described. The third group is made up of the colony-stimulating factors that regulate proliferation and maturation of red and white blood cells.
عوامل رشد
عوامل رشد در بسیاری از جنبههای مختلف فیزیولوژی اهمیت فزاینده ای پیدا کرده اند. آنها پلی پپتیدها و پروتئینهایی هستند که به راحتی به سه گروه تقسیم میشوند. یک گروه از عواملی تشکیل شده است که تکثیر یا رشد انواع مختلف سلولها را تقویت میکنند. NGF، فاکتور رشد شبه انسولین I (IGF-I)، اکتیوینها و اینهیبینها، و فاکتور رشد اپیدرمی(EGF) نمونههایی هستند. بیش از 20 مورد شرح داده شده است. سیتوکینها گروه دوم هستند. این عوامل توسط ماکروفاژها و لنفوسیتها و همچنین سلولهای دیگر تولید میشوند و در تنظیم سیستم ایمنی مهم هستند (به فصل 3 مراجعه کنید). باز هم بیش از 20 مورد شرح داده شده است. گروه سوم از عوامل محرک کلنی تشکیل شده است که تکثیر و بلوغ گلبولهای قرمز و سفید خون را تنظیم میکند.
Receptors for EGF, platelet-derived growth factor (PDGF), and many of the other factors that foster cell multiplication and growth have a single membrane- spanning domain with an intracellular tyrosine kinase domain (Figure 2-29). When ligand binds to a tyrosine kinase receptor, it first causes a dimerization of two similar receptors. The dimerization results in partial activation of the intracellular tyrosine kinase domains and a cross-phosphorylation to fully activate each other. One of the pathways activated by phosphorylation leads, through the small G-protein Ras, to MAP kinases, and eventually to the production of transcription factors in the nucleus that alter gene expression (Figure 2-31).
گیرندههای EGF، فاکتور رشد مشتق از پلاکت (PDGF)، و بسیاری از عوامل دیگر که تکثیر و رشد سلولی را تقویت میکنند، دارای یک حوزه غشایی واحد با دامنه تیروزین کیناز درون سلولی هستند (شکل 2-29). هنگامیکه لیگاند به گیرنده تیروزین کیناز متصل میشود، ابتدا باعث دیمر شدن دو گیرنده مشابه میشود. دیمریزاسیون منجر به فعال شدن جزئی دامنههای تیروزین کیناز داخل سلولی و فسفوریلاسیون متقابل برای فعال کردن کامل یکدیگر میشود. یکی از مسیرهای فعال شده توسط فسفوریلاسیون، از طریق G-protein Ras کوچک، به MAP کینازها و در نهایت به تولید فاکتورهای رونویسی در هسته منجر میشود که بیان ژن را تغییر میدهد (شکل 2-31).

FIGURE 2-31 One of the direct pathways by which growth factors alter gene activity. Grb2, Ras activator/controller; MAP K, mitogen-activated protein kinase; MAP KK, MAP kinase kinase; Ras, product of the ras gene; Sos, Ras activator; TF, transcription factors; TKR, tyrosine kinase domain. There is a cross-talk between this pathway and the cAMP pathway, as well as a cross-talk with the IP3-DAG pathway.
شکل 2-31 یکی از مسیرهای مستقیمیاست که توسط آن عوامل رشد فعالیت ژن را تغییر میدهند. Grb2، فعال/کنترل کننده Ras؛ MAP K، پروتئین کیناز فعال شده با میتوژن؛ MAP KK، MAP کیناز کیناز. Ras، محصول ژن ras; Sos, Ras activator; TF، فاکتورهای رونویسی. TKR، دامنه تیروزین کیناز. یک گفتگوی متقابل بین این مسیر و مسیر cAMP و همچنین یک گفتگوی متقابل با مسیر IP3-DAG وجود دارد.
Receptors for cytokines and colony-stimulating factors differ from the other growth factors in that most of them do not have tyrosine kinase domains in their cytoplasmic portions and some have little or no cytoplasmic tail. However, they initiate tyrosine kinase activity in the cytoplasm. In particular, they activate the so-called Janus tyrosine kinases (JAKs) in the cytoplasm (Figure 2–32). These in turn phosphorylate STAT proteins. The phosphorylated STATS form homo- and heterodimers and move to the nucleus, where they act as transcription factors. There are four known mammalian JAKS and seven known STATS. Interestingly, the JAK-STAT pathway can also be activated by growth hormone and is another important direct path from the cell surface to the nucleus. However, it should be emphasized that both the Ras and the JAK-STAT pathways are complex and there is cross-talk between them and other signaling pathways discussed previously.
گیرندههای سیتوکینها و فاکتورهای محرک کلنی با سایر فاکتورهای رشد تفاوت دارند، زیرا اکثر آنها دامنه تیروزین کیناز در بخشهای سیتوپلاسمیخود ندارند و برخی دارای دم سیتوپلاسمیکم یا بدون آن هستند. با این حال، آنها فعالیت تیروزین کیناز را در سیتوپلاسم آغاز میکنند. به طور خاص، آنها تیروزین کینازهای ژانوس (JAKs) را در سیتوپلاسم فعال میکنند (شکل 2-32). اینها به نوبه خود پروتئین STAT را فسفریله میکنند. STATS فسفریله شده همو و هترودیمرها را تشکیل میدهند و به سمت هسته حرکت میکنند، جایی که به عنوان فاکتورهای رونویسی عمل میکنند. چهار JAKS پستانداران و هفت STATS شناخته شده وجود دارد. جالب اینجاست که مسیر JAK-STAT میتواند توسط هورمون رشد نیز فعال شود و مسیر مستقیم مهم دیگری از سطح سلول به هسته است. با این حال، باید تاکید کرد که هر دو مسیر Ras و JAK-STAT پیچیده هستند و بین آنها و سایر مسیرهای سیگنالینگ که قبلاً مورد بحث قرار گرفت، گفتگوی متقابل وجود دارد.


FIGURE 2-32 Signal transduction via the JAK-STAT pathway. A) Inactive JAKs are associated with individual receptors. B) Ligand binding leads to dimerization of receptor and activation JAKS that phosphorylate tyrosine residues on opposing receptors and their associated JAK. C) STATS then associate with the phosphorylated receptors and JAKs in turn phosphorylate these STATS. D) Phosphorylated STATS dimerize and move to nucleus, where they bind to response elements on DNA.
شکل 2-32 انتقال سیگنال از طریق مسیر JAK-STAT. الف) JAKهای غیرفعال با گیرندههای فردی مرتبط هستند. ب) اتصال لیگاند منجر به دیمر شدن گیرنده و فعال سازی JAKS میشود که باقیمانده تیروزین را روی گیرندههای مخالف و JAK مرتبط با آنها فسفریله میکند. ج) STATS سپس با گیرندههای فسفریله و JAKها به نوبه خود این STATS را فسفریله میکنند. د) STATS فسفریله شده دیمر میشوند و به هسته منتقل میشوند، جایی که به عناصر پاسخ در DNA متصل میشوند.
Finally, note that the whole subject of second messengers and intracellular signaling has become immensely complex, with multiple pathways and interactions. It is only possible in a book such as this to list highlights and present general themes that will aid the reader in understanding the rest of physiology (Clinical Box 2-9).
در نهایت، توجه داشته باشید که کل موضوع پیام رسانهای دوم و سیگنال دهی درون سلولی، با مسیرها و تعاملات متعدد، بسیار پیچیده شده است. فقط در کتابی مانند این ممکن است که نکات برجسته و ارائه مضامین کلی ارائه شود که به خواننده در درک بقیه فیزیولوژی کمک میکند (کادر بالینی 2-9).
CLINICAL BOX 2.9
Receptor & G-Protein Diseases
Many diseases are being traced to mutations in the genes for receptors. For example, loss-of-function receptor mutations that cause disease have been reported for the 1,25-dihydroxycholecalciferol receptor and the insulin receptor. Certain other diseases are caused by production of antibodies against receptors. Thus, antibodies against thyroid-stimulating hormone (TSH) receptors cause Graves disease, and antibodies against nicotinic acetylcholine receptors cause myasthenia gravis.
کادر بالینی 2.9
گیرنده و بیماریهای پروتئین G
بسیاری از بیماریها در جهش در ژنهای گیرندهها ردیابی میشوند. برای مثال، جهشهای گیرنده از دست دادن عملکرد که باعث بیماری میشوند، برای گیرنده 1،25-دی هیدروکسی کوله کلسیفرول و گیرنده انسولین گزارش شدهاند. برخی از بیماریهای دیگر به دلیل تولید آنتی بادی علیه گیرندهها ایجاد میشوند. بنابراین، آنتی بادیها علیه گیرندههای هورمون محرک تیروئید (TSH) باعث بیماری گریوز میشوند و آنتیبادیها علیه گیرندههای نیکوتین استیل کولین باعث میاستنی گراویس میشوند.
An example of loss of function of a receptor is the type of nephrogenic diabetes insipidus that is due to loss of the ability of mutated V2 vasopressin receptors to mediate concentration of the urine. Mutant receptors can gain as well as lose function. A gain-of-function mutation of the calcium-sensing receptor (CaSR) causes excess inhibition of parathyroid hormone secretion and familial hypercalciuric hypocalcemia. G-proteins can also undergo loss- of-function or gain-of-function mutations that cause disease (Table 2-6). In one form of pseudohypoparathyroidism, a mutated Ga fails to respond to parathyroid hormone, producing the symptoms of hypoparathyroidism without any decline in circulating parathyroid hormone. Testotoxicosis is an interesting disease that combines gain and loss of function. In this condition, an activating mutation of Ga causes excess testosterone secretion and prepubertal sexual maturation. However, this mutation is temperature- sensitive and is active only at the relatively low temperature of the testes (33°C). At 37°C, the normal temperature of the rest of the body, it is replaced by loss of function, with the production of hypoparathyroidism and decreased responsiveness to TSH. A different activating mutation in Goa is associated with the rough-bordered areas of skin pigmentation and hypercortisolism of the McCune-Albright syndrome. This mutation occurs during fetal development, creating a mosaic of normal and abnormal cells. A third mutation in Ga reduces its intrinsic GTPase activity. As a result, it is much more active than normal, and excess cAMP is produced. This causes hyperplasia and eventually neoplasia in somatotrope cells of the anterior pituitary. Forty percent of somatotrope tumors causing acromegaly have cells containing a somatic mutation of this type.
نمونه ای از از دست دادن عملکرد یک گیرنده، نوع دیابت بی مزه نفروژنیک است که به دلیل از دست دادن توانایی گیرندههای وازوپرسین V2 جهش یافته برای واسطه غلظت ادرار است. گیرندههای جهش یافته میتوانند عملکرد خود را افزایش دهند و همچنین عملکرد خود را از دست بدهند. یک جهش افزایش عملکرد گیرنده حسگر کلسیم (CaSR) باعث مهار بیش از حد ترشح هورمون پاراتیروئید و هیپوکلسمیهیپرکلسیوری خانوادگی میشود. پروتئینهای G همچنین میتوانند دچار جهشهای از دست دادن عملکرد یا افزایش عملکرد شوند که باعث بیماری میشود (جدول 2-6). در یکی از اشکال هیپوپاراتیروئیدیسم کاذب، یک Ga جهش یافته به هورمون پاراتیروئید پاسخ نمیدهد و علائم کم کاری پاراتیروئید را بدون کاهش هورمون پاراتیروئید در گردش ایجاد میکند. تستوتوکسیکوز یک بیماری جالب است که ترکیبی از افزایش و از دست دادن عملکرد است. در این شرایط، جهش فعال کننده Ga باعث ترشح بیش از حد تستوسترون و بلوغ جنسی قبل از بلوغ میشود. با این حال، این جهش به دما حساس است و فقط در دمای نسبتاً پایین بیضهها (33 درجه سانتیگراد) فعال است. در دمای 37 درجه سانتیگراد، دمای طبیعی بقیه بدن، با از دست دادن عملکرد، با تولید کم کاری پاراتیروئید و کاهش پاسخگویی به TSH جایگزین میشود. یک جهش فعال کننده متفاوت در گوا با نواحی ناهموار رنگدانه پوست و هیپرکورتیزولیسم سندرم مک کان- آلبرایت مرتبط است. این جهش در طول رشد جنین رخ میدهد و موزاییکی از سلولهای طبیعی و غیر طبیعی ایجاد میکند. سومین جهش در Ga فعالیت GTPase ذاتی آن را کاهش میدهد. در نتیجه، بسیار بیشتر از حد معمول فعال است و cAMP اضافی تولید میشود. این باعث هیپرپلازی و در نهایت نئوپلازی در سلولهای سوماتوتروپ هیپوفیز قدامیمیشود. چهل درصد از تومورهای سوماتوتروپ که باعث آکرومگالی میشوند دارای سلولهای حاوی جهش سوماتیکی از این نوع هستند.
TABLE 2-6 Examples of abnormalities caused by lossor gain-of-function mutations of heterotrimeric G-protein-coupled receptors and G-proteins.
جدول 2-6 نمونههایی از ناهنجاریهای ناشی از جهشهای از دست دادن یا افزایش عملکرد گیرندههای هتروتریمری جفت شده با پروتئین G و پروتئینهای G.

ACTH, adrenocorticotropic hormone; LH, luteinizing hormone; TSH, thyroid- stimulating hormone.
ACTH، هورمون آدرنوکورتیکوتروپیک؛ LH، هورمون لوتئینه کننده؛ TSH، هورمون محرک تیروئید.
CHAPTER SUMMARY
خلاصه فصل
• The cell and the intracellular organelles are surrounded by semipermeable membranes. Biological membranes have a lipid bilayer core that is populated by structural and functional proteins. These proteins contribute greatly to the semipermeable properties of biological membrane.
• سلول و اندامکهای درون سلولی توسط غشاهای نیمه تراوا احاطه شده اند. غشاهای بیولوژیکی دارای یک هسته دولایه لیپیدی هستند که توسط پروتئینهای ساختاری و عملکردی پر شده است. این پروتئینها کمک زیادی به خواص نیمه تراوا غشای بیولوژیکی میکنند.
• Cells contain a variety of organelles that perform specialized cell functions. The nucleus is an organelle that contains DNA and is the site of gene transcription. The endoplasmic reticulum and the Golgi apparatus are important in protein processing and the targeting of proteins to correct compartments within the cell. Lysosomes and peroxisomes are membrane- bound organelles that contribute to protein and lipid processing. Mitochondria are organelles that allow for oxidative phosphorylation in eukaryotic cells and also are important in specialized cellular signaling.
• سلولها حاوی اندامکهای مختلفی هستند که عملکردهای تخصصی سلول را انجام میدهند. هسته اندامکی است که حاوی DNA است و محل رونویسی ژن است. شبکه آندوپلاسمیو دستگاه گلژی در پردازش پروتئین و هدفگیری پروتئینها برای اصلاح بخشهای درون سلول مهم هستند. لیزوزومها و پراکسی زومها اندامکهای متصل به غشاء هستند که به پردازش پروتئین و لیپید کمک میکنند. میتوکندری اندامکهایی هستند که امکان فسفوریلاسیون اکسیداتیو در سلولهای یوکاریوتی را فراهم میکنند و همچنین در سیگنال دهی تخصصی سلولی مهم هستند.
• The cytoskeleton is a network of three types of filaments that provide structural integrity to the cell as well as a means for trafficking of organelles and other structures around the cell. Actin filaments are important in cellular contraction, migration, and signaling. Actin filaments also provide the backbone for muscle contraction. Intermediate filaments are primarily structural. Microtubules provide a dynamic structure in cells that allows for the movement of cellular components around the cell.
• اسکلت سلولی شبکه ای از سه نوع رشته است که یکپارچگی ساختاری سلول را فراهم میکند و همچنین وسیله ای برای قاچاق اندامکها و سایر ساختارهای اطراف سلول است. رشتههای اکتین در انقباض سلولی، مهاجرت و سیگنال دهی مهم هستند. رشتههای اکتین همچنین ستون فقرات انقباض عضلانی را فراهم میکنند. رشتههای میانی در درجه اول ساختاری هستند. میکروتوبولها ساختاری پویا در سلولها ایجاد میکنند که امکان حرکت اجزای سلولی را در اطراف سلول فراهم میکند.
• There are three superfamilies of molecular motor proteins in the cell that use the energy of ATP to generate force, movement, or both. Myosin is the force generator for muscle cell contraction. Cellular myosins can also interact with the cytoskeleton (primarily thin filaments) to participate in contraction as well as movement of cell contents. Kinesins and cellular dyneins are motor proteins that primarily interact with microtubules to move cargo around the cells.Cellular adhesion molecules aid in tethering cells to each other or to the extracellular matrix as well as providing for initiation of cellular signaling. There are four main families of these proteins: integrins, immunoglobulins, cadherins, and selectins.
• سه ابرخانواده از پروتئینهای موتور مولکولی در سلول وجود دارد که از انرژی ATP برای تولید نیرو، حرکت یا هر دو استفاده میکنند. میوزین مولد نیرو برای انقباض سلولهای عضلانی است. میوزینهای سلولی همچنین میتوانند با اسکلت سلولی (عمدتاً رشتههای نازک) برای مشارکت در انقباض و همچنین حرکت محتویات سلولی تعامل داشته باشند. کینزینها و داینینهای سلولی پروتئینهای حرکتی هستند که عمدتاً با میکروتوبولها برای جابجایی محمولهها در اطراف سلولها تعامل دارند. چهار خانواده اصلی از این پروتئینها وجود دارد: اینتگرینها، ایمونوگلوبولینها، کادرینها و سلکتینها.
• Cells contain distinct protein complexes that serve as cellular connections to other cells or the extracellular matrix. Tight junctions provide intercellular connections that link cells into a regulated tissue barrier and also provide a barrier to movement of proteins in the cell membrane. Gap junctions provide contacts between cells that allow for direct passage of small molecules between two cells. Desmosomes and adherens junctions are specialized structures that hold cells together. Hemidesmosomes and focal adhesions attach cells to their basal lamina.
• سلولها حاوی کمپلکسهای پروتئینی متمایز هستند که به عنوان اتصال سلولی به سلولهای دیگر یا ماتریکس خارج سلولی عمل میکنند. اتصالات محکم اتصالات بین سلولی را ایجاد میکند که سلولها را به یک سد بافتی تنظیم شده متصل میکند و همچنین مانعی برای حرکت پروتئینها در غشای سلولی ایجاد میکند. اتصالات شکاف تماسهایی را بین سلولها ایجاد میکند که امکان عبور مستقیم مولکولهای کوچک بین دو سلول را فراهم میکند. اتصالات دسموزومها و چسبندهها ساختارهای تخصصی هستند که سلولها را کنار هم نگه میدارند. همیدزموزومها و چسبندگیهای کانونی سلولها را به لایه بازال خود متصل میکنند.
• Exocytosis and endocytosis are vesicular fusion events that allow for movement of proteins and lipids between the cell interior, the plasma membrane, and the cell exterior. Exocytosis can be constitutive or nonconstitutive; both are regulated processes that require specialized proteins for vesicular fusion. Endocytosis is the formation of vesicles at the plasma membrane to take material from the extracellular space into the cell interior.
• اگزوسیتوز و اندوسیتوز رویدادهای همجوشی تاولی هستند که امکان حرکت پروتئینها و لیپیدها را بین داخل سلول، غشای پلاسمایی و بیرونی سلول فراهم میکنند. اگزوسیتوز میتواند سازنده یا غیر سازنده باشد. هر دو فرآیندهای تنظیم شده ای هستند که به پروتئینهای تخصصی برای همجوشی تاولی نیاز دارند. اندوسیتوز تشکیل وزیکولهایی در غشای پلاسمایی است تا مواد را از فضای خارج سلولی به داخل سلول منتقل کند.
• Cells can communicate with one another via chemical messengers. Individual messengers (or ligands) typically bind to a plasma membrane receptor to initiate intracellular changes that lead to physiological changes. Plasma membrane receptor families include ion channels, G-protein-coupled receptors, or a variety of enzyme-linked receptors (eg, tyrosine kinase receptors). There are additional cytosolic receptors (eg, steroid receptors) that can bind membrane-permeant compounds. Activation of receptors leads to cellular changes that include changes in membrane potential, activation of heterotrimeric G-proteins, increase in second messenger molecules, or initiation of transcription.
• سلولها میتوانند از طریق پیام رسانهای شیمیایی با یکدیگر ارتباط برقرار کنند. پیام رسانها (یا لیگاندها) به طور معمول به گیرنده غشای پلاسمایی متصل میشوند تا تغییرات درون سلولی را آغاز کنند که منجر به تغییرات فیزیولوژیکی میشود. خانوادههای گیرنده غشای پلاسما شامل کانالهای یونی، گیرندههای جفت شده با پروتئین G یا انواع گیرندههای مرتبط با آنزیم (مانند گیرندههای تیروزین کیناز) هستند. گیرندههای سیتوزولی اضافی (به عنوان مثال، گیرندههای استروئیدی) وجود دارند که میتوانند ترکیبات غشایی را به هم متصل کنند. فعال شدن گیرندهها منجر به تغییرات سلولی میشود که شامل تغییر در پتانسیل غشاء، فعال شدن پروتئینهای G هتروتریمری، افزایش مولکولهای پیام رسان دوم یا شروع رونویسی میشود.
• Second messengers are molecules that undergo a rapid concentration changes in the cell following primary messenger recognition. Common second messenger molecules include Ca2+, cyclic adenosine monophosphate (CAMP), and cyclic guanine monophosphate (cGMP), inositol trisphosphate (IP3).
• پیام رسانهای دوم مولکولهایی هستند که به دنبال شناسایی پیام رسان اولیه، در سلول دچار تغییرات سریع غلظت میشوند. مولکولهای پیام رسان دوم رایج عبارتند از Ca2+، آدنوزین منوفسفات حلقوی (CAMP) و گوانین منوفسفات حلقوی (cGMP)، اینوزیتول تری فسفات (IP3).
MULTIPLE-CHOICE QUESTIONS
For all questions, select the single best answer unless otherwise directed.
سوالات چند گزینه ای
برای همه سؤالات، بهترین پاسخ را انتخاب کنید، مگر اینکه دستور دیگری داده شود.
1. The electrogenic Na, K ATPase plays a critical role in cellular physiology by
A. using the energy in ATP to extrude 3 Na* out of the cell in exchange for taking two K+ into the cell.
B. using the energy in ATP to extrude 3 K+ out of the cell in exchange for taking two Na+ into the cell.
C. using the energy in moving Na+ into the cell or K+ outside the cell to makeATP.
D. using the energy in moving Nat outside of the cell or K+ inside the cell to make ATP.
1. الکتروژن Na، K ATPase نقش مهمیدر فیزیولوژی سلولی ایفا میکند
الف. با استفاده از انرژی موجود در ATP برای خارج کردن 3 +Na از سلول در ازای گرفتن دو +K به سلول.
ب. استفاده از انرژی موجود در ATP برای خارج کردن 3 +K از سلول در ازای گرفتن دو +Na به داخل سلول.
ج. استفاده از انرژی در انتقال +Na به داخل سلول یا +K در خارج از سلول برای ایجاد ATP.
د. استفاده از انرژی در حرکت +Na به خارج از سلول یا +K در داخل سلول برای ساخت ATP.
2. Cell membranes
A. contain relatively few protein molecules.
B. contain many carbohydrate molecules.
C. are freely permeable to electrolytes but not to proteins.
D. have variable protein and lipid contents depending on their location in the cell.
E. have a stable composition throughout the life of the cell.
2. غشای سلولی
الف. حاوی مولکولهای پروتئین نسبتا کمیاست.
ب. حاوی تعداد زیادی مولکول کربوهیدرات است.
ج. آزادانه به الکترولیتها نفوذ میکنند اما به پروتئینها نه.
د. بسته به محل آنها در سلول، محتوای پروتئین و لیپید متغیری دارند.
ی. یک ترکیب پایدار در طول عمر سلول دارند.
3. Second messengers
A. are substances that interact with first messengers outside cells.
B. are substances that bind to first messengers in the cell membrane.
C. are hormones secreted by cells in response to stimulation by another hormone.
D. mediate the intracellular responses to many different hormones and neurotransmitters.
E. are not formed in the brain.
3. رسولان دوم
الف. موادی هستند که با اولین پیام رسانهای خارج از سلول تعامل دارند.
ب. موادی هستند که به اولین پیام رسانها در غشای سلولی متصل میشوند.
ج. هورمونهایی هستند که توسط سلولها در پاسخ به تحریک توسط هورمون دیگری ترشح میشوند.
د. واسطه پاسخهای درون سلولی به بسیاری از هورمونها و انتقال دهندههای عصبی مختلف است.
ی. در مغز تشکیل نمیشوند.
4. The Golgi complex
A. is an organelle that participates in the breakdown of proteins and lipids.
B. is an organelle that participates in posttranslational processing of proteins.
C. is an organelle that participates in energy production.
D. is an organelle that participates in transcription and translation.
E. is a subcellular compartment that stores proteins for trafficking to the nucleus.
4. مجموعه گلگی
الف. اندامکی است که در تجزیه پروتئینها و لیپیدها شرکت میکند.
ب. اندامکی است که در پردازش پس از ترجمه پروتئینها شرکت میکند.
ج. اندامکی است که در تولید انرژی شرکت میکند.
د. اندامکی است که در رونویسی و ترجمه شرکت میکند.
ی. یک بخش درون سلولی است که پروتئینها را برای انتقال به هسته ذخیره میکند.
5. Endocytosis
A. includes phagocytosis and pinocytosis, but not clathrin-mediated or caveolae-dependent uptake of extracellular contents.
B. refers to the merging of an intracellular vesicle with the plasma membrane to deliver intracellular contents to the extracellular milieu.
C. refers to the invagination of the plasma membrane to uptake extracellular contents into the cell.
D. refers to vesicular trafficking between Golgi stacks.
5. اندوسیتوز
الف. شامل فاگوسیتوز و پینوسیتوز است، اما نه جذب محتویات خارج سلولی با واسطه کلاترین یا وابسته به caveolae.
ب. به ادغام یک وزیکول درون سلولی با غشای پلاسما برای رساندن محتویات درون سلولی به محیط خارج سلولی اشاره دارد.
ج. به هجوم غشای پلاسمایی برای جذب محتویات خارج سلولی به داخل سلول اشاره دارد.
د. به قاچاق تاولی بین پشتههای گلژی اشاره دارد.
6. G-protein-coupled receptors
A. are intracellular membrane proteins that help regulate movement within the cell.
B. are plasma membrane proteins that couple the extracellular binding of primary signaling molecules to exocytosis.
C. are plasma membrane proteins that couple the extracellular binding of primary signaling molecules to the activation of heterotrimeric G-proteins.
D. are intracellular proteins that couple the binding of primary messenger molecules with transcription.
6. گیرندههای جفت شده با پروتئین G
الف. پروتئینهای غشای داخل سلولی هستند که به تنظیم حرکت در داخل سلول کمک میکنند.
ب. پروتئینهای غشای پلاسما هستند که اتصال خارج سلولی مولکولهای سیگنال دهنده اولیه را به اگزوسیتوز متصل میکنند.
ج. پروتئینهای غشای پلاسمایی هستند که اتصال خارج سلولی مولکولهای سیگنال دهنده اولیه را با فعال شدن پروتئینهای G هتروتریمری جفت میکنند.
د. پروتئینهای درون سلولی هستند که اتصال مولکولهای پیام رسان اولیه را با رونویسی جفت میکنند.
7. Gap junctions are intercellular connections that
A. primarily serve to keep cells separated and allow for transport across a tissue barrier.
B. serve as a regulated cytoplasmic bridge for sharing of small molecules between cells.
C. serve as a barrier to prevent protein movement within the cellular membrane.
D. are cellular components for constitutive exocytosis that occurs between adjacent cells.
7. اتصالات شکاف، اتصالات بین سلولی هستند که
الف. در درجه اول برای جدا نگه داشتن سلولها و امکان انتقال از طریق یک سد بافتی عمل میکند.
ب. به عنوان یک پل سیتوپلاسمیتنظیم شده برای به اشتراک گذاری مولکولهای کوچک بین سلولها عمل میکند.
ج. به عنوان یک مانع برای جلوگیری از حرکت پروتئین در غشای سلولی عمل میکند.
د. اجزای سلولی برای اگزوسیتوز سازنده ای هستند که بین سلولهای مجاور رخ میدهد.
8. F-actin is a component of the cellular cytoskeleton that
A. provides a structural component for cell movement.
B. is defined as the “functional” form of actin in the cell.
C. refers to the actin subunits that provide the molecular building blocks of the extended actin molecules found in the cell.
D. provides the molecular architecture for cell to cell communication.
8. F-اکتین جزء اسکلت سلولی است که
الف. یک جزء ساختاری برای حرکت سلول فراهم میکند.
ب. به عنوان شکل “عملکردی” اکتین در سلول تعریف میشود.
ج. به زیر واحدهای اکتین اطلاق میشود که بلوکهای ساختمان مولکولی مولکولهای اکتین گسترش یافته موجود در سلول را فراهم میکنند.
د. معماری مولکولی را برای ارتباط سلول به سلول فراهم میکند.
کلیک کنید «منابع»
🚀 با ما همراه شوید!
تازهترین مطالب و آموزشهای مغز و اعصاب را از دست ندهید. با فالو کردن کانال تلگرام آیندهنگاران مغز، از ما حمایت کنید!
