آیا پاتوژنها عامل آلزایمر هستند؟
آیا آلزایمر واکنشی در برابر عفونت است؟
یک تئوری نسبتا جدید و بحثبرانگیز میگوید که بیماری آلزایمر میتواند توسط پاتوژنها آغاز شود؛ آیا شواهدی برای این تئوری وجود دارد؟
مردم بیشتر از چه چیز پیر شدن میترسند؟ پاسخ بیماری آلزایمر است. درواقع براساس یک نظرسنجی که در سال ۲۰۱۴ در بریتانیا انجام شد، دو سوم از افراد بالای سن ۵۰ سال درمورد ابتلا به زوال عقل که عمدتا بهشکل آلزایمر نمایان میشود، اظهار نگرانی میکردند درحالیکه فقط ۱۰ درصد از مردم درمورد مبتلا شدن بهسرطان نگران بودند. البته ترس آنها دلیل منطقی دارد: در برخی از مناطق، آلزایمر علت اصلی مرگ است و تعداد بیماران مبتلا به آلزایمر انتظار است که تا سال ۲۰۵۰ سهبرابر شود.
آلزایمر یکی از معدود بیماریهای اصلی است که قابل پیشگیری و درمان نیست. ۹۹/۶ درصد از داروهای آلزایمر که در فاصلهی سالهای ۲۰۱۲-۲۰۰۲ توسعه یافتند، در آزمایشهای بالینی شکست خوردند و از آن زمان به بعد نیز چندین درمان که در ابتدا امیدوار کننده ظاهر شدند، درنهایت در آزمایشها نتایج مایوسکنندهای حاصل کردند. با وجود هزاران دانشمندی که مدتها است درحال انجام پژوهش روی آلزایمر هستند، سازمان غذا و داروی آمریکا از سال ۲۰۰۳ به بعد هیچ داروی جدیدی را برای درمان این بیماری تأیید نکرده است.
داروهای موجود عمدتا بهدنبال مهار پروتئین آمیلوئید بتا هستند. در طول چند دههی گذشته، عمدهی پژوهشگران درمورد این موضوع توافق داشتهاند که تولید غیرطبیعی آمیلوئید بتا آغازگر فرایند تخریب عصبی است که در آلزایمر اتفاق میافتد. اگرچه شکست مکرر این داروها شاید نشاندهندهی این موضوع باشد که «فرضیهی آمیلوئید بتا» ممکن است، کاملا درست نباشد.
افراد معتقد به این فرضیه ادعا میکنند که این داروها یا نقصی داشتهاند یا اینکه در زمان مناسب در اختیار بیماران قرار نگرفتهاند زیرا تجمع آمیلوئید بتا و تشکیل پلاکهای آن میتواند دههها قبل از بروز علایم آلزایمر، در مغز بیماران آغاز شده باشد. البته زمان نشان خواهد داد که آیا این ادعا درست است یا نه. پژوهشگران در مطالعهای باعنوان «مطالعهی A4» درحال آزمایش داروهایی هستند که موجب کاهش تولید آمیلوئید بتا در مغز افراد سالخوردهای که در معرض خطر ابتلا به آلزایمر قرار دارند ولی هنوز علایمی از این بیماری را نشان ندادهاند، میشوند. در همین حال، اگر ما این احتمال را نیز درنظر بگیریم که شاید آمیلوئید بتا عامل اصلی بیماری نباشد و به مطالعه بیشتری در اینباره بپردازیم، کار با ارزشی انجام دادهایم.

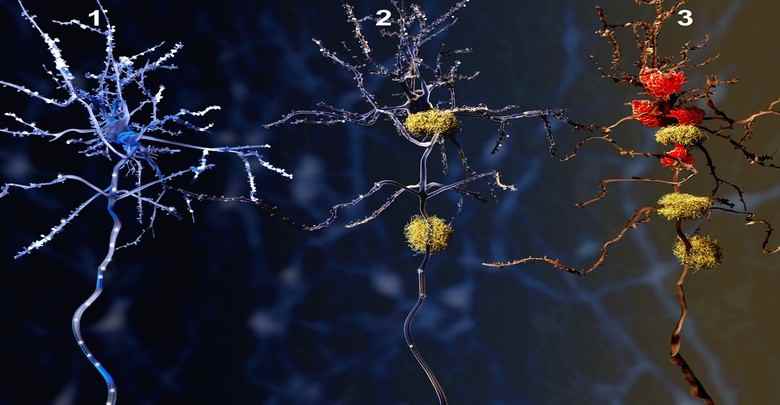
پلاکهای آمیلوئیدی مشخصه بیماری آلزایمر هستند.
سطوح اضافی آمیلوئید بتا قطعا در آلزایمر مشارکت میکند اما این اشتباه است که آمیلوئید بتا را بهعنوان پروتئینی که تنها عملکرد آن در مغز ایجاد بیماری است، تعریف کنیم. علاوهبراین، این تنها یک گمان نیست. براساس فرضیهی اخیر که از قدری حمایت تجربی نیز برخوردار است، آمیلوئید بتا در حقیقت ممکن است ابزاری باشد که مغز از آن برای مبارزه با علت اصلی آلزایمر استفاده میکند: عفونتهای حاصل از پاتوژنهایی مانند ویروسها، باکتریها و قارچها. در پژوهشهای گذشته ارتباط پاتوژنهای مختلفی با آلزایمر نشان داده شده است؛ یکی از این موارد که بسیار مورد مطالعه قرار گرفته است، ویروس هرپس سیمپلکس تیپ ۱ (HSV-1) است. از آنجایی که این ویروس از راه دهان انتقال مییابد، میزان پراکندگی آن بسیار وسیع است و در بدن بیش از ۶۷ درصد از افراد کمتر از ۵۰ سال، در سرتاسر جهان وجود دارد.
اثرات سریع عفونت HSV-1 تقریبا بیضرر هستند: عمدهی افرادی که با این ویروس درگیر میشوند، دچار تبخالهای دهانی میشوند و برخی از افراد هم هیچگاه علامتی نشان نمیدهند. اما در سال ۱۹۹۷ گروهی از دانشمندان تحت هدایت روث ایتزاکی از دانشگاه منچستر دریافتند که عفونت HSV-1 در افرادی که دارای ژن APOE ε۴ هستند، با احتمال بیشتر توسعهی آلزایمر همراه است. اخیرا ایتزاکی و همکارانش نشان دادهاند که HSV-1 سبب افزایش قابلتوجهی در تولید آمیلوئید بتا در سلولهای عفونی کشت داده شده میشود و نیز ۹۰ درصد از پلاکهای آمیلوئید بتا حاوی DNAویروسی HSV-1 هستند.
در مطالعات زیادی که تاکنون انجام شده است، وجود ارتباطی بین HSV-1 و بیماری آلزایمر نشان داده شده است ولی نه یک رابطهی سببی. در چند سال گذشته، ویلیام ایمر که در حال انجام پژوهشهایی در آزمایشگاههای رادولف تانزی و رابرت مویر در مدرسهی پزشکی هاروارد است، مکانیسمهای سببی را که ازطریق آنها HSV-1 علایم هشداردهندهی آلزایمر را آغاز میکند، مورد جستوجو قرار داده است. ایمر و همکاران نشان دادهاند که آمیلوئید بتا به سطح HSV-1 متصل میشود و برای جلوگیری از چسبیدن ویروس به سلولهای مغز، با تشکیل رشتههایی آنها را به دام میاندازد. در پژوهش ایمر، موشهایی که غلظت بالاتری از آمیلوئید بتا تولید میکردند نسبتبه جوندگان معمولی دفاع موثرتری دربرابر ویروس داشتند.
یافتههای ایمر با فرضیهی حفاظت ضدمیکروبی (APH) مطابقت دارد. طبق این فرضیه، آمیلوئید بتا وقتی در غلظتهای طبیعی در مغز تولید شود، نقش مثبتی دارد. این پروتئین از مغز دربرابر عفونتهای بیماریزا محافظت میکند. APH از این کشف که آمیلوئید بتا بسیار شبیه یک پپتید ضدمیکروبی شناخته شده به نام LL-37 است، منشا گرفته است. LL-37 بخشی از سیستم ایمنی قدیمی است که در بسیاری از موجودات زنده دیده میشود.
آمیلوئید بتا خودش یک پروتئین بسیار قدیمی است؛ پروتئینی که حدود ۶۳۰-۵۴۰ میلیون سال پیش تکامل یافته است و بهخوبی در انواع مختلف مهرهداران حفاظت شده است. بنابراین این امر امکانپذیر است که آمیلوئید بتا برای مدت طولانی در حال مبارزه با HSV-1 بوده باشد.
تانزی و مویر، دانشمندان علوم اعصاب که فرضیهی APH را باور دارند به این نکته اشاره میکنند که پپتیدهای ضدمیکروبی مختلفی مانند آمیلوئید بتا چندین مسیر ایمنی را تنظیم میکنند و از این راه روی واکنش مغز نسبتبه عفونتهای بیماریزا اثر میگذارند. بهعنوان مثال، این پپتیدها ممکن است فرایندهای مرگ سلولی را تنظیم کنند. وقتی این مسیرها بهطور مزمن دچار فعالیت بیش از اندازه میشوند، مغز دچار التهاب میشود؛ مرحلهای که تانزی و دیگر پژوهشگران آن را بهعنوان مهمترین مرحله پیشرفت آلزایمر درنظر میگیرند. درواقع التهاب ممکن است موجب آغاز مرگ سلولی فراگیری شود که در مغز بیمارانی که در مراحل پیشرفتهی آلزایمر هستند، اتفاق میافتد. بر این اساس، فعالیت آمیلوئید بتا خاتمه دادن به آسیب وارده به مغز است زیرا هدف آن کاهش آسیبهای ناشی از عفونت است و نه تشدید آن.
این فرضیه هنوز بسیار بحثبرانگیز است. جان هاردی متخصص زیستشناسی ملکولی در دانشگاه لندن که از حامیان فرضیهی بتا آمیلوئید است، معتقد است که اگر این بیماری حقیقتا توسط پاتوژنها ایجاد شود، پلاکها باید در مغز بیماران مبتلا به آلزایمر پراکندگی بیشتری داشته باشند. او همچنین میگوید که درصد کم اما قابلتوجهی از بیماران مبتلا به آلزایمر این بیماری را بهصورت ژنتیکی به ارث میبرند، بنابراین عفونتهای بیماریزا نمیتوانند بهطور کامل عامل بیماری باشند. مویر حتی خاطرنشان میکند که ما هنوز بهطور قطعی نمیدانیم که آیا پاتوژن ها علت یا پیامد آلزایمر هستند. این بیماری باعث میشود که مغز در اثر تضعیف سد خونیمغزی نسبتبه عفونتها بیشتر حساس شود، بنابراین عفونت ممکن است واقعا پس از ابتلای یک بیمار به آلزایمر اتفاق بیفتد.
اگر نشان داده شود داروهایی که عفونت را سرکوب میکنند، بیماری آلزایمر را درمان یا از آن پیشگیری میکنند، این فرضیه حمایت بیشتری بهدست میآورد. درواقع شواهد امیدوار کنندهای نیز وجود دارد که نشان میدهد که این داروها میتوانند مؤثر باشند. در سال ۲۰۱۱، ایتزاکی و همکارانش نشان دادند که داروی ضد هرپس اسیکلوویر موجب کاهش سطح آمیلوئید بتا در کشتهای سلولی عفونی شده با HSV-1 میشود.
سال گذشته مطالعهای که روی ۳۴ هزار بیمار تایوانی انجام شد، نشان میداد که احتمال ابتلا به زوال عقل در افرادی که دچار عفونت HSV-1 هستند، ۲/۵۶ برابر بیشتر است و درمان عفونت HSV-1 موجب کاهش ۸۰ درصدی در خطر ابتلای به آلزایمر میشود.
شاید اگر پژوهشگران بهطور جدی نقش پاتوژنها را بروز این بیماری درنظر بگیرند و نیز تعامل آنها با آمیلوئید بتا را مورد توجه قرار دهند و در عین حال نقش سد خونیمغزی را دقیقتر مورد بررسی قرار دهند، ما بتوانیم درنهایت به درمانی برای این بیماری برسیم. پژوهشگران در آزمایشگاه تانزی، فعالانه درحال دنبال کردن این راهها هستند و بیماری آلزایمر را در قالب یک مدل سلولی سهبعدی (آلزایمر در یک ظرف) مورد مطالعه قرار میدهند. آنها معتقدند که تنها از این راه است که آنها میتوانند یافتن روشهای درمانی جدید و درنهایت ریشهکنی این بیماری مرموز را سرعت ببخشند.







 Could Alzheimer’s Be a Reaction to Infection?
Could Alzheimer’s Be a Reaction to Infection?
A relatively new and still controversial theory suggests the disease could be triggered by pathogens

What do people fear the most about getting old? The answer is Alzheimer’s disease. Indeed, a 2014 poll conducted in the United Kingdom found that two thirds of people over the age of 50 were worried about developing dementia, which primarily manifests in the form of Alzheimer’s disease, while just 10 percent were concerned about getting cancer.
They fear the disease for good reason: in some places, Alzheimer’s is the leading cause of death, and the number of Alzheimer’s patients is expected to triple by 2050. However, it is also one of the few major diseases that cannot be treated, prevented or cured. 99.6 percent of Alzheimer’s drugs developed between 2002 and 2012 failed in clinical trials, and since then, multiple treatments that appeared to be promising delivered disappointing results in trials. Despite the thousands of scientists who are conducting research on Alzheimer’s, the Food and Drug Administration hasn’t approved a new Alzheimer’s drug since 2003.
Existing medications have mostly sought to inhibit the protein amyloid beta. For the past few decades, the majority of researchers have agreed that abnormal production of amyloid beta triggers the neurodegeneration that occurs in Alzheimer’s. However, the repeated failure of the drugs would appear to suggest that the so-called “amyloid beta hypothesis” may not be entirely correct. Staunch believers in the hypothesis assert that the drugs either were flawed or were not administered to patients at the right time; aggregates of amyloid beta known as plaques can form in the brain decades before people begin to exhibit symptoms of Alzheimer’s.
Time will tell whether this claim holds ground, as initiatives like the A4 study test drugs that lower amyloid beta production on elderly people who are at risk of Alzheimer’s but haven’t yet developed the symptoms. In the meantime, it’s worth at least entertaining the possibility that amyloid beta may not be intrinsically pathological. To be clear, excessive levels of amyloid beta certainly contribute to Alzheimer’s, but it would be wrong to characterize amyloid beta as a protein whose sole function in the brain is to cause disease.
Furthermore, this view is not merely speculative. According to recent hypotheses that have firm empirical support, amyloid beta may, in fact, be a tool that the brain uses in order to fight the underlying cause of Alzheimer’s: infections by pathogens, such as viruses, bacteria and fungi. Many different pathogens have been linked to Alzheimer’s; one that has been studied quite extensively is herpes simplex virus type 1 (HSV-1). In part because it is orally transmitted, this virus is very ubiquitous, present in over 67 percent of people around the world who are under age 50. The immediate effects of HSV-1 are mostly harmless: the majority of those who are infected display cold sores, and some never even exhibit any symptoms.
But in 1997, a team of scientists led by Ruth Itzhaki at the University of Manchester found that HSV-1 infection in people who have the APOE ε۴ gene, which is, on its own, associated with Alzheimer’s, have a much higher risk of developing the condition. More recently, Itzhaki and her colleagues have shown that HSV-1 causes a dramatic increase in amyloid beta production in infected cell cultures and furthermore that 90 percent of amyloid beta plaques contain the viral DNA of HSV-1. A large share of the research that has been conducted thus far has established a correlation between HSV-1 and Alzheimer’s but not a causal relationship.
However, in the past few years, William Eimer, who is conducting research in the labs of Rudolph Tanzi and Robert Moir at Harvard Medical School, has sought out the causal mechanisms by which HSV-1 triggers the telltale signs of Alzheimer’s. In particular, Eimer and his colleagues demonstrated that amyloid beta binds to the surface of HSV-1 and forms fibrils in order to entrap the virus before it adheres to cells in the brain. In Eimer’s research, mice that expressed higher concentrations of amyloid beta fought the virus more effectively than normal rodents.
Eimer’s findings align with the antimicrobial protection hypothesis (APH), which states that amyloid beta actually serves a positive role when it is produced at normal concentrations: it protects the brain from pathogenic infections. The APH stemmed from the discovery that amyloid beta is very similar to an antimicrobial peptide known as LL-37, which is part of an ancient immune system found in many different biological organisms. Amyloid beta itself is a very old protein, one that may have evolved some 540–۶۳۰ million years ago, and it is conserved incredibly well across a variety of vertebrates. Thus, it is possible that amyloid beta has been fighting HSV-1 for a very long time.
Tanzi and Moir, the neuroscientists who came up with the APH, point out that many antimicrobial peptides like amyloid beta modulate several immune pathways, thereby influencing the brain’s response to pathogenic infections. (For instance, these peptides may regulate cell death processes.) When these pathways become chronically over-activated, the brain undergoes inflammation, which Tanzi and other researchers consider to be the most important stage in the progression of Alzheimer’s. Indeed, inflammation might trigger the pervasive cell death that occurs in the brains of late-stage Alzheimer’s patients. Ironically, the activity of amyloid beta ends up damaging the brain because it is seeking to mitigate the harms of infection, not to exacerbate them.
The APH is still highly controversial. John Hardy, a molecular biologist at the University College London who defends the mainstream amyloid beta hypothesis, believes that plaques would be more widely distributed in the brains of Alzheimer’s patients if the disease were actually caused by pathogens. Additionally, he says, a small but substantial percentage of Alzheimer’s patients inherit the disease genetically, so pathogenic infections cannot be entirely responsible for the disease. Even Moir acknowledges that we still don’t know for certain whether pathogens are a cause or a consequence of Alzheimer’s. The disease makes the brain more susceptible to infection by weakening the blood-brain barrier, so infection may actually occur after a patient has already gotten Alzheimer’s.
Ultimately, the APH will gain more support if drugs that suppress infection are shown to treat or prevent Alzheimer’s. In fact, there is already promising evidence that suggests that these drugs could be effective. In 2011, Itzhaki and her colleagues showed that the anti-herpes drug acyclovir reduces levels of amyloid beta in cell cultures that were infected with HSV-1. Last year, a study involving over 34,000 Taiwanese patients found that people who were infected with HSV-1 were 2.56 times more likely to get dementia, but that undergoing treatment for HSV-1 lowered their risk of Alzheimer’s by over 80 percent.
Perhaps if researchers seriously consider the role of pathogens and examine their interactions with amyloid beta as well as the role of blood-brain barrier more carefully, then we will finally be able to overcome our current impasse in finding a cure. In Tanzi’s lab at Harvard Medical School, we are actively pursuing these avenues, developing cutting-edge technology for evaluating pathophysiological mechanisms involved in a three-dimensional cell culture model (more aptly known as “Alzheimer’s-in-a-Dish”). Only through these types of innovative approaches will we be able to accelerate the development of novel therapeutic approaches in the quest to treat and ultimately eradicate this enigmatic disease.








 Could Alzheimer’s Be a Reaction to Infection?
Could Alzheimer’s Be a Reaction to Infection?
عالی بود
بسیار عالی
بسیار عالی
متنی مفید قابل فهم