محور هیپوتالاموس – هیپوفیز – گناد؛ فاکتورهای بیوشیمیایی و تولیدمثل

فاکتورهای بیوشیمیایی و تولیدمثل
پیشگفتار
تولیدمثل برای بقای همه گونه های پستانداران مورد نیاز است , با این حال، بسیاری از زوج های نابارور همچنان با تشخیص نازایی ایدیوپاتیک یا تشخیص های توصیفی که دلیلی برای نقص آنها ایجاد نمی کند، برچسب گذاری می شوند. برای سایر افراد با علت شناخته شده، درمانهای مؤثر وجود ندارد، اگرچه ناباروری آنها غالباً با فناوریهای تولیدمثل(ART ) کنار گذاشته میشود، بعضی از آنها همراه با نگرانی های ایمنی یا اخلاقی هستند.
تکثیر همه گونه های مهره داران نیاز به تعامل یک اسپرم و یک تخمک برای تشکیل زیگوت دارد، که اولین مرحله برای سیر تکاملی جنین محسوب میشود. هنگامی که نوع گامتها، گنادها و ارگان های جنسی ثانویه به درستی تعیین شده باشد، کودک در حال رشد در مسیر بلوغ قرار می گیرد. محور هیپوتالاموس – هیپوفیز – گناد، مهمترین سیستم فیدبک مثبت و منفی غدد درون ریز است که در طی تکامل محافظت شده است و تولید گامتهای بالغ را تنظیم میکند.
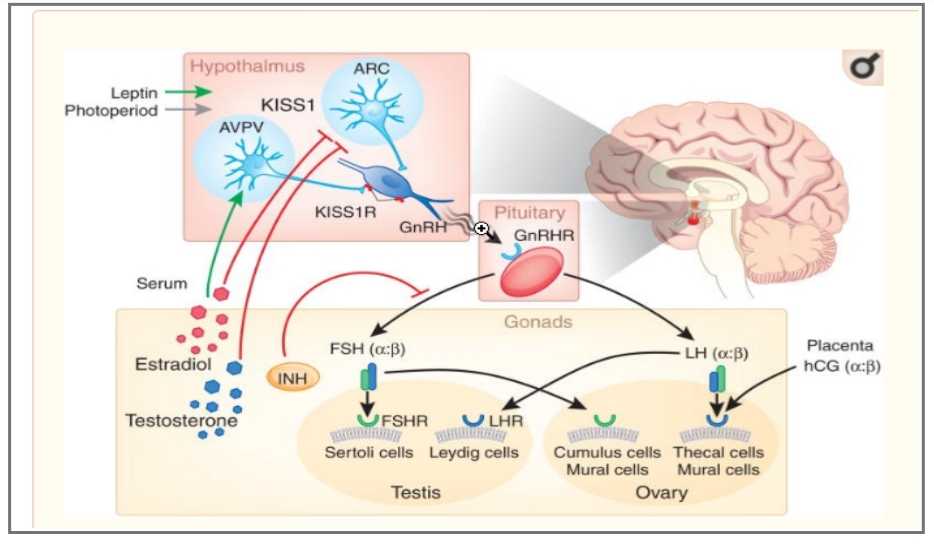
این محور به صورت تکاملی در جنین واقع می گردد، اما عمده ی اثر فیزیولوژیکی اش را بعد از تولد در دوران بلوغ و در بزرگسالی نشان می دهد. پیشرفت های سریعی در درک این محور به دلیل توسعه سنجش های بسیار حساس برای تشخیص سطوح پایین گنادوتروپین ها رخ داده است، هورمون محرکه فولیکول (FSH) , و هورمون لوتئینی کننده LH)) , که در هیپوگنادیسم هیپوگنادوتروپیک یا وجود ندارد یا به سختی قابل تشخیص هستند. بنابراین، این حالت به طور معمول نشان دهنده نقص هیپوتالاموس یا عملکرد هیپوفیز است. در حالی که هیپوگنادیسم هایپرگنادوتروپیک اغلب نشانگر نارسایی اندام انتهایی است (یعنی اختلال عملکرد تخمدان یا بیضه از جمله نقص در گیرنده های گنادوتروپین).
پالس GnRH و شروع بلوغ در پستانداران
برای سالها شناخته شده بود که ارسال پالسی (ضربانی) GnRH از هیپوتالاموس برای تنظیم ترشح FSH و LH از هیپوفیز قدامی بسیار مهم است، اما نحوه کنترل این فرایند به طور مرکزی تا زمان شناسایی جهش KISS1R در بیماران، یک معما بود. این بینش جدیدی را در مورد چگونگی سیگنال های کیس پپتین از طریق گیرنده آن برای تعدیل انتشار GnRH و بلوغ ارائه می دهد.
جهش های مرتبط با فقدان عملکرد در KISS1R منجر به مهار ترشح پالسی GnRH و ناباروری می شوند، در حالی که فعال کردن جهش در KISS1R از حساسیت زدایی مسیر KISS1-KISS1R جلوگیری میکند و منجر به بلوغ زودرس میشود. به نظر می رسد این یک مسیر مرکزی برای فیدبک منفی استروئیدها بر روی پالس GnRH و شروع بلوغ در پستانداران باشد.
تنظیم پاراکراین فولیکولوژنزیس و اووژنزیس
برهمکنش های پاراکرین و جاکستراکراین دو طرفه مهمی بین تخمک و سلولهای سوماتیک اطراف تخمدان (سلولهای گرانولوزا و سلولهای تکا ) وجود دارد که از ورود PGC ها به لبه دستگاه تناسلی شروع شده و از طریق تخمک گذاری ادامه می یابد.
از طریق مسیرهای ارتباطی پاراکرین و انتقال دو طرفه مولکولهای کوچک در میان اتصالات شکاف دار(gap junctions)، سلولهای گرانولوزا، تخمک را از تشکیل فولیکول اولیه از طریق تخمک گذاری پشتیبانی می کنند.
سلولهای تکا و باروری
سلولهای تکا(Thecal cells) که فولیکول را احاطه کرده اند، آندروژن هایی را تولید می کنند که توسط سلولهای گرانولوزا به استروژن تبدیل می شوند – هورمون هایی که برای عملکرد طبیعی تخمدان ها، ارگان های جنسی ثانویه، چرخه قاعدگی و انواع دیگر اقدامات در بافت های متنوع اعم از مغز تا استخوان گرفته تا دستگاه گوارش مورد نیاز هستند.
اختلال در این مسیرهای ارتباطی نزدیک مانع از توسعه گامتهای زنانه قابل بارور میشود. به استثنای اعضای خانواده TGF-β و GDF9 (فاکتور تمایز رشد -۹) و BMP15(پروتئین مورفوژنتیک استخوان -۱۵) , تعداد کمی از پروتئین ها در زنانی که ناهنجاری های باروری دارند، ناقص و معیوب مشاهده شده اند از آنجایی که تخمک در ترشح بسیاری از فاکتور های رشد شناخته شده است، جهش ها در مسیر های سیگنالینگ جمعی( برای مثال، مسیر فاکتور رشد فیبروبلاست (FGF) که با مسیر سیگنالینگ خانواده TGF-β تعامل دارد) احتمالاً در زنان مبتلا به ناباروری ایدیوپاتیک کشف شده است. در حالی که نشان داده شده است که فاکتور های رشد تخمک GDF9, BMP15, FGF8 به سلولهای گرانولوزای کومولوس (نوعی از سلولهای گرانولوزا که بلافاصله تخمک را احاطه می کنند) سیگنال می دهند، چندین فاکتور سلول گرانولوزا به صورت دو طرفه رشد و عمکرد تخمک را تنظیم می کنند.
کوآنزیم Q10 در ناباروری مردان و جنبه های بیوشیمیایی و درمانی
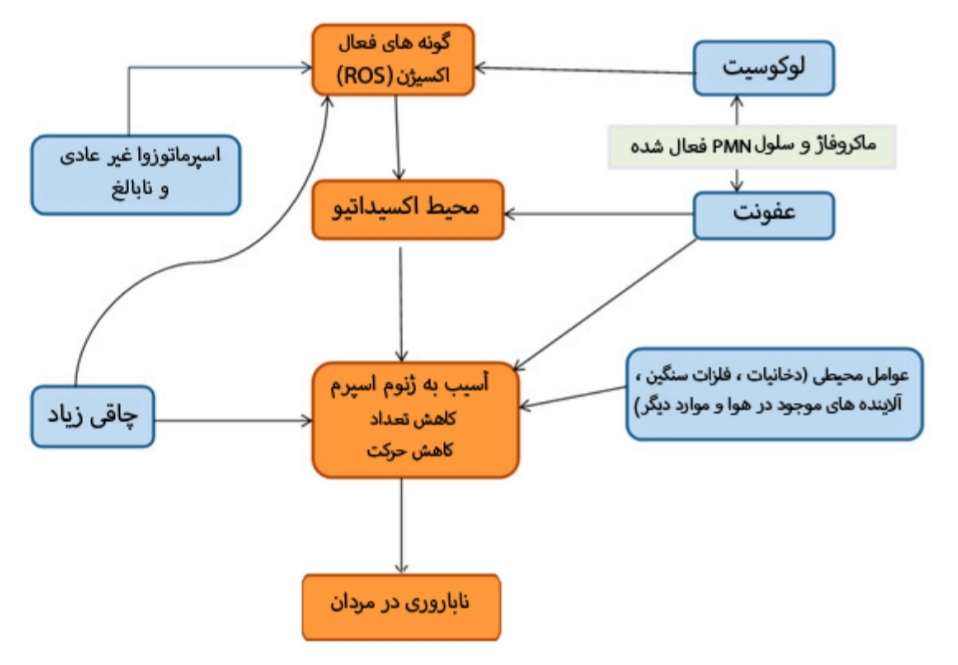
افزایش سطح استرس اکسیداتیو به عنوان یکی از مهم¬ترین عوامل ایجاد ناباروری در مردان مطرح میباشد که منجر به بروز تغییرات ریخت شناسی، حرکت و غلظت اسپرم میگردد. در ساختار غشای پلاسمایی سلول اسپرمی اسیدهای چرب غیراشباع فراوانی وجود دارد؛
گونه¬های فعال اکسیژن مانند پراکسید هیدروژن میتوانند به وسیلهی پراکسیداسیون لیپیدها سبب کاهش حرکت سلولهای اسپرم شده، ناباروری را در مردان افزایش دهند. کوآنزیم Q10 یکی از مهمترین اجزا در فرآیند فسفریلاسیون اکسیداتیو میتوکندری است که به صورت درون زاد در سلولها تولید شده و سبب افزایش تولید ATP و افزایش پایداری غشای سلولی شده و دارای نقش آنتیاکسیدانی میباشد و یکی از مهمترین اجزای آن اسیدآمینهی تایروزین است؛ و در قلب، کلیه، کبد و پانکراس یافت شده و به عنوان عاملی در جلوگیری از بروز بیماری¬های قلبی عروقی، افزایش فشارخون و دیابت مطرح است.
در افراد نابارور به دلیل کاهش سطح آنزیم¬های آنتی¬اکسیدان و وجود اسیدهای چرب غیر اشباع فراوان درون غشا، سلولهای اسپرم در مقابل استرس اکسیداتیو بسیار آسیب پذیر میباشند. استرس اکسیداتیو با آسیب رساندن به DNA و غشای پلاسمایی در سلول اسپرم سبب کاهش کیفیت مایع منی میگردد.
افزایش سطح رادیکالهای آزاد سبب بروز آسیب DNA می¬گردد که با کاهش توانایی غشای میتوکندری ارتباط دارد. مطالعات بسیاری در نقاط مختلف جهان به انجام رسیده که نشان دادهاند که حضور آنتی¬اکسیدان¬ها میتواند با مهار اکسیداسیون اسیدهای چرب موجود در غشای سلولهای اسپرم و کاهش میزان مالون¬دی¬آلدئید، سبب کاهش میزان ناباروری در مردان گردد؛ همچنین مصرف مکمل کوآنزیم Q10 به وسیلهی افزایش میزان یوبیکینون درون مایع سمینال و افزایش تولید انرژی و فعالیت آنتیاکسیدانی و کاهش سطح گونه¬های فعال اکسیژن، سبب بهبود تغییرات ریخت شناسی در سلول اسپرم و افزایش حرکت آن میگردد.
Balercia و همکارانش در مطالعه¬ی خود برروی اثر کوآنزیم Q10 در ناباروری مردان به این نتیجه رسیدند که این کوآنزیم سبب افزایش حرکت اسپرمها میشود. مطالعات انجام شده نشان دادند که کوآنزیم Q10 بدلیل قابلیت تبادل دو الکترون بین حالت احیا یعنی فرم ubiquinol و فرم اکسید آن یعنی ubiquinone قادر به تولید انرژی در سلول بوده و دارای خاصیت آنتی اکسیدانی میباشد.
بدن انسان مکانیسم های محدودی برای جبران آسیب های ناشی از اکسیژن های فعال دارد
یکی از نقش های اساسی پروتیین HspA2 در تشکیل اسپرم و تعیین ساختار صحیح آن می باشد که شامل فعالیت های زیر است:
بالغ شدن اسپرم، صحت و درستی DNA آن، بلوغ و کامل شدن ساختار کروماتین، فرکانس آنئوپلوییدی (aneuploidy) کروموزوم آن و عملکرد های اسپرم که خود شامل فعالیت هایی است که باعث افزایش پتانسیل باروری میشود.
مراحل اسپرماتوژنتیکِ اکستروژن سیتوپلاسمی و بازسازی ساختار غشای پلاسمایی باعث تسهیل تشکیل منطقه zona pellucida یعنی جایگاه اتصال در سلول اسپرماتوزوا میشود. حضور گیرنده یا رسپتور هیالورونیک اسید (HA) همراه با لایه ای از HA روی غشای پلاسمایی اسپرم بالغ، مطالعه روی این سلول ها در افراد سالم یا نابارور را آسان تر کرده است.
شایع ترین علت ناباروری اختلال در عملکرد های اسپرم یا به عبارتی اسپرم غیر طبیعی است و تا چند سال اخیر ارزیابی و درمان آن کاری سخت و پیچیده بود. در پستانداران غشای سلولهای اسپرماتوزوا سرشار از اسید های چرب اشباع نشده (Poly unsaturated fatty acids) است و ممکن است مشکلاتی از قبیل حساسیت زیاد به آسیب ناشی از اکسیژن ایجاد کند که به واسطه ی پراکسیداسیون لیپید ها به وجود می آید ؛ از این رو ، رادیکال های آزاد و گونه های فعال اکسیژن مثل O_2^- و H_2 O_2 که با نام مختصر (ROS) شناخته می شوند باعث ایجاد حالتی به نام استرس اکسیداتیو(Oxidative stress) که مشکلات خاص و متنوعی در تولیدمثل دارد .
بدن انسان مکانیسم های محدودی برای جبران آسیب های ناشی از اکسیژن های فعال دارد؛ در شرایط طبیعی بدن درون ترشحات غدد وزیکول سمینال می توان مکانیسم های آنتی اکسیدانی یافت که می توانند اثرات اکسیژن های فعال را خنثی کنند و از سلولهای اسپرماتوزوا در برابر ROS دفاع کنند. با این حال، در زمان عفونت دستگاه تناسلی یا مجاری ادراری تناسلی ممکن است فعالیت این مکانیسم ها کاهش یابد و شرایط oxidative stress را ایجاد کنند. ارزیابی و تحقیق بر روی حالت های این گونه از محیط های اکسیداتیوی (OSS) می تواند در تشخیص روش های درمانی مناسب کمک کند که با استفاده از آنتی اکسیدان های مناسب در درمان ناباروری مؤثر باشد.
علاوه بر این، عوامل محیطی مثل حشره کش ها، افزودن استروژن های بیرونی به بدن و فلزات سنگین که نقشی در متابولیسم های بدن ندارند؛ می توانند اثرات منفی بر مراحل ساخت و بالغ شدن اسپرم داشته باشند. این اثرات ممکن است به صورت کاهش تعداد اسپرم های بالغ، شکل غیر طبیعی اسپرم ها یا اختلال در عملکرد آنها دیده شوند. افزایش سن نیز به مرور زمان باعث افزایش استرس اکسیداتیو در بدن شده که این امر ناشی از اختلالات متابولیسمی است.
گروه سولفوهیدریل موجود در غشای اسپرم زمانی که توسط غلظت بسیار کمی از فلزات سنگین مثل کبالت یا مس احاطه شوند علائم مهار شدن فعالیت های پراکسیداسیون لیپید و سوپر اکسید دیسموتاز از خود نشان می دهند؛ گفته میشود که مهار شدن پراکسیداسیون لیپید ها منجر به کاهش سیال بودن غشا خواهد شد؛ در نتیجه این مهار شدن پیش نیازی برای فعالیت طبیعی اسپرم ها است. بعضی مواد مثل mycoestrogen zearalenone (ZEA) می توانند روی چرخه تولیدمثلی تاثیرات مختلفی داشته باشند؛ این ماده را می توان در برخی مواد غذایی مثل سویا یافت، با اینکه ساختار این ماده شباهتی به هورمون های استروئیدی ندارد اما گیرنده های آنها را فعال میکند که ممکن است تغییراتی در عملکرد اندامهای مربوطه ایجاد کند، علائم بالینی قرار گرفتن در معرض ZEA شامل آتروفی تخمدان، کاهش باروری و … می باشد.
ZEA فقط به گیرنده های استروئیدی متصل نمی شود بلکه علاوه بر این گیرنده ها، پیش ماده آنزیم هیدروکسی استروئید دِ هیدروژناز است که تحت تاثیر این آنزیم تقسیم میشود و دو متابولیت به نام های α-zearalenol و β-zearalenol تولید میکند که این مواد در مقایسه با ماده اصلی تاثیر بیشتری در افزایش میزان استروژن در اثر واکنش آلفا – هیدروکسیلاسیون خواهند داشت. این ترکیب ممکن در بعضی گونه ها از جانوران علائمی نداشته باشد اما در برخی دیگر اثرات شدید باشد.
منابع:
Matzuk, M., Lamb, D. The biology of infertility: research advances and clinical challenges. Nat Med 14, 1197-1213 (2008). https://doi.org/10.1038/nm.f.1895
Mancinia, A., De Marinis, L., Littarru, G.P., Balercia. G. (2005). An update of Coenzyme Q10 implications in male infertility: Biochemical and therapeutic aspects. BioFactors, 25 (2005), 165-174.
Nouri, M., Lotfi, K., Askari, G. (2019). The Effect of Coenzyme Q10 Supplementation on Male Infertility: A Systematic Review on Randomized Clinical Trial Studies. J Isfahan Med Sch; 36(504), 1401-7.
Nivsarkar, M., Cherian, B., & Patel, S. (1998). A regulatory role of sulfhydryl groups in modulation of sperm membrane conformation by heavy metals: sulfhydryl groups as markers for infertility assessment. Biochemical and biophysical research communications, 247(3), 716-718.
Cayli, S., Jakab, A., Ovari, L., Delpiano, E., Celik-Ozenci, C., Sakkas, D., … & Huszar, G. (2003). Biochemical markers of sperm function: male fertility and sperm selection for ICSI. Reproductive BioMedicine Online, 7(4), 462-468.
Fink-Gremmels, J., & Malekinejad, H. (2007). Clinical effects and biochemical mechanisms associated with exposure to the mycoestrogen zearalenone. Animal Feed Science and Technology, 137(3-4).
انجمن علمی دانشجویی ژنتیک بیوتکنولوژی دانشگاه شهید چمران اهواز شماره جدید فصلنامه «ژنوفیل» شماره چهارم سال دوم
مدیر مسئول: زهرا نصب نجار
سردبیر: آرزو آروند
هیئت تحریریه: دکتر مژگان ترابی، آرزو آروند، زهرا نصب نجار، حسین یزدانی، آمین محمدی، ماندانا عسکری و شیوا مظاهری تهرانی.
نگارنده: پریا خسروی
با همکاری: زینب نوروزی و علی صراط