فیزیولوژی پزشکی گایتون و هال؛ انتقال مواد از غشاهای سلولی
» Guyton and Hall Textbook of Medical Physiology, 14th Ed
»» CHAPTER 4
Transport of Substances Through Cell Membranes
Figure 4-1 lists the approximate concentrations of important electrolytes and other substances in the extracellular fluid and intracellular fluid. Note that the extracellular fluid contains a large amount of sodium but only a small amount of potassium. The opposite is true of the intra- cellular fluid. Also, the extracellular fluid contains a large amount of chloride ions, whereas the intracellular fluid contains very little of these ions. However, the concentra- tions of phosphates and proteins in the intracellular fluid are considerably greater than those in the extracellular fluid. These differences are extremely important to the life of the cell. The purpose of this chapter is to explain how the differences are brought about by the cell membrane transport mechanisms.
شکل ۴-۱ غلظت تقریبی الکترولیتهای مهم و سایر مواد را در مایع خارج سلولی و مایع درون سلولی فهرست میکند. توجه داشته باشید که مایع خارج سلولی حاوی مقدار زیادی سدیم است اما مقدار کمیپتاسیم دارد. عکس این موضوع در مورد مایع درون سلولی صادق است. همچنین مایع خارج سلولی حاوی مقدار زیادی یون کلرید است، در حالی که مایع داخل سلولی حاوی مقدار بسیار کمیاز این یونها است. با این حال، غلظت فسفاتها و پروتئینها در مایع درون سلولی به طور قابل توجهی بیشتر از غلظت فسفاتها در مایع خارج سلولی است. این تفاوتها برای زندگی سلول بسیار مهم هستند. هدف این فصل توضیح این است که چگونه تفاوتها توسط مکانیسمهای انتقال غشای سلولی ایجاد میشود.
Figure 4-1. Chemical compositions of extracellular and intracel- lular fluids. The question marks indicate that the precise values for intracellular fluid are unknown. The red line indicates the cell membrane.
شکل ۴-۱. ترکیبات شیمیایی مایعات خارج سلولی و درون سلولی. علامت سوال نشان میدهد که مقادیر دقیق مایع داخل سلولی ناشناخته است. خط قرمز نشان دهنده غشای سلولی است.
THE CELL MEMBRANE IS A LIPID BILAYER WITH CELL MEMBRANE TRANSPORT PROTEINS
The structure of the membrane covering the outside of every cell of the body is discussed in Chapter 2 and illus- trated in Figure 2-3 and Figure 4-2. This membrane con- sists almost entirely of a lipid bilayer with large numbers of protein molecules in the lipid, many of which penetrate all the way through the membrane.
غشای سلولی یک دولایه لیپیدی با پروتئینهای انتقال غشای سلولی است.
ساختار غشایی که بیرون هر سلول بدن را میپوشاند در فصل ۲ مورد بحث قرار گرفته و در شکل ۲-۳ و شکل ۴-۲ نشان داده شده است. این غشاء تقریباً به طور کامل از یک دولایه لیپیدی با تعداد زیادی مولکول پروتئین در لیپید تشکیل شده است که بسیاری از آنها در تمام طول غشاء نفوذ میکنند.
The lipid bilayer is not miscible with the extracellular fluid or the intracellular fluid. Therefore, it constitutes a barrier against movement of water molecules and water- soluble substances between the extracellular and intracel- lular fluid compartments. However, as shown in Figure 4-2 by the leftmost arrow, lipid-soluble substances can diffuse directly through the lipid substance.
دولایه لیپیدی با مایع خارج سلولی یا مایع درون سلولی قابل اختلاط نیست. بنابراین، مانعی در برابر حرکت مولکولهای آب و مواد محلول در آب بین بخشهای مایع خارج سلولی و درون سلولی است. با این حال، همانطور که در شکل ۴-۲ توسط فلش سمت چپ نشان داده شده است، مواد محلول در چربی میتوانند مستقیماً از طریق ماده لیپیدی پخش شوند.
The membrane protein molecules interrupt the con- tinuity of the lipid bilayer, constituting an alternative pathway through the cell membrane. Many of these pen- etrating proteins can function as transport proteins. Some proteins have watery spaces all the way through the mole- cule and allow free movement of water, as well as selected ions or molecules; these proteins are called channel pro- teins. Other proteins, called carrier proteins, bind with molecules or ions that are to be transported, and confor- mational changes in the protein molecules then move the substances through the interstices of the protein to the other side of the membrane. Channel proteins and carrier proteins are usually selective for the types of molecules or ions that are allowed to cross the membrane.
مولکولهای پروتئین غشایی، تداوم دولایه لیپیدی را قطع میکنند و یک مسیر جایگزین را از طریق غشای سلولی تشکیل میدهند. بسیاری از این پروتئینهای نافذ میتوانند به عنوان پروتئینهای انتقال عمل کنند. برخی از پروتئینها دارای فضاهای آبکی در تمام طول مولکول هستند و اجازه حرکت آزادانه آب و همچنین یونها یا مولکولهای انتخاب شده را میدهند. این پروتئینها پروتئینهای کانال نامیده میشوند. پروتئینهای دیگری که پروتئینهای حامل نامیده میشوند، با مولکولها یا یونهایی که قرار است منتقل شوند، پیوند مییابند و تغییرات ساختاری در مولکولهای پروتئین، سپس مواد را از میان بریدگیهای پروتئین به سمت دیگر غشا منتقل میکنند. پروتئینهای کانال و پروتئینهای حامل معمولاً برای انواع مولکولها یا یونهایی که اجازه عبور از غشاء را دارند انتخابی هستند.
“Diffusion” Versus “Active Transport.” Transport through the cell membrane, either directly through the li- pid bilayer or through the proteins, occurs via one of two basic processes, diffusion or active transport.
“انتشار” در مقابل “حمل و نقل فعال.” انتقال از طریق غشای سلولی، مستقیماً از طریق دولایه لیپیدی یا از طریق پروتئینها، از طریق یکی از دو فرآیند اصلی، انتشار یا انتقال فعال، انجام میشود.
Although many variations of these basic mechanisms exist, diffusion means random molecular movement of substances molecule by molecule, either through inter- molecular spaces in the membrane or in combination with a carrier protein. The energy that causes diffusion is the energy of the normal kinetic motion of matter.
اگرچه تغییرات زیادی از این مکانیسمهای اساسی وجود دارد، انتشار به معنای حرکت مولکولی تصادفی مواد مولکول به مولکول است، چه از طریق فضاهای بین مولکولی در غشاء یا در ترکیب با یک پروتئین حامل. انرژی که باعث انتشار میشود، انرژی حرکت جنبشی طبیعی ماده است.
In contrast, active transport means movement of ions or other substances across the membrane in combina- tion with a carrier protein in such a way that the carrier protein causes the substance to move against an energy gradient, such as from a low-concentration state to a high- concentration state. This movement requires an additional source of energy besides kinetic energy. A more detailed explanation of the basic physics and physical chemistry of these two processes is provided later in this chapter.
در مقابل، انتقال فعال به معنای حرکت یونها یا سایر مواد در سراسر غشاء در ترکیب با یک پروتئین حامل است، به گونه ای که پروتئین حامل باعث میشود که ماده بر خلاف گرادیان انرژی حرکت کند، مثلاً از حالت غلظت کم به حالت غلظت بالا. این حرکت علاوه بر انرژی جنبشی به منبع انرژی اضافی نیز نیاز دارد. توضیح دقیق تری از فیزیک پایه و شیمیفیزیک این دو فرآیند در ادامه این فصل ارائه میشود.
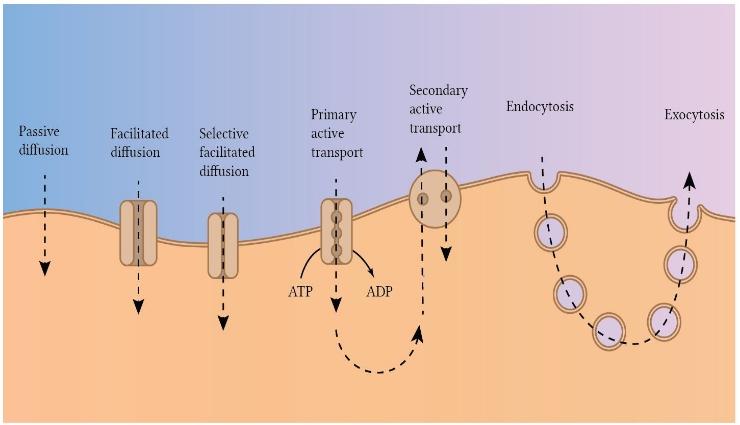
Figure 4-2.
Transport pathways through the cell membrane and the basic mechanisms of transport.
شکل ۴-۲.
مسیرهای انتقال از طریق غشای سلولی و مکانیسمهای اساسی حمل و نقل
Figure 4-3.
Diffusion of a fluid molecule during one thousandth of a second.
شکل ۴-۳.
انتشار یک مولکول سیال در طول یک هزارم ثانیه.
DIFFUSION
All molecules and ions in the body fluids, including water molecules and dissolved substances, are in constant motion, with each particle moving in its separate way. The motion of these particles is what physicists call “heat”— the greater the motion, the higher the temperature-and the motion never ceases, except at absolute zero tem- perature. When a moving molecule, A, approaches a sta- tionary molecule, B, the electrostatic and other nuclear forces of molecule A repel molecule B, transferring some of the energy of motion of molecule A to molecule B. Consequently, molecule B gains kinetic energy of motion, whereas molecule A slows down, losing some of its kinetic energy. As shown in Figure 4-3, a single molecule in a solution bounces among the other molecules-first in one direction, then another, then another, and so forth- randomly bouncing thousands of times each second. This continual movement of molecules among one another in liquids or gases is called diffusion.
انتشار
تمام مولکولها و یونها در مایعات بدن، از جمله مولکولهای آب و مواد محلول، در حرکت ثابت هستند و هر ذره به روش جداگانه خود حرکت میکند. حرکت این ذرات همان چیزی است که فیزیکدانان آن را “گرما” مینامند – هر چه حرکت بیشتر باشد، دما بالاتر میرود – و حرکت هرگز متوقف نمیشود، مگر در دمای صفر مطلق. هنگامیکه یک مولکول متحرک، A، به یک مولکول ساکن، B، نزدیک میشود، نیروهای الکترواستاتیکی و دیگر نیروهای هسته ای مولکول A، مولکول B را دفع میکنند و بخشی از انرژی حرکت مولکول A را به مولکول B منتقل میکنند. همانطور که در شکل ۴-۳ نشان داده شده است، یک مولکول منفرد در یک محلول در بین مولکولهای دیگر ابتدا در یک جهت، سپس جهت دیگر، سپس در جهت دیگر و به همین ترتیب به طور تصادفی هزاران بار در هر ثانیه میپرد. این حرکت مداوم مولکولها در بین یکدیگر در مایعات یا گازها انتشار نامیده میشود.
Ions diffuse in the same manner as whole molecules, and even suspended colloid particles diffuse in a similar manner, except that the colloids diffuse far less rapidly than molecular substances because of their large size.
یونها مانند مولکولهای کامل منتشر میشوند و حتی ذرات کلوئیدی معلق نیز به روشی مشابه منتشر میشوند، با این تفاوت که کلوئیدها به دلیل اندازه بزرگشان با سرعت بسیار کمتری نسبت به مواد مولکولی منتشر میشوند.
DIFFUSION THROUGH THE CELL MEMBRANE
Diffusion through the cell membrane is divided into two subtypes, called simple diffusion and facilitated diffusion. Simple diffusion means that kinetic movement of mol- ecules or ions occurs through a membrane opening or through intermolecular spaces without interaction with carrier proteins in the membrane. The rate of diffusion is determined by the amount of substance available, the velocity of kinetic motion, and the number and sizes of openings in the membrane through which the molecules or ions can move.
انتشار از طریق غشای سلولی
انتشار از طریق غشای سلولی به دو زیر گروه تقسیم میشود که به آنها انتشار ساده و انتشار تسهیل شده میگویند. انتشار ساده به این معنی است که حرکت جنبشی مولکولها یا یونها از طریق دهانه غشاء یا از طریق فضاهای بین مولکولی بدون برهمکنش با پروتئینهای حامل در غشاء انجام میشود. سرعت انتشار با مقدار ماده موجود، سرعت حرکت جنبشی، و تعداد و اندازه روزنههای غشایی که مولکولها از آن عبور میکنند، تعیین میشود یا یونها میتوانند حرکت کنند.
Facilitated diffusion requires interaction of a carrier protein. The carrier protein aids passage of molecules or ions through the membrane by binding chemically with them and shuttling them through the membrane in this form.
انتشار تسهیل شده نیاز به تعامل یک پروتئین حامل دارد. پروتئین حامل به عبور مولکولها یا یونها از غشاء با اتصال شیمیایی به آنها و عبور دادن آنها از طریق غشاء به این شکل کمک میکند.
Simple diffusion can occur through the cell membrane by two pathways: (1) through the interstices of the lipid bilayer if the diffusing substance is lipid-soluble; and (2) through watery channels that penetrate all the way through some of the large transport proteins, as shown to the left in Figure 4-2.
انتشار ساده میتواند از طریق غشای سلولی از طریق دو مسیر اتفاق بیفتد: (۱) در صورتی که ماده انتشار دهنده محلول در چربی باشد، از میان لایههای دولایه لیپیدی. و (۲) از طریق کانالهای آبکی که تمام راه را از طریق برخی از پروتئینهای حمل و نقل بزرگ نفوذ میکنند، همانطور که در شکل ۴-۲ در سمت چپ نشان داده شده است.
Diffusion of Lipid-Soluble Substances Through the Lipid Bilayer. The lipid solubility of a substance is an important factor for determining how rapidly it diffuses through the lipid bilayer. For example, the lipid solubili- ties of oxygen, nitrogen, carbon dioxide, and alcohols are high, and all these substances can dissolve directly in the lipid bilayer and diffuse through the cell membrane in the same manner that diffusion of water solutes occurs in a watery solution. The rate of diffusion of each of these sub- stances through the membrane is directly proportional to its lipid solubility. Especially large amounts of oxygen can be transported in this way; therefore, oxygen can be de- livered to the interior of the cell almost as though the cell membrane did not exist.
انتشار مواد محلول در چربی از طریق لایه چربی. حلالیت در چربی یک ماده عامل مهمیبرای تعیین سرعت انتشار آن در دو لایه لیپیدی است. به عنوان مثال، حلالیتهای چربی اکسیژن، نیتروژن، دی اکسید کربن و الکلها زیاد است و همه این مواد میتوانند مستقیماً در دولایه لیپیدی حل شوند و از طریق غشای سلولی پخش شوند به همان ترتیبی که انتشار املاح آب در محلول آبکی اتفاق میافتد. سرعت انتشار هر یک از این مواد از طریق غشا با حلالیت چربی آن نسبت مستقیم دارد. به خصوص مقادیر زیادی از اکسیژن را میتوان از این طریق منتقل کرد. بنابراین، اکسیژن را میتوان به داخل سلول رساند تقریباً به گونه ای که گویی غشای سلولی وجود ندارد.
Diffusion of Water and Other Lipid-Insoluble Mole- cules Through Protein Channels. Even though water is highly insoluble in the membrane lipids, it readily passes through channels in protein molecules that penetrate all the way through the membrane. Many of the body’s cell membranes contain protein “pores” called aquaporins that selectively permit rapid passage of water through the membrane. The aquaporins are highly specialized, and there are at least 13 different types in various cells of mammals.
انتشار آب و سایر مولکولهای نامحلول در چربی از طریق کانالهای پروتئینی. با وجود اینکه آب در لیپیدهای غشاء بسیار نامحلول است، اما به آسانی از کانالهای مولکولهای پروتئینی عبور میکند که تا آخر غشا نفوذ میکنند. بسیاری از غشاهای سلولی بدن حاوی “منافذ” پروتئینی به نام آکواپورین هستند که به طور انتخابی اجازه عبور سریع آب از غشاء را میدهند. آکواپورینها بسیار تخصصی هستند و حداقل ۱۳ نوع مختلف در سلولهای مختلف پستانداران وجود دارد.
The rapidity with which water molecules can diffuse through most cell membranes is astounding. For example, the total amount of water that diffuses in each direction through the red blood cell membrane during each second is about 100 times as great as the volume of the red blood cell.
سرعتی که مولکولهای آب میتوانند در بیشتر غشای سلولی منتشر شوند، شگفتانگیز است. به عنوان مثال، مقدار کل آبی که در هر جهت پخش میشوداز طریق غشای گلبول قرمز در هر ثانیه حدود ۱۰۰ برابر حجم گلبول قرمز است.
Other lipid-insoluble molecules can pass through the protein pore channels in the same way as water molecules if they are water-soluble and small enough. However, as they become larger, their penetration falls off rapidly. For example, the diameter of the urea molecule is only 20% greater than that of water, yet its penetration through the cell membrane pores is about 1000 times less than that of water. Even so, given the astonishing rate of water pen- etration, this amount of urea penetration still allows rapid transport of urea through the membrane within minutes.
سایر مولکولهای نامحلول در چربی میتوانند مانند مولکولهای آب از کانالهای منافذ پروتئین عبور کنند، اگر محلول در آب و به اندازه کافی کوچک باشند. با این حال، با بزرگتر شدن آنها، نفوذ آنها به سرعت کاهش مییابد. به عنوان مثال، قطر مولکول اوره تنها ۲۰٪ بیشتر از قطر آب است، اما نفوذ آن از طریق منافذ غشای سلولی حدود ۱۰۰۰ برابر کمتر از آب است. با این حال، با توجه به سرعت شگفتانگیز نفوذ آب، این میزان نفوذ اوره همچنان امکان انتقال سریع اوره از طریق غشا را در عرض چند دقیقه فراهم میکند.
DIFFUSION THROUGH PROTEIN PORES AND CHANNELS-SELECTIVE PERMEABILITY AND “GATING” OF CHANNELS
Computerized three-dimensional reconstructions of pro- tein pores and channels have demonstrated tubular path- ways all the way from the extracellular to the intracellular fluid. Therefore, substances can move by simple diffusion directly along these pores and channels from one side of the membrane to the other.
انتشار از طریق منافذ و کانالهای پروتئینی – نفوذ پذیری انتخابی و “دروازه” کانالها
بازسازیهای سه بعدی کامپیوتری منافذ و کانالهای پروتئینی، مسیرهای لوله ای را از مایع خارج سلولی به داخل سلولی نشان داده است. بنابراین، مواد میتوانند با انتشار ساده مستقیماً در طول این منافذ و کانالها از یک طرف غشاء به طرف دیگر حرکت کنند.
Pores are composed of integral cell membrane proteins that form open tubes through the membrane and are always open. However, the diameter of a pore and its electrical charges provide selectivity that permits only certain mole- cules to pass through. For example, aquaporins permit rapid passage of water through cell membranes but exclude other molecules. Aquaporins have a narrow pore that permits water molecules to diffuse through the membrane in single file. The pore is too narrow to permit passage of any hydrated ions. As discussed in Chapters 28 and 76, the density of some aquaporins (e.g., aquaporin-2) in cell membranes is not static but is altered in different physiological conditions.
منافذ از پروتئینهای انتگرال غشای سلولی تشکیل شده اند که لولههای باز را از طریق غشاء تشکیل میدهند و همیشه باز هستند. با این حال، قطر منافذ و بارهای الکتریکی آن گزینش پذیری را فراهم میکند که فقط به مولکولهای خاصی اجازه عبور میدهد. به عنوان مثال، آکواپورینها اجازه عبور سریع آب از غشای سلولی را میدهند اما مولکولهای دیگر را حذف میکنند. آکواپورینها دارای منافذ باریکی هستند که به مولکولهای آب اجازه میدهد از طریق غشاء در یک فایل منفرد پخش شوند. منافذ خیلی باریک است که اجازه عبور یونهای هیدراته را نمیدهد. همانطور که در فصلهای ۲۸ و ۷۶ بحث شد، چگالی برخی از آکواپورینها (به عنوان مثال، آکواپورین-۲) در غشای سلولی ساکن نیست، اما در شرایط مختلف فیزیولوژیکی تغییر میکند.
The protein channels are distinguished by two impor- tant characteristics: (1) they are often selectively perme- able to certain substances; and (2) many of the channels can be opened or closed by gates that are regulated by electrical signals (voltage-gated channels) or chemicals that bind to the channel proteins (ligand-gated channels). Thus, ion channels are flexible dynamic structures, and subtle conformational changes influence gating and ion selectivity.
کانالهای پروتئینی با دو ویژگی مهم متمایز میشوند: (۱) آنها اغلب به طور انتخابی به مواد خاصی نفوذ میکنند. و (۲) بسیاری از کانالها را میتوان با گیتهایی باز یا بسته کرد که توسط سیگنالهای الکتریکی (کانالهای دریچه ولتاژ) یا مواد شیمیایی که به پروتئینهای کانال متصل میشوند (کانالهای دریچه ای لیگاند) تنظیم میشوند. بنابراین، کانالهای یونی ساختارهای دینامیکی انعطافپذیری هستند و تغییرات ساختاری ظریف بر گیتینگ و انتخاب یون تأثیر میگذارد.
Selective Permeability of Protein Channels. Many protein channels are highly selective for transport of one or more specific ions or molecules. This selectivity results from specific characteristics of the channel, such as its diam- eter, shape, and the nature of the electrical charges and chemical bonds along its inside surfaces.
نفوذ پذیری انتخابی کانالهای پروتئینی. بسیاری از کانالهای پروتئینی برای انتقال یک یا چند یون یا مولکول خاص بسیار انتخابی هستند. این گزینش پذیری ناشی از ویژگیهای خاص کانال، مانند قطر، شکل، و ماهیت بارهای الکتریکی و پیوندهای شیمیایی در امتداد سطوح داخلی آن است.
Potassium channels permit passage of potassium ions across the cell membrane about 1000 times more read- ily than they permit passage of sodium ions. This high degree of selectivity cannot be explained entirely by the molecular diameters of the ions because potassium ions are slightly larger than sodium ions. Using x-ray crys- tallography, potassium channels were found to have a tetrameric structure consisting of four identical protein subunits surrounding a central pore (Figure 4-4). At the top of the channel pore are pore loops that form a narrow selectivity filter. Lining the selectivity filter are carbonyl oxygens. When hydrated potassium ions enter the selec- tivity filter, they interact with the carbonyl oxygens and shed most of their bound water molecules, permitting the dehydrated potassium ions to pass through the channel. The carbonyl oxygens are too far apart, however, to enable them to interact closely with the smaller sodium ions, which are therefore effectively excluded by the selectivity filter from passing through the pore.
کانالهای پتاسیم اجازه عبور یونهای پتاسیم از غشای سلولی را حدود ۱۰۰۰ برابر آسانتر از عبور یونهای سدیم میدهند. این درجه انتخاب پذیری بالا را نمیتوان به طور کامل با قطر مولکولی یونها توضیح داد زیرا یونهای پتاسیم کمیبزرگتر از یونهای سدیم هستند. با استفاده از کریستالوگرافی اشعه ایکس، کانالهای پتاسیم دارای ساختار تترامری متشکل از چهار زیرواحد پروتئینی یکسان در اطراف یک منفذ مرکزی بودند (شکل ۴-۴). در بالای منافذ کانال حلقههای منافذی وجود دارد که یک فیلتر انتخابی باریک را تشکیل میدهند. پوشش فیلتر انتخابی، اکسیژنهای کربونیل است. هنگامیکه یونهای پتاسیم هیدراته وارد فیلتر انتخابی میشوند، با اکسیژنهای کربونیل برهم کنش میکنند و بیشتر مولکولهای آب محدود شده خود را میریزند و به یونهای پتاسیم آب شده اجازه میدهند از کانال عبور کنند. با این حال، اکسیژنهای کربونیل بسیار از هم دور هستند تا بتوانند با یونهای سدیم کوچکتر تعامل نزدیک داشته باشند، بنابراین فیلتر انتخابپذیری به طور موثری از عبور از منافذ حذف میشود.
Different selectivity filters for the various ion channels are believed to determine, in large part, the specificity of various channels for cations or anions or for particular ions, such as sodium (Na), potassium (K+), and calcium (Ca2+), that gain access to the channels.
اعتقاد بر این است که فیلترهای انتخابی متفاوت برای کانالهای یونی مختلف، تا حد زیادی، ویژگی کانالهای مختلف را برای کاتیونها یا آنیونها یا یونهای خاصی مانند سدیم (Na)، پتاسیم (K+) و کلسیم (Ca2+) تعیین میکنند که به کانالها دسترسی پیدا میکنند.
One of the most important of the protein channels, the sodium channel, is only 0.3 to 0.5 nanometer in diameter, but the ability of sodium channels to discrimi- nate sodium ions among other competing ions in the surrounding fluids is crucial for proper cellular function.
یکی از مهمترین کانالهای پروتئینی، کانال سدیم، تنها ۰.۳ تا ۰.۵ نانومتر قطر دارد، اما توانایی کانالهای سدیم در تمایز یونهای سدیم در میان سایر یونهای رقیب در مایعات اطراف، برای عملکرد مناسب سلولی حیاتی است.
The narrowest part of the sodium channel’s open pore, the selectivity filter, is lined with strongly negatively charged amino acid residues, as shown in the top panel of Figure 4-5. These strong negative charges can pull small dehydrated sodium ions away from their hydrat- ing water molecules into these channels, although the ions do not need to be fully dehydrated to pass through the channels. Once in the channel, the sodium ions dif- fuse in either direction according to the usual laws of diffusion. Thus, the sodium channel is highly selective for passage of sodium ions.
همانطور که در صفحه بالای شکل ۴-۵ نشان داده شده است، باریکترین قسمت منافذ باز کانال سدیم، فیلتر گزینش پذیری، با بقایای اسید آمینه با بار منفی قوی پوشانده شده است. این بارهای منفی قوی میتوانند یونهای سدیم کم آب شده کوچک را از مولکولهای آب هیدراته کننده خود به این کانالها بکشانند، اگرچه یونها برای عبور از کانالها نیازی به آبگیری کامل ندارند. هنگامیکه در کانال قرار میگیرند، یونهای سدیم طبق قوانین معمول انتشار در هر دو جهت منتشر میشوند. بنابراین، کانال سدیم برای عبور یونهای سدیم بسیار انتخابی است.
Figure 4-4. The structure of a potassium channel.
The channel is com- posed of four subunits (only two of which are shown), each with two transmembrane helices. A narrow selectivity filter is formed from the pore loops, and carbonyl oxygens line the walls of the selectivity filter, forming sites for transiently binding dehydrated potassium ions. The in- teraction of the potassium ions with carbonyl oxygens causes the potas- sium ions to shed their bound water molecules, permitting the dehy- drated potassium ions to pass through the pore.
شکل ۴-۴. ساختار یک کانال پتاسیم.
کانال از چهار زیر واحد تشکیل شده است (فقط دو زیرواحد نشان داده شده است)، که هر کدام دارای دو مارپیچ گذرنده است. یک فیلتر انتخابی باریک از حلقههای منافذ تشکیل میشود و اکسیژنهای کربونیل دیوارههای فیلتر گزینشپذیری را میپوشانند و مکانهایی را برای اتصال گذرا یونهای پتاسیم دهیدراته تشکیل میدهند. برهمکنش یونهای پتاسیم با اکسیژنهای کربونیل باعث میشود یونهای پتاسیم مولکولهای آب محدود خود را از بین ببرند و به یونهای پتاسیم آبخورده اجازه عبور از منافذ را میدهند.
Figure 4-5.
Transport of sodium and potassium ions through protein channels. Also shown are conformational changes in the protein mol- ecules to open or close the “gates” guarding the channels.
شکل ۴-۵.
انتقال یونهای سدیم و پتاسیم از طریق کانالهای پروتئینی. همچنین تغییرات ساختاری در مولکولهای پروتئین برای باز یا بسته کردن “دروازه”های محافظ کانالها نشان داده شده است.
Gating of Protein Channels. Gating of protein chan- nels provides a means of controlling ion permeability of the channels. This mechanism is shown in both panels of Figure 4-5 for selective gating of sodium and potassium ions. Some of the gates are thought to be gatelike exten- sions of the transport protein molecule, which can close the opening of the channel or can be lifted away from the opening by a conformational change in the shape of the protein molecule.
دروازه کانالهای پروتئینی. راه اندازی کانالهای پروتئینی وسیله ای برای کنترل نفوذپذیری یون کانالها فراهم میکند. این مکانیسم در هر دو پانل شکل ۴-۵ برای دروازه بندی انتخابی یونهای سدیم و پتاسیم نشان داده شده است. تصور میشود که برخی از دروازهها امتداد دروازه مانند مولکول پروتئین حمل و نقل هستند که میتوانند دهانه کانال را ببندند یا میتوانند با تغییر ساختاری در شکل مولکول پروتئین از دهانه خارج شوند.
The opening and closing of gates are controlled in two principal ways:
باز و بسته شدن دروازهها به دو روش اصلی کنترل میشود:
۱. Voltage gating. In the case of voltage gating, the molecular conformation of the gate or its chemi- cal bonds responds to the electrical potential across the cell membrane. For example, in the top panel of Figure 4-5, a strong negative charge on the inside of the cell membrane may cause the outside sodium gates to remain tightly closed. Conversely, when the inside of the membrane loses its negative charge, these gates open suddenly and allow sodium to pass inward through the sodium pores. This process is the basic mechanism for eliciting action potentials in nerves that are responsible for nerve signals. In the bottom panel of Figure 4-5, the potassium gates are on the intracellular ends of the potassium chan- nels, and they open when the inside of the cell mem- brane becomes positively charged. The opening of these gates is partly responsible for terminating the action potential, a process discussed in Chapter 5.
2. Chemical (ligand) gating. Some protein channel gates are opened by the binding of a chemical sub- stance (a ligand) with the protein, which causes a conformational or chemical bonding change in the protein molecule that opens or closes the gate. One of the most important instances of chemical gat- ing is the effect of the neurotransmitter acetylcho- line on the acetylcholine receptor which serves as a ligand-gated ion channel. Acetylcholine opens the gate of this channel, providing a negatively charged pore about 0.65 nanometer in diameter that allows uncharged molecules or positive ions smaller than this diameter to pass through. This gate is exceed- ingly important for the transmission of nerve sig- nals from one nerve cell to another (see Chapter 46) and from nerve cells to muscle cells to cause muscle contraction (see Chapter 7).
۱. دروازه ولتاژ. در مورد دریچه ولتاژ، ترکیب مولکولی گیت یا پیوندهای شیمیایی آن به پتانسیل الکتریکی در سراسر غشای سلولی پاسخ میدهد. به عنوان مثال، در پانل بالای شکل ۴-۵، یک بار منفی قوی در داخل غشای سلولی ممکن است باعث شود که دروازههای سدیم بیرونی کاملا بسته بمانند. برعکس، زمانی که درون غشاء بار منفی خود را از دست میدهد، این دروازهها به طور ناگهانی باز میشوند و به سدیم اجازه عبور از منافذ سدیم را به داخل میدهند. این فرآیند مکانیسم اساسی برای برانگیختن پتانسیلهای عمل در اعصابی است که مسئول سیگنالهای عصبی هستند. در پانل پایینی شکل ۴-۵، دروازههای پتاسیم در انتهای درون سلولی کانالهای پتاسیم قرار دارند و زمانی باز میشوند که درون غشای سلولی دارای بار مثبت شود. باز کردن این دروازهها تا حدی مسئول پایان دادن به پتانسیل عمل است، فرآیندی که در فصل ۵ مورد بحث قرار گرفته است.
2. دروازه بندی شیمیایی (لیگاند). برخی از دروازههای کانال پروتئینی با اتصال یک ماده شیمیایی (یک لیگاند) با پروتئین باز میشوند که باعث تغییر پیوند ساختاری یا شیمیایی در مولکول پروتئین میشود که دروازه را باز یا بسته میکند. یکی از مهمترین نمونههای دروازهبندی شیمیایی، اثر انتقالدهنده عصبی استیل کولین بر گیرنده استیل کولین است که به عنوان یک کانال یونی دردار با لیگاند عمل میکند. استیل کولین دروازه این کانال را باز میکند و منافذی با بار منفی با قطر حدود ۰.۶۵ نانومتر ایجاد میکند که به مولکولهای بدون بار یا یونهای مثبت کوچکتر از این قطر اجازه عبور میدهد. این دروازه برای انتقال سیگنالهای عصبی از یک سلول عصبی به سلول عصبی دیگر (به فصل ۴۶ مراجعه کنید) و از سلولهای عصبی به سلولهای عضلانی برای ایجاد انقباض عضلانی بسیار مهم است (به فصل ۷ مراجعه کنید).
Open-State Versus Closed-State of Gated Channels. Figure 4-64 shows two recordings of electrical current flowing through a single sodium channel when there was an approximately 25-millivolt potential gradient across the membrane. Note that the channel conducts current in an all-or-none fashion. That is, the gate of the channel snaps open and then snaps closed, with each open state lasting for only a fraction of a millisecond, up to sever- al milliseconds, demonstrating the rapidity with which changes can occur during the opening and closing of the protein gates. At one voltage potential, the channel may remain closed all the time or almost all the time, whereas at another voltage, it may remain open either all or most of the time. At in-between voltages, as shown in the fig- ure, the gates tend to snap open and closed intermittently, resulting in an average current flow somewhere between the minimum and maximum.
حالت باز در مقابل وضعیت بسته کانالهای دردار. شکل ۴-۶۴ دو ضبط جریان الکتریکی را نشان میدهد که از طریق یک کانال سدیم منفرد جریان مییابد، زمانی که یک گرادیان پتانسیل تقریباً ۲۵ میلی ولت در سراسر غشاء وجود داشت. توجه داشته باشید که کانال جریان را به صورت همه یا هیچ هدایت میکند. به این معنی که دروازه کانال باز میشود و سپس بسته میشود، با هر حالت باز تنها کسری از میلی ثانیه، تا چندین میلی ثانیه طول میکشد، که نشان میدهد سرعت تغییرات میتواند در طول باز و بسته شدن دروازههای پروتئین رخ دهد. در یک پتانسیل ولتاژ، کانال ممکن است همیشه یا تقریباً همیشه بسته بماند، در حالی که در یک ولتاژ دیگر، ممکن است تمام یا بیشتر اوقات باز بماند. همانطور که در شکل نشان داده شده است، در ولتاژهای بینابینی، دروازهها به طور متناوب باز و بسته میشوند و در نتیجه جریان متوسطی بین حداقل و حداکثر جریان دارد.
Patch Clamp Method for Recording lon Current Flow Through Single Channels. The patch clamp method for recording ion current flow through single protein chan- nels is illustrated in Figure 4-6B. A micropipette with a tip diameter of only 1 or 2 micrometers is abutted against the outside of a cell membrane. Suction is then applied inside the pipette to pull the membrane against the tip of the pipette, which creates a seal where the edges of the pipette touch the cell membrane. The result is a minute membrane “patch” at the tip of the pipette through which electrical current flow can be recorded.
روش وصله گیره برای ضبط جریان جریان از طریق کانالهای تک. روش گیره پچ برای ثبت جریان یونی از طریق کانالهای تک پروتئینی در شکل ۴-6B نشان داده شده است. یک میکروپیپت با قطر نوک فقط ۱ یا ۲ میکرومتر در قسمت بیرونی غشای سلولی قرار میگیرد. سپس مکش در داخل پیپت اعمال میشود تا غشاء را به سمت نوک پیپت بکشد، که در آن یک مهر و موم ایجاد میکند که لبههای پیپت با غشای سلولی تماس میگیرد. نتیجه یک “لکه” غشایی دقیقه ای در نوک پیپت است که از طریق آن میتوان جریان الکتریکی را ثبت کرد.
Alternatively, as shown at the bottom right in Figure 4-6B, the small cell membrane patch at the end of the pipette can be torn away from the cell. The pipette with its sealed patch is then inserted into a free solution, which allows the concentrations of ions both inside the micropi- pette and in the outside solution to be altered as desired. Also, the voltage between the two sides of the membrane can be set, or “clamped,” to a given voltage.
روش دیگر، همانطور که در پایین سمت راست در شکل ۴-6B نشان داده شده است، وصله غشای سلول کوچک در انتهای پیپت میتواند از سلول جدا شود. سپس پیپت با چسب مهر و موم شده در محلول آزاد وارد میشود که اجازه میدهد غلظت یونها هم در داخل میکروپیپت و هم در محلول بیرونی به دلخواه تغییر یابد. همچنین، ولتاژ بین دو طرف غشا را میتوان به یک ولتاژ معین تنظیم کرد یا “کلمپ” کرد.
It has been possible to make such patches small enough so that only a single channel protein is found in the mem- brane patch being studied. By varying the concentrations of different ions, as well as the voltage across the mem- brane, one can determine the transport characteristics of the single channel, along with its gating properties.
امکان ایجاد چنین تکههایی به اندازهای کوچک وجود دارد که فقط یک پروتئین کانالی در پچ غشایی مورد مطالعه یافت شود. با تغییر غلظت یونهای مختلف و همچنین ولتاژ روی غشا، میتوان ویژگیهای انتقال کانال منفرد را به همراه خواص دروازهای آن تعیین کرد.
Figure 4-6.
A, Recording of current flow through a single voltage- gated sodium channel, demonstrating the all or none principle for opening and closing of the channel. B, Patch clamp method for re- cording current flow through a single protein channel. To the left, the recording is performed from a “patch” of a living cell membrane. To the right, the recording is from a membrane patch that has been torn away from the cell.
شکل ۴-۶.
الف، ثبت جریان جریان از طریق یک کانال سدیم دارای ولتاژ، که اصل همه یا هیچ را برای باز و بسته شدن کانال نشان میدهد. ب، روش پچ گیره برای ثبت جریان جریان از طریق یک کانال پروتئینی واحد. در سمت چپ، ضبط از یک “پچ” از یک غشای سلول زنده انجام میشود. در سمت راست، ضبط از یک تکه غشایی است که از سلول جدا شده است.
Figure 4-7.
Effect of concentration of a substance on the rate of diffusion through a membrane by simple diffusion and facilitated diffusion. This graph shows that facilitated diffusion approaches a maximum rate, called the Vmax
شکل ۴-۷.
تأثیر غلظت یک ماده بر سرعت انتشار از طریق غشاء با انتشار ساده و انتشار آسان. این نمودار نشان میدهد که انتشار تسهیل شده به حداکثر سرعتی نزدیک میشود که Vmax نامیده میشود
FACILITATED DIFFUSION REQUIRES MEMBRANE CARRIER PROTEINS
Facilitated diffusion is also called carrier-mediated diffu- sion because a substance transported in this manner dif- fuses through the membrane with the help of a specific carrier protein. That is, the carrier facilitates diffusion of the substance to the other side.
انتشار تسهیل شده به پروتئینهای حامل غشایی نیاز دارد
انتشار تسهیل شده، انتشار با واسطه حامل نیز نامیده میشود زیرا ماده ای که به این روش منتقل میشود با کمک یک پروتئین حامل خاص در غشاء پخش میشود. یعنی حامل، انتشار ماده را به طرف دیگر تسهیل میکند.
Facilitated diffusion differs from simple diffusion in the following important way. Although the rate of simple dif- fusion through an open channel increases proportionately with the concentration of the diffusing substance, in facili- tated diffusion the rate of diffusion approaches a maximum, called Vmax as the concentration of the diffusing substance increases. This difference between simple diffusion and facil- itated diffusion is demonstrated in Figure 4-7. The figure shows that as the concentration of the diffusing substance increases, the rate of simple diffusion continues to increase proportionately but, in the case of facilitated diffusion, the rate of diffusion cannot rise higher than the Vmax level.
انتشار تسهیل شده به روش مهم زیر با انتشار ساده متفاوت است. اگرچه سرعت انتشار ساده از طریق یک کانال باز متناسب با غلظت ماده منتشر کننده افزایش مییابد، اما در انتشار تسهیل شده سرعت انتشار به حداکثر میرسد که با افزایش غلظت ماده منتشر کننده، Vmax نامیده میشود. این تفاوت بین انتشار ساده و انتشار تسهیل شده در شکل ۴-۷ نشان داده شده است. شکل نشان میدهد که با افزایش غلظت ماده انتشار دهنده، نرخ انتشار ساده به طور متناسب به افزایش خود ادامه میدهد، اما در مورد انتشار تسهیل شده، سرعت انتشار نمیتواند بالاتر از سطح Vmax افزایش یابد.
What is it that limits the rate of facilitated diffusion? A probable answer is the mechanism illustrated in Figure 4-8. This Figure shows a carrier protein with a pore large enough to transport a specific molecule partway through. It also shows a binding receptor on the inside of the pro- tein carrier. The molecule to be transported enters the pore and becomes bound. Then, in a fraction of a second, a conformational or chemical change occurs in the carrier protein, so that the pore now opens to the opposite side of the membrane. Because the binding force of the recep- tor is weak, the thermal motion of the attached molecule causes it to break away and be released on the opposite side of the membrane. The rate at which molecules can be transported by this mechanism can never be greater than the rate at which the carrier protein molecule can undergo change back and forth between its two states. Note specifically, though, that this mechanism allows the transported molecule to move-that is, diffuse-in either direction through the membrane.
چه چیزی سرعت انتشار تسهیل شده را محدود میکند؟ پاسخ محتمل مکانیسمیاست که در شکل ۴-۸ نشان داده شده است. این شکل یک پروتئین حامل را نشان میدهد که منافذ آن به اندازه کافی بزرگ است تا یک مولکول خاص را از طریق آن منتقل کند. همچنین یک گیرنده اتصال در داخل حامل پروتئین را نشان میدهد. مولکولی که قرار است منتقل شود وارد منافذ شده و متصل میشود. سپس، در کسری از ثانیه، یک تغییر ساختاری یا شیمیایی در پروتئین حامل رخ میدهد، به طوری که منافذ در حال حاضر به سمت مخالف غشاء باز میشود. از آنجایی که نیروی اتصال گیرنده ضعیف است، حرکت حرارتی مولکول متصل باعث جدا شدن آن و رها شدن آن در طرف مقابل غشاء میشود. سرعت انتقال مولکولها توسط این مکانیسم هرگز نمیتواند بیشتر از سرعتی باشد که مولکول پروتئین حامل میتواند بین دو حالت خود تغییر کند. البته به طور خاص توجه داشته باشید که این مکانیسم به مولکول منتقل شده اجازه میدهد تا حرکت کند – یعنی در هر جهت در غشاء پخش شود.
Among the many substances that cross cell mem- branes by facilitated diffusion are glucose and most of the amino acids. In the case of glucose, at least 14 members of a family of membrane proteins (called GLUT) that trans- port glucose molecules have been discovered in various tissues. Some of these GLUT proteins transport other monosaccharides that have structures similar to that of glucose, including galactose and fructose. One of these, glucose transporter 4 (GLUT4), is activated by insulin, which can increase the rate of facilitated diffusion of glu- cose as much as 10- to 20-fold in insulin-sensitive tissues. This is the principal mechanism whereby insulin controls glucose use in the body, as discussed in Chapter 79.
ر میان بسیاری از موادی که با انتشار تسهیل شده از غشای سلولی عبور میکنند، گلوکز و بیشتر اسیدهای آمینه هستند. در مورد گلوکز، حداقل ۱۴ عضو از خانواده ای از پروتئینهای غشایی (به نام GLUT) که مولکولهای گلوکز را انتقال میدهند در بافتهای مختلف کشف شده اند. برخی از این پروتئینهای GLUT مونوساکاریدهای دیگری را که ساختاری مشابه گلوکز دارند، از جمله گالاکتوز و فروکتوز، منتقل میکنند. یکی از اینها، انتقال دهنده گلوکز ۴ (GLUT4)، توسط انسولین فعال میشود، که میتواند سرعت انتشار آسان گلوکز را تا ۱۰ تا ۲۰ برابر در بافتهای حساس به انسولین افزایش دهد. این مکانیسم اصلی است که به موجب آن انسولین مصرف گلوکز را در بدن کنترل میکند، همانطور که در فصل ۷۹ بحث شد.
Figure 4-8.
Postulated mechanism for facilitated diffusion.
شکل ۴-۸.
مکانیسم فرضی برای انتشار تسهیل شده
FACTORS THAT AFFECT NET RATE OF DIFFUSION
By now, it is evident that many substances can diffuse through the cell membrane. What is usually important is the net rate of diffusion of a substance in the desired direction. This net rate is determined by several factors.
عواملی که بر نرخ خالص انتشار تأثیر میگذارد
در حال حاضر، واضح است که بسیاری از مواد میتوانند از طریق غشای سلولی پخش شوند. آنچه معمولاً مهم است، سرعت خالص انتشار یک ماده در جهت مورد نظر است. این نرخ خالص توسط عوامل مختلفی تعیین میشود.
Net Diffusion Rate Is Proportional to the Concen- tration Difference Across a Membrane. Figure 4-94 shows a cell membrane with a high concentration of a substance on the outside and a low concentration of a substance on the inside. The rate at which the substance diffuses inward is proportional to the concentration of molecules on the outside because this concentration de- termines how many molecules strike the outside of the membrane each second. Conversely, the rate at which molecules diffuse outward is proportional to their con- centration inside the membrane. Therefore, the rate of net diffusion into the cell is proportional to the concentration on the outside minus the concentration on the inside:
in which C, is the concentration outside and C, is the con- centration inside the cell.
نرخ انتشار خالص متناسب با اختلاف غلظت در سراسر غشاء است. شکل ۴-۹۴ یک غشای سلولی را با غلظت بالای یک ماده در خارج و غلظت کم یک ماده در داخل نشان میدهد. سرعت انتشار ماده به داخل با غلظت مولکولها در خارج متناسب است زیرا این غلظت تعیین میکند که در هر ثانیه چند مولکول به بیرون غشاء برخورد میکند. برعکس، سرعت انتشار مولکولها به بیرون متناسب با غلظت آنها در داخل غشا است. بنابراین، سرعت انتشار خالص به داخل سلول متناسب با غلظت در خارج منهای غلظت در داخل است:
که در آن C، غلظت خارج و C، غلظت داخل سلول است.
Figure 4-9.
Effect of concentration difference (A), electrical poten- tial difference affecting negative ions (B), and pressure difference (C) to cause diffusion of molecules and ions through a cell membrane. Co, concentration outside the cell; C, concentration inside the cell; P1 pressure 1; P2 pressure 2.
شکل ۴-۹.
اثر اختلاف غلظت (A)، اختلاف پتانسیل الکتریکی بر یونهای منفی (B) و اختلاف فشار (C) برای انتشار مولکولها و یونها از طریق غشای سلولی. شرکت، غلظت خارج از سلول؛ ج، غلظت داخل سلول. فشار P1 1; فشار P2 2.
Membrane Electrical Potential and Diffusion of lons-The “Nernst Potential.” If an electrical poten- tial is applied across the membrane, as shown in Figure 4-9B, the electrical charges of the ions cause them to move through the membrane even though no concen- tration difference exists to cause movement. Thus, in the left panel of Figure 4-9B, the concentration of negative ions is the same on both sides of the membrane, but a positive charge has been applied to the right side of the membrane, and a negative charge has been applied to the left, creating an electrical gradient across the membrane. The positive charge attracts the negative ions, whereas the negative charge repels them. Therefore, net diffusion oc- curs from left to right. After some time, large quantities of negative ions have moved to the right, creating the condi- tion shown in the right panel of Figure 4-9B, in which a concentration difference of the ions has developed in the direction opposite to the electrical potential difference. The concentration difference now tends to move the ions to the left, whereas the electrical difference tends to move them to the right. When the concentration difference rises high enough, the two effects balance each other. At normal body temperature (98.6°F; 37°C), the electrical dif- ference that will balance a given concentration difference of univalent ions-such as Na+ ions-can be determined from the following formula, called the Nernst equation:
EMF (in millivolts) = +61log
پتانسیل الکتریکی غشایی و انتشار lons – “پتانسیل Nernst”. اگر یک پتانسیل الکتریکی در سراسر غشاء اعمال شود، همانطور که در شکل ۴-9B نشان داده شده است، بارهای الکتریکی یونها باعث میشود که آنها از طریق غشاء حرکت کنند، حتی اگر هیچ تفاوت غلظتی برای ایجاد حرکت وجود نداشته باشد. بنابراین، در پانل سمت چپ شکل ۴-9B، غلظت یونهای منفی در دو طرف غشا یکسان است، اما یک بار مثبت به سمت راست غشاء و یک بار منفی به سمت چپ اعمال شده است و یک گرادیان الکتریکی در سراسر غشا ایجاد میکند. بار مثبت یونهای منفی را جذب میکند، در حالی که بار منفی آنها را دفع میکند. بنابراین، انتشار خالص از چپ به راست رخ میدهد. پس از مدتی، مقادیر زیادی از یونهای منفی به سمت راست حرکت کردهاند و شرایطی را ایجاد میکنند که در پانل سمت راست شکل ۴-9B نشان داده شده است، که در آن اختلاف غلظت یونها در جهت مخالف اختلاف پتانسیل الکتریکی ایجاد شده است. اکنون اختلاف غلظت یونها را به سمت چپ حرکت میدهد، در حالی که اختلاف الکتریکی آنها را به سمت راست میبرد. هنگامیکه اختلاف غلظت به اندازه کافی بالا میرود، این دو اثر یکدیگر را متعادل میکنند. در دمای معمولی بدن (۹۸.۶ درجه فارنهایت؛ ۳۷ درجه سانتیگراد)، تفاوت الکتریکی که اختلاف غلظت معینی از یونهای تک ظرفیتی – مانند یونهای Na + را متعادل میکند – را میتوان از فرمول زیر تعیین کرد که معادله نرنست نامیده میشود:
EMF (بر حسب میلی ولت) = +61log
in which EMF is the electromotive force (voltage) between side 1 and side 2 of the membrane, C1 is the con- centration on side 1, and C2 is the concentration on side 2. This equation is extremely important in understanding the transmission of nerve impulses and is discussed in Chapter 5.
که در آن EMF نیروی الکتروموتور (ولتاژ) بین سمت ۱ و ضلع ۲ غشا است، C1 تمرکز در سمت ۱، و C2 غلظت سمت ۲ است. این معادله در درک انتقال تکانههای عصبی بسیار مهم است و در فصل ۵ مورد بحث قرار میگیرد.
Effect of a Pressure Difference Across the Membrane. At times, a considerable pressure difference develops be- tween the two sides of a diffusible membrane. This pres- sure difference occurs, for example, at the blood capillary membranes in all tissues of the body. The pressure in many capillaries is about 20 mm Hg greater inside than outside.
اثر اختلاف فشار در سراسر غشاء. گاهی اوقات، اختلاف فشار قابل توجهی بین دو طرف یک غشای قابل انتشار ایجاد میشود. این اختلاف فشار، برای مثال، در غشای مویرگی خون در تمام بافتهای بدن رخ میدهد. فشار در بسیاری از مویرگها در داخل حدود ۲۰ میلی متر جیوه بیشتر از خارج است.
Pressure actually means the sum of all the forces of the different molecules striking a unit surface area at a given instant. Therefore, having a higher pressure on one side of a membrane than on the other side means that the sum of all the forces of the molecules striking the channels on that side of the membrane is greater than on the other side. In most cases, this situation is caused by greater numbers of mole- cules striking the membrane per second on one side than on the other side. The result is that increased amounts of energy are available to cause a net movement of molecules from the high-pressure side toward the low-pressure side. This effect is demonstrated in Figure 4-9C, which shows a pis- ton developing high pressure on one side of a pore, thereby causing more molecules to strike the pore on this side and, therefore, more molecules to diffuse to the other side.
فشار در واقع به معنای مجموع تمام نیروهای مولکولهای مختلف است که در یک لحظه معین به یک سطح واحد برخورد میکنند. بنابراین، داشتن فشار بیشتر در یک طرف غشا نسبت به طرف دیگر به این معنی است که مجموع تمام نیروهای مولکولهایی که به کانالهای آن طرف غشا برخورد میکنند بیشتر از طرف دیگر است. در بیشتر موارد، این وضعیت ناشی از برخورد تعداد بیشتری مولکول به غشاء در هر ثانیه در یک طرف نسبت به طرف دیگر است. نتیجه این است که مقادیر افزایش یافته انرژی برای ایجاد حرکت خالص مولکولها از سمت پرفشار به سمت سمت کم فشار در دسترس است. این اثر در شکل ۴-9C نشان داده شده است، که نشان میدهد پیستونی در حال ایجاد فشار بالا در یک طرف منافذ است، در نتیجه باعث میشود مولکولهای بیشتری به منافذ این طرف برخورد کنند و بنابراین، مولکولهای بیشتری به طرف دیگر منتشر میشوند.
OSMOSIS ACROSS SELECTIVELY PERMEABLE MEMBRANES “NET DIFFUSION” OF WATER
By far, the most abundant substance that diffuses through the cell membrane is water. Enough water ordinarily dif- fuses in each direction through the red blood cell mem- brane per second to equal about 100 times the volume of the cell itself. Yet, the amount that normally diffuses in the two directions is balanced so precisely that zero net movement of water occurs. Therefore, the volume of the cell remains constant. However, under certain conditions, a concentration difference for water can develop across a membrane. When this concentration difference for water develops, net movement of water does occur across the cell membrane, causing the cell to swell or shrink, depending on the direction of the water movement. This process of net movement of water caused by a concentra- tion difference of water is called osmosis.
اسمز در میان غشاهای نفوذپذیر انتخابی “انتشار خالص” آب
تا حد زیادی، فراوان ترین ماده ای که از طریق غشای سلولی پخش میشود، آب است. معمولاً آب کافی در هر ثانیه در هر جهت از طریق غشای گلبول قرمز پخش میشود و برابر با ۱۰۰ برابر حجم خود سلول است. با این حال، مقداری که به طور معمول در دو جهت پخش میشود، به قدری متعادل است که حرکت خالص آب رخ میدهد. بنابراین حجم سلول ثابت میماند. با این حال، تحت شرایط خاص، اختلاف غلظت آب میتواند در سراسر غشاء ایجاد شود. هنگامیکه این اختلاف غلظت برای آب ایجاد میشود، حرکت خالص آب در سراسر غشای سلولی رخ میدهد و بسته به جهت حرکت آب، سلول را متورم یا منقبض میکند. این فرآیند حرکت خالص آب ناشی از اختلاف غلظت آب اسمز نامیده میشود.
To illustrate osmosis, let us assume the conditions shown in Figure 4-10, with pure water on one side of the cell membrane and a solution of sodium chloride on the other side. Water molecules pass through the cell mem- brane with ease, whereas sodium and chloride ions pass through only with difficulty. Therefore, sodium chloride solution is actually a mixture of permeant water mole- cules and nonpermeant sodium and chloride ions, and the membrane is said to be selectively permeable to water but much less so to sodium and chloride ions. Yet, the presence of the sodium and chloride has displaced some of the water molecules on the side of the membrane where these ions are present and, therefore, has reduced the concentration of water molecules to less than that of pure water. As a result, in the example shown in Figure 4-10, more water molecules strike the channels on the left side, where there is pure water, than on the right side, where the water concentration has been reduced. Thus, net movement of water occurs from left to right-that is, osmosis occurs from the pure water into the sodium chloride solution.
برای نشان دادن اسمز، اجازه دهید شرایط نشان داده شده در شکل ۴-۱۰ را با آب خالص در یک طرف غشای سلولی و محلول کلرید سدیم در طرف دیگر فرض کنیم. مولکولهای آب به راحتی از غشای سلول عبور میکنند، در حالی که یونهای سدیم و کلرید فقط به سختی از آن عبور میکنند. بنابراین، محلول کلرید سدیم در واقع مخلوطی از مولکولهای آب نفوذپذیر و یونهای سدیم و کلرید غیرقابل نفوذ است و گفته میشود که غشاء به طور انتخابی نسبت به آب نفوذپذیر است اما نسبت به یونهای سدیم و کلرید بسیار کمتر نفوذپذیر است. با این حال، حضور سدیم و کلرید برخی از مولکولهای آب را در سمت غشایی که این یونها در آن حضور دارند جابجا کرده است و بنابراین، غلظت مولکولهای آب را به کمتر از غلظت آب خالص کاهش داده است. در نتیجه، در مثال نشان داده شده در شکل ۴-۱۰، مولکولهای آب بیشتری به کانالهای سمت چپ، جایی که آب خالص وجود دارد، برخورد میکنند تا در سمت راست، جایی که غلظت آب کاهش یافته است. بنابراین، حرکت خالص آب از چپ به راست رخ میدهد، یعنی اسمز از آب خالص به محلول کلرید سدیم رخ میدهد.
Figure 4-10.
Osmosis at a cell membrane when a sodium chloride solution is placed on one side of the membrane and water is placed on the other side.
شکل ۴-۱۰.
اسمز در غشای سلولی زمانی که محلول کلرید سدیم در یک طرف غشاء و آب در طرف دیگر قرار میگیرد.
Osmotic Pressure
If in Figure 4-10 pressure were applied to the sodium chloride solution, osmosis of water into this solution would be slowed, stopped, or even reversed. The amount of pressure required to stop osmosis is called the osmotic pressure of the sodium chloride solution.
فشار اسمزی
اگر در شکل ۴-۱۰ فشار به محلول کلرید سدیم وارد شود، اسمز آب به این محلول کند میشود، متوقف میشود یا حتی معکوس میشود. مقدار فشار لازم برای توقف اسمز را فشار اسمزی محلول کلرید سدیم میگویند.
The principle of a pressure difference opposing osmo- sis is demonstrated in Figure 4-11, which shows a selec- tively permeable membrane separating two columns of fluid, one containing pure water and the other contain- ing a solution of water and any solute that will not pen- etrate the membrane. Osmosis of water from chamber B into chamber A causes the levels of the fluid columns to become farther and farther apart, until eventually a pres- sure difference develops between the two sides of the membrane that is great enough to oppose the osmotic effect. The pressure difference across the membrane at this point is equal to the osmotic pressure of the solution that contains the nondiffusible solute.
اصل اختلاف فشار مخالف اسمز در شکل ۴-۱۱ نشان داده شده است، که غشای تراوا انتخابی را نشان میدهد که دو ستون سیال را جدا میکند، یکی حاوی آب خالص و دیگری حاوی محلولی از آب و هر املاحی است که به غشاء نفوذ نمیکند. اسمز آب از محفظه B به محفظه A باعث میشود سطوح ستونهای سیال دورتر و دورتر از هم شوند تا در نهایت اختلاف فشاری بین دو طرف غشاء ایجاد شود که به اندازه کافی بزرگ باشد که با اثر اسمزی مخالفت کند. اختلاف فشار در سراسر غشا در این نقطه برابر با فشار اسمزی محلولی است که حاوی املاح غیر قابل نفوذ است.
Figure 4-11.
Demonstration of osmotic pressure caused by osmosis at a semipermeable membrane.
شکل ۴-۱۱.
نمایش فشار اسمزی ناشی از اسمز در یک غشای نیمه تراوا.
Importance of Number of Osmotic Particles (Molar Concentration) in Determining Osmotic Pressure. The osmotic pressure exerted by particles in a solution, whether they are molecules or ions, is determined by the number of particles per unit volume of fluid, not by the mass of the particles. The reason for this is that each par- ticle in a solution, regardless of its mass, exerts, on aver- age, the same amount of pressure against the membrane. That is, large particles, which have greater mass (m) than small particles, move at a slower velocity (v). The small particles move at higher velocities in such a way that their average kinetic energies (k), as determined by the following equation, k= mv2/2
اهمیت تعداد ذرات اسمزی (غلظت مولی) در تعیین فشار اسمزی. فشار اسمزی اعمال شده توسط ذرات در محلول، خواه مولکول یا یون باشند، با تعداد ذرات در واحد حجم سیال تعیین میشود، نه با جرم ذرات. دلیل این امر این است که هر ذره در یک محلول، صرف نظر از جرم آن، به طور متوسط فشار یکسانی را به غشاء وارد میکند. یعنی ذرات بزرگی که جرم آنها (m) بیشتر از ذرات کوچک است، با سرعت کمتر (v) حرکت میکنند. ذرات کوچک با سرعتهای بالاتر بهگونهای حرکت میکنند که میانگین انرژی جنبشی آنها (k) که با معادله زیر تعیین میشود:k= mv2/2
are the same for each small particle as for each large parti- cle. Consequently, the factor that determines the osmotic pressure of a solution is the concentration of the solution in terms of the number of particles (which is the same as its molar concentration if it is a nondissociated molecule), not in terms of mass of the solute.
برای هر ذره کوچک مانند هر ذره بزرگ است. در نتیجه، عاملی که فشار اسمزی محلول را تعیین میکند، غلظت محلول بر حسب تعداد ذرات است (که اگر یک مولکول غیر تفکیک شده باشد با غلظت مولی آن برابر است)، نه بر حسب جرم املاح.
Osmolality-The Osmole. To express the concentration of a solution in terms of numbers of particles, a unit called the osmole is used in place of grams.
اسمولالیته-اسمول. برای بیان غلظت یک محلول بر حسب تعداد ذرات، به جای گرم از واحدی به نام اسمول استفاده میشود.
One osmole is 1 gram molecular weight of osmotically active solute. Thus, 180 grams of glucose, which is 1 gram molecular weight of glucose, is equal to 1 osmole of glucose because glucose does not dissociate into ions. If a solute dis- sociates into two ions, 1 gram molecular weight of the solute will become 2 osmoles because the number of osmotically active particles is now twice as great as for the nondissociated solute. Therefore, when fully dissociated, 1 gram molecular weight of sodium chloride, 58.5 grams, is equal to 2 osmoles.
یک اسمول ۱ گرم وزن مولکولی املاح فعال اسمزی است. بنابراین، ۱۸۰ گرم گلوکز، که ۱ گرم وزن مولکولی گلوکز است، برابر با ۱ اسمول گلوکز است، زیرا گلوکز به یونها تجزیه نمیشود. اگر یک املاح به دو یون تجزیه شود، ۱ گرم وزن مولکولی املاح به ۲ اسمول تبدیل میشود، زیرا تعداد ذرات فعال اسمزی در حال حاضر دو برابر بیشتر از املاح غیر تفکیک شده است. بنابراین، وقتی به طور کامل تفکیک شود، ۱ گرم وزن مولکولی کلرید سدیم، ۵۸.۵ گرم، برابر با ۲ اسمول است.
Thus, a solution that has 1 osmole of solute dissolved in each kilogram of water is said to have an osmolality of 1 osmole per kilogram, and a solution that has 1/1000 osmole dissolved per kilogram has an osmolality of 1 milliosmole per kilogram. The normal osmolality of the extracellular and intracellular fluids is about 300 millios- moles per kilogram of water.
بنابراین، محلولی که دارای ۱ اسمول املاح حل شده در هر کیلوگرم آب باشد، اسمولالیته آن ۱ اسمول بر کیلوگرم و محلولی که ۱/۱۰۰۰ اسمول در هر کیلوگرم حل شده باشد، اسمولالیته آن ۱ میلیاسمول بر کیلوگرم است. اسمولالیته طبیعی مایعات خارج سلولی و درون سلولی حدود ۳۰۰ میلی مول بر کیلوگرم آب است.
Relationship of Osmolality to Osmotic Pressure. At normal body temperature, 37°C (98.6°F), a concentration of 1 osmole per liter will cause 19,300 mm Hg osmotic pressure in the solution. Likewise, 1 milliosmole per lit- er concentration is equivalent to 19.3 mm Hg osmotic pressure. Multiplying this value by the 300-milliosmolar concentration of the body fluids gives a total calculated osmotic pressure of the body fluids of 5790 mm Hg. The measured value for this, however, averages only about 5500 mm Hg. The reason for this difference is that many ions in the body fluids, such as sodium and chloride ions, are highly attracted to one another; consequently, they cannot move entirely unrestrained in the fluids and create their full osmotic pressure potential. Therefore, on aver- age, the actual osmotic pressure of the body fluids is about 0.93 times the calculated value.
رابطه اسمولالیته با فشار اسمزی. در دمای طبیعی بدن، ۳۷ درجه سانتی گراد (۹۸.۶ درجه فارنهایت)، غلظت ۱ اسمول در لیتر باعث ایجاد فشار اسمزی ۱۹۳۰۰ میلی متر جیوه در محلول میشود. به همین ترتیب، غلظت ۱ میلیاسمول در لیتر معادل فشار اسمزی ۱۹.۳ میلیمتر جیوه است. با ضرب این مقدار در غلظت ۳۰۰ میلیاسمولاری مایعات بدن، فشار اسمزی کل مایعات بدن ۵۷۹۰ میلیمتر جیوه محاسبه میشود. مقدار اندازه گیری شده برای این، با این حال، به طور متوسط تنها حدود ۵۵۰۰ میلی متر جیوه است. دلیل این تفاوت این است که بسیاری از یونهای موجود در مایعات بدن مانند یونهای سدیم و کلرید به شدت جذب یکدیگر میشوند. در نتیجه، آنها نمیتوانند به طور کامل بدون مهار در سیال حرکت کنند و پتانسیل فشار اسمزی کامل خود را ایجاد کنند. بنابراین، به طور متوسط، فشار اسمزی واقعی مایعات بدن حدود ۰.۹۳ برابر مقدار محاسبه شده است.
The Term Osmolarity. Osmolarity is the osmolar con- centration expressed as osmoles per liter of solution rather than osmoles per kilogram of water. Although, strictly speaking, it is osmoles per kilogram of water (osmolality) that determines osmotic pressure, the quantitative differ- ences between osmolarity and osmolality are less than 1% for dilute solutions such as those in the body. Because it is far more practical to measure osmolarity than osmolality, measuring osmolarity is the usual practice in physiologi- cal studies.
اصطلاح اسمولاریته. اسمولاریته غلظت اسمولی است که به عنوان اسمول در لیتر محلول به جای اسمول بر کیلوگرم آب بیان میشود. اگرچه، به بیان دقیق، این اسمول در هر کیلوگرم آب (اسمولالیته) است که فشار اسمزی را تعیین میکند، تفاوت کمیبین اسمولاریته و اسمولالیته برای محلولهای رقیق مانند محلولهای موجود در بدن کمتر از ۱٪ است. از آنجایی که اندازه گیری اسمولاریته بسیار عملی تر از اسمولاریته است، اندازه گیری اسمولاریته روش معمول در مطالعات فیزیولوژیکی است.
ACTIVE TRANSPORT OF SUBSTANCES THROUGH MEMBRANES
At times, a large concentration of a substance is required in the intracellular fluid, even though the extracellular fluid contains only a small concentration. This situation is true, for example, for potassium ions. Conversely, it is important to keep the concentrations of other ions very low inside the cell, even though their concentrations in the extracellular fluid are high. This situation is especially true for sodium ions. Neither of these two effects could occur by simple diffusion because simple diffusion eventually equil- ibrates concentrations on the two sides of the membrane. Instead, some energy source must cause excess movement of potassium ions to the inside of cells and excess move- ment of sodium ions to the outside of cells. When a cell membrane moves molecules or ions uphill against a con- centration gradient (or uphill against an electrical or pres- sure gradient), the process is called active transport.
حمل و نقل فعال مواد از طریق غشا
گاهی اوقات، غلظت زیادی از یک ماده در مایع داخل سلولی مورد نیاز است، حتی اگر مایع خارج سلولی فقط دارای غلظت کمیباشد. این وضعیت، به عنوان مثال، برای یونهای پتاسیم صادق است. برعکس، مهم است که غلظت یونهای دیگر در داخل سلول بسیار کم باشد، حتی اگر غلظت آنها در مایع خارج سلولی بالا باشد. این وضعیت به ویژه برای یونهای سدیم صادق است. هیچ یک از این دو اثر نمیتواند با انتشار ساده رخ دهد زیرا انتشار ساده در نهایت غلظتها را در دو طرف غشاء متعادل میکند. در عوض، برخی از منابع انرژی باید باعث حرکت بیش از حد یونهای پتاسیم به داخل سلول و حرکت بیش از حد یونهای سدیم به خارج سلولها شوند. هنگامیکه یک غشای سلولی مولکولها یا یونها را به سمت بالا بر خلاف گرادیان غلظت (یا در سربالایی در برابر گرادیان الکتریکی یا فشار) حرکت میدهد، این فرآیند انتقال فعال نامیده میشود.
Some examples of substances that are actively trans- ported through at least some cell membranes include sodium, potassium, calcium, iron, hydrogen, chloride, iodide, and urate ions, several different sugars, and most of the amino acids.
چند نمونه از موادی که به طور فعال از طریق حداقل برخی از غشای سلولی منتقل میشوند عبارتند از یونهای سدیم، پتاسیم، کلسیم، آهن، هیدروژن، کلرید، یدید و اورات، چندین قند مختلف و بیشتر اسیدهای آمینه.
Primary Active Transport and Secondary Active Transport. Active transport is divided into two types ac- cording to the source of the energy used to facilitate the transport, primary active transport and secondary active transport. In primary active transport, the energy is de- rived directly from the breakdown of adenosine triphos- phate (ATP) or some other high-energy phosphate com- pound. In secondary active transport, the energy is derived secondarily from energy that has been stored in the form of ionic concentration differences of secondary molecular or ionic substances between the two sides of a cell membrane, created originally by primary active transport. In both cases, transport depends on carrier proteins that pen- etrate through the cell membrane, as is true for facilitated diffusion. However, in active transport, the carrier protein functions differently from the carrier in facilitated diffusion because it is capable of imparting energy to the transported substance to move it against the electrochemical gradient. The following sections provide some examples of primary active transport and secondary active transport, with more detailed explanations of their principles of function.
حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه. حمل و نقل فعال با توجه به منبع انرژی مورد استفاده برای تسهیل حمل و نقل به دو نوع حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه تقسیم میشود. در حمل و نقل فعال اولیه، انرژی مستقیماً از تجزیه آدنوزین تری فسفات (ATP) یا برخی دیگر از ترکیبات فسفات پرانرژی به دست میآید. در حمل و نقل فعال ثانویه، انرژی به طور ثانویه از انرژی حاصل میشود که به شکل اختلاف غلظت یونی مواد مولکولی یا یونی ثانویه بین دو طرف غشای سلولی ذخیره شده است، که در اصل توسط حمل و نقل فعال اولیه ایجاد شده است. در هر دو مورد، انتقال به پروتئینهای حاملی بستگی دارد که از طریق غشای سلولی نفوذ میکنند، همانطور که برای انتشار تسهیل شده صادق است. با این حال، در حمل و نقل فعال، پروتئین حامل در انتشار تسهیل شده متفاوت از حامل عمل میکند، زیرا قادر است به ماده منتقل شده انرژی بدهد تا آن را در برابر گرادیان الکتروشیمیایی حرکت دهد. بخشهای زیر نمونههایی از حملونقل فعال اولیه و حملونقل فعال ثانویه را با توضیحات دقیقتری درباره اصول عملکرد آنها ارائه میکند.
PRIMARY ACTIVE TRANSPORT
حمل و نقل فعال اولیه
Sodium-Potassium Pump Transports Sodium lons Out of Cells and Potassium lons into Cells
Among the substances that are transported by primary active transport are sodium, potassium, calcium, hydro- gen, chloride, and a few other ions. The active transport mechanism that has been studied in greatest detail is the sodium-potassium (Na*-K) pump, a transporter that pumps sodium ions outward through the cell membrane of all cells and, at the same time, pumps potassium ions from the outside to the inside. This pump is responsible for maintaining the sodium and potassium concentra- tion differences across the cell membrane, as well as for establishing a negative electrical voltage inside the cells. Indeed, Chapter 5 shows that this pump is also the basis of nerve function, transmitting nerve signals throughout the nervous system.
پمپ سدیم-پتاسیم لونهای سدیم را از سلولها و یونهای پتاسیم را به داخل سلولها منتقل میکند.
از جمله موادی که با انتقال فعال اولیه منتقل میشوند عبارتند از: سدیم، پتاسیم، کلسیم، هیدروژن، کلرید و چند یون دیگر. مکانیسم انتقال فعالی که با جزئیات بیشتر مورد مطالعه قرار گرفته است، پمپ سدیم-پتاسیم (Na*-K) است، یک انتقال دهنده که یونهای سدیم را از طریق غشای سلولی همه سلولها به بیرون پمپ میکند و در همان زمان، یونهای پتاسیم را از بیرون به داخل پمپ میکند. این پمپ مسئول حفظ اختلاف غلظت سدیم و پتاسیم در سراسر غشای سلولی و همچنین ایجاد ولتاژ الکتریکی منفی در داخل سلولها است. در واقع، فصل ۵ نشان میدهد که این پمپ همچنین اساس عملکرد عصبی است و سیگنالهای عصبی را در سراسر سیستم عصبی منتقل میکند.
Figure 4-12 shows the basic physical components of the Na*-K+ pump. The carrier protein is a complex of two separate globular proteins-a larger one called the a subunit, with a molecular weight of about 100,000, and a smaller one called the ẞ subunit, with a molecular weight of about 55,000. Although the function of the smaller pro- tein is not known (except that it might anchor the protein complex in the lipid membrane), the larger protein has three specific features that are important for the function- ing of the pump:
شکل ۴-۱۲ اجزای فیزیکی پایه پمپ Na*-K+ را نشان میدهد. پروتئین حامل مجموعه ای از دو پروتئین کروی مجزا است – یکی بزرگتر به نام زیر واحد با وزن مولکولی حدود ۱۰۰۰۰۰ و دیگری کوچکتر به نام زیرواحد ẞ با وزن مولکولی حدود ۵۵۰۰۰. اگرچه عملکرد پروتئین کوچکتر مشخص نیست (به جز اینکه ممکن است کمپلکس پروتئین را در غشای لیپیدی لنگر بیاندازد)، پروتئین بزرگتر دارای سه ویژگی خاص است که برای عملکرد پمپ مهم هستند:
۱. It has three binding sites for sodium ions on the portion of the protein that protrudes to the inside of the cell.
2. It has two binding sites for potassium ions on the outside.
3. The inside portion of this protein near the sodium binding sites has adenosine triphosphatase (AT- Pase) activity.
۱. دارای سه محل اتصال برای یون سدیم در بخشی از پروتئین است که به داخل سلول بیرون زده است.
2. دارای دو محل اتصال برای یونهای پتاسیم در خارج است.
3. بخش داخلی این پروتئین در نزدیکی محلهای اتصال سدیم دارای فعالیت آدنوزین تری فسفاتاز (AT-Pase) است.
When two potassium ions bind on the outside of the carrier protein and three sodium ions bind on the inside, the ATPase function of the protein becomes activated. Activation of the ATPase function leads to cleavage of one molecule of ATP, splitting it to adenos- ine diphosphate (ADP) and liberating a high-energy phosphate bond of energy. This liberated energy is believed to cause a chemical and conformational change in the protein carrier molecule, extruding three sodium ions to the outside and two potassium ions to the inside.
هنگامیکه دو یون پتاسیم در خارج از پروتئین حامل و سه یون سدیم در داخل متصل میشوند، عملکرد ATPase پروتئین فعال میشود. فعال شدن عملکرد ATPase منجر به جدا شدن یک مولکول ATP، تقسیم آن به آدنوزین دی فسفات (ADP) و آزادسازی یک پیوند فسفات با انرژی بالا میشود. اعتقاد بر این است که این انرژی آزاد شده باعث ایجاد یک تغییر شیمیایی و ساختاری در مولکول حامل پروتئین میشود و سه یون سدیم را به بیرون و دو یون پتاسیم را به داخل خارج میکند.
As with other enzymes, the Na+-K+ ATPase pump can run in reverse. If the electrochemical gradients for Na+ and K+ are experimentally increased to the degree that the energy stored in their gradients is greater than the chemi- cal energy of ATP hydrolysis, these ions will move down their concentration gradients, and the Na+-K+ pump will synthesize ATP from ADP and phosphate. The phosphor- ylated form of the Na+-K+ pump, therefore, can either donate its phosphate to ADP to produce ATP or use the energy to change its conformation and pump Na+ out of the cell and K+ into the cell. The relative concentrations of ATP, ADP, and phosphate, as well as the electrochemical gradients for Na+ and K+, determine the direction of the enzyme reaction. For some cells, such as electrically active nerve cells, 60% to 70% of the cell’s energy requirement may be devoted to pumping Na+ out of the cell and K+ into the cell.
همانند سایر آنزیمها، پمپ Na+-K+ ATPase میتواند به صورت معکوس کار کند. اگر گرادیانهای الکتروشیمیایی برای Na+ و K+ بطور تجربی به درجه ای افزایش یابد که انرژی ذخیره شده در شیب آنها بیشتر از انرژی شیمیایی هیدرولیز ATP باشد، این یونها شیب غلظت خود را پایین میآورند و پمپ Na+-K+ ATP را از ADP و فسفات سنتز میکند. بنابراین، شکل فسفریله شده پمپ Na+-K+ میتواند فسفات خود را به ADP برای تولید ATP ببخشد یا از انرژی برای تغییر ساختار آن استفاده کند و Na+ را از سلول و K+ را به سلول پمپ کند. غلظت نسبی ATP، ADP و فسفات، و همچنین گرادیانهای الکتروشیمیایی برای Na+ و K+، جهت واکنش آنزیم را تعیین میکند. برای برخی سلولها، مانند سلولهای عصبی فعال الکتریکی، ۶۰ تا ۷۰ درصد انرژی مورد نیاز سلول ممکن است به پمپ کردن Na+ از سلول و K+ به داخل سلول اختصاص یابد.
Figure 4-12.
Postulated mechanism of the sodium-potassium pump. ADP, Adenosine diphosphate; ATP, adenosine triphosphate; Pi, phos- phate ion.
شکل ۴-۱۲.
مکانیسم فرضی پمپ سدیم-پتاسیم. ADP، آدنوزین دی فسفات؛ ATP، آدنوزین تری فسفات؛ پی، یون فسفات.
The Na+-K+ Pump Is Important for Controlling Cell Volume. One of the most important functions of the Na+-K+ pump is to control the cell volume. Without func- tion of this pump, most cells of the body would swell until they burst.
پمپ Na+-K+ برای کنترل حجم سلول مهم است. یکی از مهمترین وظایف پمپ Na+-K+ کنترل حجم سلول است. بدون عملکرد این پمپ، اکثر سلولهای بدن تا زمانی که ترکیده شوند متورم میشوند.
The mechanism for controlling the volume is as fol- lows. Inside the cell are large numbers of proteins and other organic molecules that cannot escape from the cell. Most of these proteins and other organic molecules are negatively charged and, therefore, attract large numbers of potassium, sodium, and other positive ions. All these molecules and ions then cause osmosis of water to the interior of the cell. Unless this process is checked, the cell will swell indefinitely until it bursts. The normal mecha- nism for preventing this outcome is the Na+-K+ pump. Note again that this mechanism pumps three Na+ ions to the outside of the cell for every two K+ ions pumped to the interior. Also, the membrane is far less permeable to sodium ions than to potassium ions and, once the sodium ions are on the outside, they have a strong tendency to stay there. This process thus represents a net loss of ions out the cell, which also initiates osmosis of water out of the cell.
مکانیسم کنترل صدا به شرح زیر است. در داخل سلول تعداد زیادی پروتئین و سایر مولکولهای آلی وجود دارد که نمیتوانند از سلول فرار کنند. بیشتر این پروتئینها و سایر مولکولهای آلی بار منفی دارند و بنابراین تعداد زیادی پتاسیم، سدیم و سایر یونهای مثبت را جذب میکنند. سپس تمام این مولکولها و یونها باعث اسمز آب به داخل سلول میشوند. مگر اینکه این فرآیند بررسی شود، سلول به طور نامحدود متورم میشود تا زمانی که ترکیده شود. مکانیسم عادی برای جلوگیری از این نتیجه پمپ Na+-K+ است. مجدداً توجه داشته باشید که این مکانیسم به ازای هر دو یون K+ که به داخل پمپ میشود، سه یون Na+ را به بیرون سلول پمپ میکند. همچنین، نفوذپذیری غشاء به یونهای سدیم بسیار کمتر از یونهای پتاسیم است و هنگامیکه یونهای سدیم در خارج هستند، تمایل زیادی به ماندن در آنجا دارند. بنابراین این فرآیند نشان دهنده از دست دادن خالص یونها از سلول است که همچنین اسمز آب را از سلول آغاز میکند.
If a cell begins to swell for any reason, the Na+-K+ pump is automatically activated, moving still more ions to the exterior and carrying water with them. Therefore, the Na+-K+ pump performs a continual surveillance role in maintaining normal cell volume.
اگر یک سلول به هر دلیلی شروع به متورم شدن کند، پمپ Na+-K+ به طور خودکار فعال میشود و یونهای بیشتری را به بیرون منتقل میکند و آب را با خود حمل میکند. بنابراین، پمپ Na+-K+ نقش نظارت مستمر را در حفظ حجم طبیعی سلول ایفا میکند.
Electrogenic Nature of the Na+-K+ Pump. The fact that the Na+-K+ pump moves three Na+ ions to the exte- rior for every two K+ ions that are moved to the interior means that a net of one positive charge is moved from the interior of the cell to the exterior of the cell for each cycle of the pump. This action creates positivity outside the cell but results in a deficit of positive ions inside the cell; that is, it causes negativity on the inside. Therefore, the Na+-K+ pump is said to be electrogenic because it cre- ates an electrical potential across the cell membrane. As discussed in Chapter 5, this electrical potential is a basic requirement in nerve and muscle fibers for transmitting nerve and muscle signals.
ماهیت الکتروژنی پمپ Na+-K+. این واقعیت که پمپ Na+-K+ به ازای هر دو یون K+ که به داخل منتقل میشوند، سه یون Na+ را به بیرون منتقل میکند به این معنی است که برای هر چرخه پمپ، یک بار مثبت از داخل سلول به بیرون سلول منتقل میشود. این عمل باعث ایجاد حالت مثبت در خارج از سلول میشود اما منجر به کمبود یونهای مثبت در داخل سلول میشود. یعنی باعث منفی شدن درون میشود. بنابراین، پمپ Na+-K+ الکتروژنیک است زیرا پتانسیل الکتریکی در سراسر غشای سلول ایجاد میکند. همانطور که در فصل ۵ بحث شد، این پتانسیل الکتریکی یک نیاز اساسی در رشتههای عصبی و ماهیچه ای برای انتقال سیگنالهای عصبی و عضلانی است.
Primary Active Transport of Calcium Ions
Another important primary active transport mecha- nism is the calcium pump. Calcium ions are normally maintained at an extremely low concentration in the intracellular cytosol of virtually all cells in the body, at a concentration about 10,000 times less than that in the extracellular fluid. This level of maintenance is achieved mainly by two primary active transport calcium pumps. One, which is in the cell membrane, pumps calcium to the outside of the cell. The other pumps calcium ions into one or more of the intracel- lular vesicular organelles of the cell, such as the sarco- plasmic reticulum of muscle cells and the mitochondria in all cells. In each of these cases, the carrier protein penetrates the membrane and functions as an enzyme ATPase, with the same capability to cleave ATP as the ATPase of the sodium carrier protein. The difference is that this protein has a highly specific binding site for calcium instead of for sodium.
انتقال فعال اولیه یونهای کلسیم
یکی دیگر از مکانیسمهای مهم انتقال فعال اولیه، پمپ کلسیم است. یونهای کلسیم معمولاً در غلظت بسیار کم در سیتوزول داخل سلولی تقریباً تمام سلولهای بدن، در غلظتی حدود ۱۰۰۰۰ برابر کمتر از غلظت مایع خارج سلولی نگهداری میشوند. این سطح نگهداری عمدتاً توسط دو پمپ کلسیم انتقال فعال اولیه حاصل میشود. یکی که در غشای سلولی است، کلسیم را به خارج از سلول پمپاژ میکند. دیگری یونهای کلسیم را به یک یا چند اندامک وزیکولی درون سلولی مانند شبکه سارکوپلاسمیسلولهای ماهیچه ای و میتوکندری در همه سلولها پمپ میکند. در هر یک از این موارد، پروتئین حامل به غشاء نفوذ میکند و به عنوان یک آنزیم ATPase عمل میکند، با همان توانایی برای جدا کردن ATP مانند ATPase پروتئین حامل سدیم. تفاوت این است که این پروتئین یک محل اتصال بسیار ویژه برای کلسیم به جای سدیم دارد.
Primary Active Transport of Hydrogen lons
Primary active transport of hydrogen ions is especially important at two places in the body: (1) in the gastric glands of the stomach; and (2) in the late distal tubules and cortical collecting ducts of the kidneys.
حمل و نقل فعال اولیه یونهای هیدروژن
انتقال فعال اولیه یونهای هیدروژن به ویژه در دو مکان در بدن مهم است: (۱) در غدد معده معده. و (۲) در لولههای انتهایی دیستال و مجاری جمع کننده قشر کلیهها.
In the gastric glands, the deep-lying parietal cells have the most potent primary active mechanism for transport- ing hydrogen ions of any part of the body. This mechanism is the basis for secreting hydrochloric acid in stomach digestive secretions. At the secretory ends of the gastric gland parietal cells, the hydrogen ion concentration is increased as much as a million-fold and then is released into the stomach, along with chloride ions, to form hydro- chloric acid.
در غدد معده، سلولهای جداری عمیق قویترین مکانیسم فعال اولیه برای انتقال یونهای هیدروژن در هر قسمت از بدن را دارند. این مکانیسم اساس ترشح اسید هیدروکلریک در ترشحات گوارشی معده است. در انتهای ترشحی سلولهای جداری غده معده، غلظت یون هیدروژن تا یک میلیون برابر افزایش مییابد و سپس به همراه یونهای کلرید به معده رها میشود تا اسید کلریدریک تشکیل شود.
In the renal tubules, special intercalated cells found in the late distal tubules and cortical collecting ducts also transport hydrogen ions by primary active transport. In this case, large amounts of hydrogen ions are secreted from the blood into the renal tubular fluid for the purpose of eliminating excess hydrogen ions from the body fluids. The hydrogen ions can be secreted into the renal tubular fluid against a concentration gradient of about 900-fold. Yet, as discussed in Chapter 31, most of these hydrogen ions combine with tubular fluid buffers before they are eliminated in the urine
در لولههای کلیوی، سلولهای میانپیچیده ویژهای که در لولههای انتهایی دیستال و مجاری جمعآوری قشری یافت میشوند نیز یونهای هیدروژن را با انتقال فعال اولیه منتقل میکنند. در این حالت، مقادیر زیادی یون هیدروژن از خون به داخل مایع لولهای کلیه ترشح میشود تا یونهای هیدروژن اضافی از مایعات بدن حذف شود. یونهای هیدروژن را میتوان در مایع لوله ای کلیوی در برابر شیب غلظت حدود ۹۰۰ برابر ترشح کرد. با این حال، همانطور که در فصل ۳۱ بحث شد، بیشتر این یونهای هیدروژن قبل از دفع در ادرار با بافرهای مایع لوله ای ترکیب میشوند.
Energetics of Primary Active Transport
The amount of energy required to transport a substance actively through a membrane is determined by how much the substance is concentrated during transport. Com- pared with the energy required to concentrate a sub- stance 10-fold, concentrating it 100-fold requires twice as much energy, and concentrating it 1000-fold requires three times as much energy. In other words, the energy required is proportional to the logarithm of the degree that the substance is concentrated, as expressed by the following formula:
Energy (in calories per osmole) = 1400 log c1/c2
انرژی حمل و نقل فعال اولیه
مقدار انرژی مورد نیاز برای انتقال یک ماده به طور فعال از طریق غشاء بر اساس میزان غلظت ماده در حین انتقال تعیین میشود. در مقایسه با انرژی مورد نیاز برای تغلیظ ۱۰ برابر ماده، تغلیظ ۱۰۰ برابر آن به دو برابر انرژی و تمرکز ۱۰۰۰ برابر آن به سه برابر انرژی نیاز دارد. به عبارت دیگر، انرژی مورد نیاز متناسب با لگاریتم درجه غلظت ماده است که با فرمول زیر بیان میشود:
انرژی (بر حسب کالری در هر اسمول) = 1400 log c1/c2
Thus, in terms of calories, the amount of energy required to concentrate 1 osmole of a substance 10-fold is about 1400 calories, whereas to concentrate it 100-fold, 2800 calories are required. One can see that the energy expen- diture for concentrating substances in cells or for remov- ing substances from cells against a concentration gradient can be tremendous. Some cells, such as those lining the renal tubules and many glandular cells, expend as much as 90% of their energy for this purpose alone.
بنابراین، از نظر کالری، مقدار انرژی مورد نیاز برای تغلیظ ۱ اسمول از یک ماده ۱۰ برابر، حدود ۱۴۰۰ کالری است، در حالی که برای تمرکز آن ۱۰۰ برابر، ۲۸۰۰ کالری لازم است. میتوان مشاهده کرد که مصرف انرژی برای متمرکز کردن مواد در سلولها یا برای حذف مواد از سلولها در برابر گرادیان غلظت میتواند بسیار زیاد باشد. برخی از سلولها، مانند سلولهای پوشاننده لولههای کلیوی و بسیاری از سلولهای غدد، ۹۰ درصد انرژی خود را صرف این هدف میکنند.
SECONDARY ACTIVE TRANSPORT- CO-TRANSPORT AND COUNTER-TRANSPORT
When sodium ions are transported out of cells by pri- mary active transport, a large concentration gradient ofsodium ions across the cell membrane usually develops, with a high concentration outside the cell and a low con- centration inside. This gradient represents a storehouse of energy, because the excess sodium outside the cell membrane is always attempting to diffuse to the interior. Under appropriate conditions, this diffusion energy of sodium can pull other substances along with the sodium through the cell membrane. This phenomenon, called co- transport, is one form of secondary active transport.
حمل و نقل فعال ثانویه – حمل و نقل مشترک و متقابل
وقتی یونهای سدیم از طریق انتقال فعال اولیه به خارج از سلول منتقل میشوند، معمولاً یک گرادیان غلظت زیادی از یونهای سدیم در سراسر غشای سلول ایجاد میشود که غلظت بالایی در خارج از سلول و غلظت کم در داخل سلول دارد. این گرادیان نشان دهنده یک انبار انرژی است، زیرا سدیم اضافی در خارج از غشای سلولی همیشه در تلاش است تا به داخل نفوذ کند. تحت شرایط مناسب، این انرژی انتشار سدیم میتواند مواد دیگر را همراه با سدیم از طریق غشای سلولی بکشد. این پدیده که حمل و نقل مشترک نامیده میشود، یکی از اشکال حمل و نقل فعال ثانویه است.
For sodium to pull another substance along with it, a coupling mechanism is required; this is achieved by means of still another carrier protein in the cell mem- brane. The carrier in this case serves as an attachment point for both the sodium ion and the substance to be co-transported. Once they are both attached, the energy gradient of the sodium ion causes the sodium ion and the other substance to be transported together to the interior of the cell.
برای اینکه سدیم ماده دیگری را به همراه خود بکشد، مکانیسم جفت مورد نیاز است. این با استفاده از پروتئین حامل دیگری در غشای سلولی به دست میآید. حامل در این مورد به عنوان یک نقطه اتصال هم برای یون سدیم و هم برای ماده ای که باید به طور مشترک منتقل شود عمل میکند. هنگامیکه هر دو به هم متصل شدند، گرادیان انرژی یون سدیم باعث میشود یون سدیم و ماده دیگر با هم به داخل سلول منتقل شوند.
In counter-transport, sodium ions again attempt to dif- fuse to the interior of the cell because of their large con- centration gradient. However, this time, the substance to be transported is on the inside of the cell and is trans- ported to the outside. Therefore, the sodium ion binds to the carrier protein, where it projects to the exterior sur- face of the membrane, and the substance to be counter- transported binds to the interior projection of the carrier protein. Once both have become bound, a conformational change occurs, and energy released by the action of the sodium ion moving to the interior causes the other sub- stance to move to the exterior.
در حمل و نقل متقابل، یونهای سدیم دوباره تلاش میکنند تا به داخل سلول به دلیل گرادیان غلظت زیادشان منتشر شوند. با این حال، این بار، ماده ای که قرار است منتقل شود در داخل سلول قرار دارد و به خارج منتقل میشود. بنابراین، یون سدیم به پروتئین حامل متصل میشود، جایی که به سطح بیرونی غشاء میریزد، و ماده ای که قرار است در مقابل منتقل شود، به برجستگی داخلی پروتئین حامل متصل میشود. هنگامیکه هر دو متصل شدند، یک تغییر ساختاری رخ میدهد و انرژی آزاد شده توسط عمل یون سدیم که به سمت داخل حرکت میکند باعث میشود ماده دیگر به سمت بیرون حرکت کند.
Co-Transport of Glucose and Amino Acids Along with Sodium lons
Glucose and many amino acids are transported into most cells against large concentration gradients; the mechanism of this action is entirely by co-transport, as shown in Figure 4-13. Note that the transport carrier protein has two binding sites on its exterior side, one for sodium and one for glucose. Also, the concentration of sodium ions is high on the outside and low on the inside, which provides energy for the transport. A special prop- erty of the transport protein is that a conformational change to allow sodium movement to the interior will not occur until a glucose molecule also attaches. When they both become attached, the conformational change takes place, and the sodium and glucose are transported to the inside of the cell at the same time. Hence, this is a sodium-glucose co-transporter. Sodium-glucose co- transporters are especially important for transporting glucose across renal and intestinal epithelial cells, as dis- cussed in Chapters 28 and 66.
انتقال همزمان گلوکز و اسیدهای آمینه همراه با لون سدیم
گلوکز و بسیاری از آمینو اسیدها در برابر شیب غلظت زیاد به اکثر سلولها منتقل میشوند. همانطور که در شکل ۴-۱۳ نشان داده شده است، مکانیسم این عمل کاملاً با حمل و نقل مشترک است. توجه داشته باشید که پروتئین حامل حامل دو محل اتصال در قسمت بیرونی خود دارد، یکی برای سدیم و دیگری برای گلوکز. همچنین، غلظت یونهای سدیم در بیرون زیاد و در داخل کم است که انرژی را برای حمل و نقل فراهم میکند. یک ویژگی خاص پروتئین حمل و نقل این است که تا زمانی که یک مولکول گلوکز هم نچسبد، تغییر ساختاری برای اجازه حرکت سدیم به داخل رخ نمیدهد. هنگامیکه هر دو به هم متصل میشوند، تغییر ساختاری رخ میدهد و سدیم و گلوکز به طور همزمان به داخل سلول منتقل میشوند. از این رو، این یک ناقل سدیم-گلوکز است.همانطور که در فصلهای ۲۸ و ۶۶ بحث شد، انتقال دهندههای سدیم-گلوکز به ویژه برای انتقال گلوکز از طریق سلولهای اپیتلیال کلیه و روده مهم هستند.
Sodium co-transport of amino acids occurs in the same manner as for glucose, except that it uses a different set of transport proteins. At least five amino acid transport proteins have been identified, each of which is responsible for transporting one subset of amino acids with specific molecular characteristics.
انتقال همزمان اسیدهای آمینه سدیم به روشی مشابه گلوکز انجام میشود، با این تفاوت که از مجموعه متفاوتی از پروتئینهای انتقال استفاده میکند. حداقل پنج پروتئین انتقال آمینو اسید شناسایی شده است که هر کدام مسئول انتقال یک زیر مجموعه از اسیدهای آمینه با ویژگیهای مولکولی خاص هستند.
Sodium co-transport of glucose and amino acids occurs especially through the epithelial cells of the intes- tinal tract and the renal tubules of the kidneys to promote absorption of these substances into the blood. This pro- cess will be discussed in later chapters.
انتقال همزمان سدیم گلوکز و اسیدهای آمینه به ویژه از طریق سلولهای اپیتلیال مجرای روده و لولههای کلیوی کلیه انجام میشود تا جذب این مواد در خون را افزایش دهد. این فرآیند در فصول بعدی مورد بحث قرار خواهد گرفت.
Other important co-transport mechanisms in at least some cells include co-transport of potassium, chloride, bicarbonate, phosphate, iodine, iron, and urate ions.
سایر مکانیسمهای مهم انتقال مشترک حداقل در برخی سلولها شامل انتقال همزمان یونهای پتاسیم، کلرید، بیکربنات، فسفات، ید، آهن و اورات است.
Figure 4-13.
Postulated mechanism for sodium co-transport of glucose.
شکل ۴-۱۳.
مکانیسم فرضی برای انتقال همزمان سدیم گلوکز.
Figure 4-14.
Sodium counter-transport of calcium and hydrogen ions.
شکل ۴-۱۴.
سدیم ضد انتقال یونهای کلسیم و هیدروژن.
Sodium Counter-Transport of Calcium and Hydrogen lons
Two especially important counter-transporters (ie., transport in a direction opposite to the primary ion) are sodium-calcium counter-transport and sodium-hydrogen counter-transport (Figure 4-14).
سدیم ضد انتقال کلسیم و یون هیدروژن
دو ضد انتقال دهنده مهم (یعنی انتقال در جهت مخالف یون اولیه) ضد انتقال سدیم-کلسیم و ضدحمل سدیم-هیدروژن هستند (شکل ۴-۱۴).
Sodium-calcium counter-transport occurs through all or almost all cell membranes, with sodium ions mov- ing to the interior and calcium ions to the exterior; both are bound to the same transport protein in a counter- transport mode. This mechanism is in addition to the pri- mary active transport of calcium that occurs in some cells.
انتقال متقابل سدیم-کلسیم از طریق تمام یا تقریباً تمام غشای سلولی انجام میشود که یونهای سدیم به داخل و یونهای کلسیم به بیرون حرکت میکنند. هر دو در یک حالت انتقال متقابل به یک پروتئین حمل و نقل متصل میشوند. این مکانیسم علاوه بر انتقال فعال اولیه کلسیم است که در برخی از سلولها رخ میدهد.
Sodium-hydrogen counter-transport occurs in several tissues. An especially important example is in the proxi- mal tubules of the kidneys, where sodium ions move from the lumen of the tubule to the interior of the tubular cell and hydrogen ions are counter-transported into the tubule lumen. As a mechanism for concentrating hydrogen ions, counter-transport is not nearly as powerful as the primary active transport of hydrogen ions that occurs in the more dis- tal renal tubules, but it can transport extremely large numbers of hydrogen ions, thus making it a key to hydrogen ion control in the body fluids, as discussed in detail in Chapter 31.
انتقال متقابل سدیم-هیدروژن در چندین بافت رخ میدهد. یک مثال مهم در لولههای پروگزیمال کلیهها است، جایی که یونهای سدیم از مجرای لوله به داخل سلول لولهای حرکت میکنند و یونهای هیدروژن به طور متقابل به مجرای توبول منتقل میشوند. به عنوان مکانیزمیبرای تمرکز یونهای هیدروژن، انتقال متقابل به اندازه انتقال فعال اولیه یونهای هیدروژن که در لولههای کلیوی دیستالتر اتفاق میافتد، قدرتمند نیست، اما میتواند تعداد بسیار زیادی یون هیدروژن را انتقال دهد، بنابراین، همانطور که در فصل ۳۱ به تفصیل مورد بحث قرار گرفت، آن را به کلیدی برای کنترل یون هیدروژن در مایعات بدن تبدیل میکند.
Figure 4-15.
Basic mechanism of active transport across a layer of cells.
شکل ۴-۱۵.
مکانیسم اصلی انتقال فعال در سراسر لایه ای از سلولها.
ACTIVE TRANSPORT THROUGH CELLULAR SHEETS
At many places in the body, substances must be trans- ported all the way through a cellular sheet instead of sim- ply through the cell membrane. Transport of this type occurs through the following: (1) intestinal epithelium; (2) epithelium of the renal tubules; (3) epithelium of all exocrine glands; (4) epithelium of the gallbladder; and (5) membrane of the choroid plexus of the brain, along with other membranes.
حمل و نقل فعال از طریق ورقهای سلولی
در بسیاری از نقاط بدن، مواد باید از طریق یک ورقه سلولی به جای صرفاً از طریق غشای سلولی منتقل شوند. انتقال این نوع از طریق موارد زیر انجام میشود: (۱) اپیتلیوم روده. (۲) اپیتلیوم لولههای کلیوی. (۳) اپیتلیوم تمام غدد برون ریز. (۴) اپیتلیوم کیسه صفرا. و (۵) غشای شبکه مشیمیه مغز، همراه با غشاهای دیگر.
The basic mechanism for transport of a substance through a cellular sheet is as follows: (1) active transport through the cell membrane on one side of the transporting cells in the sheet; and then (2) either simple diffusion or facilitated diffusion through the membrane on the oppo- site side of the cell.
مکانیسم اصلی برای انتقال یک ماده از طریق یک ورقه سلولی به شرح زیر است: (۱) انتقال فعال از طریق غشای سلولی در یک طرف سلولهای انتقال دهنده در ورقه. و سپس (۲) یا انتشار ساده یا انتشار آسان از طریق غشاء در طرف مقابل سلول.
Figure 4-15 shows a mechanism for the transport of sodium ions through the epithelial sheet of the intestines, gallbladder, and renal tubules. This figure shows that the epithelial cells are connected together tightly at the lumi- nal pole by means of junctions. The brush border on the luminal surfaces of the cells is permeable to both sodium ions and water. Therefore, sodium and water diffuse read- ily from the lumen into the interior of the cell. Then, at the basal and lateral membranes of the cells, sodium ions are actively transported into the extracellular fluid of the sur- rounding connective tissue and blood vessels. This action creates a high sodium ion concentration gradient across these membranes, which in turn causes osmosis of water. Thus, active transport of sodium ions at the basolateral sides of the epithelial cells results in the transport not only of sodium ions but also of water.
شکل ۴-۱۵ مکانیسمیرا برای انتقال یونهای سدیم از طریق ورقه اپیتلیال رودهها، کیسه صفرا و لولههای کلیوی نشان میدهد. این شکل نشان میدهد که سلولهای اپیتلیال بهوسیله اتصالات در قطب لومینال محکم به هم متصل شدهاند. مرز قلم مو روی سطوح مجرای سلولها هم برای یونهای سدیم و هم آب نفوذپذیر است. بنابراین، سدیم و آب به آسانی از لومن به داخل سلول پخش میشود. سپس در غشای پایه و جانبی سلولها، یونهای سدیم به طور فعال به مایع خارج سلولی بافت همبند اطراف و عروق خونی منتقل میشوند. این عمل باعث ایجاد گرادیان غلظت یون سدیم بالا در این غشاها میشود که به نوبه خود باعث اسمز آب میشود. بنابراین، انتقال فعال یونهای سدیم در طرفهای قاعدهای سلولهای اپیتلیال منجر به انتقال نه تنها یونهای سدیم، بلکه همچنین انتقال آب میشود.
It is through these mechanisms that almost all nutri- ents, ions, and other substances are absorbed into the blood from the intestine. These mechanisms are also how the same substances are reabsorbed from the glomerular filtrate by the renal tubules.
از طریق این مکانیسمها است که تقریباً تمام مواد مغذی، یونها و سایر مواد از روده به خون جذب میشوند. این مکانیسمها همچنین نحوه جذب مجدد همان مواد از فیلتر گلومرولی توسط لولههای کلیوی است.
Numerous examples of the different types of transport discussed in this chapter are provided throughout this text.
Bibliography
کتابشناسی
Agre P, Kozono D: Aquaporin water channels: molecular mechanisms for human diseases. FEBS Lett 555:72, 2003.
Bröer S: Amino acid transport across mammalian intestinal and renal epithelia. Physiol Rev 88:249, 2008.
DeCoursey TE: Voltage-gated proton channels: molecular biology, physiology, and pathophysiology of the H(V) family. Physiol Rev 93:599, 2013.
DiPolo R, Beaugé L: Sodium/calcium exchanger: influence of metabol- ic regulation on ion carrier interactions. Physiol Rev 86:155, 2006.
Drummond HA, Jernigan NL, Grifoni SC: Sensing tension: epithelial sodium channel/acid-sensing ion channel proteins in cardiovascular homeostasis. Hypertension 51:1265, 2008.
Eastwood AL, Goodman MB: Insight into DEG/ENaC channel gating from genetics and structure. Physiology (Bethesda) 27:282, 2012.
Fischbarg J: Fluid transport across leaky epithelia: central role of the tight junction and supporting role of aquaporins. Physiol Rev 90:1271, 2010.
Gadsby DC: lon channels versus ion pumps: the principal difference, in principle. Nat Rev Mol Cell Biol 10:344, 2009. Ghezzi C, Loo DDF, Wright EM. Physiology of renal glucose handling
via SGLT1, SGLT2 and GLUT2. Diabetologia 61:2087-2097, 2018. Hilge M: Ca2+ regulation of ion transport in the Na+/Ca2+ exchanger. J Biol Chem 287:31641, 2012.
Jentsch TJ, Pusch M. CLC Chloride channels and transporters: struc- ture, function, physiology, and disease. Physiol Rev 2018 98:1493- 1590, 2018.
Kaksonen M, Roux A. Mechanisms of clathrin-mediated endocytosis. Nat Rev Mol Cell Biol 19:313-326, 2018.
Kandasamy P, Gyimesi G, Kanai Y, Hediger MA. Amino acid trans- porters revisited: new views in health and disease. Trends Biochem Sci 43:752-789, 2018.
Papadopoulos MC, Verkman AS: Aquaporin water channels in the nervous system. Nat Rev Neurosci 14:265, 2013.
Rieg T, Vallon V. Development of SGLT1 and SGLT2 inhibitors. Diabe- tologia 61:2079-2086, 2018.
Sachs F: Stretch-activated ion channels: what are they? Physiology 25:50, 2010.
Schwab A, Fabian A, Hanley PJ, Stock C: Role of ion channels and transporters in cell migration. Physiol Rev 92:1865, 2012.
Stransky L, Cotter K, Forgac M. The function of V-ATPases in cancer. Physiol Rev 96:1071-1091, 2016
Tian J, Xie ZJ: The Na-K-ATPase and calcium-signaling microdomains. Physiology (Bethesda) 23:205, 2008.
Verkman AS, Anderson MO, Papadopoulos MC. Aquaporins: impor- tant but elusive drug targets. Nat Rev Drug Discov 13:259-277, 2014.
Wright EM, Loo DD, Hirayama BA: Biology of human sodium glucose transporters. Physiol Rev 91:733, 2011.
شکل ۱-۴ غلظت تقریبی الکترولیتهای مهم و سایر مواد در مایع خارج سلولی و مایع درون سلولی را نشان میدهد. توجه داشته باشید که مایع خارج سلولی حاوی مقدار زیادی سدیم است اما مقدار کمی پتاسیم دارد. دقیقا برعکس در مورد مایع داخل سلولی صادق است. همچنین مایع خارج سلولی حاوی مقدار زیادی یون کلرید است، در حالی که مایع داخل سلولی حاوی مقدار بسیار کمییون کلرید است. اما غلظت فسفاتها و پروتئینها در مایع داخل سلولی به طور قابل توجهی بیشتر از مایعات خارج سلولی است. این تفاوتها برای زندگی سلول بسیار مهم هستند. هدف این فصل توضیح این است که چگونه تفاوتها توسط مکانیسمهای انتقال غشای سلولی ایجاد میشود.
 شکل ۱-۴ ترکیبات شیمیایی مایعات خارج سلولی و درون سلولی.
شکل ۱-۴ ترکیبات شیمیایی مایعات خارج سلولی و درون سلولی.
سد لیپیدی غشای سلولی و پروتئینهای انتقال غشای سلولی
ساختار غشایی که بیرون هر سلول بدن را میپوشاند در فصل ۲ مورد بحث قرار گرفته و در شکلهای ۲-۳ و ۲-۴ نشان داده شده است. این غشاء تقریباً به طور کامل از یک لایه دولایه لیپیدی تشکیل شده است، اما همچنین حاوی تعداد زیادی مولکول پروتئین در لیپید است که بسیاری از آنها در تمام طول غشا نفوذ میکنند، همانطور که در شکل ۲-۴ نشان داده شده است.
 شکل ۳-۴ انتشار یک مولکول سیال در طول یک هزارم ثانیه.
شکل ۳-۴ انتشار یک مولکول سیال در طول یک هزارم ثانیه.
 شکل ۲-۴ مسیرهای انتقال از طریق غشای سلولی و مکانیسمهای اصلی انتقال.
شکل ۲-۴ مسیرهای انتقال از طریق غشای سلولی و مکانیسمهای اصلی انتقال.
دولایه لیپیدی نه با مایع خارج سلولی و نه با مایع درون سلولی قابل اختلاط نیست. بنابراین، مانعی در برابر حرکت مولکولهای آب و مواد محلول در آب بین قسمتهای مایع خارج سلولی و درون سلولی است. با این حال، همانطور که در شکل ۲-۴ توسط فلش سمت چپ نشان داده شده است، چند ماده میتوانند به این لایه دوتایی لیپیدی نفوذ کنند و مستقیماً از طریق خود ماده لیپیدی منتشر شوند. این به طور عمده در مورد مواد محلول در چربی صادق است، همانطور که بعدا توضیح داده شد.
مولکولهای پروتئین در غشاء خواص کاملاً متفاوتی برای انتقال مواد دارند. ساختارهای مولکولی آنها تداوم دولایه لیپیدی را قطع میکند و مسیر جایگزینی را از طریق غشای سلولی تشکیل میدهد. بنابراین، بیشتر این پروتئینهای نافذ میتوانند به عنوان پروتئینهای انتقال عمل کنند. پروتئینهای مختلف عملکرد متفاوتی دارند. برخی از آنها دارای فضاهای آبی در تمام طول مولکول هستند و اجازه حرکت آزادانه آب و همچنین یونها یا مولکولهای انتخاب شده را میدهند. اینها پروتئینهای کانال نامیده میشوند. برخی دیگر به نام پروتئینهای حامل، با مولکولها یا یونهایی که قرار است منتقل شوند، پیوند برقرار کنند. تغییرات ساختاری در مولکولهای پروتئین، سپس مواد را از میان لایههای پروتئین به سمت دیگر غشاء حرکت میدهد. هم پروتئینهای کانال و هم پروتئینهای حامل معمولاً برای انواع مولکولها یا یونهایی که اجازه عبور از غشاء را دارند بسیار انتخابی هستند.
“Diffusion” در مقابل “Active Transport.”
انتقال از طریق غشای سلولی، یا مستقیماً از طریق دولایه لیپیدی یا از طریق پروتئینها، توسط یکی از دو فرآیند اساسی انجام میشود: انتشار یا انتقال فعال.
اگرچه تغییرات زیادی از این مکانیسمهای اساسی وجود دارد، انتشار به معنای حرکت مولکولی تصادفی مواد به مولکول به مولکول است، چه از طریق فضاهای بین مولکولی در غشاء یا در ترکیب با یک پروتئین حامل. انرژی که باعث انتشار میشود، انرژی حرکت جنبشی طبیعی ماده است.
در مقابل، انتقال فعال به معنای حرکت یونها یا سایر مواد در سراسر غشاء در ترکیب با یک پروتئین حامل است، به گونه ای که پروتئین حامل باعث میشود که ماده بر خلاف گرادیان انرژی حرکت کند، مثلاً از حالت غلظت کم به حالت زیاد. – حالت تمرکز این حرکت علاوه بر انرژی جنبشی به منبع انرژی اضافی نیز نیاز دارد. در ادامه توضیحات مفصل تری در مورد فیزیک و شیمیفیزیک پایه این دو فرآیند ارائه شده است.
انتشار
تمام مولکولها و یونهای موجود در مایعات بدن، از جمله مولکولهای آب و مواد محلول، در حرکت ثابت هستند و هر ذره بهصورت جداگانه حرکت میکند. حرکت این ذرات همان چیزی است که فیزیکدانان آن را “گرما” مینامند – هر چه حرکت بیشتر باشد، دما بالاتر است – و حرکت هرگز در هیچ شرایطی متوقف نمیشود مگر در دمای صفر مطلق. هنگامیکه یک مولکول متحرک، A، به یک مولکول ساکن، B، نزدیک میشود، نیروهای الکترواستاتیک و دیگر نیروهای هسته ای مولکول A، مولکول B را دفع میکنند و مقداری از انرژی حرکت مولکول A را به مولکول B منتقل میکنند. در نتیجه، مولکول B انرژی جنبشی حرکتی به دست میآورد.، در حالی که مولکول A کند میشود و مقداری از انرژی جنبشی خود را از دست میدهد. بنابراین، همانطور که در شکل ۳-۴ نشان داده شده است، یک مولکول منفرد در یک محلول در بین مولکولهای دیگر ابتدا در یک جهت، سپس جهت دیگر، سپس جهت دیگر، و به همین ترتیب، به طور تصادفی هزاران بار در هر ثانیه پرش میکند. این حرکت پیوسته مولکولها بین یکدیگر در مایعات یا گازها انتشار نامیده میشود.
یونها مانند مولکولهای کامل منتشر میشوند و حتی ذرات کلوئیدی معلق نیز به روشی مشابه منتشر میشوند، با این تفاوت که کلوئیدها به دلیل اندازه بزرگشان با سرعت بسیار کمتری نسبت به مواد مولکولی منتشر میشوند.
انتشار از طریق غشای سلولی
انتشار از طریق غشای سلولی به دو زیرگروه به نامهای انتشار ساده و انتشار تسهیل شده تقسیم میشود. انتشار ساده به این معنی است که حرکت جنبشی مولکولها یا یونها از طریق یک دهانه غشاء یا از طریق فضاهای بین مولکولی بدون هیچ گونه تعامل با پروتئینهای حامل در غشاء انجام میشود. سرعت انتشار با توجه به مقدار ماده موجود، سرعت حرکت جنبشی، و تعداد و اندازه روزنههای غشا که مولکولها یا یونها میتوانند از طریق آن حرکت کنند، تعیین میشود.
انتشار تسهیل شده نیاز به تعامل یک پروتئین حامل دارد. پروتئین حامل به عبور مولکولها یا یونها از غشاء با اتصال شیمیایی به آنها و عبور دادن آنها از طریق غشاء به این شکل کمک میکند.
انتشار ساده میتواند از طریق غشای سلولی توسط دو مسیر اتفاق بیفتد: (۱) از طریق فواصل دولایه لیپیدی اگر ماده انتشار دهنده محلول در چربی باشد و (۲) از طریق کانالهای آبکی که تمام راه را از طریق برخی از پروتئینهای حمل و نقل بزرگ نفوذ میکنند. در شکل ۲-۴ در سمت چپ نشان داده شده است.
انتشار مواد محلول در چربی از طریق لایه چربی
یکی از مهم ترین عواملی که تعیین میکند یک ماده با چه سرعتی در دو لایه لیپیدی منتشر میشود، حلالیت آن در چربی است. به عنوان مثال، حلالیتهای چربی اکسیژن، نیتروژن، دی اکسید کربن و الکلها زیاد است، بنابراین همه اینها میتوانند مستقیماً در دولایه لیپیدی حل شوند و از طریق غشای سلولی پخش شوند، به همان ترتیبی که انتشار املاح آب در محلول آبکی اتفاق میافتد. به دلایل واضح، سرعت انتشار هر یک از این مواد از طریق غشا با حلالیت چربی آن نسبت مستقیم دارد. به خصوص مقادیر زیادی از اکسیژن را میتوان از این طریق منتقل کرد. بنابراین، اکسیژن را میتوان به داخل سلول تقریباً به صورتی که غشای سلولی وجود ندارد، تحویل داد.
انتشار آب و سایر مولکولهای نامحلول در چربی از طریق کانالهای پروتئینی
با وجود اینکه آب در لیپیدهای غشاء بسیار نامحلول است، اما به آسانی از کانالهای مولکولهای پروتئینی عبور میکند که تا آخر غشا نفوذ میکنند. سرعت حرکت مولکولهای آب در بیشتر غشای سلولی شگفت انگیز است. به عنوان مثال، مقدار کل آبی که در هر ثانیه در هر جهت از طریق غشای گلبول قرمز منتشر میشود، حدود ۱۰۰ برابر حجم خود گلبول قرمز است.
سایر مولکولهای نامحلول در چربی اگر محلول در آب و به اندازه کافی کوچک باشند میتوانند مانند مولکولهای آب از کانالهای منافذ پروتئین عبور کنند. با این حال، با بزرگتر شدن آنها، نفوذ آنها به سرعت کاهش مییابد. به عنوان مثال، قطر مولکول اوره تنها ۲۰ درصد بیشتر از قطر آب است، اما نفوذ آن از طریق منافذ غشای سلولی حدود ۱۰۰۰ برابر کمتر از نفوذ آب است. با این حال، با توجه به سرعت شگفتانگیز نفوذ آب، این مقدار از نفوذ اوره همچنان امکان انتقال سریع اوره از طریق غشا را در عرض چند دقیقه فراهم میکند.
انتشار از طریق منافذ و کانالهای پروتئین – نفوذ پذیری انتخابی و “دروازه” کانالها
بازسازیهای سه بعدی کامپیوتری منافذ و کانالهای پروتئینی، مسیرهای لولهای را از خارج سلولی تا مایع درون سلولی نشان دادهاند. بنابراین، مواد میتوانند با انتشار ساده مستقیماً در طول این منافذ و کانالها از یک طرف غشاء به طرف دیگر حرکت کنند.
منافذ از پروتئینهای انتگرال غشای سلولی تشکیل شده اند که لولههای باز را از طریق غشاء تشکیل میدهند و همیشه باز هستند. با این حال، قطر منافذ و بارهای الکتریکی آن گزینش پذیری را فراهم میکند که فقط به مولکولهای خاصی اجازه عبور میدهد. به عنوان مثال، منافذ پروتئین، به نام آکواپورین یا کانالهای آب، اجازه عبور سریع آب از غشای سلولی را میدهند، اما مولکولهای دیگر را حذف میکنند. حداقل ۱۳ نوع مختلف آکواپورین در سلولهای مختلف بدن انسان یافت شده است. آکواپورینها دارای منافذ باریکی هستند که به مولکولهای آب اجازه میدهد از طریق غشاء در یک فایل منفرد پخش شوند. منافذ خیلی باریک است که اجازه عبور یونهای هیدراته را نمیدهد. همانطور که در فصلهای ۲۹ و ۷۵ بحث شدچگالی برخی از آکواپورینها (مثلاً آکواپورین-۲) در غشای سلولی ساکن نیست، اما در شرایط مختلف فیزیولوژیکی تغییر میکند.
کانالهای پروتئینی با دو ویژگی مهم متمایز میشوند: (۱) آنها اغلب به طور انتخابی به مواد خاصی نفوذ میکنند و (۲) بسیاری از کانالها را میتوان توسط دروازههایی باز یا بسته کرد که توسط سیگنالهای الکتریکی تنظیم میشوند (کانالهای دریچه ولتاژ) یا مواد شیمیایی که به پروتئینهای کانال متصل میشوند (کانالهای دروازه ای لیگاند).
نفوذپذیری انتخابی کانالهای پروتئینی
بسیاری از کانالهای پروتئینی برای انتقال یک یا چند یون یا مولکول خاص بسیار انتخابی هستند. این نتیجه از خصوصیات خود کانال، مانند قطر، شکل آن، و ماهیت بارهای الکتریکی و پیوندهای شیمیایی در امتداد سطوح داخلی آن است.
کانالهای پتاسیم اجازه عبور یونهای پتاسیم از غشای سلولی را حدود ۱۰۰۰ برابر آسانتر از عبور یونهای سدیم میدهند. با این حال، این درجه انتخابی بالا را نمیتوان به طور کامل با قطر مولکولی یونها توضیح داد زیرا یونهای پتاسیم کمیبزرگتر از یونهای سدیم هستند. مکانیسم این انتخاب یون قابل توجه چیست؟ زمانی که ساختار یک کانال پتاسیم باکتریایی توسط کریستالوگرافی اشعه ایکس تعیین شد، این سوال تا حدی پاسخ داده شد. کانالهای پتاسیم دارای ساختار تترامری متشکل از چهار زیرواحد پروتئینی یکسان در اطراف یک منفذ مرکزی هستند (شکل ۴-۴). در بالای منافذ کانال حلقههای منفذی وجود دارد که یک باریک را تشکیل میدهند فیلتر انتخابی. پوشش فیلتر انتخابی، اکسیژنهای کربونیل است. هنگامیکه یونهای پتاسیم هیدراته وارد فیلتر انتخابی میشوند، با اکسیژنهای کربونیل برهم کنش میکنند و بیشتر مولکولهای آب محدود شده خود را میریزند و به یونهای پتاسیم دهیدراته اجازه عبور از کانال را میدهند. با این حال، اکسیژنهای کربونیل بسیار از هم دور هستند تا بتوانند با یونهای سدیم کوچکتر تعامل نزدیک داشته باشند، بنابراین فیلتر انتخابپذیری به طور موثری از عبور از منافذ حذف میشود.
 شکل ۴-۴ ساختار یک کانال پتاسیم. کانال از چهار زیر واحد تشکیل شده است (فقط دو زیر واحد نشان داده شده است)، که هر کدام دارای دو مارپیچ گذرنده است. یک فیلتر انتخابی باریک از حلقههای منافذ تشکیل میشود و اکسیژنهای کربونیل دیوارههای فیلتر گزینشپذیری را میپوشاند و محلهایی را برای اتصال گذرا یونهای پتاسیم دهیدراته تشکیل میدهد. برهمکنش یونهای پتاسیم با اکسیژنهای کربونیل باعث میشود یونهای پتاسیم مولکولهای آب محدود خود را از بین ببرند و به یونهای پتاسیم آبخورده اجازه عبور از منافذ را میدهند.
شکل ۴-۴ ساختار یک کانال پتاسیم. کانال از چهار زیر واحد تشکیل شده است (فقط دو زیر واحد نشان داده شده است)، که هر کدام دارای دو مارپیچ گذرنده است. یک فیلتر انتخابی باریک از حلقههای منافذ تشکیل میشود و اکسیژنهای کربونیل دیوارههای فیلتر گزینشپذیری را میپوشاند و محلهایی را برای اتصال گذرا یونهای پتاسیم دهیدراته تشکیل میدهد. برهمکنش یونهای پتاسیم با اکسیژنهای کربونیل باعث میشود یونهای پتاسیم مولکولهای آب محدود خود را از بین ببرند و به یونهای پتاسیم آبخورده اجازه عبور از منافذ را میدهند.
اعتقاد بر این است که فیلترهای انتخابی متفاوت برای کانالهای یونی مختلف، تا حد زیادی، ویژگی کانال را برای کاتیونها یا آنیونها یا یونهای خاصی مانند Na +، K + و Ca ++ تعیین میکنند که به کانال دسترسی پیدا میکنند.
یکی از مهمترین کانالهای پروتئینی، کانال سدیم، تنها ۰.۳ در ۰.۵ نانومتر قطر دارد، اما مهمتر از آن، سطوح داخلی این کانال با آمینو اسیدهایی پوشانده شده است که دارای بار منفی قوی هستند، همانطور که علائم منفی نشان میدهد. داخل پروتئینهای کانال در پانل بالای شکل ۵-۴. این بارهای منفی قوی میتوانند یونهای سدیم کم آب شده کوچک را به این کانالها بکشانند و در واقع یونهای سدیم را از مولکولهای آب هیدراته خود دور کنند. هنگامیکه در کانال قرار میگیرند، یونهای سدیم طبق قوانین معمول انتشار در هر جهت منتشر میشوند. بنابراین، کانال سدیم به طور خاص برای عبور یونهای سدیم انتخابی است.
 شکل ۵-۴ انتقال یونهای سدیم و پتاسیم از طریق کانالهای پروتئینی. همچنین تغییرات ساختاری در مولکولهای پروتئین برای باز یا بسته کردن “دروازه” محافظ کانالها نشان داده شده است.
شکل ۵-۴ انتقال یونهای سدیم و پتاسیم از طریق کانالهای پروتئینی. همچنین تغییرات ساختاری در مولکولهای پروتئین برای باز یا بسته کردن “دروازه” محافظ کانالها نشان داده شده است.
دروازه کانالهای پروتئینی
راه اندازی کانالهای پروتئینی وسیله ای برای کنترل نفوذپذیری یون کانالها فراهم میکند. این در هر دو پانل شکل ۵-۴ برای دروازه بندی انتخابی یونهای سدیم و پتاسیم نشان داده شده است. اعتقاد بر این است که برخی از دروازهها امتداد دروازهای واقعی مولکول پروتئین انتقال هستند که میتوانند دهانه کانال را ببندند یا با تغییر ساختاری در شکل مولکول پروتئین از دهانه خارج شوند.
باز و بسته شدن دروازهها به دو روش اصلی کنترل میشود:
۱. دروازه ولتاژ. در این مثال، ترکیب مولکولی دروازه یا پیوندهای شیمیایی آن به پتانسیل الکتریکی در سراسر غشای سلولی پاسخ میدهد. به عنوان مثال، در پانل بالای شکل ۵-۴، هنگامیکه یک بار منفی قوی در داخل غشای سلولی وجود دارد، احتمالاً میتواند باعث شود که دروازههای سدیم بیرونی کاملاً بسته بمانند. برعکس، زمانی که داخل غشاء بار منفی خود را از دست میدهد، این دروازهها به طور ناگهانی باز میشوند و اجازه میدهند مقادیر زیادی سدیم از منافذ سدیم به داخل عبور کند. این مکانیسم اساسی برای برانگیختن پتانسیلهای عمل در اعصابی است که مسئول سیگنالهای عصبی هستند. در پانل پایین شکل ۵-۴دروازههای پتاسیم در انتهای درون سلولی کانالهای پتاسیم قرار دارند و زمانی که داخل غشای سلولی دارای بار مثبت میشوند باز میشوند. باز کردن این دروازهها تا حدی مسئول پایان دادن به پتانسیل عمل است، همانطور که در فصل ۵ به طور کامل مورد بحث قرار گرفته است.
۲. دروازه بندی شیمیایی (لیگاند). برخی از دروازههای کانال پروتئین با اتصال یک ماده شیمیایی (یک لیگاند) با پروتئین باز میشوند. این باعث تغییر پیوند ساختاری یا شیمیایی در مولکول پروتئین میشود که دروازه را باز یا بسته میکند. به این روش دروازهسازی شیمیایی یا دروازهبندی لیگاندی گفته میشود. یکی از مهم ترین موارد استفاده از دروازه شیمیایی، اثر استیل کولین بر کانال به اصطلاح استیل کولین است. استیل کولین دروازه این کانال را باز میکند و منافذی با بار منفی با قطر حدود ۰.۶۵ نانومتر ایجاد میکند که به مولکولهای بدون بار یا یونهای مثبت کوچکتر از این قطر اجازه عبور میدهد. این دروازه برای انتقال سیگنالهای عصبی از یک سلول عصبی به سلول عصبی دیگر بسیار مهم است (نگاه کنید به فصل ۴۵) و از سلولهای عصبی به سلولهای ماهیچه ای برای ایجاد انقباض عضلانی (به فصل ۷ مراجعه کنید).
حالت باز در مقابل وضعیت بسته کانالهای دردار
شکل ۶-۴ الف مشخصه جالب توجه اکثر کانالهای ولتاژدار را نشان میدهد. این شکل دو ضبط جریان الکتریکی را نشان میدهد که از طریق یک کانال سدیم منفرد جریان مییابد، زمانی که یک گرادیان پتانسیل تقریبی ۲۵ میلی ولت در سراسر غشاء وجود داشت. توجه داشته باشید که کانال جریان “همه یا هیچ” را هدایت میکند. یعنی دروازه کانال باز میشود و سپس بسته میشود، هر حالت باز فقط کسری از میلی ثانیه تا چندین میلی ثانیه طول میکشد. این نشان دهنده سرعت تغییراتی است که میتواند در طول باز و بسته شدن دروازههای مولکولی پروتئین رخ دهد. در یک پتانسیل ولتاژ، کانال ممکن است همیشه یا تقریباً همیشه بسته بماند، در حالی که در سطح ولتاژ دیگر، ممکن است تمام یا بیشتر اوقات باز بماند. در ولتاژهای بین، همانطور که در شکل نشان داده شده است،
 شکل ۶-۴ الف، ثبت جریان جریان از طریق یک کانال سدیم دردار ولتاژی، که اصل “همه یا هیچ” را برای باز و بسته شدن کانال نشان میدهد. ب، روش “پچ-گیره” برای ثبت جریان جریان از طریق یک کانال پروتئینی واحد. در سمت چپ، ضبط از یک “پچ” از یک غشای سلول زنده انجام میشود. در سمت راست، ضبط از یک وصله غشایی است که از سلول جدا شده است.
شکل ۶-۴ الف، ثبت جریان جریان از طریق یک کانال سدیم دردار ولتاژی، که اصل “همه یا هیچ” را برای باز و بسته شدن کانال نشان میدهد. ب، روش “پچ-گیره” برای ثبت جریان جریان از طریق یک کانال پروتئینی واحد. در سمت چپ، ضبط از یک “پچ” از یک غشای سلول زنده انجام میشود. در سمت راست، ضبط از یک وصله غشایی است که از سلول جدا شده است.
روش Patch-Clamp برای ضبط جریان یونی از طریق کانالهای تک
ممکن است تعجب کنید که چگونه میتوان جریان یونی را از طریق کانالهای تک پروتئینی همانطور که در شکل ۶-۴ الف نشان داده شده است، ثبت کرد. این با استفاده از روش “پچ-گیره” نشان داده شده در شکل ۶-۴ B به دست آمده است. خیلی ساده، یک میکروپیپت که قطر نوک آن تنها ۱ یا ۲ میکرومتر است، به قسمت بیرونی یک غشای سلولی متصل میشود. سپس مکش در داخل پیپت اعمال میشود تا غشاء را به سمت نوک پیپت بکشد. این یک مهر و موم در جایی ایجاد میکند که لبههای پیپت با غشای سلولی تماس میگیرد. نتیجه یک “لکه” غشایی دقیقه ای در نوک پیپت است که از طریق آن میتوان جریان الکتریکی را ثبت کرد.
متناوبا، همانطور که در شکل ۶-۴ B در سمت راست نشان داده شده است، وصله غشای سلول کوچک در انتهای پیپت میتواند از سلول جدا شود. سپس پیپت با پچ مهر و موم شده آن در محلول آزاد قرار میگیرد. این اجازه میدهد تا غلظت یونها هم در داخل میکروپیپت و هم در محلول بیرونی به دلخواه تغییر کند. همچنین، ولتاژ بین دو طرف غشا را میتوان به دلخواه تنظیم کرد – یعنی به یک ولتاژ معین “کلمپ” کرد.
میتوان چنین تکههایی را به اندازه کافی کوچک ساخت که فقط یک پروتئین کانالی در پچ غشایی مورد مطالعه یافت شود. با تغییر غلظت یونهای مختلف و همچنین ولتاژ روی غشا، میتوان ویژگیهای انتقال کانال منفرد و همچنین خواص دروازهای آن را تعیین کرد.
انتشار تسهیل شده
انتشار تسهیل شده، انتشار واسطه حامل نیز نامیده میشود زیرا ماده ای که به این روش منتقل میشود با استفاده از یک پروتئین حامل خاص برای کمک از طریق غشاء پخش میشود. یعنی حامل، انتشار ماده را به طرف دیگر تسهیل میکند.
انتشار تسهیل شده با انتشار ساده به روش مهم زیر متفاوت است: اگرچه سرعت انتشار ساده از طریق یک کانال باز متناسب با غلظت ماده منتشر کننده افزایش مییابد، اما در انتشار تسهیل شده، سرعت انتشار به حداکثر غلظت به نام V max نزدیک می شود. ماده منتشر کننده افزایش مییابد. این تفاوت بین انتشار ساده و انتشار تسهیل شده در شکل ۷-۴ نشان داده شده است. شکل نشان میدهد که با افزایش غلظت ماده منتشر کننده، سرعت انتشار ساده به طور متناسب به افزایش خود ادامه میدهد، اما در مورد انتشار تسهیل شده، سرعت انتشار نمیتواند بیشتر از سطح V max افزایش یابد.
 شکل ۷-۴ اثر غلظت یک ماده بر سرعت انتشار از طریق غشا با انتشار ساده و انتشار آسان. این نشان میدهد که انتشار تسهیل شده به حداکثر سرعتی به نام V max نزدیک میشود.
شکل ۷-۴ اثر غلظت یک ماده بر سرعت انتشار از طریق غشا با انتشار ساده و انتشار آسان. این نشان میدهد که انتشار تسهیل شده به حداکثر سرعتی به نام V max نزدیک میشود.
چه چیزی سرعت انتشار تسهیل شده را محدود میکند؟ پاسخ محتمل مکانیسمیاست که در شکل ۸-۴ نشان داده شده است. این شکل یک پروتئین حامل را نشان میدهد که منافذ آن به اندازه کافی بزرگ است تا یک مولکول خاص را از طریق آن منتقل کند. همچنین یک “گیرنده” اتصال در داخل حامل پروتئین را نشان میدهد. مولکولی که قرار است منتقل شود وارد منافذ شده و متصل میشود. سپس، در کسری از ثانیه، یک تغییر ساختاری یا شیمیایی در پروتئین حامل رخ میدهد، بنابراین منافذ اکنون به سمت مخالف غشاء باز میشود. از آنجایی که نیروی اتصال گیرنده ضعیف است، حرکت حرارتی مولکول متصل باعث جدا شدن آن و آزاد شدن آن در طرف مقابل غشاء میشود. سرعتی که در آن مولکولها میتوانند توسط این مکانیسم منتقل شوند، هرگز نمیتواند بیشتر از سرعتی باشد که مولکول پروتئین حامل میتواند بین دو حالت خود تغییر کند. البته به طور خاص توجه داشته باشید،
 شکل ۸-۴ مکانیسم فرضی برای انتشار تسهیل شده.
شکل ۸-۴ مکانیسم فرضی برای انتشار تسهیل شده.
از جمله مهم ترین موادی که با انتشار تسهیل شده از غشاهای سلولی عبور میکنند، گلوکز و بیشتر اسیدهای آمینه هستند. در مورد گلوکز، حداقل پنج مولکول ناقل گلوکز در بافتهای مختلف کشف شده است. برخی از اینها همچنین میتوانند مونوساکاریدهای دیگری را که ساختارهای مشابه گلوکز دارند، از جمله گالاکتوز و فروکتوز، انتقال دهند. یکی از اینها، انتقال دهنده گلوکز ۴ (GLUT4)، توسط انسولین فعال میشود، که میتواند سرعت انتشار آسان گلوکز را به میزان ۱۰ تا ۲۰ برابر در بافتهای حساس به انسولین افزایش دهد. این مکانیسم اصلی است که توسط آن انسولین مصرف گلوکز را در بدن کنترل میکند، همانطور که در فصل ۷۸ بحث شد.
عواملی که بر نرخ خالص انتشار تأثیر میگذارند
در حال حاضر واضح است که بسیاری از مواد میتوانند از طریق غشای سلولی پخش شوند. آنچه معمولاً مهم است، سرعت خالص انتشار یک ماده در جهت مورد نظر است. این نرخ خالص توسط عوامل مختلفی تعیین میشود.
نرخ انتشار خالص متناسب با اختلاف غلظت در سراسر غشاء است
شکل ۹-۴ A یک غشای سلولی را با یک ماده با غلظت بالا در خارج و غلظت کم در داخل نشان میدهد. سرعت انتشار ماده به داخل با غلظت مولکولها در خارج متناسب است زیرا این غلظت تعیین میکند که در هر ثانیه چند مولکول به بیرون غشاء برخورد میکند. برعکس، سرعت انتشار مولکولها به بیرون متناسب با غلظت آنها در داخل غشا است. بنابراین، سرعت انتشار خالص به داخل سلول متناسب با غلظت در خارج منهای غلظت در داخل است، یا:
 شکل ۹-۴ اثر اختلاف غلظت (A)، اختلاف پتانسیل الکتریکی بر یونهای منفی (B) و اختلاف فشار (C) برای انتشار مولکولها و یونها از طریق غشای سلولی.
شکل ۹-۴ اثر اختلاف غلظت (A)، اختلاف پتانسیل الکتریکی بر یونهای منفی (B) و اختلاف فشار (C) برای انتشار مولکولها و یونها از طریق غشای سلولی.
که در آن C o غلظت بیرون و C i غلظت داخل است.
اثر پتانسیل الکتریکی غشاء بر انتشار یونها – “پتانسیل Nernst”.
اگر یک پتانسیل الکتریکی در سراسر غشا اعمال شود، همانطور که در شکل ۹-۴ B نشان داده شده است، بارهای الکتریکی یونها باعث میشود که آنها از طریق غشاء حرکت کنند، حتی اگر هیچ تفاوت غلظتی برای ایجاد حرکت وجود نداشته باشد. بنابراین، در پانل سمت چپ شکل ۹-۴ B، غلظت منفی است یونها در دو طرف غشا یکسان هستند، اما یک بار مثبت به سمت راست غشاء و یک بار منفی به سمت چپ اعمال شده است و یک گرادیان الکتریکی در سراسر غشا ایجاد میکند. بار مثبت یونهای منفی را جذب میکند، در حالی که بار منفی آنها را دفع میکند. بنابراین، انتشار خالص از چپ به راست رخ میدهد. پس از مدتی، مقادیر زیادی از یونهای منفی به سمت راست حرکت کرده اند و شرایط نشان داده شده در پانل سمت راست شکل ۹-۴ B را ایجاد میکنند.که در آن اختلاف غلظت یونها در جهت مخالف اختلاف پتانسیل الکتریکی ایجاد شده است. اکنون اختلاف غلظت یونها را به سمت چپ حرکت میدهد، در حالی که اختلاف الکتریکی آنها را به سمت راست میبرد. هنگامیکه اختلاف غلظت به اندازه کافی بالا میرود، این دو اثر یکدیگر را متعادل میکنند. در دمای طبیعی بدن (۳۷ درجه سانتیگراد)، تفاوت الکتریکی که اختلاف غلظت معینی از یونهای تک ظرفیتی – مانند یونهای سدیم (Na +) را متعادل میکند – را میتوان از فرمول زیر تعیین کرد که معادله نرنست نامیده میشود:
که در آن EMF نیروی محرکه (ولتاژ) بین سمت ۱ و ضلع ۲ غشا است، C ۱ غلظت سمت ۱، و C ۲ غلظت سمت ۲ است. این معادله در درک انتقال عصب بسیار مهم است. تکانه میکند و در فصل ۵ با جزئیات بیشتر مورد بحث قرار میگیرد.
اثر اختلاف فشار در سراسر غشاء
گاهی اوقات، اختلاف فشار قابل توجهی بین دو طرف یک غشای قابل انتشار ایجاد میشود. به عنوان مثال، این اتفاق در غشای مویرگ خون در تمام بافتهای بدن رخ میدهد. فشار داخل مویرگ حدود ۲۰ میلی متر جیوه بیشتر از خارج است.
فشار در واقع به معنای مجموع تمام نیروهای مولکولهای مختلف است که در یک لحظه معین به یک سطح واحد برخورد میکنند. بنابراین، هنگامیکه فشار در یک طرف غشاء بیشتر از طرف دیگر باشد، به این معنی است که مجموع تمام نیروهای مولکولهایی که به کانالهای آن طرف غشا برخورد میکنند بیشتر از طرف دیگر است. در بیشتر موارد، این به دلیل برخورد تعداد بیشتری از مولکولها به غشاء در هر ثانیه در یک طرف نسبت به طرف دیگر است. نتیجه این است که مقادیر افزایش یافته انرژی برای ایجاد حرکت خالص مولکولها از سمت پرفشار به سمت سمت کم فشار در دسترس است. این اثر در شکل ۹-۴ C نشان داده شده است، که نشان میدهد پیستونی در حال ایجاد فشار بالا در یک طرف “منافذ” است و در نتیجه باعث میشود مولکولهای بیشتری به منافذ این طرف برخورد کنند و بنابراین مولکولهای بیشتری به طرف دیگر “پراکنده شوند”.
اسمز در سراسر غشاء نفوذ پذیر انتخابی – “انتشار خالص” آب
تا کنون فراوان ترین ماده ای که از طریق غشای سلولی پخش میشود آب است. معمولاً آب کافی در هر ثانیه از طریق غشای گلبول قرمز در هر ثانیه منتشر میشود و تقریباً ۱۰۰ برابر حجم خود سلول است. با این حال معمولاً مقداری که در دو جهت پخش میشود به قدری متعادل است که حرکت خالص آب رخ میدهد. بنابراین حجم سلول ثابت میماند. با این حال، تحت شرایط خاص، اختلاف غلظت برای آب میتواند در سراسر یک غشاء ایجاد شود، همانطور که اختلاف غلظت برای سایر مواد ممکن است رخ دهد. هنگامیکه این اتفاق میافتد، حرکت خالص آب در سراسر غشای سلولی رخ میدهد، که بسته به جهت حرکت آب، سلول را متورم یا کوچک میکند. این فرآیند حرکت خالص آب که در اثر اختلاف غلظت آب ایجاد میشود اسمز نامیده میشود.
برای مثالی از اسمز، اجازه دهید شرایط نشان داده شده در شکل ۱۰-۴ را با آب خالص در یک طرف غشای سلولی و محلول کلرید سدیم در طرف دیگر فرض کنیم. مولکولهای آب به راحتی از غشای سلولی عبور میکنند، در حالی که یونهای سدیم و کلرید فقط به سختی از آن عبور میکنند. بنابراین محلول کلرید سدیم در واقع مخلوطی از مولکولهای آب نفوذپذیر و یونهای سدیم و کلرید غیرقابل نفوذ است و گفته میشود که غشاء به طور انتخابی نفوذپذیر است. به آب، اما نسبت به یونهای سدیم و کلرید بسیار کمتر است. با این حال، وجود سدیم و کلرید برخی از مولکولهای آب را در سمت غشایی که این یونها در آن حضور دارند جابجا کرده است و بنابراین، غلظت مولکولهای آب را به کمتر از غلظت آب خالص کاهش داده است. در نتیجه، در مثال شکل ۱۰-۴، مولکولهای آب بیشتری به کانالهای سمت چپ، جایی که آب خالص وجود دارد، نسبت به سمت راست، جایی که غلظت آب کاهش یافته است، برخورد میکند. بنابراین، حرکت خالص آب از چپ به راست رخ میدهد – یعنی اسمز از آب خالص به محلول کلرید سدیم رخ میدهد.
 شکل ۱۰-۴ اسمز در غشای سلولی زمانی که محلول کلرید سدیم در یک طرف غشا و آب در طرف دیگر قرار میگیرد.
شکل ۱۰-۴ اسمز در غشای سلولی زمانی که محلول کلرید سدیم در یک طرف غشا و آب در طرف دیگر قرار میگیرد.
فشار اسمزی
اگر در شکل ۱۰-۴ فشار به محلول کلرید سدیم وارد شود، اسمز آب به این محلول کند میشود، متوقف میشود یا حتی معکوس میشود. مقدار دقیق فشار لازم برای توقف اسمز را فشار اسمزی محلول کلرید سدیم مینامند.
اصل اختلاف فشار مخالف اسمز در شکل ۱۱-۴ نشان داده شده است که یک غشای تراوا انتخابی را نشان میدهد که دو ستون سیال را از هم جدا میکند، یکی حاوی آب خالص و دیگری حاوی محلولی از آب و هر املاحی است که به غشاء نفوذ نمیکند. اسمز آب از محفظه B به محفظه A باعث میشود سطوح ستونهای سیال دورتر و دورتر از هم شوند تا در نهایت اختلاف فشاری بین دو طرف غشاء به اندازه کافی ایجاد شود که با اثر اسمزی مخالفت کند. اختلاف فشار در سراسر غشا در این نقطه برابر با فشار اسمزی محلولی است که حاوی املاح غیر قابل نفوذ است.
 شکل ۱۱-۴ نمایش فشار اسمزی ناشی از اسمز در یک غشای نیمه تراوا.
شکل ۱۱-۴ نمایش فشار اسمزی ناشی از اسمز در یک غشای نیمه تراوا.
اهمیت تعداد ذرات اسمزی (غلظت مولی) در تعیین فشار اسمزی
فشار اسمزی اعمال شده توسط ذرات در محلول، خواه مولکول یا یون باشند، با تعداد ذرات در واحد حجم سیال تعیین میشود، نه با جرم ذرات. دلیل این امر این است که هر ذره در یک محلول، صرف نظر از جرمش، به طور متوسط فشار یکسانی را به غشاء وارد میکند. یعنی ذرات بزرگی که جرم آنها (m) بیشتر از ذرات کوچک است، با سرعت کمتر (v) حرکت میکنند. ذرات کوچک با سرعتهای بالاتر حرکت میکنند به گونه ای که میانگین انرژی جنبشی آنها (k) که توسط معادله تعیین میشود.
برای هر ذره کوچک مانند هر ذره بزرگ است. در نتیجه، عاملی که فشار اسمزی محلول را تعیین میکند، غلظت محلول بر حسب تعداد ذرات است (که اگر یک مولکول غیر تفکیک شده باشد با غلظت مولی آن برابر است )، نه بر حسب جرم املاح.
اسمولالیته – اسمول
برای بیان غلظت یک محلول بر حسب تعداد ذرات، به جای گرم از واحدی به نام اسمول استفاده میشود.
یک اسمول ۱ گرم وزن مولکولی املاح فعال اسمزی است. بنابراین، ۱۸۰ گرم گلوکز، که ۱ گرم وزن مولکولی گلوکز است، برابر با ۱ اسمول گلوکز است، زیرا گلوکز به یونها تجزیه نمیشود. اگر یک املاح به دو یون تجزیه شود، وزن مولکولی ۱ گرم از املاح به ۲ اسمول تبدیل میشود زیرا تعداد ذرات فعال اسمزی اکنون دو برابر بیشتر از حالت املاح غیر تفکیک شده است. بنابراین، وقتی به طور کامل تفکیک شود، ۱ گرم وزن مولکولی کلرید سدیم، ۵۸.۵ گرم، برابر با ۲ اسمول است.
بنابراین، محلولی که دارای ۱ اسمول املاح حل شده در هر کیلوگرم آب باشد، اسمولالیته آن ۱ اسمول بر کیلوگرم و محلولی که ۱/۱۰۰۰ اسمول در هر کیلوگرم حل شده باشد، اسمولالیته آن ۱ میلیاسمول بر کیلوگرم است. اسمولالیته طبیعی مایعات خارج سلولی و درون سلولی حدود ۳۰۰ میلی مول بر کیلوگرم آب است.
رابطه اسمولالیته به فشار اسمزی
در دمای طبیعی بدن ۳۷ درجه سانتی گراد غلظت ۱ اسمول در لیتر باعث ایجاد فشار اسمزی ۱۹۳۰۰ میلی متر جیوه در محلول میشود. به همین ترتیب، غلظت ۱ میلی مول در لیتر معادل ۱۹.۳ میلی متر جیوه است.فشار اسمزی. با ضرب این مقدار در غلظت ۳۰۰ میلیاسمولاری مایعات بدن، فشار اسمزی کل مایعات بدن ۵۷۹۰ میلیمتر جیوه محاسبه میشود. مقدار اندازه گیری شده برای این، با این حال، به طور متوسط تنها حدود ۵۵۰۰ میلی متر جیوه است. دلیل این تفاوت این است که بسیاری از یونهای موجود در مایعات بدن، مانند یونهای سدیم و کلرید، به شدت جذب یکدیگر میشوند. در نتیجه، آنها نمیتوانند به طور کامل بدون مهار در سیال حرکت کنند و پتانسیل فشار اسمزی کامل خود را ایجاد کنند. بنابراین، به طور متوسط، فشار اسمزی واقعی مایعات بدن حدود ۰.۹۳ برابر مقدار محاسبه شده است.
اصطلاح اسمولاریته.
اسمولاریته غلظت اسمولی است که به عنوان اسمول در لیتر محلول به جای اسمول بر کیلوگرم آب بیان میشود. اگرچه، به بیان دقیق، این اسمول در هر کیلوگرم آب (اسمولالیته) است که فشار اسمزی را تعیین میکند، اما برای محلولهای رقیق مانند محلولهای موجود در بدن، تفاوت کمیبین اسمولاریته و اسمولالیته کمتر از ۱ درصد است. از آنجایی که اندازه گیری اسمولاریته بسیار کاربردی تر از اسمولالیته است، این روش تقریباً در تمام مطالعات فیزیولوژیکی معمول است.
“انتقال فعال” مواد از طریق غشاء
گاهی اوقات، غلظت زیادی از یک ماده در مایع داخل سلولی مورد نیاز است، حتی اگر مایع خارج سلولی فقط دارای غلظت کمیباشد. این درست است، به عنوان مثال، برای یونهای پتاسیم. برعکس، مهم است که غلظت یونهای دیگر در داخل سلول بسیار پایین نگه داشته شود، حتی اگر غلظت آنها در مایع خارج سلولی زیاد باشد. این به ویژه برای یونهای سدیم صادق است. هیچ یک از این دو اثر نمیتواند با انتشار ساده رخ دهد زیرا انتشار ساده در نهایت غلظتها را در دو طرف غشاء متعادل میکند. در عوض، برخی از منابع انرژی باید باعث حرکت بیش از حد یونهای پتاسیم به داخل سلولها و حرکت بیش از حد یونهای سدیم به خارج سلولها شود. حمل و نقل فعال
مواد مختلفی که به طور فعال از طریق حداقل برخی از غشای سلولی منتقل میشوند عبارتند از یونهای سدیم، یون پتاسیم، یون کلسیم، یون آهن، یون هیدروژن، یون کلرید، یون یدید، یون اورات، چندین قند مختلف و بیشتر اسیدهای آمینه.
حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه
حمل و نقل فعال با توجه به منبع انرژی مورد استفاده برای حمل و نقل به دو نوع تقسیم میشود: حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه. در حمل و نقل فعال اولیه، انرژی مستقیماً از تجزیه آدنوزین تری فسفات (ATP) یا برخی ترکیبات فسفات پرانرژی به دست میآید. در حمل و نقل فعال ثانویه، انرژی به طور ثانویه از انرژی حاصل میشود که به شکل اختلاف غلظت یونی مواد مولکولی یا یونی ثانویه بین دو طرف غشای سلولی ذخیره شده است، که در اصل توسط حمل و نقل فعال اولیه ایجاد شده است. در هر دو مورد، انتقال به پروتئینهای حامل بستگی دارد که از طریق غشای سلولی نفوذ میکنند، همانطور که برای انتشار تسهیل شده صادق است. با این حال، در حمل و نقل فعال، پروتئین حامل در انتشار تسهیل شده متفاوت از حامل عمل میکند، زیرا قادر است به ماده منتقل شده انرژی بدهد تا آن را در برابر گرادیان الکتروشیمیایی حرکت دهد. در ادامه چند نمونه از حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه با توضیحات دقیق تر در مورد اصول عملکرد آنها آورده شده است.
حمل و نقل فعال اولیه
پمپ سدیم پتاسیم
از جمله موادی که با انتقال فعال اولیه منتقل میشوند عبارتند از: سدیم، پتاسیم، کلسیم، هیدروژن، کلرید و چند یون دیگر.
مکانیسم انتقال فعال که با جزئیات بیشتر مورد مطالعه قرار گرفته است پمپ سدیم پتاسیم (Na + -K +) است، یک فرآیند انتقال که یونهای سدیم را از طریق غشای سلولی همه سلولها به بیرون پمپ میکند و در همان زمان یونهای پتاسیم را از بیرون به داخل این پمپ وظیفه حفظ اختلاف غلظت سدیم و پتاسیم در غشای سلولی و همچنین ایجاد ولتاژ الکتریکی منفی در داخل سلولها را بر عهده دارد. در واقع، فصل ۵ نشان میدهد که این پمپ همچنین اساس عملکرد عصبی است و سیگنالهای عصبی را در سراسر سیستم عصبی منتقل میکند.
شکل ۱۲-۴ اجزای فیزیکی پایه پمپ +Na+-K را نشان میدهد. پروتئین حامل مجموعه ای از دو پروتئین کروی مجزا است: یکی بزرگتر به نام زیرواحد α با وزن مولکولی حدود ۱۰۰۰۰۰ و دیگری کوچکتر به نام زیرواحد β با وزن مولکولی حدود ۵۵۰۰۰. اگرچه عملکرد پروتئین کوچکتر مشخص نیست (به جز اینکه ممکن است کمپلکس پروتئین را در غشای لیپیدی لنگر بیاندازد)، پروتئین بزرگتر دارای سه ویژگی خاص است که برای عملکرد پمپ مهم هستند:
۱. دارای سه جایگاه گیرنده برای اتصال یونهای سدیم بر روی بخشی از پروتئین که به داخل سلول بیرون زده است.
۲. دارای دو جایگاه گیرنده برای یونهای پتاسیم در خارج است.
۳. قسمت داخلی این پروتئین در نزدیکی محلهای اتصال سدیم دارای فعالیت ATPase است.
 شکل ۱۲-۴ مکانیسم فرضی پمپ سدیم-پتاسیم. ADP، آدنوزین دی فسفات؛ ATP، آدنوزین تری فسفات؛ پی، یون فسفات.
شکل ۱۲-۴ مکانیسم فرضی پمپ سدیم-پتاسیم. ADP، آدنوزین دی فسفات؛ ATP، آدنوزین تری فسفات؛ پی، یون فسفات.
هنگامیکه دو یون پتاسیم در خارج از پروتئین حامل و سه یون سدیم در داخل متصل میشوند، عملکرد ATPase پروتئین فعال میشود. سپس یک مولکول ATP را میشکافد، آن را به آدنوزین دی فسفات (ADP) تقسیم میکند و یک پیوند فسفات با انرژی بالا آزاد میکند. سپس اعتقاد بر این است که این انرژی آزاد شده باعث ایجاد یک تغییر شیمیایی و ساختاری در مولکول حامل پروتئین میشود و سه یون سدیم را به بیرون و دو یون پتاسیم را به داخل خارج میکند.
مانند سایر آنزیمها، پمپ Na+-K+ ATPase میتواند به صورت معکوس کار کند. اگر گرادیانهای الکتروشیمیایی برای +Na و +K بطور تجربی به اندازه ای افزایش یابد که انرژی ذخیره شده در شیب آنها بیشتر از انرژی شیمیایی هیدرولیز ATP باشد، این یونها شیب غلظت خود را پایین میآورند و پمپ +Na+-K سنتز میشود. ATP از ADP و فسفات. بنابراین، شکل فسفریله شده پمپ +Na+-K میتواند فسفات خود را به ADP برای تولید ATP ببخشد یا از انرژی برای تغییر ساختار آن استفاده کند و +Na را به بیرون از سلول و K + پمپ کند. داخل سلول غلظت نسبی ATP، ADP و فسفات، و همچنین گرادیانهای الکتروشیمیایی برای +Na و +K، جهت واکنش آنزیم را تعیین میکند. برای برخی از سلولها، مانند سلولهای عصبی فعال الکتریکی، ۶۰ تا ۷۰ درصد انرژی مورد نیاز سلولها ممکن است به پمپ کردن Na + از سلول و K + به داخل سلول اختصاص یابد.
پمپ Na + -K + برای کنترل حجم سلول مهم است
یکی از مهمترین وظایف پمپ Na + -K + کنترل حجم هر سلول است. بدون عملکرد این پمپ، اکثر سلولهای بدن تا زمانی که ترکیده شوند متورم میشوند. مکانیسم کنترل حجم به شرح زیر است: در داخل سلول تعداد زیادی پروتئین و سایر مولکولهای آلی وجود دارد که نمیتوانند از سلول فرار کنند. اکثر اینها دارای بار منفی هستند و بنابراین تعداد زیادی پتاسیم، سدیم و سایر یونهای مثبت را نیز جذب میکنند. سپس تمام این مولکولها و یونها باعث اسمز آب به داخل سلول میشوند. مگر اینکه این مورد بررسی شود، سلول به طور نامحدود متورم میشود تا زمانی که ترکیده شود. مکانیسم طبیعی برای جلوگیری از این امر پمپ Na + -K + است. مجددا توجه داشته باشید که این دستگاه سه Na را پمپاژ میکند+ یون به خارج از سلول به ازای هر دو یون K + پمپ شده به داخل. همچنین، نفوذپذیری غشاء به یونهای سدیم بسیار کمتر از یونهای پتاسیم است، بنابراین هنگامیکه یونهای سدیم در خارج هستند، تمایل زیادی به ماندن در آنجا پیدا میکنند. بنابراین، این نشان دهنده از دست دادن خالص یونها از سلول است که باعث شروع اسمز آب از سلول نیز میشود.
اگر یک سلول به هر دلیلی شروع به متورم شدن کند، پمپ Na + -K + به طور خودکار فعال میشود و یونهای بیشتری را به بیرون منتقل میکند و آب را با خود حمل میکند. بنابراین، پمپ Na + -K + نقش نظارت مستمر را در حفظ حجم طبیعی سلول ایفا میکند.
ماهیت الکتروژنی پمپ Na + -K +
این واقعیت که پمپ Na + -K + به ازای هر دو یون K + به داخل، سه یون Na + را به بیرون منتقل میکند به این معنی است که برای هر چرخه از داخل سلول یک بار مثبت از داخل سلول به بیرون منتقل میشود. پمپ. این امر باعث ایجاد حالت مثبت در خارج از سلول میشود، اما کمبود یونهای مثبت را در داخل سلول ایجاد میکند. یعنی باعث منفی شدن درون میشود. بنابراین، پمپ Na + -K + الکتروژنیک است زیرا پتانسیل الکتریکی را در سراسر غشای سلول ایجاد میکند. همانطور که در فصل ۵ بحث شد، این پتانسیل الکتریکی یک نیاز اساسی در رشتههای عصبی و ماهیچه ای برای انتقال سیگنالهای عصبی و عضلانی است.
انتقال فعال اولیه یونهای کلسیم
یکی دیگر از مکانیسمهای مهم انتقال فعال اولیه، پمپ کلسیم است. یونهای کلسیم معمولاً در غلظت بسیار کم در سیتوزول درون سلولی تقریباً تمام سلولهای بدن، با غلظتی حدود ۱۰۰۰۰ برابر کمتر از غلظت مایع خارج سلولی نگهداری میشوند. این به طور عمده توسط دو پمپ کلسیم انتقال فعال اولیه به دست میآید. یکی در غشای سلولی است و کلسیم را به خارج از سلول پمپاژ میکند. دیگری یونهای کلسیم را به یک یا چند اندامک وزیکولی داخل سلولی مانند شبکه سارکوپلاسمیسلولهای عضلانی و میتوکندری در همه سلولها پمپ میکند. در هر یک از این موارد، پروتئین حامل به غشاء نفوذ میکند و به عنوان یک آنزیم ATPase عمل میکند، و دارای همان توانایی برای تجزیه ATP به عنوان ATPase پروتئین حامل سدیم است. تفاوت این است که این پروتئین یک محل اتصال بسیار ویژه برای کلسیم به جای سدیم دارد.
انتقال فعال اولیه یونهای هیدروژن
در دو نقطه از بدن، انتقال فعال اولیه یونهای هیدروژن مهم است: (۱) در غدد معده معده و (۲) در لولههای انتهایی انتهایی و مجاری جمع کننده قشر کلیهها.
در غدد معده، سلولهای جداری عمیق قویترین مکانیسم فعال اولیه برای انتقال یونهای هیدروژن در هر قسمت از بدن را دارند. این اساس ترشح اسید هیدروکلریک در ترشحات گوارشی معده است. در انتهای ترشحی سلولهای جداری غده معده، غلظت یون هیدروژن تا یک میلیون برابر افزایش مییابد و سپس همراه با یونهای کلرید به معده رها میشود تا اسید کلریدریک تشکیل شود.
در لولههای کلیوی، سلولهای درونپیچیده ویژهای در لولههای انتهایی دیستال و مجاری جمعآوری قشر مغز قرار دارند که یونهای هیدروژن را نیز با انتقال فعال اولیه منتقل میکنند. در این حالت مقادیر زیادی یون هیدروژن از خون به داخل ادرار ترشح میشود تا یونهای هیدروژن اضافی از مایعات بدن خارج شود. یونهای هیدروژن میتوانند در ادرار در برابر شیب غلظت حدود ۹۰۰ برابر ترشح شوند.
انرژی حمل و نقل فعال اولیه
مقدار انرژی مورد نیاز برای انتقال یک ماده به طور فعال از طریق غشاء بر اساس میزان غلظت ماده در حین انتقال تعیین میشود. در مقایسه با انرژی مورد نیاز برای تغلیظ ۱۰ برابر ماده، برای تغلیظ ۱۰۰ برابر آن دو برابر انرژی و برای تغلیظ ۱۰۰۰ برابر ۳ برابر انرژی لازم است. به عبارت دیگر، انرژی مورد نیاز متناسب با لگاریتم درجه غلظت ماده است که با فرمول زیر بیان میشود:
بنابراین، از نظر کالری، مقدار انرژی مورد نیاز برای تغلیظ ۱ اسمول از یک ماده ۱۰ برابر، حدود ۱۴۰۰ کالری است. یا برای ۱۰۰ برابر کردن ۲۸۰۰ کالری. میتوان مشاهده کرد که مصرف انرژی برای متمرکز کردن مواد در سلولها یا برای حذف مواد از سلولها در برابر گرادیان غلظت میتواند بسیار زیاد باشد. برخی از سلولها، مانند سلولهای پوشاننده لولههای کلیوی و بسیاری از سلولهای غدد، ۹۰ درصد انرژی خود را صرف این هدف میکنند.
حمل و نقل فعال ثانویه – حمل و نقل مشترک و حمل و نقل متقابل
هنگامیکه یونهای سدیم از طریق انتقال فعال اولیه از سلولها خارج میشوند، معمولاً یک گرادیان غلظت زیادی از یونهای سدیم در سراسر غشای سلول ایجاد میشود – غلظت زیاد در خارج از سلول و غلظت کم در داخل. این گرادیان نشان دهنده یک انبار انرژی است زیرا سدیم اضافی در خارج از غشای سلولی همیشه در تلاش است تا به داخل نفوذ کند. تحت شرایط مناسب، این انرژی انتشار سدیم میتواند مواد دیگر را همراه با سدیم از طریق غشای سلولی بکشد. این پدیده حمل و نقل مشترک نامیده میشود. این یکی از اشکال حمل و نقل فعال ثانویه است.
برای اینکه سدیم ماده دیگری را به همراه خود بکشد، مکانیسم جفت مورد نیاز است. این با استفاده از پروتئین حامل دیگری در غشای سلولی به دست میآید. حامل در این مثال به عنوان یک نقطه اتصال هم برای یون سدیم و هم برای ماده ای که باید به طور مشترک منتقل شود عمل میکند. هنگامیکه هر دو به هم متصل میشوند، گرادیان انرژی یون سدیم باعث میشود که یون سدیم و ماده دیگر با هم به داخل سلول منتقل شوند.
در حمل و نقل متقابل، یونهای سدیم دوباره سعی میکنند بهدلیل گرادیان غلظت زیادشان به داخل سلول منتشر شوند. با این حال، این بار، ماده ای که قرار است منتقل شود، در داخل سلول است و باید به بیرون منتقل شود. بنابراین، یون سدیم به پروتئین حامل متصل میشود، جایی که به سطح بیرونی غشاء میریزد، در حالی که ماده ای که قرار است به صورت متقابل منتقل شود، به برجستگی داخلی پروتئین حامل متصل میشود. هنگامیکه هر دو متصل شدند، یک تغییر ساختاری رخ میدهد و انرژی آزاد شده توسط یون سدیم که به سمت داخل حرکت میکند باعث میشود ماده دیگر به سمت بیرون حرکت کند.
انتقال همزمان گلوکز و اسیدهای آمینه همراه با یونهای سدیم
گلوکز و بسیاری از آمینو اسیدها در برابر شیب غلظت زیاد به اکثر سلولها منتقل میشوند. همانطور که در شکل ۱۳-۴ نشان داده شده است، مکانیسم این کاملاً با حمل و نقل مشترک است. توجه داشته باشید که پروتئین حامل حامل دو محل اتصال در قسمت بیرونی خود دارد، یکی برای سدیم و دیگری برای گلوکز. همچنین غلظت یونهای سدیم در بیرون زیاد و در داخل کم است که انرژی لازم برای انتقال را فراهم میکند. یک ویژگی خاص پروتئین انتقال این است که تا زمانی که یک مولکول گلوکز به آن متصل نشود، تغییر ساختاری برای اجازه حرکت سدیم به داخل رخ نخواهد داد. هنگامیکه هر دو به هم متصل میشوند، تغییر ساختاری به طور خودکار انجام میشود و سدیم و گلوکز به طور همزمان به داخل سلول منتقل میشوند. از این رو، این یک انتقال همزمان سدیم و گلوکز است سازوکار. همان طور که در فصلهای ۲۷ و ۶۵ مورد بحث قرار گرفت، هم انتقال دهندههای سدیم-گلوکز مکانیسمهای مهمیدر انتقال گلوکز از طریق سلولهای اپیتلیال کلیه و روده هستند.
 شکل ۱۳-۴ مکانیسم فرضی برای انتقال همزمان سدیم گلوکز.
شکل ۱۳-۴ مکانیسم فرضی برای انتقال همزمان سدیم گلوکز.
انتقال همزمان اسیدهای آمینه سدیم به همان روشی انجام میشود که برای گلوکز انجام میشود، با این تفاوت که از مجموعه متفاوتی از پروتئینهای انتقال استفاده میکند. پنج پروتئین انتقال آمینو اسید شناسایی شده است که هر کدام وظیفه انتقال یک زیر مجموعه از اسیدهای آمینه با ویژگیهای مولکولی خاص را بر عهده دارند.
انتقال همزمان گلوکز و آمینو اسیدها به ویژه از طریق سلولهای اپیتلیال مجرای روده و لولههای کلیوی کلیهها انجام میشود تا جذب این مواد در خون را افزایش دهد، همانطور که در فصلهای بعدی مورد بحث قرار میگیرد.
سایر مکانیسمهای مهم انتقال مشترک حداقل در برخی سلولها شامل انتقال همزمان یونهای کلرید، یونهای ید، یونهای آهن و یونهای اورات است.
سدیم ضد انتقال یونهای کلسیم و هیدروژن
دو مکانیسم ضد حمل و نقل بسیار مهم (انتقال در جهت مخالف یون اولیه) ضد انتقال سدیم-کلسیم و ضدحمل سدیم-هیدروژن هستند (شکل ۱۴-۴).
 شکل ۱۴-۴ انتقال متقابل سدیم یونهای کلسیم و هیدروژن.
شکل ۱۴-۴ انتقال متقابل سدیم یونهای کلسیم و هیدروژن.
انتقال متقابل سدیم-کلسیم از طریق تمام یا تقریباً همه غشاهای سلولی انجام میشود، با یونهای سدیم به داخل و یونهای کلسیم به بیرون، که هر دو به یک پروتئین حملونقل در حالت ضد انتقال متصل میشوند. این علاوه بر انتقال فعال اولیه کلسیم است که در برخی از سلولها رخ میدهد.
انتقال متقابل سدیم-هیدروژن در چندین بافت رخ میدهد. یک مثال مهم در لولههای پروگزیمال کلیهها است، جایی که یونهای سدیم از مجرای توبول به داخل سلول لولهای حرکت میکنند، در حالی که یونهای هیدروژن به طور متقابل به مجرای لوله منتقل میشوند. به عنوان مکانیزمیبرای متمرکز کردن یونهای هیدروژن، انتقال متقابل به اندازه انتقال فعال اولیه یونهای هیدروژن که در لولههای کلیوی دیستالتر اتفاق میافتد، قوی نیست، اما میتواند تعداد بسیار زیادی یون هیدروژن را انتقال دهد، بنابراین آن را به یک کلید برای انتقال یونهای هیدروژن تبدیل میکند. کنترل یون هیدروژن در مایعات بدن، همانطور که در فصل ۳۰ به تفصیل مورد بحث قرار گرفت.
حمل و نقل فعال از طریق صفحات سلولی
در بسیاری از نقاط بدن، مواد باید از طریق یک صفحه سلولی به جای صرفاً از طریق غشای سلولی منتقل شوند. انتقال این نوع از طریق (۱) اپیتلیوم روده، (۲) اپیتلیوم لولههای کلیوی، (۳) اپیتلیوم تمام غدد برون ریز، (۴) اپیتلیوم کیسه صفرا، و (۵) غشای شبکه مشیمیه انجام میشود. مغز و غشاهای دیگر
مکانیسم اصلی برای انتقال یک ماده از طریق یک صفحه سلولی (۱) انتقال فعال از طریق غشای سلولی در یک طرف سلولهای انتقال دهنده در ورقه، و سپس (۲) یا انتشار ساده یا انتشار آسان از طریق غشاء در طرف مقابل است. سمت سلول
شکل ۱۵-۴ مکانیسمیرا برای انتقال یونهای سدیم از طریق ورقه اپیتلیال رودهها، کیسه صفرا و لولههای کلیوی نشان میدهد. این شکل نشان میدهد که سلولهای اپیتلیال در قطب مجرا بهوسیله اتصالاتی به نام «بوسه» به یکدیگر متصل شدهاند. مرز قلم مو روی سطوح مجرای سلولها هم برای یونهای سدیم و هم آب نفوذپذیر است. بنابراین، سدیم و آب به راحتی از لومن به داخل سلول منتشر میشود. سپس، در غشای پایه و جانبی سلولها، یونهای سدیم به طور فعال به مایع خارج سلولی بافت همبند اطراف و عروق خونی منتقل میشوند. این باعث ایجاد گرادیان غلظت یون سدیم بالا در این غشاها میشود که به نوبه خود باعث اسمز آب نیز میشود. بدین ترتیب،
 شکل ۱۵-۴ مکانیسم اصلی انتقال فعال در میان لایه ای از سلولها.
شکل ۱۵-۴ مکانیسم اصلی انتقال فعال در میان لایه ای از سلولها.
این مکانیسمهایی هستند که تقریباً تمام مواد مغذی، یونها و سایر مواد از روده به خون جذب میشوند. آنها همچنین روشی هستند که همان مواد از فیلتر گلومرولی توسط لولههای کلیوی بازجذب میشوند.
در سراسر این متن نمونههای متعددی از انواع مختلف حمل و نقل مورد بحث در این فصل وجود دارد.
کتاب درسی فیزیولوژی پزشکی گایتون وهال، ویرایش دوازدهم فصل ۴
کلیک کنید «بیبلیوگرافی: فهرست کتب مربوطه»
Agre P., Kozono D. Aquaporin water channels: molecular mechanisms for human diseases. FEBS Lett. ۲۰۰۳;۵۵۵:۷۲.
Ashcroft F.M. From molecule to malady. Nature. ۲۰۰۶;۴۴۰:۴۴۰.
Benos D.J., Stanton B.A. Functional domains within the degenerin/epithelial sodium channel (Deg/ENaC) superfamily of ion channels. J Physiol. ۱۹۹۹;۵۲۰:۶۳۱.
Benziane B., Chibalin A.V. Frontiers: skeletal muscle sodium pump regulation: a translocation paradigm. Am J Physiol Endocrinol Metab. ۲۰۰۸;۲۹۵:E553.
Biel M., Wahl-Schott C., Michalakis S., Zong X. Hyperpolarization-activated cation channels: from genes to function. Physiol Rev. ۲۰۰۹;۸۹:۸۴۷.
Blaustein M.P., Zhang J., Chen L., et al. The pump, the exchanger, and endogenous ouabain: signaling mechanisms that link salt retention to hypertension. Hypertension. ۲۰۰۹;۵۳:۲۹۱.
Bröer S. Amino acid transport across mammalian intestinal and renal epithelia. Physiol Rev. ۲۰۰۸;۸۸:۲۴۹.
DeCoursey T.E. Voltage-gated proton channels: what’s next? J Physiol. ۲۰۰۸;۵۸۶:۵۳۰۵.
DeCoursey T.E. Voltage-gated proton channels and other proton transfer pathways. Physiol Rev
DiPolo R., Beaugé L. Sodium/calcium exchanger: influence of metabolic regulation on ion carrier interactions. Physiol Rev. ۲۰۰۶;۸۶:۱۵۵.
Drummond H.A., Jernigan N.L., Grifoni S.C. Sensing tension: epithelial sodium channel/acid-sensing ion channel proteins in cardiovascular homeostasis. Hypertension. ۲۰۰۸;۵۱:۱۲۶۵.
Gadsby D.C. Ion channels versus ion pumps: the principal difference, in principle. Nat Rev Mol Cell Biol
Jentsch T.J., Stein V., Weinreich F., Zdebik A.A. Molecular structure and physiological function of chloride channels. Physiol Rev
Kaupp U.B., Seifert R. Cyclic nucleotide-gated ion channels. Physiol Rev. ۲۰۰۲;۸۲:۷۶۹.
King L.S., Kozono D., Agre P. From structure to disease: the evolving tale of aquaporin biology. Nat Rev Mol Cell Biol. ۲۰۰۴;۵:۶۸۷.
Kleyman T.R., Carattino M.D., Hughey R.P. ENaC at the cutting edge: regulation of epithelial sodium channels by proteases. J Biol Chem. ۲۰۰۹;۲۸۴:۲۰۴۴۷.
Mazzochi C., Benos D.J., Smith P.R. Interaction of epithelial ion channels with the actin-based cytoskeleton. Am J Physiol Renal Physiol. ۲۰۰۶;۲۹۱:F1113.
Peres A., Giovannardi S., Bossi E., Fesce R. Electrophysiological insights into the mechanism of ion-coupled cotransporters. News Physiol Sci. ۲۰۰۴;۱۹:۸۰.
Russell J.M. Sodium-potassium-chloride cotransport. Physiol Rev. ۲۰۰۰;۸۰:۲۱۱.
Shin J.M., Munson K., Vagin O., Sachs G. The gastric HK-ATPase: structure, function, and inhibition. Pflugers Arch. ۲۰۰۹;۴۵۷:۶۰۹.
Tian J., Xie Z.J. The Na-K-ATPase and calcium-signaling microdomains. Physiology (Bethesda). ۲۰۰۸;۲۳:۲۰۵.

