فصل ۴ کتاب فیزیولوژی پزشکی گایتون؛ انتقال مواد از غشاهای سلولی
» Guyton and Hall Textbook of Medical Physiology, 12th Ed
»» CHAPTER 4
Transport of Substances Through Cell Membranes
شکل ۱-۴ غلظت تقریبی الکترولیتهای مهم و سایر مواد در مایع خارج سلولی و مایع درون سلولی را نشان میدهد. توجه داشته باشید که مایع خارج سلولی حاوی مقدار زیادی سدیم است اما مقدار کمی پتاسیم دارد. دقیقا برعکس در مورد مایع داخل سلولی صادق است. همچنین مایع خارج سلولی حاوی مقدار زیادی یون کلرید است، در حالی که مایع داخل سلولی حاوی مقدار بسیار کمی یون کلرید است. اما غلظت فسفاتها و پروتئینها در مایع داخل سلولی به طور قابل توجهی بیشتر از مایعات خارج سلولی است. این تفاوتها برای زندگی سلول بسیار مهم هستند. هدف این فصل توضیح این است که چگونه تفاوتها توسط مکانیسمهای انتقال غشای سلولی ایجاد میشود.
 شکل ۱-۴ ترکیبات شیمیایی مایعات خارج سلولی و درون سلولی.
شکل ۱-۴ ترکیبات شیمیایی مایعات خارج سلولی و درون سلولی.
سد لیپیدی غشای سلولی و پروتئینهای انتقال غشای سلولی
ساختار غشایی که بیرون هر سلول بدن را میپوشاند در فصل ۲ مورد بحث قرار گرفته و در شکلهای ۲-۳ و ۲-۴ نشان داده شده است. این غشاء تقریباً به طور کامل از یک لایه دولایه لیپیدی تشکیل شده است، اما همچنین حاوی تعداد زیادی مولکول پروتئین در لیپید است که بسیاری از آنها در تمام طول غشا نفوذ میکنند، همانطور که در شکل ۲-۴ نشان داده شده است.
 شکل ۳-۴ انتشار یک مولکول سیال در طول یک هزارم ثانیه.
شکل ۳-۴ انتشار یک مولکول سیال در طول یک هزارم ثانیه.
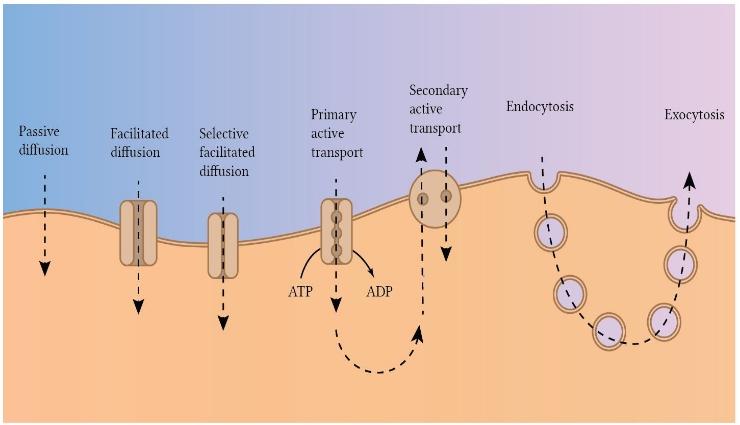
 شکل ۲-۴ مسیرهای انتقال از طریق غشای سلولی و مکانیسمهای اصلی انتقال.
شکل ۲-۴ مسیرهای انتقال از طریق غشای سلولی و مکانیسمهای اصلی انتقال.
دولایه لیپیدی نه با مایع خارج سلولی و نه با مایع درون سلولی قابل اختلاط نیست. بنابراین، مانعی در برابر حرکت مولکولهای آب و مواد محلول در آب بین قسمتهای مایع خارج سلولی و درون سلولی است. با این حال، همانطور که در شکل ۲-۴ توسط فلش سمت چپ نشان داده شده است، چند ماده میتوانند به این لایه دوتایی لیپیدی نفوذ کنند و مستقیماً از طریق خود ماده لیپیدی منتشر شوند. این به طور عمده در مورد مواد محلول در چربی صادق است، همانطور که بعدا توضیح داده شد.
مولکولهای پروتئین در غشاء خواص کاملاً متفاوتی برای انتقال مواد دارند. ساختارهای مولکولی آنها تداوم دولایه لیپیدی را قطع میکند و مسیر جایگزینی را از طریق غشای سلولی تشکیل میدهد. بنابراین، بیشتر این پروتئینهای نافذ میتوانند به عنوان پروتئینهای انتقال عمل کنند. پروتئینهای مختلف عملکرد متفاوتی دارند. برخی از آنها دارای فضاهای آبی در تمام طول مولکول هستند و اجازه حرکت آزادانه آب و همچنین یونها یا مولکولهای انتخاب شده را میدهند. اینها پروتئینهای کانال نامیده میشوند. برخی دیگر به نام پروتئینهای حامل، با مولکولها یا یونهایی که قرار است منتقل شوند، پیوند برقرار کنند. تغییرات ساختاری در مولکولهای پروتئین، سپس مواد را از میان لایههای پروتئین به سمت دیگر غشاء حرکت میدهد. هم پروتئینهای کانال و هم پروتئینهای حامل معمولاً برای انواع مولکولها یا یونهایی که اجازه عبور از غشاء را دارند بسیار انتخابی هستند.
“Diffusion” در مقابل “Active Transport.”
انتقال از طریق غشای سلولی، یا مستقیماً از طریق دولایه لیپیدی یا از طریق پروتئینها، توسط یکی از دو فرآیند اساسی انجام میشود: انتشار یا انتقال فعال.
اگرچه تغییرات زیادی از این مکانیسمهای اساسی وجود دارد، انتشار به معنای حرکت مولکولی تصادفی مواد به مولکول به مولکول است، چه از طریق فضاهای بین مولکولی در غشاء یا در ترکیب با یک پروتئین حامل. انرژی که باعث انتشار میشود، انرژی حرکت جنبشی طبیعی ماده است.
در مقابل، انتقال فعال به معنای حرکت یونها یا سایر مواد در سراسر غشاء در ترکیب با یک پروتئین حامل است، به گونه ای که پروتئین حامل باعث میشود که ماده بر خلاف گرادیان انرژی حرکت کند، مثلاً از حالت غلظت کم به حالت زیاد. – حالت تمرکز این حرکت علاوه بر انرژی جنبشی به منبع انرژی اضافی نیز نیاز دارد. در ادامه توضیحات مفصل تری در مورد فیزیک و شیمیفیزیک پایه این دو فرآیند ارائه شده است.
انتشار
تمام مولکولها و یونهای موجود در مایعات بدن، از جمله مولکولهای آب و مواد محلول، در حرکت ثابت هستند و هر ذره بهصورت جداگانه حرکت میکند. حرکت این ذرات همان چیزی است که فیزیکدانان آن را “گرما” مینامند – هر چه حرکت بیشتر باشد، دما بالاتر است – و حرکت هرگز در هیچ شرایطی متوقف نمیشود مگر در دمای صفر مطلق. هنگامیکه یک مولکول متحرک، A، به یک مولکول ساکن، B، نزدیک میشود، نیروهای الکترواستاتیک و دیگر نیروهای هسته ای مولکول A، مولکول B را دفع میکنند و مقداری از انرژی حرکت مولکول A را به مولکول B منتقل میکنند. در نتیجه، مولکول B انرژی جنبشی حرکتی به دست میآورد.، در حالی که مولکول A کند میشود و مقداری از انرژی جنبشی خود را از دست میدهد. بنابراین، همانطور که در شکل ۳-۴ نشان داده شده است، یک مولکول منفرد در یک محلول در بین مولکولهای دیگر ابتدا در یک جهت، سپس جهت دیگر، سپس جهت دیگر، و به همین ترتیب، به طور تصادفی هزاران بار در هر ثانیه پرش میکند. این حرکت پیوسته مولکولها بین یکدیگر در مایعات یا گازها انتشار نامیده میشود.
یونها مانند مولکولهای کامل منتشر میشوند و حتی ذرات کلوئیدی معلق نیز به روشی مشابه منتشر میشوند، با این تفاوت که کلوئیدها به دلیل اندازه بزرگشان با سرعت بسیار کمتری نسبت به مواد مولکولی منتشر میشوند.
انتشار از طریق غشای سلولی
انتشار از طریق غشای سلولی به دو زیرگروه به نامهای انتشار ساده و انتشار تسهیل شده تقسیم میشود. انتشار ساده به این معنی است که حرکت جنبشی مولکولها یا یونها از طریق یک دهانه غشاء یا از طریق فضاهای بین مولکولی بدون هیچ گونه تعامل با پروتئینهای حامل در غشاء انجام میشود. سرعت انتشار با توجه به مقدار ماده موجود، سرعت حرکت جنبشی، و تعداد و اندازه روزنههای غشا که مولکولها یا یونها میتوانند از طریق آن حرکت کنند، تعیین میشود.
انتشار تسهیل شده نیاز به تعامل یک پروتئین حامل دارد. پروتئین حامل به عبور مولکولها یا یونها از غشاء با اتصال شیمیایی به آنها و عبور دادن آنها از طریق غشاء به این شکل کمک میکند.
انتشار ساده میتواند از طریق غشای سلولی توسط دو مسیر اتفاق بیفتد: (۱) از طریق فواصل دولایه لیپیدی اگر ماده انتشار دهنده محلول در چربی باشد و (۲) از طریق کانالهای آبکی که تمام راه را از طریق برخی از پروتئینهای حمل و نقل بزرگ نفوذ میکنند. در شکل ۲-۴ در سمت چپ نشان داده شده است.
انتشار مواد محلول در چربی از طریق لایه چربی
یکی از مهم ترین عواملی که تعیین میکند یک ماده با چه سرعتی در دو لایه لیپیدی منتشر میشود، حلالیت آن در چربی است. به عنوان مثال، حلالیتهای چربی اکسیژن، نیتروژن، دی اکسید کربن و الکلها زیاد است، بنابراین همه اینها میتوانند مستقیماً در دولایه لیپیدی حل شوند و از طریق غشای سلولی پخش شوند، به همان ترتیبی که انتشار املاح آب در محلول آبکی اتفاق میافتد. به دلایل واضح، سرعت انتشار هر یک از این مواد از طریق غشا با حلالیت چربی آن نسبت مستقیم دارد. به خصوص مقادیر زیادی از اکسیژن را میتوان از این طریق منتقل کرد. بنابراین، اکسیژن را میتوان به داخل سلول تقریباً به صورتی که غشای سلولی وجود ندارد، تحویل داد.
انتشار آب و سایر مولکولهای نامحلول در چربی از طریق کانالهای پروتئینی
با وجود اینکه آب در لیپیدهای غشاء بسیار نامحلول است، اما به آسانی از کانالهای مولکولهای پروتئینی عبور میکند که تا آخر غشا نفوذ میکنند. سرعت حرکت مولکولهای آب در بیشتر غشای سلولی شگفت انگیز است. به عنوان مثال، مقدار کل آبی که در هر ثانیه در هر جهت از طریق غشای گلبول قرمز منتشر میشود، حدود ۱۰۰ برابر حجم خود گلبول قرمز است.
سایر مولکولهای نامحلول در چربی اگر محلول در آب و به اندازه کافی کوچک باشند میتوانند مانند مولکولهای آب از کانالهای منافذ پروتئین عبور کنند. با این حال، با بزرگتر شدن آنها، نفوذ آنها به سرعت کاهش مییابد. به عنوان مثال، قطر مولکول اوره تنها ۲۰ درصد بیشتر از قطر آب است، اما نفوذ آن از طریق منافذ غشای سلولی حدود ۱۰۰۰ برابر کمتر از نفوذ آب است. با این حال، با توجه به سرعت شگفتانگیز نفوذ آب، این مقدار از نفوذ اوره همچنان امکان انتقال سریع اوره از طریق غشا را در عرض چند دقیقه فراهم میکند.
انتشار از طریق منافذ و کانالهای پروتئین – نفوذ پذیری انتخابی و “دروازه” کانالها
بازسازیهای سه بعدی کامپیوتری منافذ و کانالهای پروتئینی، مسیرهای لولهای را از خارج سلولی تا مایع درون سلولی نشان دادهاند. بنابراین، مواد میتوانند با انتشار ساده مستقیماً در طول این منافذ و کانالها از یک طرف غشاء به طرف دیگر حرکت کنند.
منافذ از پروتئینهای انتگرال غشای سلولی تشکیل شده اند که لولههای باز را از طریق غشاء تشکیل میدهند و همیشه باز هستند. با این حال، قطر منافذ و بارهای الکتریکی آن گزینش پذیری را فراهم میکند که فقط به مولکولهای خاصی اجازه عبور میدهد. به عنوان مثال، منافذ پروتئین، به نام آکواپورین یا کانالهای آب، اجازه عبور سریع آب از غشای سلولی را میدهند، اما مولکولهای دیگر را حذف میکنند. حداقل ۱۳ نوع مختلف آکواپورین در سلولهای مختلف بدن انسان یافت شده است. آکواپورینها دارای منافذ باریکی هستند که به مولکولهای آب اجازه میدهد از طریق غشاء در یک فایل منفرد پخش شوند. منافذ خیلی باریک است که اجازه عبور یونهای هیدراته را نمیدهد. همانطور که در فصلهای ۲۹ و ۷۵ بحث شدچگالی برخی از آکواپورینها (مثلاً آکواپورین-۲) در غشای سلولی ساکن نیست، اما در شرایط مختلف فیزیولوژیکی تغییر میکند.
کانالهای پروتئینی با دو ویژگی مهم متمایز میشوند: (۱) آنها اغلب به طور انتخابی به مواد خاصی نفوذ میکنند و (۲) بسیاری از کانالها را میتوان توسط دروازههایی باز یا بسته کرد که توسط سیگنالهای الکتریکی تنظیم میشوند (کانالهای دریچه ولتاژ) یا مواد شیمیایی که به پروتئینهای کانال متصل میشوند (کانالهای دروازه ای لیگاند).
نفوذپذیری انتخابی کانالهای پروتئینی
بسیاری از کانالهای پروتئینی برای انتقال یک یا چند یون یا مولکول خاص بسیار انتخابی هستند. این نتیجه از خصوصیات خود کانال، مانند قطر، شکل آن، و ماهیت بارهای الکتریکی و پیوندهای شیمیایی در امتداد سطوح داخلی آن است.
کانالهای پتاسیم اجازه عبور یونهای پتاسیم از غشای سلولی را حدود ۱۰۰۰ برابر آسانتر از عبور یونهای سدیم میدهند. با این حال، این درجه انتخابی بالا را نمیتوان به طور کامل با قطر مولکولی یونها توضیح داد زیرا یونهای پتاسیم کمیبزرگتر از یونهای سدیم هستند. مکانیسم این انتخاب یون قابل توجه چیست؟ زمانی که ساختار یک کانال پتاسیم باکتریایی توسط کریستالوگرافی اشعه ایکس تعیین شد، این سوال تا حدی پاسخ داده شد. کانالهای پتاسیم دارای ساختار تترامری متشکل از چهار زیرواحد پروتئینی یکسان در اطراف یک منفذ مرکزی هستند (شکل ۴-۴). در بالای منافذ کانال حلقههای منفذی وجود دارد که یک باریک را تشکیل میدهند فیلتر انتخابی. پوشش فیلتر انتخابی، اکسیژنهای کربونیل است. هنگامیکه یونهای پتاسیم هیدراته وارد فیلتر انتخابی میشوند، با اکسیژنهای کربونیل برهم کنش میکنند و بیشتر مولکولهای آب محدود شده خود را میریزند و به یونهای پتاسیم دهیدراته اجازه عبور از کانال را میدهند. با این حال، اکسیژنهای کربونیل بسیار از هم دور هستند تا بتوانند با یونهای سدیم کوچکتر تعامل نزدیک داشته باشند، بنابراین فیلتر انتخابپذیری به طور موثری از عبور از منافذ حذف میشود.
 شکل ۴-۴ ساختار یک کانال پتاسیم. کانال از چهار زیر واحد تشکیل شده است (فقط دو زیر واحد نشان داده شده است)، که هر کدام دارای دو مارپیچ گذرنده است. یک فیلتر انتخابی باریک از حلقههای منافذ تشکیل میشود و اکسیژنهای کربونیل دیوارههای فیلتر گزینشپذیری را میپوشاند و محلهایی را برای اتصال گذرا یونهای پتاسیم دهیدراته تشکیل میدهد. برهمکنش یونهای پتاسیم با اکسیژنهای کربونیل باعث میشود یونهای پتاسیم مولکولهای آب محدود خود را از بین ببرند و به یونهای پتاسیم آبخورده اجازه عبور از منافذ را میدهند.
شکل ۴-۴ ساختار یک کانال پتاسیم. کانال از چهار زیر واحد تشکیل شده است (فقط دو زیر واحد نشان داده شده است)، که هر کدام دارای دو مارپیچ گذرنده است. یک فیلتر انتخابی باریک از حلقههای منافذ تشکیل میشود و اکسیژنهای کربونیل دیوارههای فیلتر گزینشپذیری را میپوشاند و محلهایی را برای اتصال گذرا یونهای پتاسیم دهیدراته تشکیل میدهد. برهمکنش یونهای پتاسیم با اکسیژنهای کربونیل باعث میشود یونهای پتاسیم مولکولهای آب محدود خود را از بین ببرند و به یونهای پتاسیم آبخورده اجازه عبور از منافذ را میدهند.
اعتقاد بر این است که فیلترهای انتخابی متفاوت برای کانالهای یونی مختلف، تا حد زیادی، ویژگی کانال را برای کاتیونها یا آنیونها یا یونهای خاصی مانند Na +، K + و Ca ++ تعیین میکنند که به کانال دسترسی پیدا میکنند.
یکی از مهمترین کانالهای پروتئینی، کانال سدیم، تنها ۰.۳ در ۰.۵ نانومتر قطر دارد، اما مهمتر از آن، سطوح داخلی این کانال با آمینو اسیدهایی پوشانده شده است که دارای بار منفی قوی هستند، همانطور که علائم منفی نشان میدهد. داخل پروتئینهای کانال در پانل بالای شکل ۵-۴. این بارهای منفی قوی میتوانند یونهای سدیم کم آب شده کوچک را به این کانالها بکشانند و در واقع یونهای سدیم را از مولکولهای آب هیدراته خود دور کنند. هنگامیکه در کانال قرار میگیرند، یونهای سدیم طبق قوانین معمول انتشار در هر جهت منتشر میشوند. بنابراین، کانال سدیم به طور خاص برای عبور یونهای سدیم انتخابی است.
 شکل ۵-۴ انتقال یونهای سدیم و پتاسیم از طریق کانالهای پروتئینی. همچنین تغییرات ساختاری در مولکولهای پروتئین برای باز یا بسته کردن “دروازه” محافظ کانالها نشان داده شده است.
شکل ۵-۴ انتقال یونهای سدیم و پتاسیم از طریق کانالهای پروتئینی. همچنین تغییرات ساختاری در مولکولهای پروتئین برای باز یا بسته کردن “دروازه” محافظ کانالها نشان داده شده است.
دروازه کانالهای پروتئینی
راه اندازی کانالهای پروتئینی وسیله ای برای کنترل نفوذپذیری یون کانالها فراهم میکند. این در هر دو پانل شکل ۵-۴ برای دروازه بندی انتخابی یونهای سدیم و پتاسیم نشان داده شده است. اعتقاد بر این است که برخی از دروازهها امتداد دروازهای واقعی مولکول پروتئین انتقال هستند که میتوانند دهانه کانال را ببندند یا با تغییر ساختاری در شکل مولکول پروتئین از دهانه خارج شوند.
باز و بسته شدن دروازهها به دو روش اصلی کنترل میشود:
۱. دروازه ولتاژ. در این مثال، ترکیب مولکولی دروازه یا پیوندهای شیمیایی آن به پتانسیل الکتریکی در سراسر غشای سلولی پاسخ میدهد. به عنوان مثال، در پانل بالای شکل ۵-۴، هنگامیکه یک بار منفی قوی در داخل غشای سلولی وجود دارد، احتمالاً میتواند باعث شود که دروازههای سدیم بیرونی کاملاً بسته بمانند. برعکس، زمانی که داخل غشاء بار منفی خود را از دست میدهد، این دروازهها به طور ناگهانی باز میشوند و اجازه میدهند مقادیر زیادی سدیم از منافذ سدیم به داخل عبور کند. این مکانیسم اساسی برای برانگیختن پتانسیلهای عمل در اعصابی است که مسئول سیگنالهای عصبی هستند. در پانل پایین شکل ۵-۴دروازههای پتاسیم در انتهای درون سلولی کانالهای پتاسیم قرار دارند و زمانی که داخل غشای سلولی دارای بار مثبت میشوند باز میشوند. باز کردن این دروازهها تا حدی مسئول پایان دادن به پتانسیل عمل است، همانطور که در فصل ۵ به طور کامل مورد بحث قرار گرفته است.
۲. دروازه بندی شیمیایی (لیگاند). برخی از دروازههای کانال پروتئین با اتصال یک ماده شیمیایی (یک لیگاند) با پروتئین باز میشوند. این باعث تغییر پیوند ساختاری یا شیمیایی در مولکول پروتئین میشود که دروازه را باز یا بسته میکند. به این روش دروازهسازی شیمیایی یا دروازهبندی لیگاندی گفته میشود. یکی از مهم ترین موارد استفاده از دروازه شیمیایی، اثر استیل کولین بر کانال به اصطلاح استیل کولین است. استیل کولین دروازه این کانال را باز میکند و منافذی با بار منفی با قطر حدود ۰.۶۵ نانومتر ایجاد میکند که به مولکولهای بدون بار یا یونهای مثبت کوچکتر از این قطر اجازه عبور میدهد. این دروازه برای انتقال سیگنالهای عصبی از یک سلول عصبی به سلول عصبی دیگر بسیار مهم است (نگاه کنید به فصل ۴۵) و از سلولهای عصبی به سلولهای ماهیچه ای برای ایجاد انقباض عضلانی (به فصل ۷ مراجعه کنید).
حالت باز در مقابل وضعیت بسته کانالهای دردار
شکل ۶-۴ الف مشخصه جالب توجه اکثر کانالهای ولتاژدار را نشان میدهد. این شکل دو ضبط جریان الکتریکی را نشان میدهد که از طریق یک کانال سدیم منفرد جریان مییابد، زمانی که یک گرادیان پتانسیل تقریبی ۲۵ میلی ولت در سراسر غشاء وجود داشت. توجه داشته باشید که کانال جریان “همه یا هیچ” را هدایت میکند. یعنی دروازه کانال باز میشود و سپس بسته میشود، هر حالت باز فقط کسری از میلی ثانیه تا چندین میلی ثانیه طول میکشد. این نشان دهنده سرعت تغییراتی است که میتواند در طول باز و بسته شدن دروازههای مولکولی پروتئین رخ دهد. در یک پتانسیل ولتاژ، کانال ممکن است همیشه یا تقریباً همیشه بسته بماند، در حالی که در سطح ولتاژ دیگر، ممکن است تمام یا بیشتر اوقات باز بماند. در ولتاژهای بین، همانطور که در شکل نشان داده شده است،
 شکل ۶-۴ الف، ثبت جریان جریان از طریق یک کانال سدیم دردار ولتاژی، که اصل “همه یا هیچ” را برای باز و بسته شدن کانال نشان میدهد. ب، روش “پچ-گیره” برای ثبت جریان جریان از طریق یک کانال پروتئینی واحد. در سمت چپ، ضبط از یک “پچ” از یک غشای سلول زنده انجام میشود. در سمت راست، ضبط از یک وصله غشایی است که از سلول جدا شده است.
شکل ۶-۴ الف، ثبت جریان جریان از طریق یک کانال سدیم دردار ولتاژی، که اصل “همه یا هیچ” را برای باز و بسته شدن کانال نشان میدهد. ب، روش “پچ-گیره” برای ثبت جریان جریان از طریق یک کانال پروتئینی واحد. در سمت چپ، ضبط از یک “پچ” از یک غشای سلول زنده انجام میشود. در سمت راست، ضبط از یک وصله غشایی است که از سلول جدا شده است.
روش Patch-Clamp برای ضبط جریان یونی از طریق کانالهای تک
ممکن است تعجب کنید که چگونه میتوان جریان یونی را از طریق کانالهای تک پروتئینی همانطور که در شکل ۶-۴ الف نشان داده شده است، ثبت کرد. این با استفاده از روش “پچ-گیره” نشان داده شده در شکل ۶-۴ B به دست آمده است. خیلی ساده، یک میکروپیپت که قطر نوک آن تنها ۱ یا ۲ میکرومتر است، به قسمت بیرونی یک غشای سلولی متصل میشود. سپس مکش در داخل پیپت اعمال میشود تا غشاء را به سمت نوک پیپت بکشد. این یک مهر و موم در جایی ایجاد میکند که لبههای پیپت با غشای سلولی تماس میگیرد. نتیجه یک “لکه” غشایی دقیقه ای در نوک پیپت است که از طریق آن میتوان جریان الکتریکی را ثبت کرد.
متناوبا، همانطور که در شکل ۶-۴ B در سمت راست نشان داده شده است، وصله غشای سلول کوچک در انتهای پیپت میتواند از سلول جدا شود. سپس پیپت با پچ مهر و موم شده آن در محلول آزاد قرار میگیرد. این اجازه میدهد تا غلظت یونها هم در داخل میکروپیپت و هم در محلول بیرونی به دلخواه تغییر کند. همچنین، ولتاژ بین دو طرف غشا را میتوان به دلخواه تنظیم کرد – یعنی به یک ولتاژ معین “کلمپ” کرد.
میتوان چنین تکههایی را به اندازه کافی کوچک ساخت که فقط یک پروتئین کانالی در پچ غشایی مورد مطالعه یافت شود. با تغییر غلظت یونهای مختلف و همچنین ولتاژ روی غشا، میتوان ویژگیهای انتقال کانال منفرد و همچنین خواص دروازهای آن را تعیین کرد.
انتشار تسهیل شده
انتشار تسهیل شده، انتشار واسطه حامل نیز نامیده میشود زیرا ماده ای که به این روش منتقل میشود با استفاده از یک پروتئین حامل خاص برای کمک از طریق غشاء پخش میشود. یعنی حامل، انتشار ماده را به طرف دیگر تسهیل میکند.
انتشار تسهیل شده با انتشار ساده به روش مهم زیر متفاوت است: اگرچه سرعت انتشار ساده از طریق یک کانال باز متناسب با غلظت ماده منتشر کننده افزایش مییابد، اما در انتشار تسهیل شده، سرعت انتشار به حداکثر غلظت به نام V max نزدیک می شود. ماده منتشر کننده افزایش مییابد. این تفاوت بین انتشار ساده و انتشار تسهیل شده در شکل ۷-۴ نشان داده شده است. شکل نشان میدهد که با افزایش غلظت ماده منتشر کننده، سرعت انتشار ساده به طور متناسب به افزایش خود ادامه میدهد، اما در مورد انتشار تسهیل شده، سرعت انتشار نمیتواند بیشتر از سطح V max افزایش یابد.
 شکل ۷-۴ اثر غلظت یک ماده بر سرعت انتشار از طریق غشا با انتشار ساده و انتشار آسان. این نشان میدهد که انتشار تسهیل شده به حداکثر سرعتی به نام V max نزدیک میشود.
شکل ۷-۴ اثر غلظت یک ماده بر سرعت انتشار از طریق غشا با انتشار ساده و انتشار آسان. این نشان میدهد که انتشار تسهیل شده به حداکثر سرعتی به نام V max نزدیک میشود.
چه چیزی سرعت انتشار تسهیل شده را محدود میکند؟ پاسخ محتمل مکانیسمیاست که در شکل ۸-۴ نشان داده شده است. این شکل یک پروتئین حامل را نشان میدهد که منافذ آن به اندازه کافی بزرگ است تا یک مولکول خاص را از طریق آن منتقل کند. همچنین یک “گیرنده” اتصال در داخل حامل پروتئین را نشان میدهد. مولکولی که قرار است منتقل شود وارد منافذ شده و متصل میشود. سپس، در کسری از ثانیه، یک تغییر ساختاری یا شیمیایی در پروتئین حامل رخ میدهد، بنابراین منافذ اکنون به سمت مخالف غشاء باز میشود. از آنجایی که نیروی اتصال گیرنده ضعیف است، حرکت حرارتی مولکول متصل باعث جدا شدن آن و آزاد شدن آن در طرف مقابل غشاء میشود. سرعتی که در آن مولکولها میتوانند توسط این مکانیسم منتقل شوند، هرگز نمیتواند بیشتر از سرعتی باشد که مولکول پروتئین حامل میتواند بین دو حالت خود تغییر کند. البته به طور خاص توجه داشته باشید،
 شکل ۸-۴ مکانیسم فرضی برای انتشار تسهیل شده.
شکل ۸-۴ مکانیسم فرضی برای انتشار تسهیل شده.
از جمله مهم ترین موادی که با انتشار تسهیل شده از غشاهای سلولی عبور میکنند، گلوکز و بیشتر اسیدهای آمینه هستند. در مورد گلوکز، حداقل پنج مولکول ناقل گلوکز در بافتهای مختلف کشف شده است. برخی از اینها همچنین میتوانند مونوساکاریدهای دیگری را که ساختارهای مشابه گلوکز دارند، از جمله گالاکتوز و فروکتوز، انتقال دهند. یکی از اینها، انتقال دهنده گلوکز ۴ (GLUT4)، توسط انسولین فعال میشود، که میتواند سرعت انتشار آسان گلوکز را به میزان ۱۰ تا ۲۰ برابر در بافتهای حساس به انسولین افزایش دهد. این مکانیسم اصلی است که توسط آن انسولین مصرف گلوکز را در بدن کنترل میکند، همانطور که در فصل ۷۸ بحث شد.
عواملی که بر نرخ خالص انتشار تأثیر میگذارند
در حال حاضر واضح است که بسیاری از مواد میتوانند از طریق غشای سلولی پخش شوند. آنچه معمولاً مهم است، سرعت خالص انتشار یک ماده در جهت مورد نظر است. این نرخ خالص توسط عوامل مختلفی تعیین میشود.
نرخ انتشار خالص متناسب با اختلاف غلظت در سراسر غشاء است
شکل ۹-۴ A یک غشای سلولی را با یک ماده با غلظت بالا در خارج و غلظت کم در داخل نشان میدهد. سرعت انتشار ماده به داخل با غلظت مولکولها در خارج متناسب است زیرا این غلظت تعیین میکند که در هر ثانیه چند مولکول به بیرون غشاء برخورد میکند. برعکس، سرعت انتشار مولکولها به بیرون متناسب با غلظت آنها در داخل غشا است. بنابراین، سرعت انتشار خالص به داخل سلول متناسب با غلظت در خارج منهای غلظت در داخل است، یا:
 شکل ۹-۴ اثر اختلاف غلظت (A)، اختلاف پتانسیل الکتریکی بر یونهای منفی (B) و اختلاف فشار (C) برای انتشار مولکولها و یونها از طریق غشای سلولی.
شکل ۹-۴ اثر اختلاف غلظت (A)، اختلاف پتانسیل الکتریکی بر یونهای منفی (B) و اختلاف فشار (C) برای انتشار مولکولها و یونها از طریق غشای سلولی.
که در آن C o غلظت بیرون و C i غلظت داخل است.
اثر پتانسیل الکتریکی غشاء بر انتشار یونها – “پتانسیل Nernst”.
اگر یک پتانسیل الکتریکی در سراسر غشا اعمال شود، همانطور که در شکل ۹-۴ B نشان داده شده است، بارهای الکتریکی یونها باعث میشود که آنها از طریق غشاء حرکت کنند، حتی اگر هیچ تفاوت غلظتی برای ایجاد حرکت وجود نداشته باشد. بنابراین، در پانل سمت چپ شکل ۹-۴ B، غلظت منفی است یونها در دو طرف غشا یکسان هستند، اما یک بار مثبت به سمت راست غشاء و یک بار منفی به سمت چپ اعمال شده است و یک گرادیان الکتریکی در سراسر غشا ایجاد میکند. بار مثبت یونهای منفی را جذب میکند، در حالی که بار منفی آنها را دفع میکند. بنابراین، انتشار خالص از چپ به راست رخ میدهد. پس از مدتی، مقادیر زیادی از یونهای منفی به سمت راست حرکت کرده اند و شرایط نشان داده شده در پانل سمت راست شکل ۹-۴ B را ایجاد میکنند.که در آن اختلاف غلظت یونها در جهت مخالف اختلاف پتانسیل الکتریکی ایجاد شده است. اکنون اختلاف غلظت یونها را به سمت چپ حرکت میدهد، در حالی که اختلاف الکتریکی آنها را به سمت راست میبرد. هنگامیکه اختلاف غلظت به اندازه کافی بالا میرود، این دو اثر یکدیگر را متعادل میکنند. در دمای طبیعی بدن (۳۷ درجه سانتیگراد)، تفاوت الکتریکی که اختلاف غلظت معینی از یونهای تک ظرفیتی – مانند یونهای سدیم (Na +) را متعادل میکند – را میتوان از فرمول زیر تعیین کرد که معادله نرنست نامیده میشود:
که در آن EMF نیروی محرکه (ولتاژ) بین سمت ۱ و ضلع ۲ غشا است، C ۱ غلظت سمت ۱، و C ۲ غلظت سمت ۲ است. این معادله در درک انتقال عصب بسیار مهم است. تکانه میکند و در فصل ۵ با جزئیات بیشتر مورد بحث قرار میگیرد.
اثر اختلاف فشار در سراسر غشاء
گاهی اوقات، اختلاف فشار قابل توجهی بین دو طرف یک غشای قابل انتشار ایجاد میشود. به عنوان مثال، این اتفاق در غشای مویرگ خون در تمام بافتهای بدن رخ میدهد. فشار داخل مویرگ حدود ۲۰ میلی متر جیوه بیشتر از خارج است.
فشار در واقع به معنای مجموع تمام نیروهای مولکولهای مختلف است که در یک لحظه معین به یک سطح واحد برخورد میکنند. بنابراین، هنگامیکه فشار در یک طرف غشاء بیشتر از طرف دیگر باشد، به این معنی است که مجموع تمام نیروهای مولکولهایی که به کانالهای آن طرف غشا برخورد میکنند بیشتر از طرف دیگر است. در بیشتر موارد، این به دلیل برخورد تعداد بیشتری از مولکولها به غشاء در هر ثانیه در یک طرف نسبت به طرف دیگر است. نتیجه این است که مقادیر افزایش یافته انرژی برای ایجاد حرکت خالص مولکولها از سمت پرفشار به سمت سمت کم فشار در دسترس است. این اثر در شکل ۹-۴ C نشان داده شده است، که نشان میدهد پیستونی در حال ایجاد فشار بالا در یک طرف “منافذ” است و در نتیجه باعث میشود مولکولهای بیشتری به منافذ این طرف برخورد کنند و بنابراین مولکولهای بیشتری به طرف دیگر “پراکنده شوند”.
اسمز در سراسر غشاء نفوذ پذیر انتخابی – “انتشار خالص” آب
تا کنون فراوان ترین ماده ای که از طریق غشای سلولی پخش میشود آب است. معمولاً آب کافی در هر ثانیه از طریق غشای گلبول قرمز در هر ثانیه منتشر میشود و تقریباً ۱۰۰ برابر حجم خود سلول است. با این حال معمولاً مقداری که در دو جهت پخش میشود به قدری متعادل است که حرکت خالص آب رخ میدهد. بنابراین حجم سلول ثابت میماند. با این حال، تحت شرایط خاص، اختلاف غلظت برای آب میتواند در سراسر یک غشاء ایجاد شود، همانطور که اختلاف غلظت برای سایر مواد ممکن است رخ دهد. هنگامیکه این اتفاق میافتد، حرکت خالص آب در سراسر غشای سلولی رخ میدهد، که بسته به جهت حرکت آب، سلول را متورم یا کوچک میکند. این فرآیند حرکت خالص آب که در اثر اختلاف غلظت آب ایجاد میشود اسمز نامیده میشود.
برای مثالی از اسمز، اجازه دهید شرایط نشان داده شده در شکل ۱۰-۴ را با آب خالص در یک طرف غشای سلولی و محلول کلرید سدیم در طرف دیگر فرض کنیم. مولکولهای آب به راحتی از غشای سلولی عبور میکنند، در حالی که یونهای سدیم و کلرید فقط به سختی از آن عبور میکنند. بنابراین محلول کلرید سدیم در واقع مخلوطی از مولکولهای آب نفوذپذیر و یونهای سدیم و کلرید غیرقابل نفوذ است و گفته میشود که غشاء به طور انتخابی نفوذپذیر است. به آب، اما نسبت به یونهای سدیم و کلرید بسیار کمتر است. با این حال، وجود سدیم و کلرید برخی از مولکولهای آب را در سمت غشایی که این یونها در آن حضور دارند جابجا کرده است و بنابراین، غلظت مولکولهای آب را به کمتر از غلظت آب خالص کاهش داده است. در نتیجه، در مثال شکل ۱۰-۴، مولکولهای آب بیشتری به کانالهای سمت چپ، جایی که آب خالص وجود دارد، نسبت به سمت راست، جایی که غلظت آب کاهش یافته است، برخورد میکند. بنابراین، حرکت خالص آب از چپ به راست رخ میدهد – یعنی اسمز از آب خالص به محلول کلرید سدیم رخ میدهد.
 شکل ۱۰-۴ اسمز در غشای سلولی زمانی که محلول کلرید سدیم در یک طرف غشا و آب در طرف دیگر قرار میگیرد.
شکل ۱۰-۴ اسمز در غشای سلولی زمانی که محلول کلرید سدیم در یک طرف غشا و آب در طرف دیگر قرار میگیرد.
فشار اسمزی
اگر در شکل ۱۰-۴ فشار به محلول کلرید سدیم وارد شود، اسمز آب به این محلول کند میشود، متوقف میشود یا حتی معکوس میشود. مقدار دقیق فشار لازم برای توقف اسمز را فشار اسمزی محلول کلرید سدیم مینامند.
اصل اختلاف فشار مخالف اسمز در شکل ۱۱-۴ نشان داده شده است که یک غشای تراوا انتخابی را نشان میدهد که دو ستون سیال را از هم جدا میکند، یکی حاوی آب خالص و دیگری حاوی محلولی از آب و هر املاحی است که به غشاء نفوذ نمیکند. اسمز آب از محفظه B به محفظه A باعث میشود سطوح ستونهای سیال دورتر و دورتر از هم شوند تا در نهایت اختلاف فشاری بین دو طرف غشاء به اندازه کافی ایجاد شود که با اثر اسمزی مخالفت کند. اختلاف فشار در سراسر غشا در این نقطه برابر با فشار اسمزی محلولی است که حاوی املاح غیر قابل نفوذ است.
 شکل ۱۱-۴ نمایش فشار اسمزی ناشی از اسمز در یک غشای نیمه تراوا.
شکل ۱۱-۴ نمایش فشار اسمزی ناشی از اسمز در یک غشای نیمه تراوا.
اهمیت تعداد ذرات اسمزی (غلظت مولی) در تعیین فشار اسمزی
فشار اسمزی اعمال شده توسط ذرات در محلول، خواه مولکول یا یون باشند، با تعداد ذرات در واحد حجم سیال تعیین میشود، نه با جرم ذرات. دلیل این امر این است که هر ذره در یک محلول، صرف نظر از جرمش، به طور متوسط فشار یکسانی را به غشاء وارد میکند. یعنی ذرات بزرگی که جرم آنها (m) بیشتر از ذرات کوچک است، با سرعت کمتر (v) حرکت میکنند. ذرات کوچک با سرعتهای بالاتر حرکت میکنند به گونه ای که میانگین انرژی جنبشی آنها (k) که توسط معادله تعیین میشود.
برای هر ذره کوچک مانند هر ذره بزرگ است. در نتیجه، عاملی که فشار اسمزی محلول را تعیین میکند، غلظت محلول بر حسب تعداد ذرات است (که اگر یک مولکول غیر تفکیک شده باشد با غلظت مولی آن برابر است )، نه بر حسب جرم املاح.
اسمولالیته – اسمول
برای بیان غلظت یک محلول بر حسب تعداد ذرات، به جای گرم از واحدی به نام اسمول استفاده میشود.
یک اسمول ۱ گرم وزن مولکولی املاح فعال اسمزی است. بنابراین، ۱۸۰ گرم گلوکز، که ۱ گرم وزن مولکولی گلوکز است، برابر با ۱ اسمول گلوکز است، زیرا گلوکز به یونها تجزیه نمیشود. اگر یک املاح به دو یون تجزیه شود، وزن مولکولی ۱ گرم از املاح به ۲ اسمول تبدیل میشود زیرا تعداد ذرات فعال اسمزی اکنون دو برابر بیشتر از حالت املاح غیر تفکیک شده است. بنابراین، وقتی به طور کامل تفکیک شود، ۱ گرم وزن مولکولی کلرید سدیم، ۵۸.۵ گرم، برابر با ۲ اسمول است.
بنابراین، محلولی که دارای ۱ اسمول املاح حل شده در هر کیلوگرم آب باشد، اسمولالیته آن ۱ اسمول بر کیلوگرم و محلولی که ۱/۱۰۰۰ اسمول در هر کیلوگرم حل شده باشد، اسمولالیته آن ۱ میلیاسمول بر کیلوگرم است. اسمولالیته طبیعی مایعات خارج سلولی و درون سلولی حدود ۳۰۰ میلی مول بر کیلوگرم آب است.
رابطه اسمولالیته به فشار اسمزی
در دمای طبیعی بدن ۳۷ درجه سانتی گراد غلظت ۱ اسمول در لیتر باعث ایجاد فشار اسمزی ۱۹۳۰۰ میلی متر جیوه در محلول میشود. به همین ترتیب، غلظت ۱ میلی مول در لیتر معادل ۱۹.۳ میلی متر جیوه است.فشار اسمزی. با ضرب این مقدار در غلظت ۳۰۰ میلیاسمولاری مایعات بدن، فشار اسمزی کل مایعات بدن ۵۷۹۰ میلیمتر جیوه محاسبه میشود. مقدار اندازه گیری شده برای این، با این حال، به طور متوسط تنها حدود ۵۵۰۰ میلی متر جیوه است. دلیل این تفاوت این است که بسیاری از یونهای موجود در مایعات بدن، مانند یونهای سدیم و کلرید، به شدت جذب یکدیگر میشوند. در نتیجه، آنها نمیتوانند به طور کامل بدون مهار در سیال حرکت کنند و پتانسیل فشار اسمزی کامل خود را ایجاد کنند. بنابراین، به طور متوسط، فشار اسمزی واقعی مایعات بدن حدود ۰.۹۳ برابر مقدار محاسبه شده است.
اصطلاح اسمولاریته.
اسمولاریته غلظت اسمولی است که به عنوان اسمول در لیتر محلول به جای اسمول بر کیلوگرم آب بیان میشود. اگرچه، به بیان دقیق، این اسمول در هر کیلوگرم آب (اسمولالیته) است که فشار اسمزی را تعیین میکند، اما برای محلولهای رقیق مانند محلولهای موجود در بدن، تفاوت کمیبین اسمولاریته و اسمولالیته کمتر از ۱ درصد است. از آنجایی که اندازه گیری اسمولاریته بسیار کاربردی تر از اسمولالیته است، این روش تقریباً در تمام مطالعات فیزیولوژیکی معمول است.
“انتقال فعال” مواد از طریق غشاء
گاهی اوقات، غلظت زیادی از یک ماده در مایع داخل سلولی مورد نیاز است، حتی اگر مایع خارج سلولی فقط دارای غلظت کمیباشد. این درست است، به عنوان مثال، برای یونهای پتاسیم. برعکس، مهم است که غلظت یونهای دیگر در داخل سلول بسیار پایین نگه داشته شود، حتی اگر غلظت آنها در مایع خارج سلولی زیاد باشد. این به ویژه برای یونهای سدیم صادق است. هیچ یک از این دو اثر نمیتواند با انتشار ساده رخ دهد زیرا انتشار ساده در نهایت غلظتها را در دو طرف غشاء متعادل میکند. در عوض، برخی از منابع انرژی باید باعث حرکت بیش از حد یونهای پتاسیم به داخل سلولها و حرکت بیش از حد یونهای سدیم به خارج سلولها شود. حمل و نقل فعال
مواد مختلفی که به طور فعال از طریق حداقل برخی از غشای سلولی منتقل میشوند عبارتند از یونهای سدیم، یون پتاسیم، یون کلسیم، یون آهن، یون هیدروژن، یون کلرید، یون یدید، یون اورات، چندین قند مختلف و بیشتر اسیدهای آمینه.
حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه
حمل و نقل فعال با توجه به منبع انرژی مورد استفاده برای حمل و نقل به دو نوع تقسیم میشود: حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه. در حمل و نقل فعال اولیه، انرژی مستقیماً از تجزیه آدنوزین تری فسفات (ATP) یا برخی ترکیبات فسفات پرانرژی به دست میآید. در حمل و نقل فعال ثانویه، انرژی به طور ثانویه از انرژی حاصل میشود که به شکل اختلاف غلظت یونی مواد مولکولی یا یونی ثانویه بین دو طرف غشای سلولی ذخیره شده است، که در اصل توسط حمل و نقل فعال اولیه ایجاد شده است. در هر دو مورد، انتقال به پروتئینهای حامل بستگی دارد که از طریق غشای سلولی نفوذ میکنند، همانطور که برای انتشار تسهیل شده صادق است. با این حال، در حمل و نقل فعال، پروتئین حامل در انتشار تسهیل شده متفاوت از حامل عمل میکند، زیرا قادر است به ماده منتقل شده انرژی بدهد تا آن را در برابر گرادیان الکتروشیمیایی حرکت دهد. در ادامه چند نمونه از حمل و نقل فعال اولیه و حمل و نقل فعال ثانویه با توضیحات دقیق تر در مورد اصول عملکرد آنها آورده شده است.
حمل و نقل فعال اولیه
پمپ سدیم پتاسیم
از جمله موادی که با انتقال فعال اولیه منتقل میشوند عبارتند از: سدیم، پتاسیم، کلسیم، هیدروژن، کلرید و چند یون دیگر.
مکانیسم انتقال فعال که با جزئیات بیشتر مورد مطالعه قرار گرفته است پمپ سدیم پتاسیم (Na + -K +) است، یک فرآیند انتقال که یونهای سدیم را از طریق غشای سلولی همه سلولها به بیرون پمپ میکند و در همان زمان یونهای پتاسیم را از بیرون به داخل این پمپ وظیفه حفظ اختلاف غلظت سدیم و پتاسیم در غشای سلولی و همچنین ایجاد ولتاژ الکتریکی منفی در داخل سلولها را بر عهده دارد. در واقع، فصل ۵ نشان میدهد که این پمپ همچنین اساس عملکرد عصبی است و سیگنالهای عصبی را در سراسر سیستم عصبی منتقل میکند.
شکل ۱۲-۴ اجزای فیزیکی پایه پمپ +Na+-K را نشان میدهد. پروتئین حامل مجموعه ای از دو پروتئین کروی مجزا است: یکی بزرگتر به نام زیرواحد α با وزن مولکولی حدود ۱۰۰۰۰۰ و دیگری کوچکتر به نام زیرواحد β با وزن مولکولی حدود ۵۵۰۰۰. اگرچه عملکرد پروتئین کوچکتر مشخص نیست (به جز اینکه ممکن است کمپلکس پروتئین را در غشای لیپیدی لنگر بیاندازد)، پروتئین بزرگتر دارای سه ویژگی خاص است که برای عملکرد پمپ مهم هستند:
۱. دارای سه جایگاه گیرنده برای اتصال یونهای سدیم بر روی بخشی از پروتئین که به داخل سلول بیرون زده است.
۲. دارای دو جایگاه گیرنده برای یونهای پتاسیم در خارج است.
۳. قسمت داخلی این پروتئین در نزدیکی محلهای اتصال سدیم دارای فعالیت ATPase است.
 شکل ۱۲-۴ مکانیسم فرضی پمپ سدیم-پتاسیم. ADP، آدنوزین دی فسفات؛ ATP، آدنوزین تری فسفات؛ پی، یون فسفات.
شکل ۱۲-۴ مکانیسم فرضی پمپ سدیم-پتاسیم. ADP، آدنوزین دی فسفات؛ ATP، آدنوزین تری فسفات؛ پی، یون فسفات.
هنگامیکه دو یون پتاسیم در خارج از پروتئین حامل و سه یون سدیم در داخل متصل میشوند، عملکرد ATPase پروتئین فعال میشود. سپس یک مولکول ATP را میشکافد، آن را به آدنوزین دی فسفات (ADP) تقسیم میکند و یک پیوند فسفات با انرژی بالا آزاد میکند. سپس اعتقاد بر این است که این انرژی آزاد شده باعث ایجاد یک تغییر شیمیایی و ساختاری در مولکول حامل پروتئین میشود و سه یون سدیم را به بیرون و دو یون پتاسیم را به داخل خارج میکند.
مانند سایر آنزیمها، پمپ Na+-K+ ATPase میتواند به صورت معکوس کار کند. اگر گرادیانهای الکتروشیمیایی برای +Na و +K بطور تجربی به اندازه ای افزایش یابد که انرژی ذخیره شده در شیب آنها بیشتر از انرژی شیمیایی هیدرولیز ATP باشد، این یونها شیب غلظت خود را پایین میآورند و پمپ +Na+-K سنتز میشود. ATP از ADP و فسفات. بنابراین، شکل فسفریله شده پمپ +Na+-K میتواند فسفات خود را به ADP برای تولید ATP ببخشد یا از انرژی برای تغییر ساختار آن استفاده کند و +Na را به بیرون از سلول و K + پمپ کند. داخل سلول غلظت نسبی ATP، ADP و فسفات، و همچنین گرادیانهای الکتروشیمیایی برای +Na و +K، جهت واکنش آنزیم را تعیین میکند. برای برخی از سلولها، مانند سلولهای عصبی فعال الکتریکی، ۶۰ تا ۷۰ درصد انرژی مورد نیاز سلولها ممکن است به پمپ کردن Na + از سلول و K + به داخل سلول اختصاص یابد.
پمپ Na + -K + برای کنترل حجم سلول مهم است
یکی از مهمترین وظایف پمپ Na + -K + کنترل حجم هر سلول است. بدون عملکرد این پمپ، اکثر سلولهای بدن تا زمانی که ترکیده شوند متورم میشوند. مکانیسم کنترل حجم به شرح زیر است: در داخل سلول تعداد زیادی پروتئین و سایر مولکولهای آلی وجود دارد که نمیتوانند از سلول فرار کنند. اکثر اینها دارای بار منفی هستند و بنابراین تعداد زیادی پتاسیم، سدیم و سایر یونهای مثبت را نیز جذب میکنند. سپس تمام این مولکولها و یونها باعث اسمز آب به داخل سلول میشوند. مگر اینکه این مورد بررسی شود، سلول به طور نامحدود متورم میشود تا زمانی که ترکیده شود. مکانیسم طبیعی برای جلوگیری از این امر پمپ Na + -K + است. مجددا توجه داشته باشید که این دستگاه سه Na را پمپاژ میکند+ یون به خارج از سلول به ازای هر دو یون K + پمپ شده به داخل. همچنین، نفوذپذیری غشاء به یونهای سدیم بسیار کمتر از یونهای پتاسیم است، بنابراین هنگامیکه یونهای سدیم در خارج هستند، تمایل زیادی به ماندن در آنجا پیدا میکنند. بنابراین، این نشان دهنده از دست دادن خالص یونها از سلول است که باعث شروع اسمز آب از سلول نیز میشود.
اگر یک سلول به هر دلیلی شروع به متورم شدن کند، پمپ Na + -K + به طور خودکار فعال میشود و یونهای بیشتری را به بیرون منتقل میکند و آب را با خود حمل میکند. بنابراین، پمپ Na + -K + نقش نظارت مستمر را در حفظ حجم طبیعی سلول ایفا میکند.
ماهیت الکتروژنی پمپ Na + -K +
این واقعیت که پمپ Na + -K + به ازای هر دو یون K + به داخل، سه یون Na + را به بیرون منتقل میکند به این معنی است که برای هر چرخه از داخل سلول یک بار مثبت از داخل سلول به بیرون منتقل میشود. پمپ. این امر باعث ایجاد حالت مثبت در خارج از سلول میشود، اما کمبود یونهای مثبت را در داخل سلول ایجاد میکند. یعنی باعث منفی شدن درون میشود. بنابراین، پمپ Na + -K + الکتروژنیک است زیرا پتانسیل الکتریکی را در سراسر غشای سلول ایجاد میکند. همانطور که در فصل ۵ بحث شد، این پتانسیل الکتریکی یک نیاز اساسی در رشتههای عصبی و ماهیچه ای برای انتقال سیگنالهای عصبی و عضلانی است.
انتقال فعال اولیه یونهای کلسیم
یکی دیگر از مکانیسمهای مهم انتقال فعال اولیه، پمپ کلسیم است. یونهای کلسیم معمولاً در غلظت بسیار کم در سیتوزول درون سلولی تقریباً تمام سلولهای بدن، با غلظتی حدود ۱۰۰۰۰ برابر کمتر از غلظت مایع خارج سلولی نگهداری میشوند. این به طور عمده توسط دو پمپ کلسیم انتقال فعال اولیه به دست میآید. یکی در غشای سلولی است و کلسیم را به خارج از سلول پمپاژ میکند. دیگری یونهای کلسیم را به یک یا چند اندامک وزیکولی داخل سلولی مانند شبکه سارکوپلاسمیسلولهای عضلانی و میتوکندری در همه سلولها پمپ میکند. در هر یک از این موارد، پروتئین حامل به غشاء نفوذ میکند و به عنوان یک آنزیم ATPase عمل میکند، و دارای همان توانایی برای تجزیه ATP به عنوان ATPase پروتئین حامل سدیم است. تفاوت این است که این پروتئین یک محل اتصال بسیار ویژه برای کلسیم به جای سدیم دارد.
انتقال فعال اولیه یونهای هیدروژن
در دو نقطه از بدن، انتقال فعال اولیه یونهای هیدروژن مهم است: (۱) در غدد معده معده و (۲) در لولههای انتهایی انتهایی و مجاری جمع کننده قشر کلیهها.
در غدد معده، سلولهای جداری عمیق قویترین مکانیسم فعال اولیه برای انتقال یونهای هیدروژن در هر قسمت از بدن را دارند. این اساس ترشح اسید هیدروکلریک در ترشحات گوارشی معده است. در انتهای ترشحی سلولهای جداری غده معده، غلظت یون هیدروژن تا یک میلیون برابر افزایش مییابد و سپس همراه با یونهای کلرید به معده رها میشود تا اسید کلریدریک تشکیل شود.
در لولههای کلیوی، سلولهای درونپیچیده ویژهای در لولههای انتهایی دیستال و مجاری جمعآوری قشر مغز قرار دارند که یونهای هیدروژن را نیز با انتقال فعال اولیه منتقل میکنند. در این حالت مقادیر زیادی یون هیدروژن از خون به داخل ادرار ترشح میشود تا یونهای هیدروژن اضافی از مایعات بدن خارج شود. یونهای هیدروژن میتوانند در ادرار در برابر شیب غلظت حدود ۹۰۰ برابر ترشح شوند.
انرژی حمل و نقل فعال اولیه
مقدار انرژی مورد نیاز برای انتقال یک ماده به طور فعال از طریق غشاء بر اساس میزان غلظت ماده در حین انتقال تعیین میشود. در مقایسه با انرژی مورد نیاز برای تغلیظ ۱۰ برابر ماده، برای تغلیظ ۱۰۰ برابر آن دو برابر انرژی و برای تغلیظ ۱۰۰۰ برابر ۳ برابر انرژی لازم است. به عبارت دیگر، انرژی مورد نیاز متناسب با لگاریتم درجه غلظت ماده است که با فرمول زیر بیان میشود:
بنابراین، از نظر کالری، مقدار انرژی مورد نیاز برای تغلیظ ۱ اسمول از یک ماده ۱۰ برابر، حدود ۱۴۰۰ کالری است. یا برای ۱۰۰ برابر کردن ۲۸۰۰ کالری. میتوان مشاهده کرد که مصرف انرژی برای متمرکز کردن مواد در سلولها یا برای حذف مواد از سلولها در برابر گرادیان غلظت میتواند بسیار زیاد باشد. برخی از سلولها، مانند سلولهای پوشاننده لولههای کلیوی و بسیاری از سلولهای غدد، ۹۰ درصد انرژی خود را صرف این هدف میکنند.
حمل و نقل فعال ثانویه – حمل و نقل مشترک و حمل و نقل متقابل
هنگامیکه یونهای سدیم از طریق انتقال فعال اولیه از سلولها خارج میشوند، معمولاً یک گرادیان غلظت زیادی از یونهای سدیم در سراسر غشای سلول ایجاد میشود – غلظت زیاد در خارج از سلول و غلظت کم در داخل. این گرادیان نشان دهنده یک انبار انرژی است زیرا سدیم اضافی در خارج از غشای سلولی همیشه در تلاش است تا به داخل نفوذ کند. تحت شرایط مناسب، این انرژی انتشار سدیم میتواند مواد دیگر را همراه با سدیم از طریق غشای سلولی بکشد. این پدیده حمل و نقل مشترک نامیده میشود. این یکی از اشکال حمل و نقل فعال ثانویه است.
برای اینکه سدیم ماده دیگری را به همراه خود بکشد، مکانیسم جفت مورد نیاز است. این با استفاده از پروتئین حامل دیگری در غشای سلولی به دست میآید. حامل در این مثال به عنوان یک نقطه اتصال هم برای یون سدیم و هم برای ماده ای که باید به طور مشترک منتقل شود عمل میکند. هنگامیکه هر دو به هم متصل میشوند، گرادیان انرژی یون سدیم باعث میشود که یون سدیم و ماده دیگر با هم به داخل سلول منتقل شوند.
در حمل و نقل متقابل، یونهای سدیم دوباره سعی میکنند بهدلیل گرادیان غلظت زیادشان به داخل سلول منتشر شوند. با این حال، این بار، ماده ای که قرار است منتقل شود، در داخل سلول است و باید به بیرون منتقل شود. بنابراین، یون سدیم به پروتئین حامل متصل میشود، جایی که به سطح بیرونی غشاء میریزد، در حالی که ماده ای که قرار است به صورت متقابل منتقل شود، به برجستگی داخلی پروتئین حامل متصل میشود. هنگامیکه هر دو متصل شدند، یک تغییر ساختاری رخ میدهد و انرژی آزاد شده توسط یون سدیم که به سمت داخل حرکت میکند باعث میشود ماده دیگر به سمت بیرون حرکت کند.
انتقال همزمان گلوکز و اسیدهای آمینه همراه با یونهای سدیم
گلوکز و بسیاری از آمینو اسیدها در برابر شیب غلظت زیاد به اکثر سلولها منتقل میشوند. همانطور که در شکل ۱۳-۴ نشان داده شده است، مکانیسم این کاملاً با حمل و نقل مشترک است. توجه داشته باشید که پروتئین حامل حامل دو محل اتصال در قسمت بیرونی خود دارد، یکی برای سدیم و دیگری برای گلوکز. همچنین غلظت یونهای سدیم در بیرون زیاد و در داخل کم است که انرژی لازم برای انتقال را فراهم میکند. یک ویژگی خاص پروتئین انتقال این است که تا زمانی که یک مولکول گلوکز به آن متصل نشود، تغییر ساختاری برای اجازه حرکت سدیم به داخل رخ نخواهد داد. هنگامیکه هر دو به هم متصل میشوند، تغییر ساختاری به طور خودکار انجام میشود و سدیم و گلوکز به طور همزمان به داخل سلول منتقل میشوند. از این رو، این یک انتقال همزمان سدیم و گلوکز است سازوکار. همان طور که در فصلهای ۲۷ و ۶۵ مورد بحث قرار گرفت، هم انتقال دهندههای سدیم-گلوکز مکانیسمهای مهمیدر انتقال گلوکز از طریق سلولهای اپیتلیال کلیه و روده هستند.
 شکل ۱۳-۴ مکانیسم فرضی برای انتقال همزمان سدیم گلوکز.
شکل ۱۳-۴ مکانیسم فرضی برای انتقال همزمان سدیم گلوکز.
انتقال همزمان اسیدهای آمینه سدیم به همان روشی انجام میشود که برای گلوکز انجام میشود، با این تفاوت که از مجموعه متفاوتی از پروتئینهای انتقال استفاده میکند. پنج پروتئین انتقال آمینو اسید شناسایی شده است که هر کدام وظیفه انتقال یک زیر مجموعه از اسیدهای آمینه با ویژگیهای مولکولی خاص را بر عهده دارند.
انتقال همزمان گلوکز و آمینو اسیدها به ویژه از طریق سلولهای اپیتلیال مجرای روده و لولههای کلیوی کلیهها انجام میشود تا جذب این مواد در خون را افزایش دهد، همانطور که در فصلهای بعدی مورد بحث قرار میگیرد.
سایر مکانیسمهای مهم انتقال مشترک حداقل در برخی سلولها شامل انتقال همزمان یونهای کلرید، یونهای ید، یونهای آهن و یونهای اورات است.
سدیم ضد انتقال یونهای کلسیم و هیدروژن
دو مکانیسم ضد حمل و نقل بسیار مهم (انتقال در جهت مخالف یون اولیه) ضد انتقال سدیم-کلسیم و ضدحمل سدیم-هیدروژن هستند (شکل ۱۴-۴).
 شکل ۱۴-۴ انتقال متقابل سدیم یونهای کلسیم و هیدروژن.
شکل ۱۴-۴ انتقال متقابل سدیم یونهای کلسیم و هیدروژن.
انتقال متقابل سدیم-کلسیم از طریق تمام یا تقریباً همه غشاهای سلولی انجام میشود، با یونهای سدیم به داخل و یونهای کلسیم به بیرون، که هر دو به یک پروتئین حملونقل در حالت ضد انتقال متصل میشوند. این علاوه بر انتقال فعال اولیه کلسیم است که در برخی از سلولها رخ میدهد.
انتقال متقابل سدیم-هیدروژن در چندین بافت رخ میدهد. یک مثال مهم در لولههای پروگزیمال کلیهها است، جایی که یونهای سدیم از مجرای توبول به داخل سلول لولهای حرکت میکنند، در حالی که یونهای هیدروژن به طور متقابل به مجرای لوله منتقل میشوند. به عنوان مکانیزمیبرای متمرکز کردن یونهای هیدروژن، انتقال متقابل به اندازه انتقال فعال اولیه یونهای هیدروژن که در لولههای کلیوی دیستالتر اتفاق میافتد، قوی نیست، اما میتواند تعداد بسیار زیادی یون هیدروژن را انتقال دهد، بنابراین آن را به یک کلید برای انتقال یونهای هیدروژن تبدیل میکند. کنترل یون هیدروژن در مایعات بدن، همانطور که در فصل ۳۰ به تفصیل مورد بحث قرار گرفت.
حمل و نقل فعال از طریق صفحات سلولی
در بسیاری از نقاط بدن، مواد باید از طریق یک صفحه سلولی به جای صرفاً از طریق غشای سلولی منتقل شوند. انتقال این نوع از طریق (۱) اپیتلیوم روده، (۲) اپیتلیوم لولههای کلیوی، (۳) اپیتلیوم تمام غدد برون ریز، (۴) اپیتلیوم کیسه صفرا، و (۵) غشای شبکه مشیمیه انجام میشود. مغز و غشاهای دیگر
مکانیسم اصلی برای انتقال یک ماده از طریق یک صفحه سلولی (۱) انتقال فعال از طریق غشای سلولی در یک طرف سلولهای انتقال دهنده در ورقه، و سپس (۲) یا انتشار ساده یا انتشار آسان از طریق غشاء در طرف مقابل است. سمت سلول
شکل ۱۵-۴ مکانیسمیرا برای انتقال یونهای سدیم از طریق ورقه اپیتلیال رودهها، کیسه صفرا و لولههای کلیوی نشان میدهد. این شکل نشان میدهد که سلولهای اپیتلیال در قطب مجرا بهوسیله اتصالاتی به نام «بوسه» به یکدیگر متصل شدهاند. مرز قلم مو روی سطوح مجرای سلولها هم برای یونهای سدیم و هم آب نفوذپذیر است. بنابراین، سدیم و آب به راحتی از لومن به داخل سلول منتشر میشود. سپس، در غشای پایه و جانبی سلولها، یونهای سدیم به طور فعال به مایع خارج سلولی بافت همبند اطراف و عروق خونی منتقل میشوند. این باعث ایجاد گرادیان غلظت یون سدیم بالا در این غشاها میشود که به نوبه خود باعث اسمز آب نیز میشود. بدین ترتیب،
 شکل ۱۵-۴ مکانیسم اصلی انتقال فعال در میان لایه ای از سلولها.
شکل ۱۵-۴ مکانیسم اصلی انتقال فعال در میان لایه ای از سلولها.
این مکانیسمهایی هستند که تقریباً تمام مواد مغذی، یونها و سایر مواد از روده به خون جذب میشوند. آنها همچنین روشی هستند که همان مواد از فیلتر گلومرولی توسط لولههای کلیوی بازجذب میشوند.
در سراسر این متن نمونههای متعددی از انواع مختلف حمل و نقل مورد بحث در این فصل وجود دارد.
کتاب درسی فیزیولوژی پزشکی گایتون وهال، ویرایش دوازدهم فصل ۴
کلیک کنید «بیبلیوگرافی: فهرست کتب مربوطه»
Agre P., Kozono D. Aquaporin water channels: molecular mechanisms for human diseases. FEBS Lett. ۲۰۰۳;۵۵۵:۷۲.
Ashcroft F.M. From molecule to malady. Nature. ۲۰۰۶;۴۴۰:۴۴۰.
Benos D.J., Stanton B.A. Functional domains within the degenerin/epithelial sodium channel (Deg/ENaC) superfamily of ion channels. J Physiol. ۱۹۹۹;۵۲۰:۶۳۱.
Benziane B., Chibalin A.V. Frontiers: skeletal muscle sodium pump regulation: a translocation paradigm. Am J Physiol Endocrinol Metab. ۲۰۰۸;۲۹۵:E553.
Biel M., Wahl-Schott C., Michalakis S., Zong X. Hyperpolarization-activated cation channels: from genes to function. Physiol Rev. ۲۰۰۹;۸۹:۸۴۷.
Blaustein M.P., Zhang J., Chen L., et al. The pump, the exchanger, and endogenous ouabain: signaling mechanisms that link salt retention to hypertension. Hypertension. ۲۰۰۹;۵۳:۲۹۱.
Bröer S. Amino acid transport across mammalian intestinal and renal epithelia. Physiol Rev. ۲۰۰۸;۸۸:۲۴۹.
DeCoursey T.E. Voltage-gated proton channels: what’s next? J Physiol. ۲۰۰۸;۵۸۶:۵۳۰۵.
DeCoursey T.E. Voltage-gated proton channels and other proton transfer pathways. Physiol Rev
DiPolo R., Beaugé L. Sodium/calcium exchanger: influence of metabolic regulation on ion carrier interactions. Physiol Rev. ۲۰۰۶;۸۶:۱۵۵.
Drummond H.A., Jernigan N.L., Grifoni S.C. Sensing tension: epithelial sodium channel/acid-sensing ion channel proteins in cardiovascular homeostasis. Hypertension. ۲۰۰۸;۵۱:۱۲۶۵.
Gadsby D.C. Ion channels versus ion pumps: the principal difference, in principle. Nat Rev Mol Cell Biol
Jentsch T.J., Stein V., Weinreich F., Zdebik A.A. Molecular structure and physiological function of chloride channels. Physiol Rev
Kaupp U.B., Seifert R. Cyclic nucleotide-gated ion channels. Physiol Rev. ۲۰۰۲;۸۲:۷۶۹.
King L.S., Kozono D., Agre P. From structure to disease: the evolving tale of aquaporin biology. Nat Rev Mol Cell Biol. ۲۰۰۴;۵:۶۸۷.
Kleyman T.R., Carattino M.D., Hughey R.P. ENaC at the cutting edge: regulation of epithelial sodium channels by proteases. J Biol Chem. ۲۰۰۹;۲۸۴:۲۰۴۴۷.
Mazzochi C., Benos D.J., Smith P.R. Interaction of epithelial ion channels with the actin-based cytoskeleton. Am J Physiol Renal Physiol. ۲۰۰۶;۲۹۱:F1113.
Peres A., Giovannardi S., Bossi E., Fesce R. Electrophysiological insights into the mechanism of ion-coupled cotransporters. News Physiol Sci. ۲۰۰۴;۱۹:۸۰.
Russell J.M. Sodium-potassium-chloride cotransport. Physiol Rev. ۲۰۰۰;۸۰:۲۱۱.
Shin J.M., Munson K., Vagin O., Sachs G. The gastric HK-ATPase: structure, function, and inhibition. Pflugers Arch. ۲۰۰۹;۴۵۷:۶۰۹.
Tian J., Xie Z.J. The Na-K-ATPase and calcium-signaling microdomains. Physiology (Bethesda). ۲۰۰۸;۲۳:۲۰۵.

